文档内容
高一化学必修第一册同步单元AB卷(新教材人教版)
高一化学上学期期末模拟卷(一)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Fe 56
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 下列有关物质分类的叙述正确的是
A.CaCl 、NaOH、HCl、HD四种物质都属于化合物
2
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.溶液、浊液、胶体都属于混合物
D.CO、CO等非金属氧化物均属于酸性氧化物
2
【答案】C
【解析】
H和D互为同位素,则HD是由同种元素构成的单质,不是化合物,A项错误;
纯碱是碳酸钠,属于盐,B项错误;
溶液、胶体、浊液都是由分散质和分散剂组成的分散系,都属于混合物,C项正确;
CO不能和碱反应生成盐和水,故其不属于酸性氧化物,D项错误。
2. 下列物质间的转化需要通过氧化还原反应才能实现的是
A. CO→NaHCO B.Fe(OH) →Fe(OH)
2 3 2 3
C. CaCO →NaCO D.CuO→Cu(NO )
3 2 3 3 2
【答案】B
【解析】Fe(OH) 中铁元素为+2价,Fe(OH) 中铁元素为+3价,有元素化合价的变化,故
2 3
Fe(OH) →Fe(OH) 一定是通过氧化还原反应实现的。
2 3
3. 下列反应的离子方程式书写正确的是
A.用稀硫酸清洗铁锈(Fe O):Fe O+6H+===2Fe3++3HO
2 3 2 3 2
B.铝片与硝酸汞溶液反应:Al+Hg2+===Al3++Hg
C.硫酸铜溶液和氢氧化钡溶液混合:Ba2++SO===BaSO ↓
4
D.碳酸氢钙溶液与盐酸反应:Ca(HCO )+2H+===Ca2++2HO+2CO↑
3 2 2 2
【答案】A
【解析】
用稀硫酸清洗铁锈(Fe O),离子方程式为Fe O+6H+===2Fe3++3HO,故A项正确;
2 3 2 3 2
铝片与硝酸汞溶液反应,离子方程式为2Al+3Hg2+===2Al3++3Hg,故B项错误;
硫酸铜溶液和氢氧化钡溶液混合,离子方程式为 Cu2++2OH-+Ba2+ +SO===BaSO ↓+Cu(OH) ↓,故
4 2
C项错误;碳酸氢钙溶液与盐酸反应,离子方程式为HCO+H+===H O+CO↑,故D项错误。
2 2
4. 某运载火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,二者剧烈反应产生大
量气体并释放出大量的热,该反应的化学方程式为R+2NO===3N ↑+4HO↑+2CO↑,则下列叙述错误的
2 4 2 2 2
是
A. 此反应是氧化还原反应
B. 反应瞬间产生大量高温气体,推动火箭飞行
C. 在反应中NO 作还原剂
2 4
D. R的分子式为C HN
2 8 2
【答案】C
【解析】
A. N元素在反应物中以化合态存在,反应生成氮气,N元素化合价变化,反应是氧化还原反应,故A
正确;
B. 偏二甲肼和四氧化二氮剧烈反应产生大量气体并释放出大量的热,瞬间产生大量高温气体,推动火
箭飞行,故B正确;
C. N2O4中N元素化合价降低,N2O4是氧化剂,偏二甲肼中所含元素化合价一定有升高,故偏二甲肼
作还原剂,故C错误;
D. 根据原子守恒可知,偏二甲肼的分子式为C2H8N2,故D正确;
5. 下列说法正确的是
A.78 g Na O 固体中阴、阳离子总数为4N
2 2 A
B.7.8 g Na O 与水反应,转移0.2N 电子
2 2 A
B. NaO 与CO 反应:2NaO+2CO===2Na CO+O,则NaO 与SO 反应:
2 2 2 2 2 2 2 3 2 2 2 2
2NaO+2SO ===2Na SO +O
2 2 2 2 3 2
D.将NaO 投入到紫色石蕊试液中,溶液先变蓝后褪色
2 2
【答案】D
【解析】
每个NaO 中含有2个Na+、1个O,故78 g即1 mol Na O 固体中阴、阳离子总数为3N ,A错误;
2 2 2 2 A
,故 7.8 g 即0.1 mol Na O 与水反应转移
2 2
0.1N 电子,B错误;
A
NaO 具有氧化性,NaO+SO ===Na SO ,C错误;
2 2 2 2 2 2 4
由于2NaO+2HO===4NaOH+O↑,溶液显碱性,故紫色石蕊试液变蓝,又由于NaO 的强氧化性而
2 2 2 2 2 2
将溶液漂白,最终溶液变成无色,D正确。6. 某兴趣小组设计“氯气与金属钠反应”的装置。实验操作:先给钠预热,到钠熔融成圆球时,停止
加热,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是
A.钠着火燃烧产生苍白色火焰和白烟
B.白烟是氯化钠微晶分散在空气中形成
C.玻璃管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境
D.根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收
【答案】A
【解析】
A. 钠着火燃烧产生黄色火焰,故A错误;
B. 氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,反应时有大量白烟,所以白烟是氯化钠
微晶分散在空气中形成,故B正确;
C. 氯气有毒,不能排放到空气中,氯气易与NaOH溶液反应而被吸收,故C正确;
D. 氯气具有强氧化性,与碘化钾发生置换反应,可根据其颜色变化判断氯气是否被碱液完全吸收,故
D正确。
7. 市场上销售的某消毒液,其商标上有如下说明:①本产品为无色液体,呈弱碱性;②使用时,加水
稀释;③可对餐具、衣服进行消毒,也可用于漂白浅色衣物。据此推断,该产品的有效成分可能是
A.HClO B.NaCl
C.NaClO D.KMnO
4
【答案】C
【解析】HClO、NaClO、KMnO 等都可以用于消毒,而NaCl没有这方面的性质。HClO溶液呈酸性,
4
KMnO 溶液有颜色,均不符合题意。NaClO与水和二氧化碳反应生成的次氯酸具有强氧化性,可表现出漂
4
白性。
8. 在酸性条件下,可发生如下反应:ClO+2M3++4HO===M O+Cl-+8H+,MO中M的化合价是
2 2 2
A.+4 B.+5 C.+6 D.+7
【答案】C【解析】根据电荷守恒可得:-1+3×2=-n+(-1)+8×1,解得n=2。设MO中M的化合价为+
2
x,则有:2x+(-2)×7=-2,解得x=6,即MO中M的化合价为+6,C项正确。
2
9. 设N 表示阿伏加德罗常数的值,下列叙述正确的是
A
A. 常温常压下,48 g O 含有的氧原子数为3N
3 A
B. 24 g Mg完全变为Mg2+时失去的电子数为N
A
C. 4 ℃时9 mL H O和标准状况下11.2 L N 含有相同的原子数
2 2
D. 同温同压下,N 个NO与N 个N 和O 组成的混合气体的体积不相等
A A 2 2
【答案】A
【解析】
48 g O 的物质的量为1 mol,含有的氧原子的物质的量为3 mol,故其氧原子数为3N ,A项正确;
3 A
24 g Mg完全变为Mg2+时失去的电子数为2N ,B项错误;
A
4 ℃时9 mL H O的质量为9 g,其物质的量为0.5 mol,所含原子数为1.5N ,而标准状况下11.2 L N
2 A 2
的物质的量为0.5 mol,所含原子数为N ,C项错误;
A
同温同压下,N 个NO与N 个N 和O 组成的混合气体的物质的量相等,其体积也相等,D项错误。
A A 2 2
10. 把V L含有MgSO 和KSO 的混合溶液分成两等份,一份加入含a mol BaCl 的溶液,恰好使硫酸
4 2 4 2
根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原
混合溶液中钾离子的浓度为
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
【答案】D
【解析】根据题中信息可知,每份溶液中含有a mol SO和 mol Mg2+,则每份溶液中K+为2
mol=(2a-b) mol,故原混合溶液中c(K+)= mol·L-1。
11. 下列铁的化合物通过化合反应、置换反应、复分解反应均能得到的是
A.Fe O B.Fe (SO )
3 4 2 4 3
C.FeCl D.Fe(OH)
2 3
【答案】C
Fe O 无法通过复分解反应得到,A错误;
3 4
硫酸铁可以通过FeSO 溶液与氧气的化合得到,也可以通过氢氧化铁与稀硫酸发生复分解反应得到,
4
但无法通过置换反应得到,B错误;
FeCl 可以由FeCl 和Fe的化合得到,也可以由Fe和HCl的置换得到,也可以由Fe(OH) 和HCl发生
2 3 2
复分解反应得到,C正确;
Fe(OH) 可以通过Fe(OH) 和氧气、水的化合得到,也可以通过氯化铁与氢氧化钠发生复分解反应得到,
3 2
但无法通过置换反应得到,D错误。
12. 下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是选项 M N P Q
A NH ·H O Ba(OH) 铜 石蕊溶液
3 2 2
B Na BaCl FeO KSCN
2
C NaOH Ba(NO ) 锌粉 KSCN
3 2
D NaO MgCl Fe 石蕊溶液
2 2 2
【答案】C
【解析】
A项中Ba(OH) 与Fe (SO ) 反应得到的是Fe(OH) 与BaSO 的混合物,沉淀不是白色的,A项错误;
2 2 4 3 3 4
B项中FeO不能还原Fe3+,B项错误;
D项中MgCl 与Fe (SO ) 不反应,D项错误。
2 2 4 3
13. 下列反应的离子方程式书写正确的是
A.钠和冷水反应:Na+2HO===Na++2OH-+H↑
2 2
B.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO+H↑
2
C.金属铝溶于盐酸中:2Al+6H+===2Al3++3H↑
2
D.铁跟稀硫酸反应:2Fe+6H+===2Fe3++3H↑
2【答案】C
【解析】
A中,电荷不守恒,正确的离子方程式为2Na+2HO===2Na++2OH-+H↑;
2 2
B中,不符合反应实际,正确的离子方程式为2Al+2OH-+2HO===2AlO+3H↑;
2 2
D中,稀HSO 与Fe反应只能生成Fe2+:Fe+2H+===Fe2++H↑。
2 4 2
14. 碲锌镉(TeZnCd)晶体可以用于制造红外探测器的基础材料,下列有关叙述中不正确的是
A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔、沸点
B. 它易导电、导热,具有延展性
C. 它的熔、沸点比Zn的低
D. 它的硬度和强度比Cd的大
【答案】A
【解析】碲锌镉晶体是由Te、Zn、Cd按一定比例熔合而成的具有金属特性的合金,只要比例确定,
其组成就固定,因而有固定的熔、沸点;合金具有比各成分金属低的熔、沸点,高的硬度和强度。
15. 在自然界中,锗有70Ge、72Ge等多种稳定的核素。下列有关说法中正确的是
A.70Ge、72Ge互称同素异形体
B.70Ge、72Ge互称同位素
C.70Ge、72Ge的核外电子排布不同
D.70Ge、72Ge的质子数、质量数、核外电子数相等
【答案】B
【解析】
70Ge、72Ge是同种元素的不同核素,互称为同位素,不是同素异形体,A错,B正确;
70Ge、72Ge的质子数、核外电子数相等,故核外电子排布相同,而核内中子数不同,质量数不相等,
C、D错。
16. 铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同主族元素,元素符号是
Tl,以下对铊的性质的推断不正确的是
A.铊是易导电的银白色金属
B.能生成+3价离子化合物
C.Tl(OH) 是两性氢氧化物
3
D.Tl3+的氧化能力比Al3+弱
【答案】C
【解析】
A. 铝为易导电的银白色金属,Tl与Al同主族,则铊也是易导电的银白色金属,故A正确;
B. 第ⅢA族元素的最高正价为+3,且为金属元素,则能生成+3价离子化合物,故B正确;
C. 同主族从上到下,元素金属性逐渐增强,则Tl(OH) 是碱性氢氧化物,故C错误;
3
D. 金属性Tl>Al,则Tl3+的氧化能力比Al3+弱,故D正确。
17. 现有如下说法:
①在水分子内氢、氧原子间均以化学键相结合;②金属和非金属化合一定形成离子键;③离子键是阳离子和阴离子化合而形成的;④根据电离方程式 HCl===H++Cl-,可知HCl分子里存在离子键;⑤H 分
2
子和Cl 分子的反应过程是H 、Cl 分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的
2 2 2
过程。
上述各种说法正确的是
A.①②⑤正确 B.都不正确
C.④正确,其他不正确 D.仅①正确
【答案】D
【解析】
②中,金属与非金属化合不一定形成离子键,如Al和Cl 化合形成的AlCl 中是共价键;
2 3
③中,离子键是阴、阳离子间通过静电作用而形成的;
④中,HCl分子中存在的是共价键;
⑤中,H、Cl原子形成的是共价键。
18. 如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
A.Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由Z与X两种元素组成的化合物能与水反应
【答案】C
【解析】
根据图示可知X、Y、Z、M、N分别是O、Na、Al、Si、Cl。AlCl 熔融状态下以分子形式存在,不能
3
导电,A项错误;
HO分子间存在氢键,导致水的沸点比氯化氢的高,B项错误;
2
Al O 是两性氧化物,能够溶于NaOH溶液和HCl溶液,C项正确;
2 3
Al O 不能溶于水也不与水反应,D项错误。
2 3
19. 四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,
X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。
下列说法正确的是
A.简单离子半径:WZ
【答案】B【解析】
首先根据题中“X的原子半径是短周期主族元素原子中最大的”可知X元素为Na,再根据“Z与X形
成的离子化合物的水溶液呈中性”可知Z元素为Cl,进而可推知W、Y元素分别为N或O、P或S。
简单离子半径:Cl->N3-(O2-)>Na+,A错误;
Na与N或O形成的NaN、NaO或NaO 溶于水后均得到NaOH溶液,溶液呈碱性,B正确;
3 2 2 2
W与Y处于同一主族,同主族元素从上到下,非金属性逐渐减弱,对应的气态氢化物的热稳定性逐渐
减弱,则W>Y,C错误;
Y与Z处于同一周期,同周期元素从左到右,非金属性逐渐增强,最高价氧化物对应水化物的酸性逐
渐增强,则Z>Y,D错误。
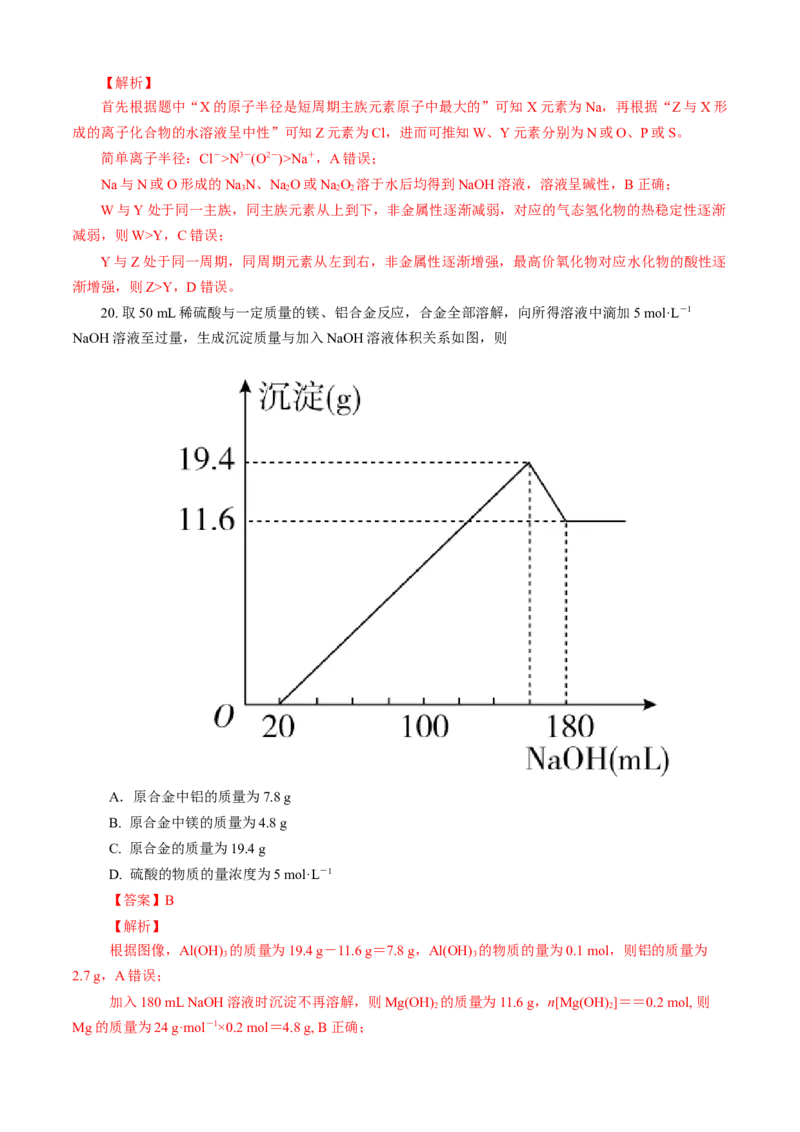
20. 取50 mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol·L-1
NaOH溶液至过量,生成沉淀质量与加入NaOH溶液体积关系如图,则
A.原合金中铝的质量为7.8 g
B. 原合金中镁的质量为4.8 g
C. 原合金的质量为19.4 g
D. 硫酸的物质的量浓度为5 mol·L-1
【答案】B
【解析】
根据图像,Al(OH) 的质量为19.4 g-11.6 g=7.8 g,Al(OH) 的物质的量为0.1 mol,则铝的质量为
3 3
2.7 g,A错误;
加入180 mL NaOH溶液时沉淀不再溶解,则Mg(OH) 的质量为11.6 g,n[Mg(OH) ]==0.2 mol, 则
2 2
Mg的质量为24 g·mol-1×0.2 mol=4.8 g, B正确;原合金质量为4.8 g+2.7 g=7.5 g,C错误;
消耗NaOH溶液的体积为160 mL 时,溶液的溶质全为NaSO ,从而可求出消耗HSO 的总量为=
2 4 2 4
0.4 mol,则硫酸的浓度为0.4 mol÷0.05 L=8 mol·L-1,D错误。
二、非选择题:本题共5个题,共60分。
21. (10分)
下图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。
(1)写出下列物质的化学式:B________;E__________。
(2)以上反应中属于氧化还原反应的有________(填写编号)。
(3)写出B→C反应的离子方程式:________________________________________;
C→E的化学方程式:_____________________________________________________。
(4)加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中
D的质量为__________。
【答案】
(1)Na O NaHCO
2 2 3
(2)①②③④
(3)2Na O+2HO===4Na++4OH-+O↑ NaOH+CO ===NaHCO
2 2 2 2 2 3
(4)4.16 g
【解析】
(1)A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色试验均为黄色,则为
钠的单质或钠的化合物,所以A为Na,结合转化关系可知,B为NaO ,C为NaOH,D为NaCO ,E为
2 2 2 3
NaHCO
3;
(2)以上反应中①为钠的燃烧,②为Na与水反应,③为过氧化钠与水反应,④为过氧化钠与二氧化碳
反应,均属于氧化还原反应;
(3)B→C是过氧化钠与水反应,离子方程式为2NaO +2HO===4Na++4OH-+O ↑,C→E是氢氧化
2 2 2 2
钠与过量CO 反应生成NaHCO ,化学方程式为NaOH+CO===NaHCO;
2 3 2 3
(4)利用差量法计算:
2NaHCO =====NaCO+CO↑+HO Δm
3 2 3 2 2
2×84 62
0.84 g 0.31 g
计算得到原混合物中碳酸氢钠的质量为0.84 g,所以混合物中碳酸钠的质量为5.00 g-0.84 g=4.16 g。
22. (12分)
已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G
为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当
前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A__________,E__________。
(2)F转化为G的过程中出现的现象是__________________________________________________。
(3)写出②中反应的离子方程式:____________________________________。
(4)①~⑥转化中不含有氧化还原反应的是__________(填序号)。
【答案】
(1)Na O HCl
2 2
(2)产生白色沉淀迅速变为灰绿色最终变为红褐色
(3)2Al+2OH-+2HO===2AlO+3H↑
2 2
(4)⑤⑥
【解析】由各物质的颜色和状态,可大致先推测A是NaO ,B是水,G是Fe(OH) ,丙是Cl ,则甲
2 2 3 2
是O ,C是NaOH,能与NaOH溶液反应的金属是Al,所以丁是Al,乙是H ,D是NaAlO ,戊是当前用
2 2 2
量最大的金属,应为Fe。E应是HCl,F是FeCl 。各物质确定后,不难得出各小题的答案。
2
(1)由上述分析可知,A为NaO,E为HCl,戊为Fe,故答案为:NaO;HCl;Fe;
2 2 2 2
(2)F转化为G是氯化亚铁反应得到氢氧化亚铁,氢氧化亚铁反应得到氢氧化铁,出现的现象是:产生
白色沉淀,迅速变为灰绿色,最终变为红褐色;
(3)反应②是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的离子方程式为:2Al+2OH-+
2HO===2AlO+3H↑;
2 2
(4)①∼⑥转化中,反应⑤是偏铝酸钠与HCl反应生成氢氧化铝,反应⑥是氢氧化铝与HCl反应生成氯
化铝,属于非氧化还原反应,其余为氧化还原反应,故答案为:⑤⑥。
23. (12分)
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是__________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示
“偏大”,填B表示“偏小”,填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面。( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
Ⅲ.定容摇匀后,发现液面低于刻度线,未做任何处理。( )
Ⅳ.定容时,俯视刻度线。( )
【答案】(1)11.9 (2)BD (3)①16.8 ②B B C A
【解析】
(1)c(HCl)==11.9 mol·L-1。
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl−的数目与溶液体积有关
(3)①根据c(浓)×V(浓)=c(稀)×V(稀),则取浓盐酸的体积V(浓)=≈0.016 8 L=16.8 mL。
②I. 用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液
浓度偏低;故答案为:B;
II. 转移浓溶液时操作不慎,有一滴液体溅出容量瓶,导致溶质部分损耗,溶质的物质的量偏小,溶
液浓度偏低;故答案为:B;
III. 定容摇匀后,发现液面低于刻度线,属于正常操作,溶液浓度准确,不受影响;故答案为:C;
IV. 定容时,俯视读数,所得溶液的浓度,导致溶液体积偏小,溶液浓度浓度偏高;故答案为:A.
24. (12分)
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元
素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为HBO ;C元素原
3
子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化
合物DC;C、E同主族。
2
(1)D在周期表中的位置为________;B的原子结构示意图为________。
(2)E元素形成的最高价氧化物对应水化物的化学式为______________。(3)元素C、D、E的原子半径大小关系是____________(用元素符号表示)。
(4)C、D可形成化合物DC ,DC 含有的化学键是______________________。
2 2 2 2
(5)A、C两种元素形成的原子个数比为1∶1的化合物的电子式为________。
【答案】
(1)第三周期ⅠA族
(2)H SO (3)Na>S>O (4)离子键、共价键
2 4
(5)HOOH
【解析】A元素的原子核内只有1个质子,则A为H,B元素的原子半径是其所在主族元素原子中最
小的,B的最高价氧化物对应水化物的化学式为HBO ,则B的最高化合价为+5,位于周期表中第ⅤA族,
3
应为N,C元素原子的最外层电子数比次外层电子数多4,则原子核外电子排布为2、6,应为O,C的阴
离子与D的阳离子具有相同的电子排布,两元素可形成化合物 DC,则D的化合价为+1,应为Na,C、E
2
同主族,则E为S。
(1)D为Na,核电荷数为 11,在周期表中的位置为第三周期Ⅰ A族,B为N,原子结构示意图为
。
(2)E为S,其最高价氧化物对应的水化物是HSO 。
2 4
(3)同主族元素的原子半径从上到下逐渐增大,同周期主族元素的原子半径从左到右逐渐减小,所以原
子半径大小关系为Na>S>O。
(4)D C 为过氧化钠,含有的化学键是离子键、共价键。
2 2
(5)A、C两种元素形成的原子个数比为1∶1的化合物为过氧化氢,电子式为HOOH。
25. (14分)
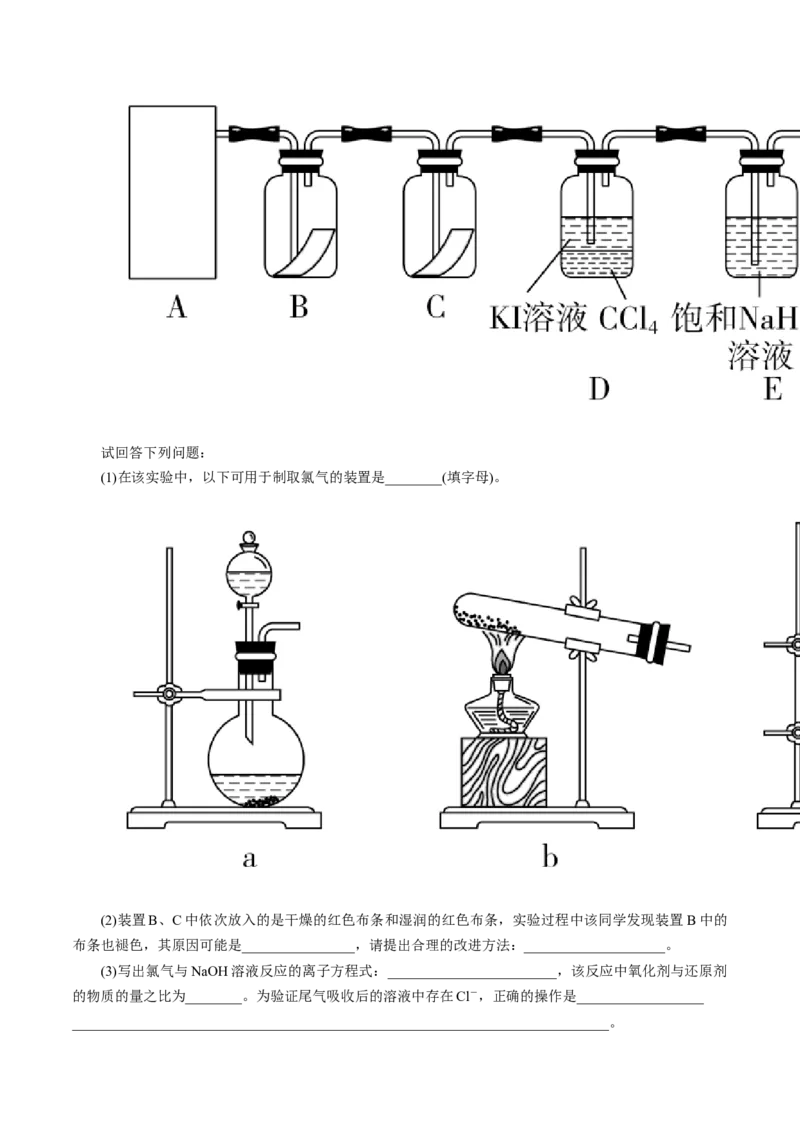
已知反应NaClO+NaCl+HSO =====NaSO +Cl↑+HO,为探究氯气的性质,某同学设计了如图
2 4 2 4 2 2
所示的实验装置。试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是________(填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的
布条也褪色,其原因可能是________________,请提出合理的改进方法:____________________。
(3)写出氯气与NaOH溶液反应的离子方程式:________________________,该反应中氧化剂与还原剂
的物质的量之比为________。为验证尾气吸收后的溶液中存在Cl-,正确的操作是__________________
____________________________________________________________________________。(4)氯气通入饱和NaHCO 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明Cl
3 2
与HO反应的产物中含有__________(填化学式)。
2
【答案】
(1)c
(2)Cl 中混有少量HO(g) 在A~B之间增设装有浓HSO 的洗气瓶
2 2 2 4
(3)Cl +2OH-===Cl-+ClO-+HO 1∶1 取少量烧杯内吸收Cl 后的溶液,加入足量的稀HNO 酸化,
2 2 2 3
再加入AgNO 溶液,若有白色沉淀生成,证明其中含有Cl-
3
(4)HCl
【解析】
(1)根据“固+液 气”可知应选择c装置制取Cl。
2
(2)干燥的布条褪色说明Cl 中混有HO(g),生成了HClO,故应增设除HO(g)的装置。
2 2 2
(3)Cl 与NaOH溶液反应的离子方程式为Cl +2OH-===Cl-+ClO-+HO,Cl 既作氧化剂,又作还原
2 2 2 2
剂,且物质的量之比为1∶1;为检验Cl-,应先用稀HNO 酸化中和溶液中的OH-,再加AgNO 溶液,若有
3 3
AgCl白色沉淀生成,证明含有Cl-。
(4)因酸性:HCl>H CO>HClO,HCl可与 NaHCO 反应:HCl+NaHCO ===NaCl+HO+CO↑,而
2 3 3 3 2 2
HClO不与NaHCO 反应,故氯气与HO反应的产物中含有HCl。
3 2