文档内容
【冲刺期末】高二化学期末模拟测试卷(一)
(时间:90分钟 满分:100分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1下列变化过程属于放热反应的是
①碳酸钙高温分解②H 在Cl 中燃烧③镁与稀硫酸反应④水蒸气变成液态水⑤酸碱中和⑥NH Cl晶体与
2 2 4
Ba(OH) •8H O晶体混合搅拌⑦SO 与水反应
2 2 3
A.①②③⑤ B.②③④⑤ C.②③⑤⑦ D.②④⑤⑦
2.已知断裂下列化学键需要吸收的能量:H—H为436 kJ/mol,F—F为153 kJ/mol,H—F为565 kJ/mol。下列说
法中正确的是 ( )
A.H 与F 反应的热化学方程式为H(g)+F (g) 2HF(g) ΔH=-541 kJ
2 2 2 2
B.2 L HF气体分解成1 L H 和1 L F 吸收541 kJ的热量
2 2
C.1 mol H 与1 mol F 反应生成2 mol液态HF放出的热量小于541 kJ
2 2
D.在相同条件下,1 mol H 与1 mol F 的能量总和大于2 mol HF气体的能量
2 2
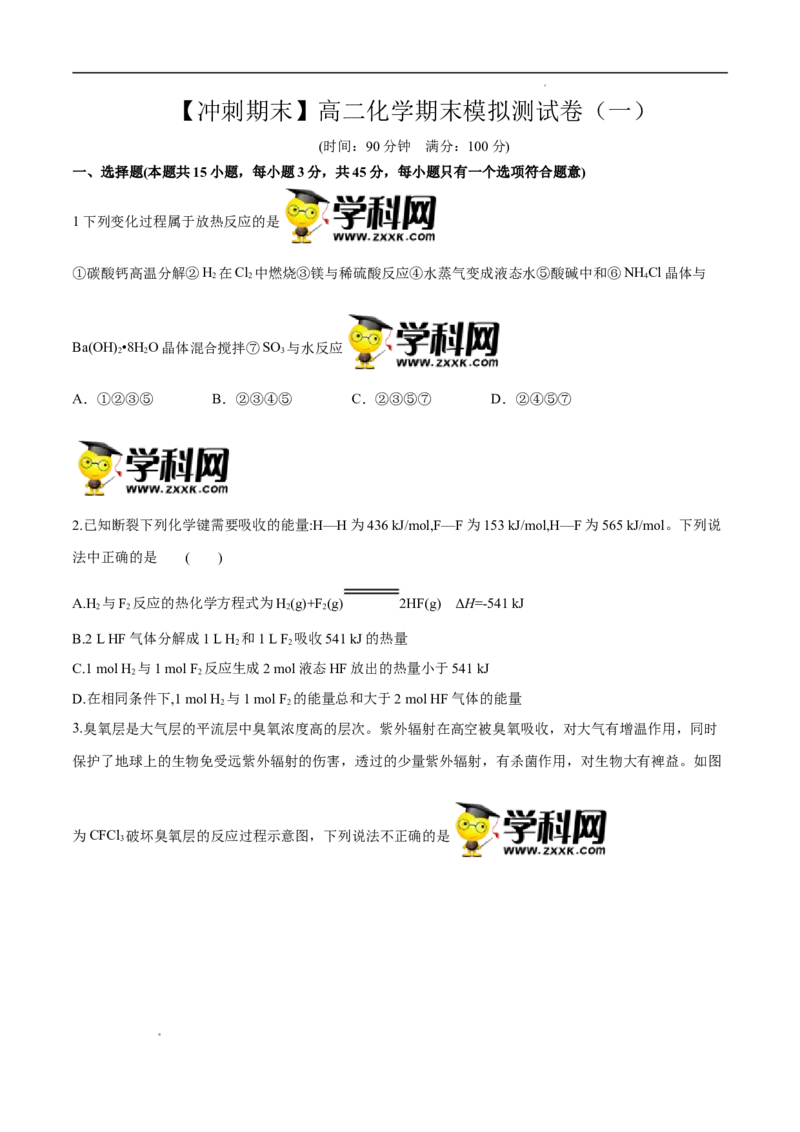
3.臭氧层是大气层的平流层中臭氧浓度高的层次。紫外辐射在高空被臭氧吸收,对大气有增温作用,同时
保护了地球上的生物免受远紫外辐射的伤害,透过的少量紫外辐射,有杀菌作用,对生物大有裨益。如图
为CFCl 破坏臭氧层的反应过程示意图,下列说法不正确的是
3
学科网(北京)股份有限公司学科网(北京)股份有限公司A.过程Ⅰ中断裂极性键C-Cl键
B.过程Ⅱ可表示为O+ Cl=ClO + O
3 2
C.过程Ⅲ中O+O=O 是吸热过程
2
D.上述过程说明氟利昂中氯原子是破坏O 的催化剂
3
4.原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是 ( )
A.由Al、Cu、稀HSO 溶液组成原电池,其负极反应式为Al-3e- Al3+
2 4
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al+4OH--3e- AlO-+2H O
2 2
C.由Fe、Cu、FeCl 溶液组成原电池,其负极反应式为Cu-2e- Cu2+
3
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e- Cu2+
5.一定条件下,2.24L(标准状况)CO与 的混合气体燃烧时,放出11.32 kJ的热
量,反应后恢复至原状态,产物的密度为原来气体密度的1.25倍,则CO的燃烧热
A. B.
C. D.
学科网(北京)股份有限公司6.将固体NH I置于密闭容器中,在一定温度下发生下列反应:①NHI(s) NH (g)+HI(g);②2HI(g)
4 4 3
H(g)+I (g)。达到化学平衡时,c(H )=0.5 mol/L,c(HI)=4 mol/L,则此温度下反应①的平衡常数为(
2 2 2
)
A.9 B.16 C.20 D.25
7.在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和反应反应热。下列关于
该实验的说法正确的是
A.烧杯间的碎泡沫塑料的作用是固定烧杯的位置
B.如果没有玻璃搅拌器,酸碱混合后可用温度计轻轻搅拌
C.完成一次中和反应反应热测定实验温度计需要使用2次,分别用于测混合液的初始温度和反应最高温
度
D.由 可知,0.5 mol稀
溶液与1 mol NaOH稀溶液完全反应,放出热量为57.3 kJ
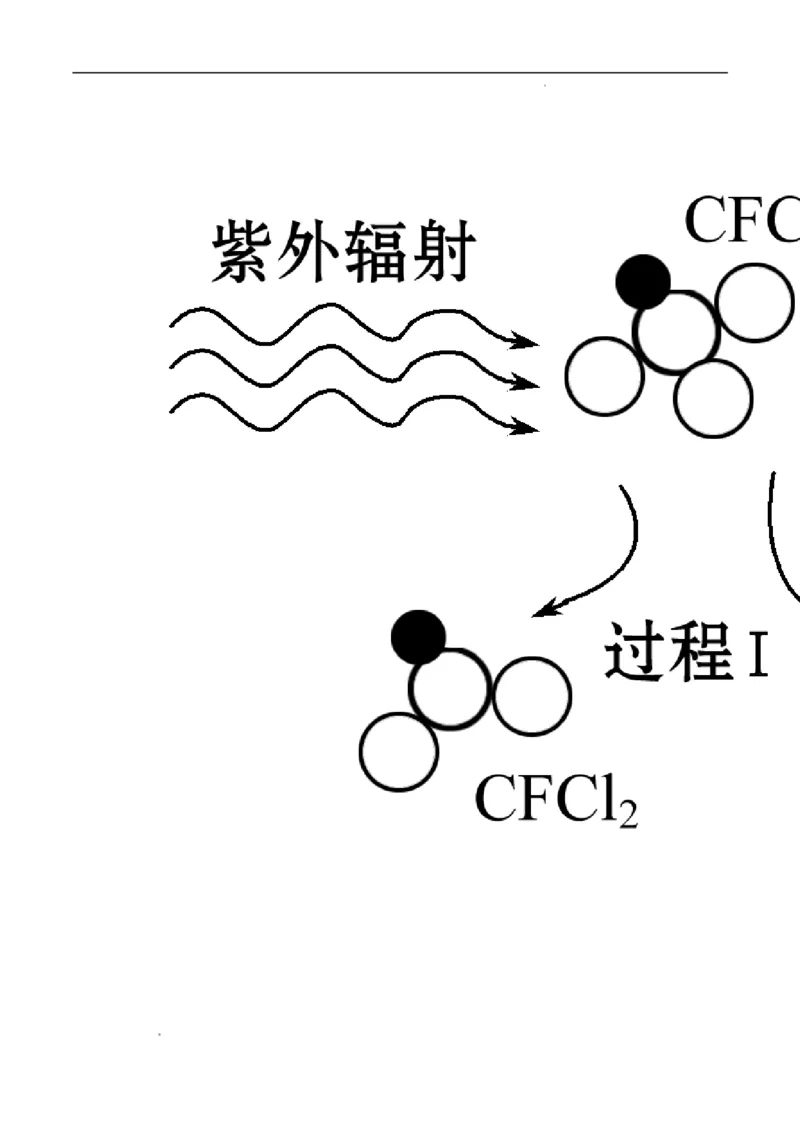
8.实现“节能减排”和“低碳经济”的一个重要课题就是如何将CO 转化为可利用的资源。目前工业上有
2
一种方法是用CO 来生产燃料甲醇。一定条件下发生反应:CO(g)+3H(g) ===CH OH(g)+HO(g),如图
2 2 2 3 2
学科网(北京)股份有限公司表示该反应过程中能量(单位为 kJ·mol-1)的变化。关于该反应的下列说法中,正确的是( )
A.ΔH>0,ΔS>0 B . ΔH > 0 , ΔS < 0
学科网(北京)股份有限公司C.ΔH<0,ΔS<0 D . ΔH < 0 , ΔS > 0
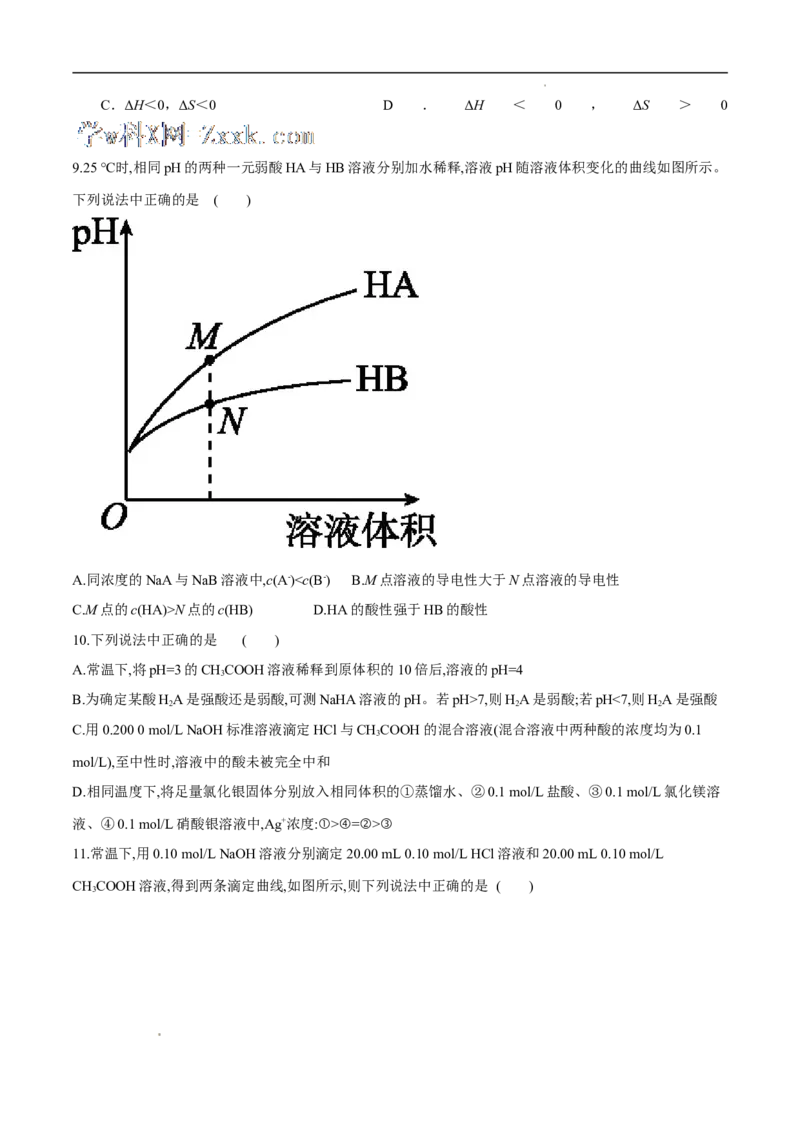
9.25 ℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。
下列说法中正确的是 ( )
A.同浓度的NaA与NaB溶液中,c(A-)N点的c(HB) D.HA的酸性强于HB的酸性
10.下列说法中正确的是 ( )
A.常温下,将pH=3的CHCOOH溶液稀释到原体积的10倍后,溶液的pH=4
3
B.为确定某酸HA是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则HA是弱酸;若pH<7,则HA是强酸
2 2 2
C.用0.200 0 mol/L NaOH标准溶液滴定HCl与CHCOOH的混合溶液(混合溶液中两种酸的浓度均为0.1
3
mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶
液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③
11.常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10 mol/L HCl溶液和20.00 mL 0.10 mol/L
CHCOOH溶液,得到两条滴定曲线,如图所示,则下列说法中正确的是 ( )
3
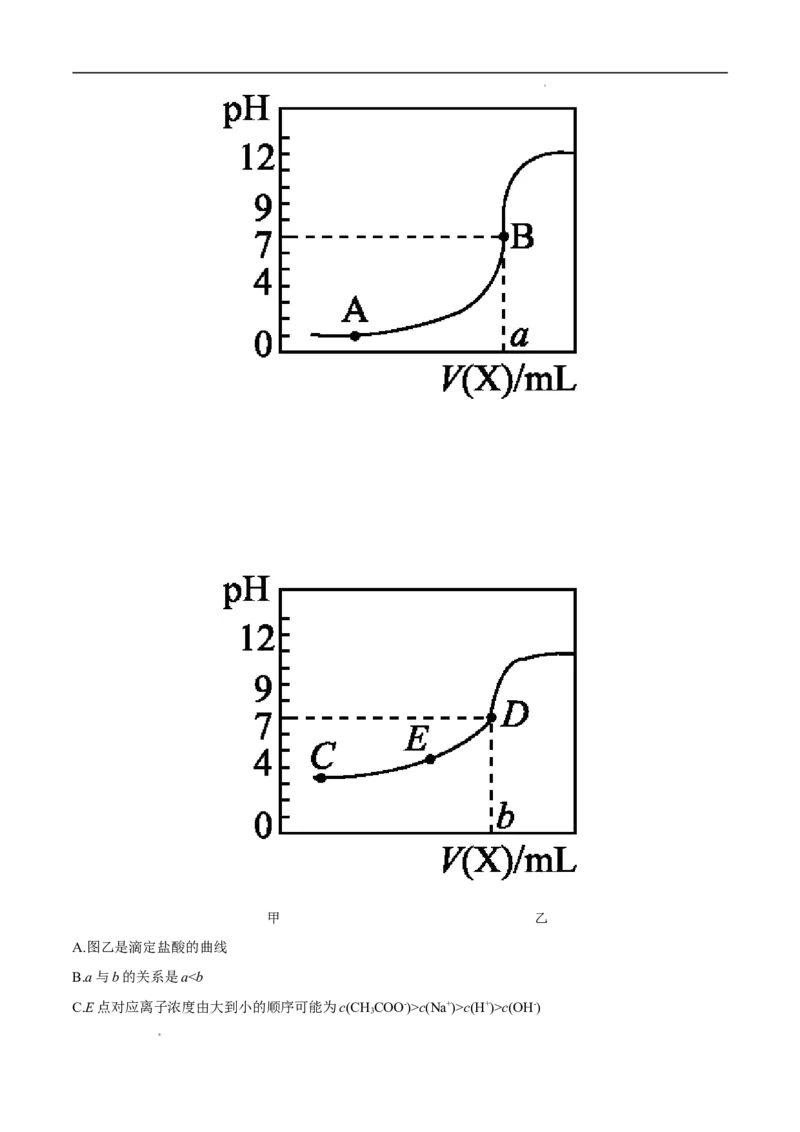
学科网(北京)股份有限公司甲 乙
A.图乙是滴定盐酸的曲线
B.a与b的关系是ac(Na+)>c(H+)>c(OH-)
3
学科网(北京)股份有限公司D.这两次滴定都可以用甲基橙作为指示剂
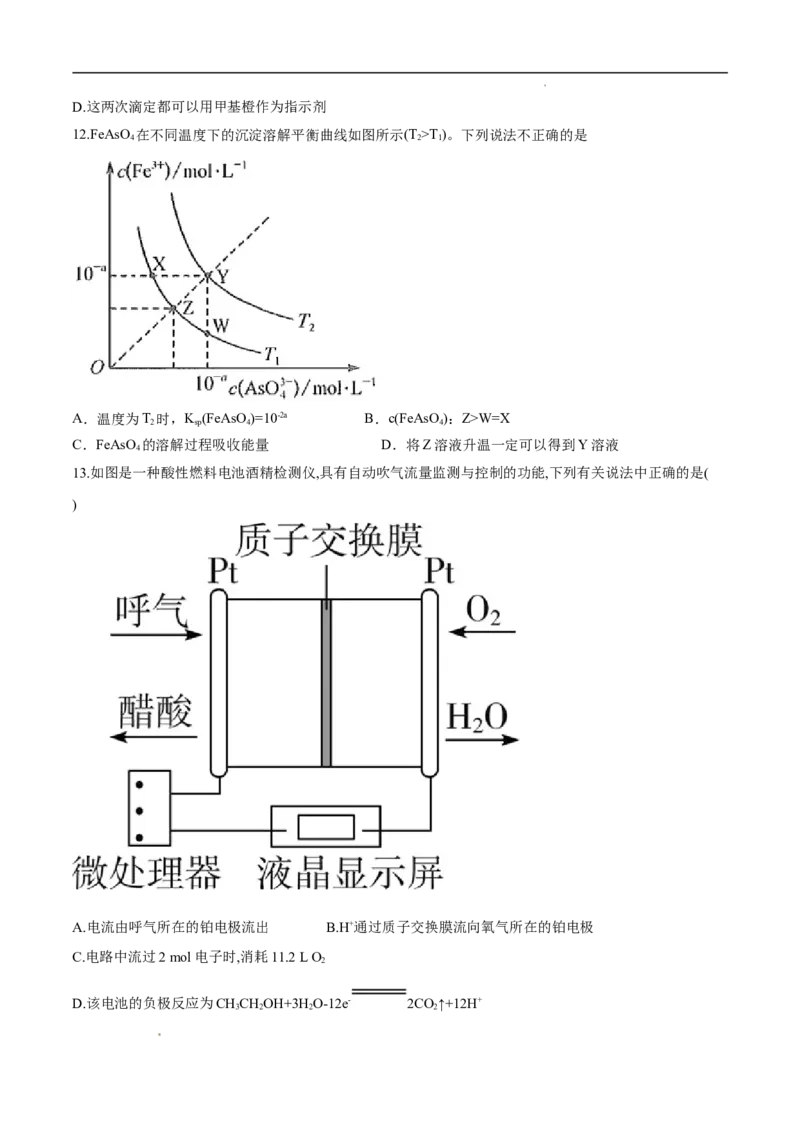
12.FeAsO 在不同温度下的沉淀溶解平衡曲线如图所示(T >T)。下列说法不正确的是
4 2 1
A.温度为T 时,K (FeAsO)=10-2a B.c(FeAsO ):Z>W=X
2 sp 4 4
C.FeAsO 的溶解过程吸收能量 D.将Z溶液升温一定可以得到Y溶液
4
13.如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法中正确的是(
)
A.电流由呼气所在的铂电极流出 B.H+通过质子交换膜流向氧气所在的铂电极
C.电路中流过2 mol电子时,消耗11.2 L O
2
D.该电池的负极反应为CHCHOH+3H O-12e- 2CO↑+12H+
3 2 2 2
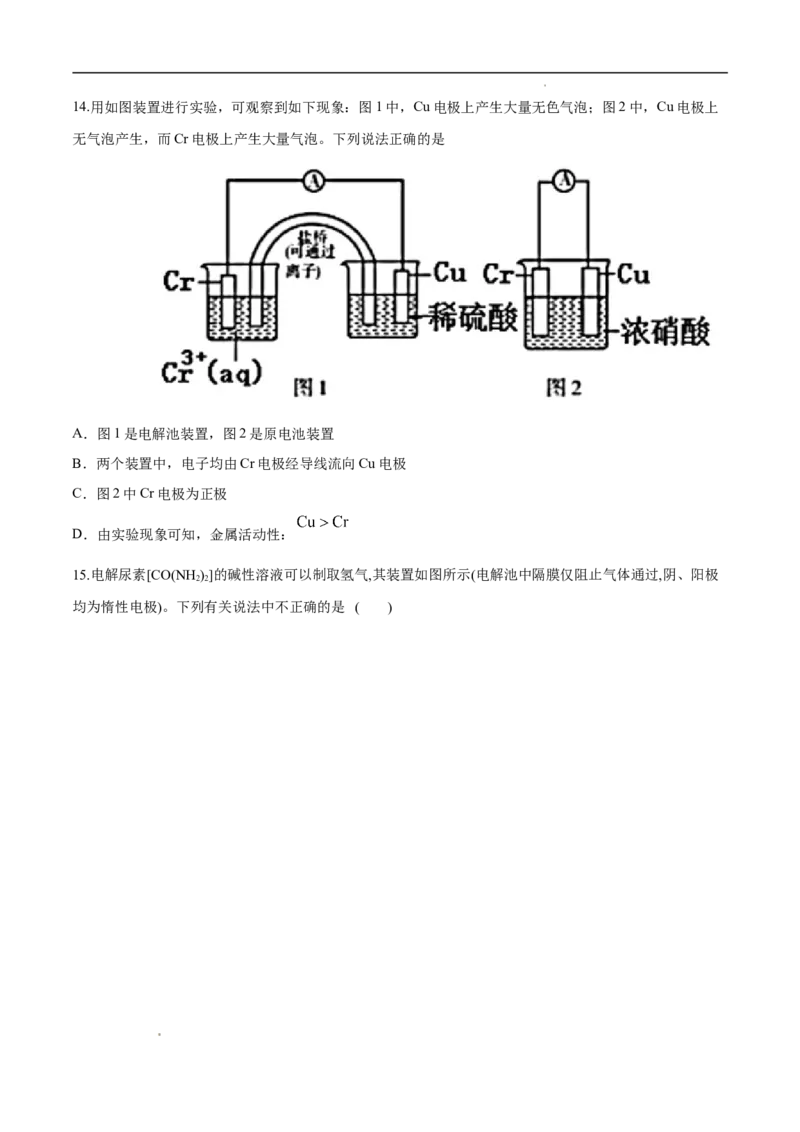
学科网(北京)股份有限公司14.用如图装置进行实验,可观察到如下现象:图1中,Cu电极上产生大量无色气泡;图2中,Cu电极上
无气泡产生,而Cr电极上产生大量气泡。下列说法正确的是
A.图1是电解池装置,图2是原电池装置
B.两个装置中,电子均由Cr电极经导线流向Cu电极
C.图2中Cr电极为正极
D.由实验现象可知,金属活动性:
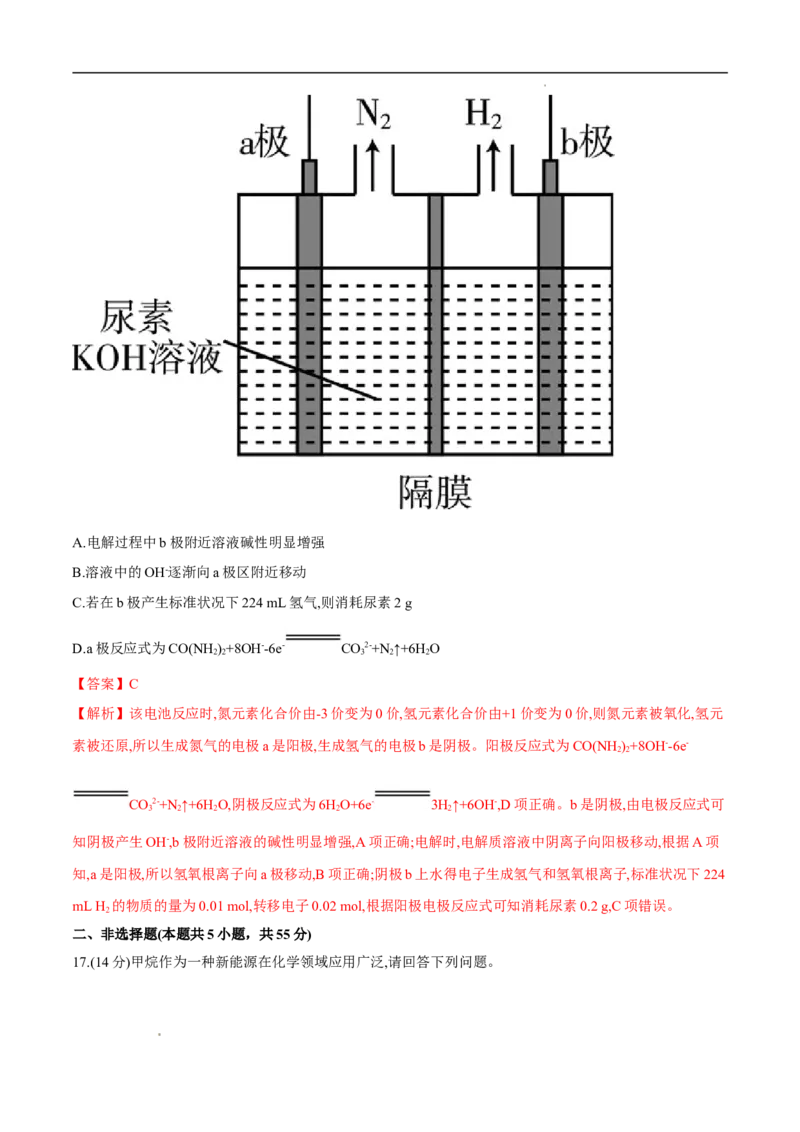
15.电解尿素[CO(NH)]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极
2 2
均为惰性电极)。下列有关说法中不正确的是 ( )
学科网(北京)股份有限公司A.电解过程中b极附近溶液碱性明显增强
B.溶液中的OH-逐渐向a极区附近移动
C.若在b极产生标准状况下224 mL氢气,则消耗尿素2 g
D.a极反应式为CO(NH)+8OH--6e- CO2-+N ↑+6H O
2 2 3 2 2
【答案】C
【解析】该电池反应时,氮元素化合价由-3价变为0价,氢元素化合价由+1价变为0价,则氮元素被氧化,氢元
素被还原,所以生成氮气的电极a是阳极,生成氢气的电极b是阴极。阳极反应式为CO(NH)+8OH--6e-
2 2
CO2-+N ↑+6H O,阴极反应式为6HO+6e- 3H↑+6OH-,D项正确。b是阴极,由电极反应式可
3 2 2 2 2
知阴极产生OH-,b极附近溶液的碱性明显增强,A项正确;电解时,电解质溶液中阴离子向阳极移动,根据A项
知,a是阳极,所以氢氧根离子向a极移动,B项正确;阴极b上水得电子生成氢气和氢氧根离子,标准状况下224
mL H 的物质的量为0.01 mol,转移电子0.02 mol,根据阳极电极反应式可知消耗尿素0.2 g,C项错误。
2
二、非选择题(本题共5小题,共55分)
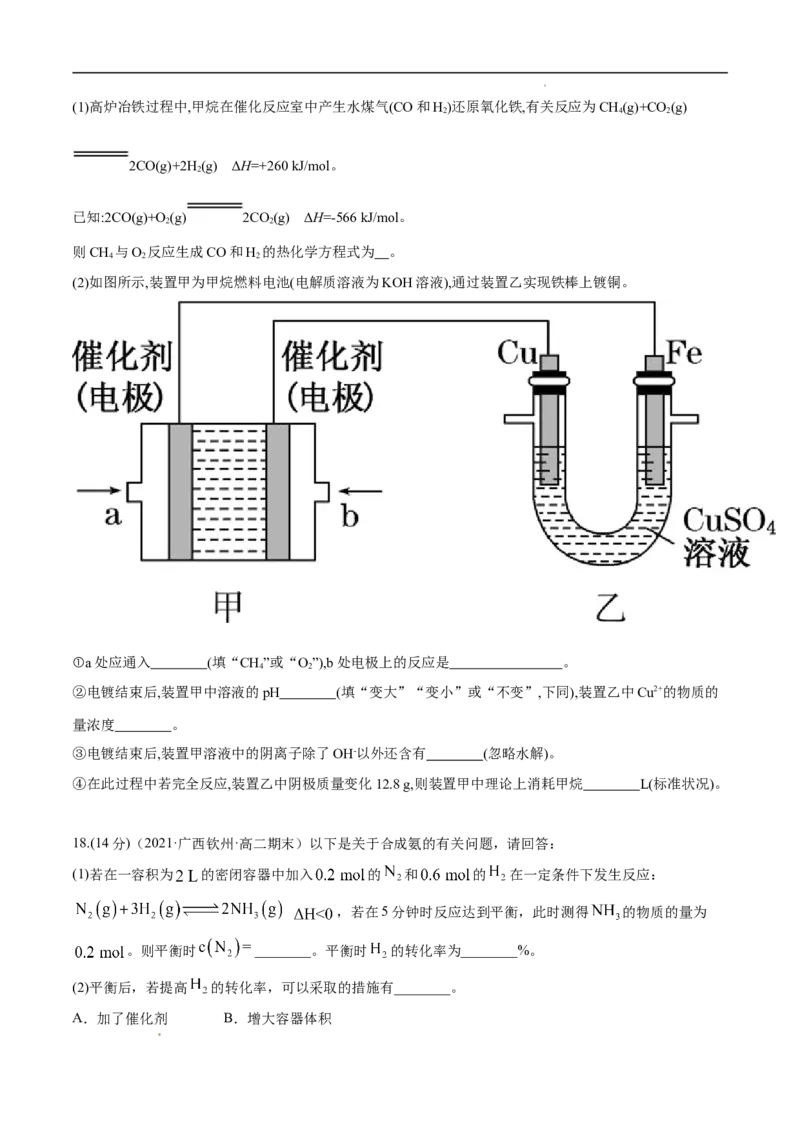
17.(14分)甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
学科网(北京)股份有限公司(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H)还原氧化铁,有关反应为CH(g)+CO (g)
2 4 2
2CO(g)+2H(g) ΔH=+260 kJ/mol。
2
已知:2CO(g)+O (g) 2CO(g) ΔH=-566 kJ/mol。
2 2
则CH 与O 反应生成CO和H 的热化学方程式为 。
4 2 2
(2)如图所示,装置甲为甲烷燃料电池(电解质溶液为KOH溶液),通过装置乙实现铁棒上镀铜。
①a处应通入 (填“CH”或“O”),b处电极上的反应是 。
4 2
②电镀结束后,装置甲中溶液的pH (填“变大”“变小”或“不变”,下同),装置乙中Cu2+的物质的
量浓度 。
③电镀结束后,装置甲溶液中的阴离子除了OH-以外还含有 (忽略水解)。
④在此过程中若完全反应,装置乙中阴极质量变化12.8 g,则装置甲中理论上消耗甲烷 L(标准状况)。
18.(14分)(2021·广西钦州·高二期末)以下是关于合成氨的有关问题,请回答:
(1)若在一容积为 的密闭容器中加入 的 和 的 在一定条件下发生反应:
,若在5分钟时反应达到平衡,此时测得 的物质的量为
。则平衡时 ________。平衡时 的转化率为________%。
(2)平衡后,若提高 的转化率,可以采取的措施有________。
A.加了催化剂 B.增大容器体积
学科网(北京)股份有限公司C.降低反应体系的温度 D.加入一定量
(3)若在 的密闭容器中,一定量的氮气和氢气进行如下反应:
,其化学平衡常数 与温度 的关系如表所示:
T/
200 300 400
℃
0.5
请完成下列问题:
①写出化学平衡常数 的表达式___________。
②试比较 、 的大小, ___________ (填“ ”、“ ”或“ ”);
③400℃时,反应 的化学平衡常数为_____。当测得 、 和 物质
的量分别为 、 和 时,则该反应的 _________ (填“ ”、“ ”或“ ”)。
19.(13分)某些非金属单质如白磷(P )可以与强碱溶液发生反应,可以与过量的热NaOH溶液反应生成PH 气
4 3
体和NaH PO (次磷酸钠)。
2 2
(1)已知NaH PO 溶液的pH>7,次磷酸是 (填“一”“二”或“三”)元 (填“强”或“弱”)
2 2
酸。次磷酸的电离方程式为 ;NaHPO 溶液的pH>7的原因是 (用离子
2 2
方程式表示)。
(2)25 ℃时,向100 mL 0.1 mol/L的HPO 溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的
3 2
体积 (填“>”“<”或“=”)100 mL。此时溶液中离子浓度由大到小的顺序是
。
20.(14分)(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
a.当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是_______ (用字母表示,下同)。
b.同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是_______。
c.若三者c(H+)相同时,物质的量浓度由大到小的顺序是_______。
d.将c(H+)相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液液
的体积大小关系为_______。
e.将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_______。
(2)当HS浓度较低时常用纯碱溶液进行吸收。表为HS、HCO 的电离平衡常数。
2 2 2 3
电离平衡常数 K K
al a2
HS 9.1×10-8 1.1×10-12
2
学科网(北京)股份有限公司HCO 4.3×10-7 5.61×10-11
2 3
纯碱溶液吸收少量HS的离子方程式为_______。
2
(3)磷酸是三元弱酸,常温下三级电离常数分别是K =7.1×10-3,K =6.2×10-8,K =4.5×10-13,解答下列问
a1 a2 a3
题:
a.常温下同浓度①NaPO 、②NaHPO 、③NaH PO 的pH由小到大的顺序是_______(填序号)。
3 4 2 4 2 4
b.常温下,NaH PO 的水溶液pH_______ (填“>”“<”或“=”)7。
2 4
c.常温下,NaHPO 的水溶液呈_______(填“酸”“碱”或“中”)性
2 4
学科网(北京)股份有限公司学科网(北京)股份有限公司