文档内容
北海市 2024 年春季学期期末教学质量检测
高一化学
全卷满分100分,考试时间75分钟.
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的
指定位置.
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题
区域均无效.
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作
答;字体工整,笔迹清楚.
4.考试结束后,请将试卷和答题卡一并上交.
5.本卷主要考查内容:必修第二册.
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项
是符合题目要求的.
1.化学与生产、生活及科技密切相关.下列有关说法正确的是( )
A.生活中常用聚乙烯制成的薄膜来包装水果、蔬菜等食物
B.几千年以前,人们就知道用粮食发酵来制作美酒,酒的主要成分为乙酸
C.生物实验室里,常用福尔马林来保存动物标本,福尔马林是乙醛溶液的俗称
D.用二氧化硅可以制成计算机、通信设备和家用电器等的芯片
2.从微观角度认识物质是掌握物质性质的途径之一.下列有关说法错误的是( )
A.乙烯分子的电子式: B.乙酸中含有的官能团: 或
C.甲烷分子的空间填充模型: D.乙醇的结构简式:
3.在现代食品工业中,食品添加剂的合理使用满足了人们对食品多样化的需求.下列食品添加剂与类别对应
正确的是( )
A.加工腊肉、香肠时添加的亚硝酸钠属于着色剂
B.制作馒头、面包时加入的小苏打属于膨松剂
C.糖果中添加的苋菜红、柠檬黄、靛蓝等属于增味剂
D.食物中添加的味精(即谷氨酸钠)属于防腐剂
4.“绿色化学”也称作环境友好化学,其核心思想就是改变“先污染后治理”的观念和做法.下列实验或叙
述中不符合“绿色化学”理念的是( )
学科网(北京)股份有限公司A.用乙醇汽油代替普通汽油作汽车燃料
B.工业合成氨时,氨分离后剩余的气体再利用
C.制 时先将 氧化成 后再与稀硫酸反应
D.通过化学方法去治理排放到环境中的废气、废渣、废液
5.氮的化合物对人类社会发展意义重大,下列说法错误的是( )
A.氮元素是动植物生长的必需元素,自然界有丰富的固氮途径
B.人工固氮的途径发展到今天已经很成熟,没有继续研究的必要
C.液氨汽化吸收大量热,因此可用作工业制冷剂
D.浓硝酸常温下可以用铁或铝制容器盛装
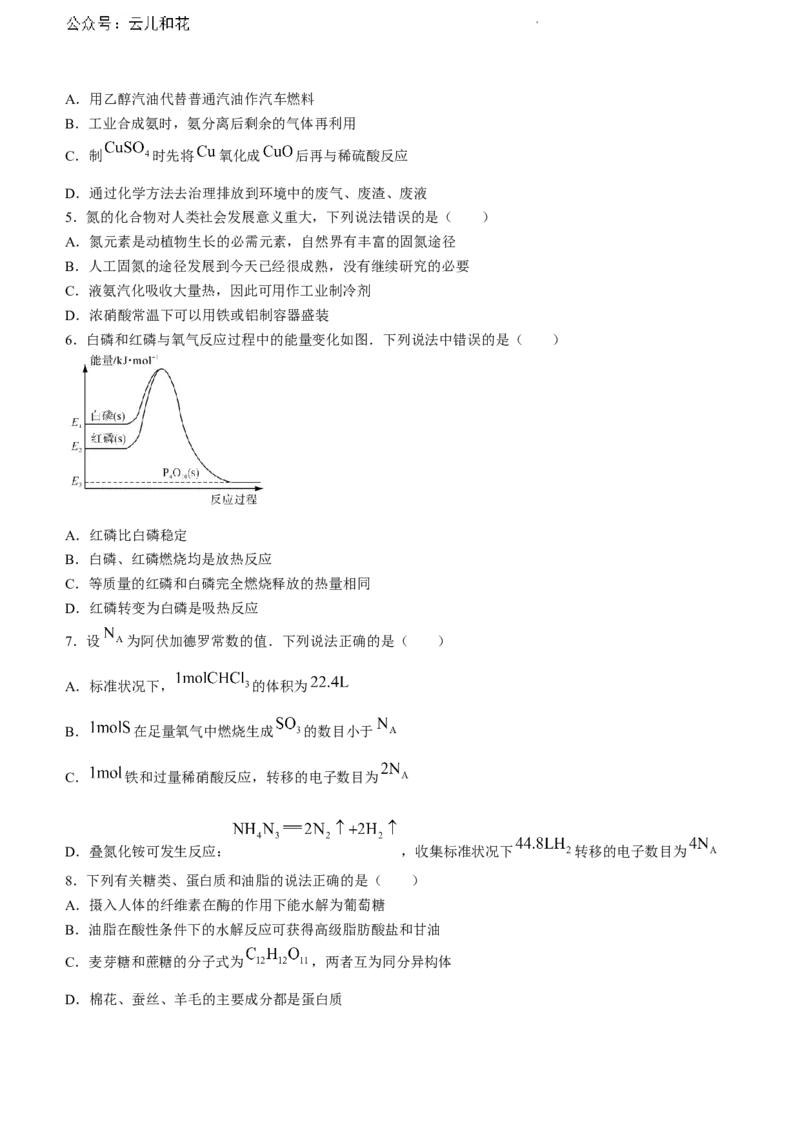
6.白磷和红磷与氧气反应过程中的能量变化如图.下列说法中错误的是( )
A.红磷比白磷稳定
B.白磷、红磷燃烧均是放热反应
C.等质量的红磷和白磷完全燃烧释放的热量相同
D.红磷转变为白磷是吸热反应
7.设 为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下, 的体积为
B. 在足量氧气中燃烧生成 的数目小于
C. 铁和过量稀硝酸反应,转移的电子数目为
D.叠氮化铵可发生反应: ,收集标准状况下 转移的电子数目为
8.下列有关糖类、蛋白质和油脂的说法正确的是( )
A.摄入人体的纤维素在酶的作用下能水解为葡萄糖
B.油脂在酸性条件下的水解反应可获得高级脂肪酸盐和甘油
C.麦芽糖和蔗糖的分子式为 ,两者互为同分异构体
D.棉花、蚕丝、羊毛的主要成分都是蛋白质
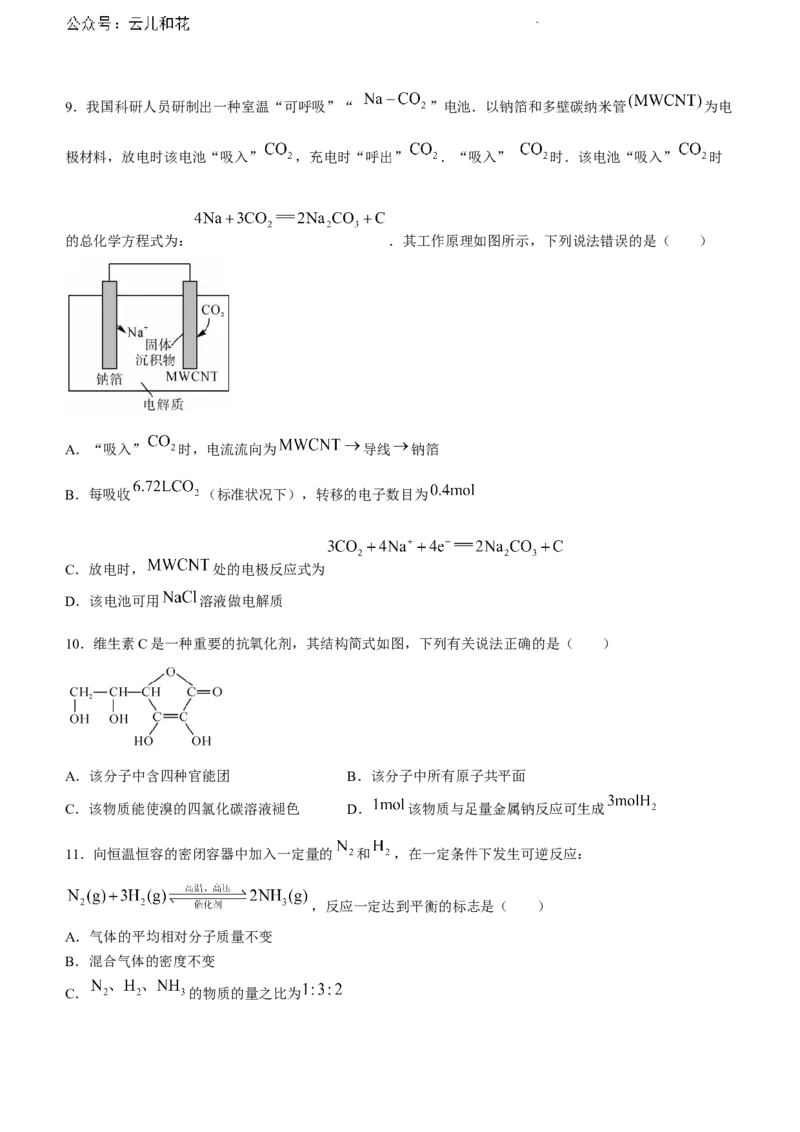
学科网(北京)股份有限公司9.我国科研人员研制出一种室温“可呼吸”“ ”电池.以钠箔和多壁碳纳米管 为电
极材料,放电时该电池“吸入” ,充电时“呼出” .“吸入” 时.该电池“吸入” 时
的总化学方程式为: .其工作原理如图所示,下列说法错误的是( )
A.“吸入” 时,电流流向为 导线 钠箔
B.每吸收 (标准状况下),转移的电子数目为
C.放电时, 处的电极反应式为
D.该电池可用 溶液做电解质
10.维生素C是一种重要的抗氧化剂,其结构简式如图,下列有关说法正确的是( )
A.该分子中含四种官能团 B.该分子中所有原子共平面
C.该物质能使溴的四氯化碳溶液褪色 D. 该物质与足量金属钠反应可生成
11.向恒温恒容的密闭容器中加入一定量的 和 ,在一定条件下发生可逆反应:
,反应一定达到平衡的标志是( )
A.气体的平均相对分子质量不变
B.混合气体的密度不变
C. 的物质的量之比为
学科网(北京)股份有限公司D.单位时间内 键断裂,同时 键形成
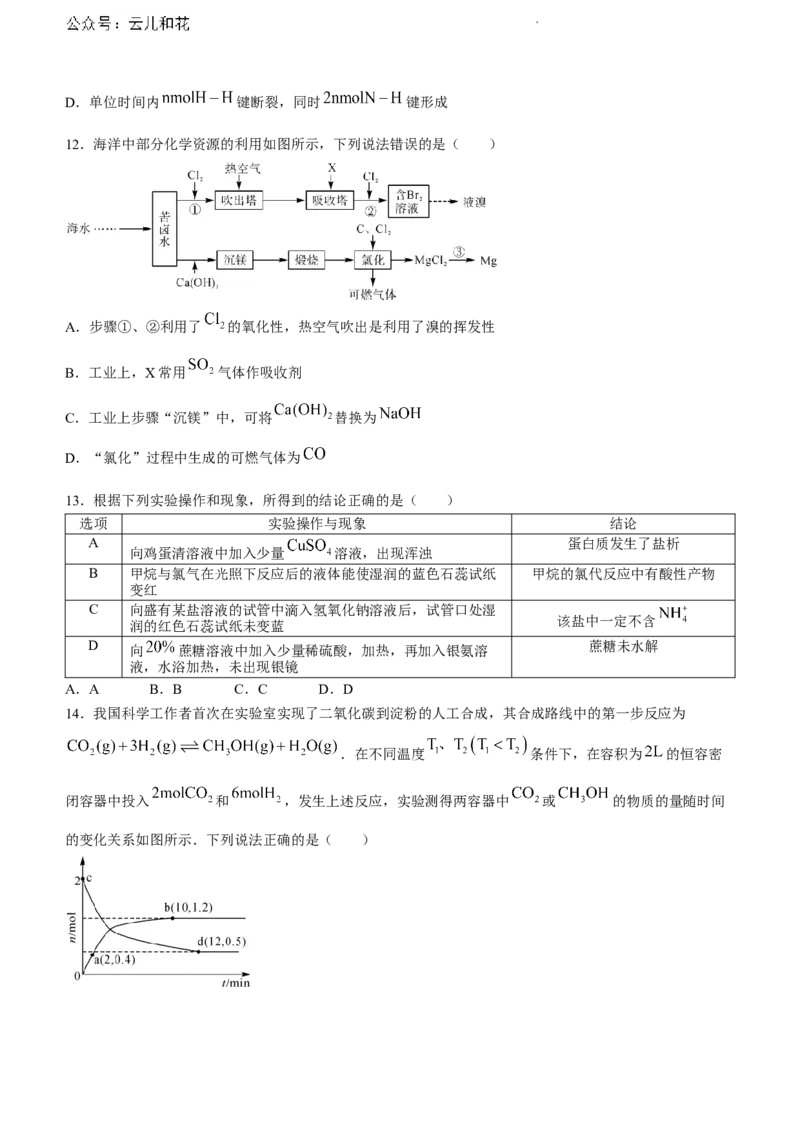
12.海洋中部分化学资源的利用如图所示,下列说法错误的是( )
A.步骤①、②利用了 的氧化性,热空气吹出是利用了溴的挥发性
B.工业上,X常用 气体作吸收剂
C.工业上步骤“沉镁”中,可将 替换为
D.“氯化”过程中生成的可燃气体为
13.根据下列实验操作和现象,所得到的结论正确的是( )
选项 实验操作与现象 结论
A 蛋白质发生了盐析
向鸡蛋清溶液中加入少量 溶液,出现浑浊
B 甲烷与氯气在光照下反应后的液体能使湿润的蓝色石蕊试纸 甲烷的氯代反应中有酸性产物
变红
C 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,试管口处湿
该盐中一定不含
润的红色石蕊试纸未变蓝
D 蔗糖未水解
向 蔗糖溶液中加入少量稀硫酸,加热,再加入银氨溶
液,水浴加热,未出现银镜
A.A B.B C.C D.D
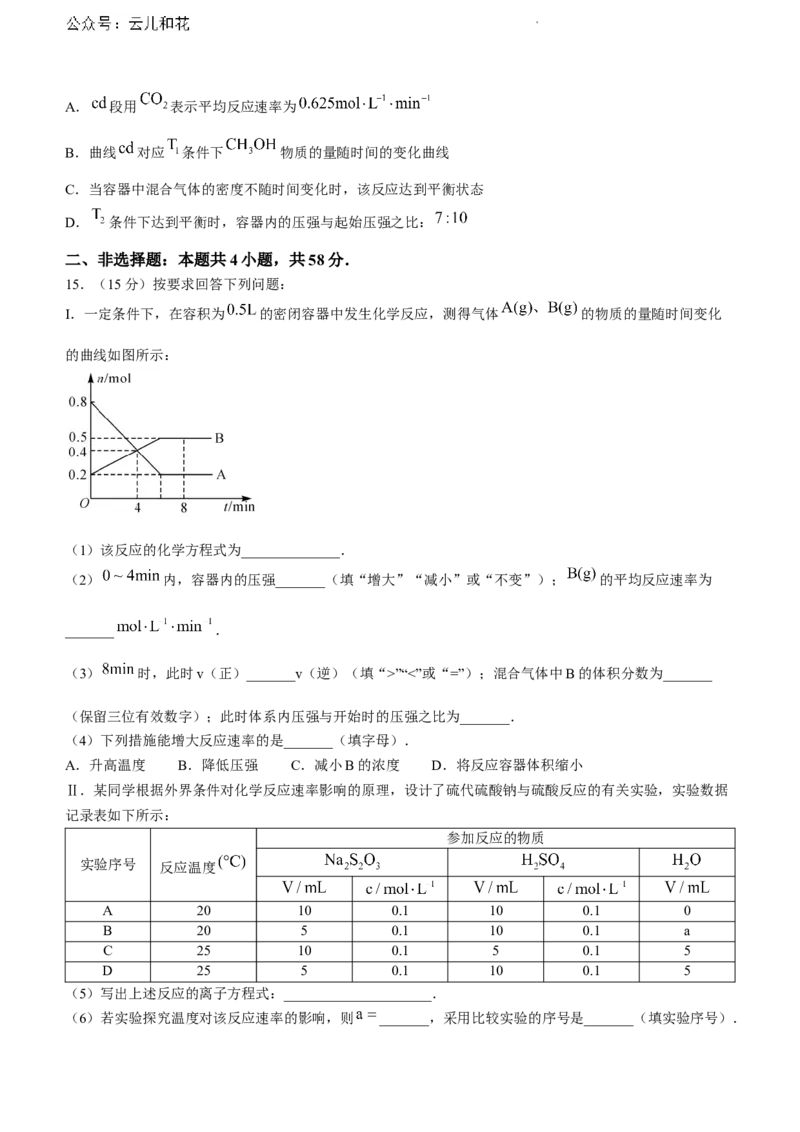
14.我国科学工作者首次在实验室实现了二氧化碳到淀粉的人工合成,其合成路线中的第一步反应为
.在不同温度 条件下,在容积为 的恒容密
闭容器中投入 和 ,发生上述反应,实验测得两容器中 或 的物质的量随时间
的变化关系如图所示.下列说法正确的是( )
学科网(北京)股份有限公司A. 段用 表示平均反应速率为
B.曲线 对应 条件下 物质的量随时间的变化曲线
C.当容器中混合气体的密度不随时间变化时,该反应达到平衡状态
D. 条件下达到平衡时,容器内的压强与起始压强之比:
二、非选择题:本题共4小题,共58分.
15.(15分)按要求回答下列问题:
I.一定条件下,在容积为 的密闭容器中发生化学反应,测得气体 的物质的量随时间变化
的曲线如图所示:
(1)该反应的化学方程式为______________.
(2) 内,容器内的压强_______(填“增大”“减小”或“不变”); 的平均反应速率为
_______ .
(3) 时,此时v(正)_______v(逆)(填“>”“<”或“=”);混合气体中B的体积分数为_______
(保留三位有效数字);此时体系内压强与开始时的压强之比为_______.
(4)下列措施能增大反应速率的是_______(填字母).
A.升高温度 B.降低压强 C.减小B的浓度 D.将反应容器体积缩小
Ⅱ.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验数据
记录表如下所示:
参加反应的物质
实验序号 反应温度
A 20 10 0.1 10 0.1 0
B 20 5 0.1 10 0.1 a
C 25 10 0.1 5 0.1 5
D 25 5 0.1 10 0.1 5
(5)写出上述反应的离子方程式:_____________________.
(6)若实验探究温度对该反应速率的影响,则 _______,采用比较实验的序号是_______(填实验序号).
学科网(北京)股份有限公司(7)比较A和B的组合可得,两组所研究的问题是______________.
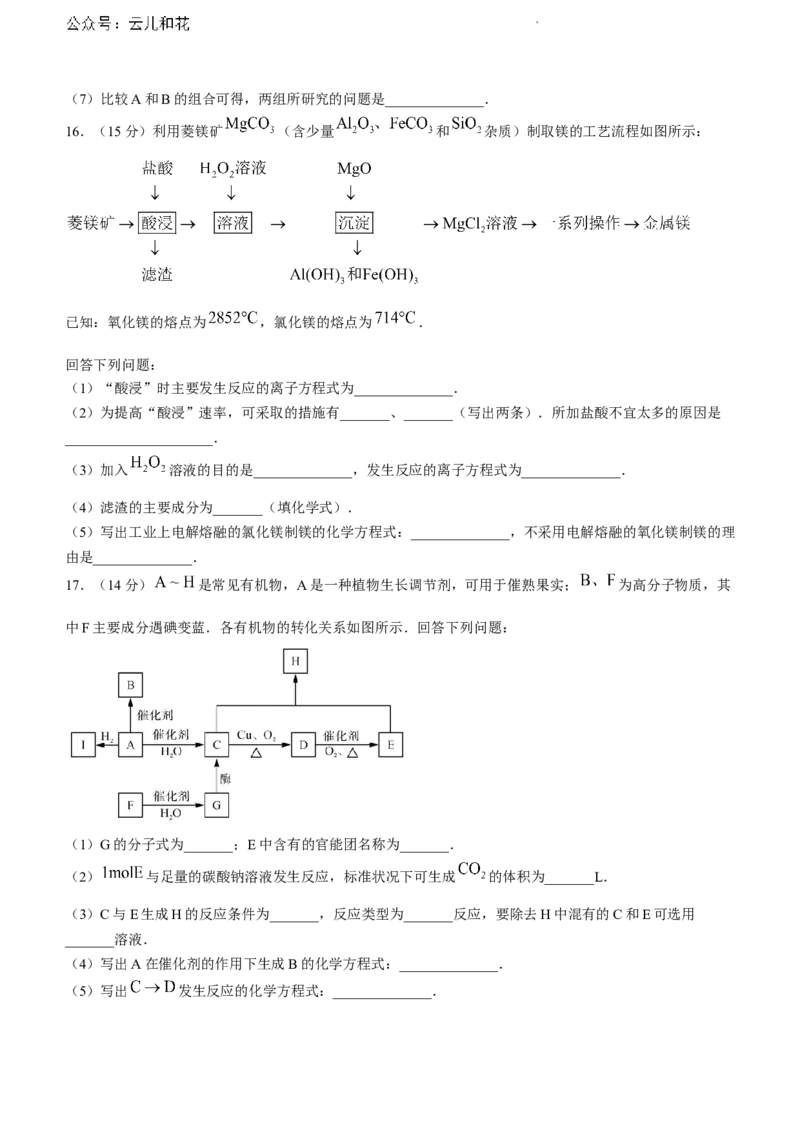
16.(15分)利用菱镁矿 (含少量 和 杂质)制取镁的工艺流程如图所示:
已知:氧化镁的熔点为 ,氯化镁的熔点为 .
回答下列问题:
(1)“酸浸”时主要发生反应的离子方程式为______________.
(2)为提高“酸浸”速率,可采取的措施有_______、_______(写出两条).所加盐酸不宜太多的原因是
_____________________.
(3)加入 溶液的目的是______________,发生反应的离子方程式为______________.
(4)滤渣的主要成分为_______(填化学式).
(5)写出工业上电解熔融的氯化镁制镁的化学方程式:______________,不采用电解熔融的氧化镁制镁的理
由是______________.
17.(14分) 是常见有机物,A是一种植物生长调节剂,可用于催熟果实; 为高分子物质,其
中F主要成分遇碘变蓝.各有机物的转化关系如图所示.回答下列问题:
(1)G的分子式为_______;E中含有的官能团名称为_______.
(2) 与足量的碳酸钠溶液发生反应,标准状况下可生成 的体积为_______L.
(3)C与E生成H的反应条件为_______,反应类型为_______反应,要除去H中混有的C和E可选用
_______溶液.
(4)写出A在催化剂的作用下生成B的化学方程式:______________.
(5)写出 发生反应的化学方程式:______________.
学科网(北京)股份有限公司(6)J与I互为同系物,相对分子质量为 的同分异构体有_______种.
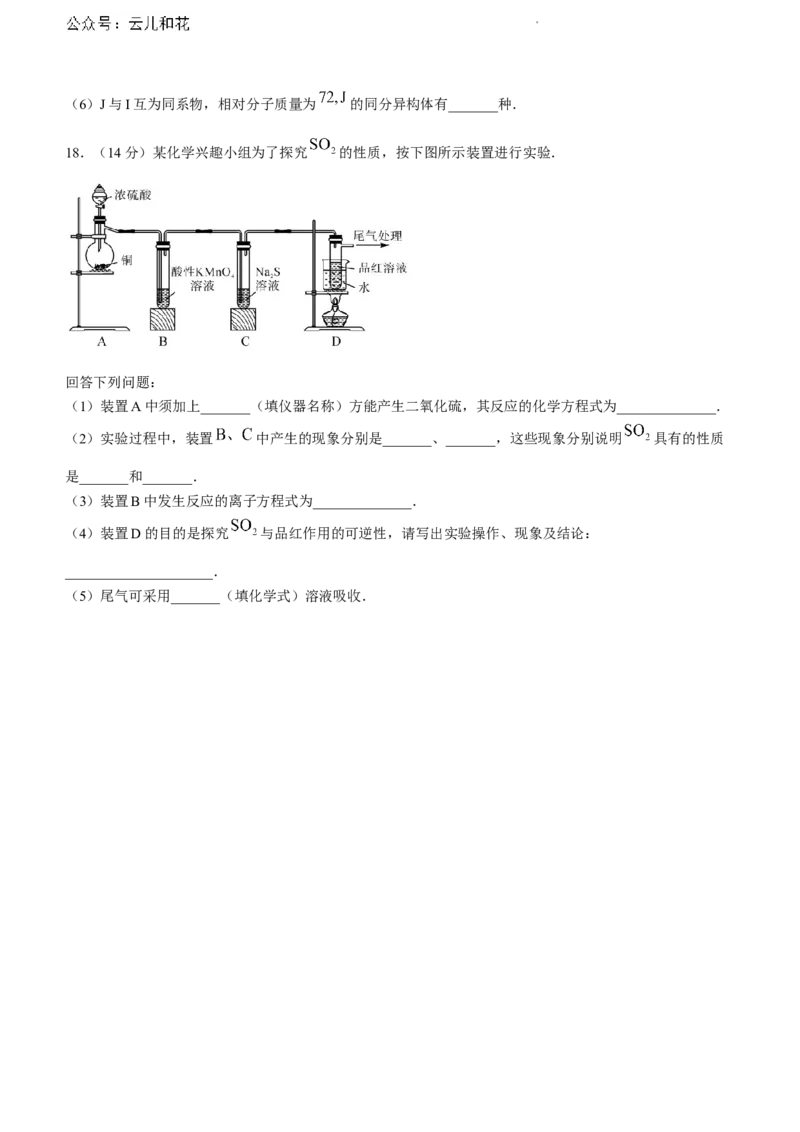
18.(14分)某化学兴趣小组为了探究 的性质,按下图所示装置进行实验.
回答下列问题:
(1)装置A中须加上_______(填仪器名称)方能产生二氧化硫,其反应的化学方程式为______________.
(2)实验过程中,装置 中产生的现象分别是_______、_______,这些现象分别说明 具有的性质
是_______和_______.
(3)装置B中发生反应的离子方程式为______________.
(4)装置D的目的是探究 与品红作用的可逆性,请写出实验操作、现象及结论:
_____________________.
(5)尾气可采用_______(填化学式)溶液吸收.
学科网(北京)股份有限公司北海市 2024 年春季学期期末教学质量检测·高一化学
参考答案、提示及评分细则
1.A 聚乙烯无毒、耐化学腐蚀、耐寒,可制成薄膜,作为食品、药物的包装材料,A正确;酒的主要成
分为乙醇,B错误;福尔马林是甲醛溶液的俗称,C错误;用高纯硅可以制成计算机、通信设备和家用电器
等的芯片,D错误.
2.A 乙烯分子的两个碳原子间以碳碳双键相连,A错误;乙酸中含有的官能团: 或 ,
B正确;甲烷分子的空间填充模型为 ,C正确;乙醇的结构简式: ,D正确.
3.B 加工腊肉、香肠时添加的亚硝酸钠属于防腐剂,A错误;糖果中添加的苋菜红、柠檬黄、靛蓝等属
于着色剂,C错误;食物中添加的味精(即谷氨酸钠)属于增味剂,D错误.
4.D 用乙醇代替汽油作汽车燃料,能够减少有害气体的排放,有利于环境保护,符合“绿色化学”的理
念,A正确;工业合成氨时,氨分离后剩余的气体再利用,能够提高原料利用率,符合“绿色化学”的理念,
B正确;制 时先将 氧化成 后再与稀硫酸反应,不会产生有毒气体,消耗的硫酸的量少,符合
“绿色化学”理念,C正确;D项做法为“先污染后治理”,不符合“绿色化学”理念,D错误.
5.B 氮元素广泛存在于生命体中,是动植物生长的必需元素,自然界有丰富的固氮途径,A正确;优化
固氮方法,能有效提高固氮效率,B错误;液氨汽化时吸收大量的热,使周围温度急剧降低,因此液氨可用
作工业制冷剂,C正确;常温下铁或铝遇浓硝酸钝化,故浓硝酸常温下可以用铁或铝制容器盛装,D正确.
6.C 图中白磷能量高于红磷,能量越高物质越不稳定,所以红磷比白磷稳定,A正确;白磷、红磷燃烧
后生成物的能量低于反应物的能量,因此都是放热反应,B正确;等质量白磷的能量高于红磷,则完全燃烧
释放的热量不同,C错误;图像分析,白磷能量高于红磷,依据能量守恒,红磷转变为白磷是吸热反应,D
正确.
7.D 标准状况下 为液体, 在标准状况下的体积不是 错误; 在足量氧
气中燃烧只能生成 ,不能生成 错误; 铁和过量稀硝酸反应,转移的电子数目为 错
误;由反应可知,收集标准状况下 (即 ) ,转移电子数为 ,D正确.
8.C 人体中没有能水解纤维素的酶,摄入人体的纤维素不能水解为葡萄糖,A错误;油脂的皂化反应是
在碱性条件下,得到高级脂肪酸盐和甘油,B错误;麦芽糖和蔗糖的分子式都是 ,但分子结构不
同,两者互为同分异构体,C正确;棉花的主要成分是纤维素,D错误.
学科网(北京)股份有限公司9.D “吸入” 时,碳纳米管为正极,故电流流向为 导线 钠箔,A正确;标准状况下,
为 ,由总化学方程式可知,每吸收 ,消耗 ,转移的电子数目为
,B正确;放电时,正极上 得电子和 反应生成 和 正确; 溶液中的水会
与金属钠反应,D错误.
10.C 该分子中含三种官能团,分别为羟基、碳碳双键,酯基,A错误;该分子中左边的碳原子类似甲烷
的结构,碳四个价键与其他原子连接,因此不是所有原子共平面,B错误;该物质含有碳碳双键,因此能使
溴的四氯化碳溶液褪色,C正确;该物质含有羟基,因此可与金属钠反应生成 ,该分子中有四个羟基,故
可生成 故D正确.
11.A 反应前后气体的总物质的量减少,总质量不变由 可知,当反应达到平衡时,总物质的量不
变,气体的平均相对分子质量不变,A符合题意;容器内混合气体的总质量与总体积没有改变,所以反应前
后混合气体的密度不变,B不符合题意;题中未给出加入的 和 的物质的量及转化率,所以无法判断反
应是否达到平衡状态,C不符合题意;单位时间内 键断裂,同时 键形成,反应均向
正向进行,D不符合题意.
12.C 步骤①、②都是将溴离子氧化为溴单质,利用了 的氧化性,热空气吹出利用了溴的挥发性,A
正确;二氧化硫具有还原性,物质X用于将溴转化为溴离子,故X常选用 ,B正确;工业上应选用廉价
的石灰乳进行“沉镁”,C错误;由图知,“氯化”过程中 和 反应生成 和可燃性气体
,发生的反应为 ,D正确.
13.B 向鸡蛋清溶液中加入少量 溶液,出现浑浊,是硫酸铜使蛋白质变性,A错误;甲烷与氯气在
光照下反应后的混合物中,有 能使湿润的石蕊试纸变红,B正确;要检验 ,滴入氢氧化钠溶液后
必须加热,若试管口处湿润的红色石蕊试纸变蓝,则说明原溶液中含 ,C错误;银镜反应是在碱性条件
下进行的,向 蔗糖溶液中加入少量稀 ,加热;再加入银氨溶液,水浴加热后未出现银镜是必然
学科网(北京)股份有限公司的,因为没有加氢氧化钠中和硫酸,所以不能说明蔗糖未水解,D项错误.
14.D 由图知, 段物质的量增加,则为甲醇物质的量随时间的变化曲线; 段物质的量减小,为二氧
化碳物质的量随时间的变化曲线;且 段曲线在 达到平衡状态, 段在 达到平衡状态,故
段对应的温度较高, 对应的温度较低,曲线 为 条件下 物质的量随时间的变化曲线; 段用
表示平均反应速率为 , 错误;反应为恒容条件下的
气体反应,总体积和总质量不变,密度不会改变,故容器中混合气体的密度不随时间变化时,不能判定该反
应达到平衡状态,C错误;由阿伏加德罗定律可得,同温同体积下气体的压强之比等于气体的物质的量之比.
条件下达到平衡(b点)时,反应生成 的物质的量为 ,由方程式可得:
开始时: 0 0
平衡时:
则平衡时容器内的压强与起始压强之比: ,D正确.
15.(除特殊标注外,每空1分)
(1) (2)减小0.1 (3)= (2分) (2分) (4)AD(2
分)
(5) (2分) (6)5 BD
(7)浓度不同对反应速率的影响(答案合理即可)
16.(除特殊标注外,每空2分)
(1)
(2)适当增大硫酸浓度、适当升高酸浸温度(或搅拌等其他合理答案)(任写两种)(各1分) 避免沉
淀时消耗过多的氧化镁(或其他合理答案)
(3)将 氧化为 (或其他合理答案)
学科网(北京)股份有限公司(4) (1分)
(5) 氧化镁的熔点远高于氯化镁,熔融时耗能大,成本高(或其他
合理答案)
17.(除特殊标注外,每空2分)
(1) 羧基(各1分) (2)11.2
(3)浓硫酸、加热条件 取代(酯化)(1分) 饱和碳酸钠(1分)
(4)
(5) (6)3
18.(除特殊标注外,每空2分)
(1)酒精灯(1分)
(2)溶液由紫红色变为无色(答案合理均可) 无色溶液中出现黄色浑浊(答案合理均可) 还
原性(1分) 氧化性(1分)
(3)
(4)D中品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色,则证明 与品红
作用具有可逆性(答案合理均可)
(5) (答案合理均可)(1分)
学科网(北京)股份有限公司