文档内容
期末模拟测试(提高卷)
(时间:75分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Br 80 I 127
一、选择题(本题包括10个小题,每小题只有一个选项符合题意。每小题2分,共20分)
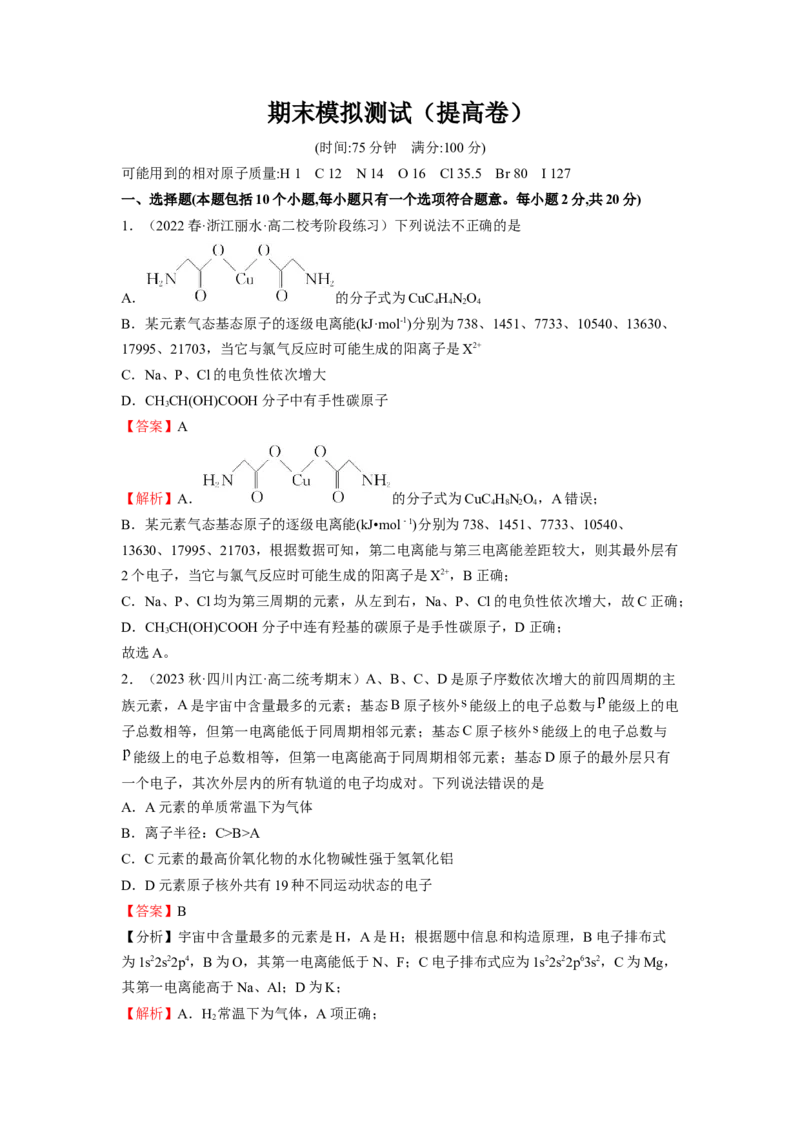
1.(2022春·浙江丽水·高二校考阶段练习)下列说法不正确的是
A. 的分子式为CuC HNO
4 4 2 4
B.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、
17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.Na、P、Cl的电负性依次增大
D.CHCH(OH)COOH分子中有手性碳原子
3
【答案】A
【解析】A. 的分子式为CuC HNO,A错误;
4 8 2 4
B.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为738、1451、7733、10540、
13630、17995、21703,根据数据可知,第二电离能与第三电离能差距较大,则其最外层有
2个电子,当它与氯气反应时可能生成的阳离子是X2+,B正确;
C.Na、P、Cl均为第三周期的元素,从左到右,Na、P、Cl的电负性依次增大,故C正确;
D.CHCH(OH)COOH分子中连有羟基的碳原子是手性碳原子,D正确;
3
故选A。
2.(2023秋·四川内江·高二统考期末)A、B、C、D是原子序数依次增大的前四周期的主
族元素,A是宇宙中含量最多的元素;基态B原子核外 能级上的电子总数与 能级上的电
子总数相等,但第一电离能低于同周期相邻元素;基态C原子核外 能级上的电子总数与
能级上的电子总数相等,但第一电离能高于同周期相邻元素;基态D原子的最外层只有
一个电子,其次外层内的所有轨道的电子均成对。下列说法错误的是
A.A元素的单质常温下为气体
B.离子半径:C>B>A
C.C元素的最高价氧化物的水化物碱性强于氢氧化铝
D.D元素原子核外共有19种不同运动状态的电子
【答案】B
【分析】宇宙中含量最多的元素是H,A是H;根据题中信息和构造原理,B电子排布式
为1s22s22p4,B为O,其第一电离能低于N、F;C电子排布式应为1s22s22p63s2,C为Mg,
其第一电离能高于Na、Al;D为K;
【解析】A.H 常温下为气体,A项正确;
2B.O2-与Mg2+核外电子排布相同,核电荷数越大半径越小,故离子半径:O2->Mg2+>H+,B
项错误;
C.金属性Mg>Al,故二者最高价氧化物的水化物碱性Mg(OH) >Al(OH) ,C项正确;
2 3
D.原子核外电子运动状态均不相同,K核外共有19个电子,故共有19种不同运动状态的
电子,D项正确;
答案选B。
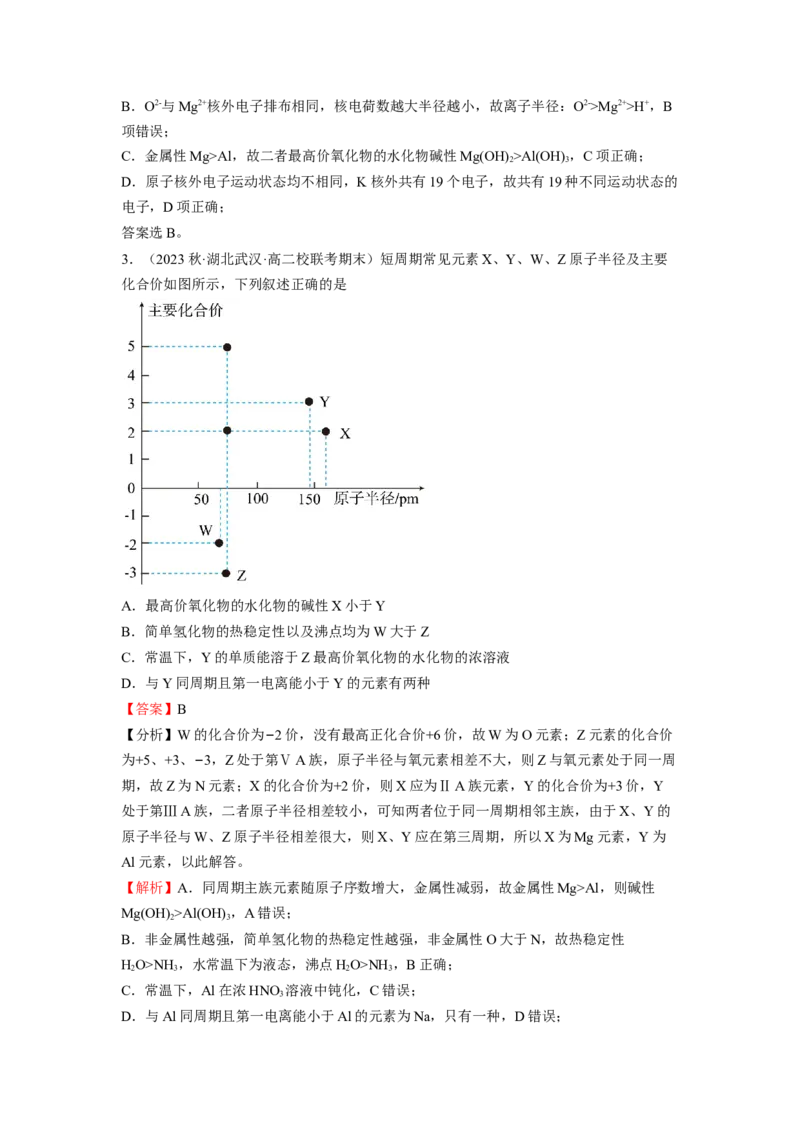
3.(2023秋·湖北武汉·高二校联考期末)短周期常见元素X、Y、W、Z原子半径及主要
化合价如图所示,下列叙述正确的是
A.最高价氧化物的水化物的碱性X小于Y
B.简单氢化物的热稳定性以及沸点均为W大于Z
C.常温下,Y的单质能溶于Z最高价氧化物的水化物的浓溶液
D.与Y同周期且第一电离能小于Y的元素有两种
【答案】B
【分析】W的化合价为−2价,没有最高正化合价+6价,故W为O元素;Z元素的化合价
为+5、+3、−3,Z处于第ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周
期,故Z为N元素;X的化合价为+2价,则X应为ⅡA族元素,Y的化合价为+3价,Y
处于第ⅢA族,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的
原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为
Al元素,以此解答。
【解析】A.同周期主族元素随原子序数增大,金属性减弱,故金属性Mg>Al,则碱性
Mg(OH) >Al(OH) ,A错误;
2 3
B.非金属性越强,简单氢化物的热稳定性越强,非金属性O大于N,故热稳定性
HO>NH ,水常温下为液态,沸点HO>NH ,B正确;
2 3 2 3
C.常温下,Al在浓HNO 溶液中钝化,C错误;
3
D.与Al同周期且第一电离能小于Al的元素为Na,只有一种,D错误;故选B。
4.(2023秋·内蒙古通辽·高二开鲁县第一中学校考期末)向含 的废水中加入铁粉和
可制备 ,发生反应:
,下列说法错误的是
A.依据反应可知: ;还原性:
B.基态碳原子和基态氮原子的未成对电子之比为2∶3
C. 位于周期表中第VIII族;反应中 失去 电子
D.离子半径大小:
【答案】A
【解析】A.由方程式可知,该反应为有化合价变化的氧化还原反应,因此无法判断
和 的酸性强弱,即无法比较酸的电离常数的大小,故A项错误;
B.基态碳原子的电子排布式为 ,基态氮原子的电子排布式为 ,因此基
态碳原子、氮原子的未成对电子数分别为2、3,故B项正确;
C.Fe是26号元素,在周期表中的位置为第四周期第Ⅷ族, 的价层电子排布式为
,在该反应中 元素升两价,失两个电子,因此失去了 电子,故C项正确;
D.离子半径大小比较,电子层数相同时,核电荷数越多,半径越小,故D项正确。
5.(2023秋·重庆北碚·高二西南大学附中校考阶段练习)近期重庆新冠肺炎疫情蔓延,防
疫人员使用了多种消毒剂进行环境消毒。 为阿伏加德罗常数的值,下列关于常见消毒剂
的说法中不正确的是
A.1mol 中 键的数目为
B.84消毒液不能与洁厕灵混合使用
C.过氧乙酸( )分子中C的杂化类型均相同
D.饱和氯水既有酸性又有漂白性,向其中加入 固体后漂白性增强
【答案】C
【解析】A.1个 分子中的化学键包括5个C-H键、1个C-C键、1个C-O键、
1个O-H键,全部属于 键,因此1mol 中 键的数目为 ,A正确;
B.84消毒液有效成分是NaClO,具有强氧化性,洁厕灵主要成分是HCl,具有一定还原
性,混合使用时NaClO与HCl会发生反应生成Cl 引起中毒,故不能混合使用,B正确;
2
C.与H成键的C原子是sp3杂化,与O成键的C原子是sp2杂化,杂化类型不同,C错误;
D.饱和氯水中存在以下平衡体系: ,HClO具有漂白性,HClO与
HCl具有酸性,因此溶液既有酸性又有漂白性;已知酸性强弱关系:,向其中加入NaHCO 固体后,NaHCO 与HCl反应,使HCl浓
3 3
度减小, 平衡向正方向移动,使HClO浓度增大,溶液漂白性增强,
D正确;
故选C。
6.(2023秋·河北秦皇岛·高二秦皇岛一中校考期末)南京理工大学化工学院胡炳成教授团
队成功合成世界首个全氮阴离子盐,其局部结构如图所示。下列说法错误的是
A.经 射线衍射可以测得全氮阴离子盐晶体结构
B.全氮阴离子盐两种阳离子中心原子的杂化轨道类型相同
C. 中所有的氮原子在同一平面内
D. 的键角比全氮阴离子盐的两种阳离子键角都大
【答案】D
【解析】A.X射线衍射技术用于晶体结构的测定,A正确;
B.全氮阴离子盐两种阳离子为: 和 ,中心原子的价层电子对数均为4,中心原
子的杂化轨道类型为:sp3杂化,B正确;
C. 氮原子之间除了形成σ键之外,还形成大π键,所以所有的氮原子在同一平面内,
C正确;
D. 分子内含有两对孤电子对,孤电子对对成键电子对的斥力大于成键电子对之间的
斥力,导致 分子的键角小于 和 ,D错误;
答案为:D。
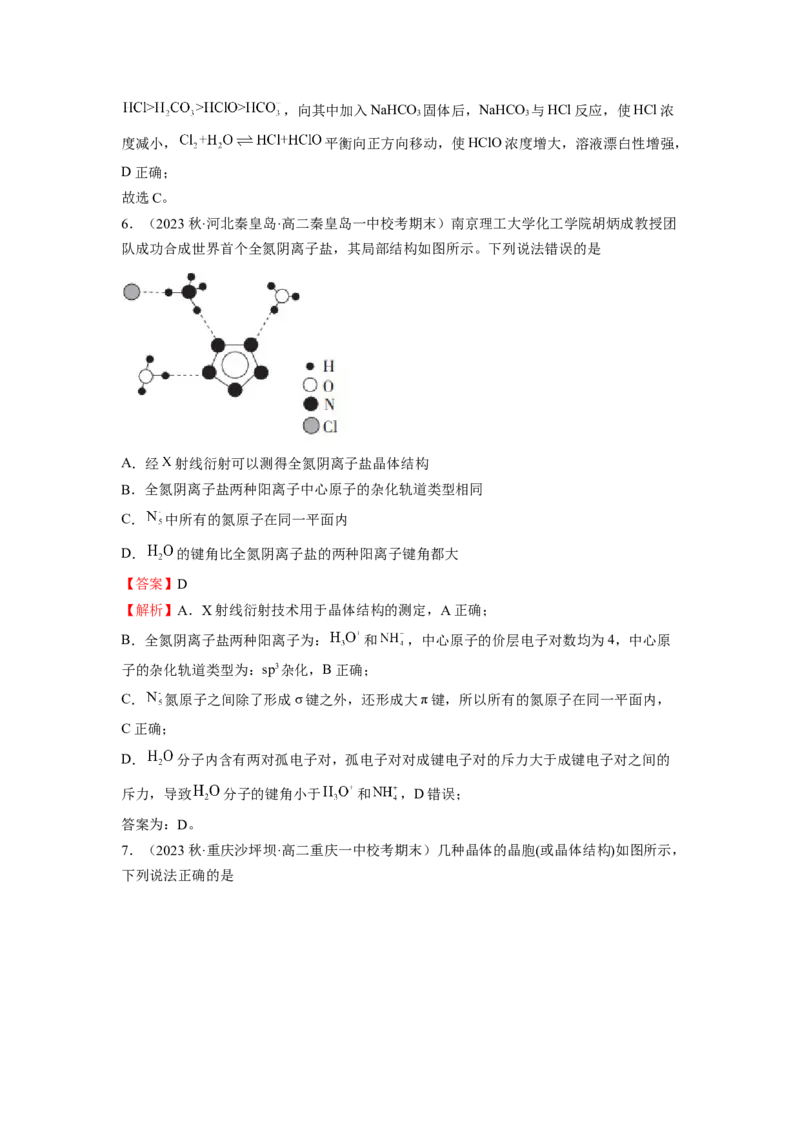
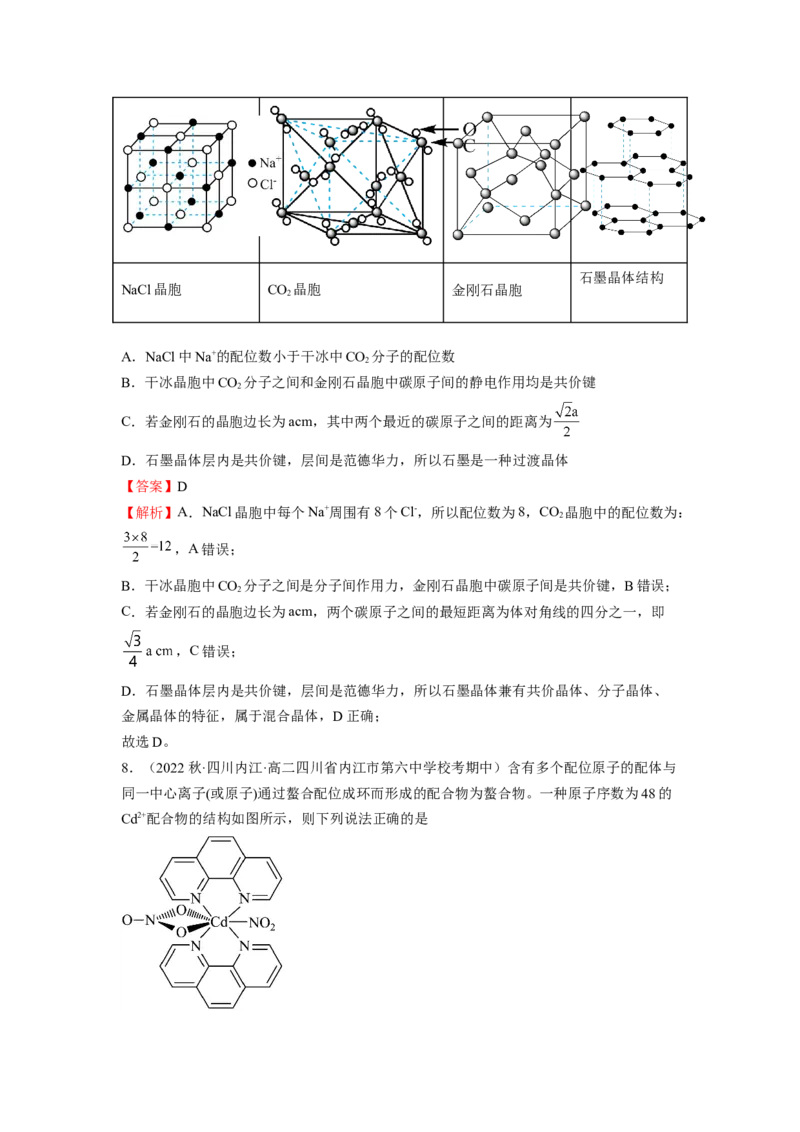
7.(2023秋·重庆沙坪坝·高二重庆一中校考期末)几种晶体的晶胞(或晶体结构)如图所示,
下列说法正确的是石墨晶体结构
NaCl晶胞 CO 晶胞 金刚石晶胞
2
A.NaCl中Na+的配位数小于干冰中CO 分子的配位数
2
B.干冰晶胞中CO 分子之间和金刚石晶胞中碳原子间的静电作用均是共价键
2
C.若金刚石的晶胞边长为acm,其中两个最近的碳原子之间的距离为
D.石墨晶体层内是共价键,层间是范德华力,所以石墨是一种过渡晶体
【答案】D
【解析】A.NaCl晶胞中每个Na+周围有8个Cl-,所以配位数为8,CO 晶胞中的配位数为:
2
,A错误;
B.干冰晶胞中CO 分子之间是分子间作用力,金刚石晶胞中碳原子间是共价键,B错误;
2
C.若金刚石的晶胞边长为acm,两个碳原子之间的最短距离为体对角线的四分之一,即
,C错误;
D.石墨晶体层内是共价键,层间是范德华力,所以石墨晶体兼有共价晶体、分子晶体、
金属晶体的特征,属于混合晶体,D正确;
故选D。
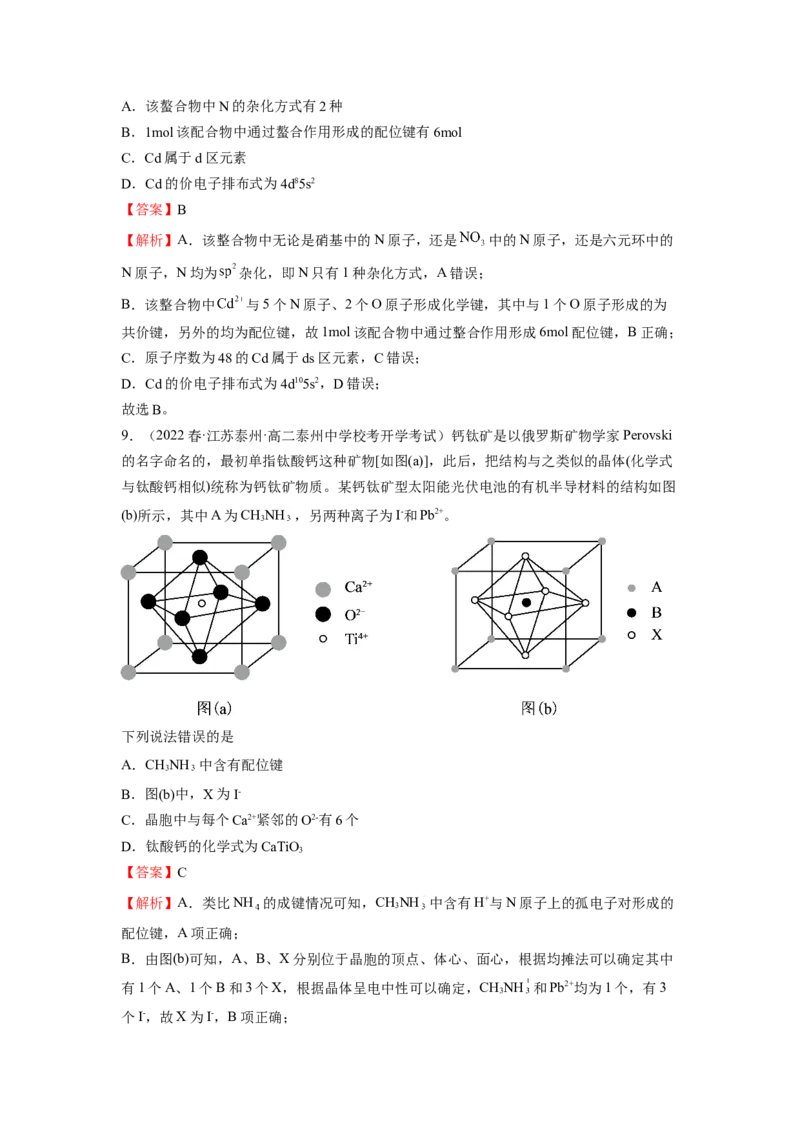
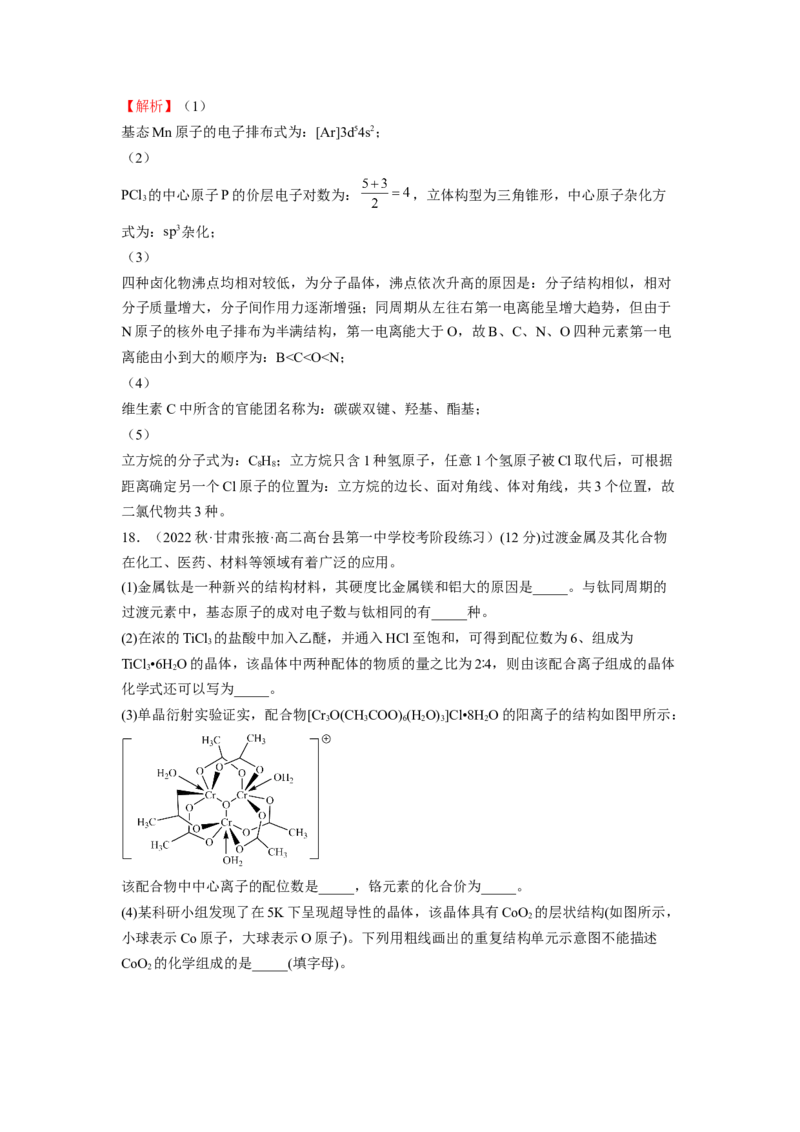
8.(2022秋·四川内江·高二四川省内江市第六中学校考期中)含有多个配位原子的配体与
同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种原子序数为48的
Cd2+配合物的结构如图所示,则下列说法正确的是A.该螯合物中N的杂化方式有2种
B.1mol该配合物中通过螯合作用形成的配位键有6mol
C.Cd属于d区元素
D.Cd的价电子排布式为4d85s2
【答案】B
【解析】A.该整合物中无论是硝基中的N原子,还是 中的N原子,还是六元环中的
N原子,N均为 杂化,即N只有1种杂化方式,A错误;
B.该整合物中 与5个N原子、2个O原子形成化学键,其中与1个O原子形成的为
共价键,另外的均为配位键,故1mol该配合物中通过整合作用形成6mol配位键,B正确;
C.原子序数为48的Cd属于ds区元素,C错误;
D.Cd的价电子排布式为4d105s2,D错误;
故选B。
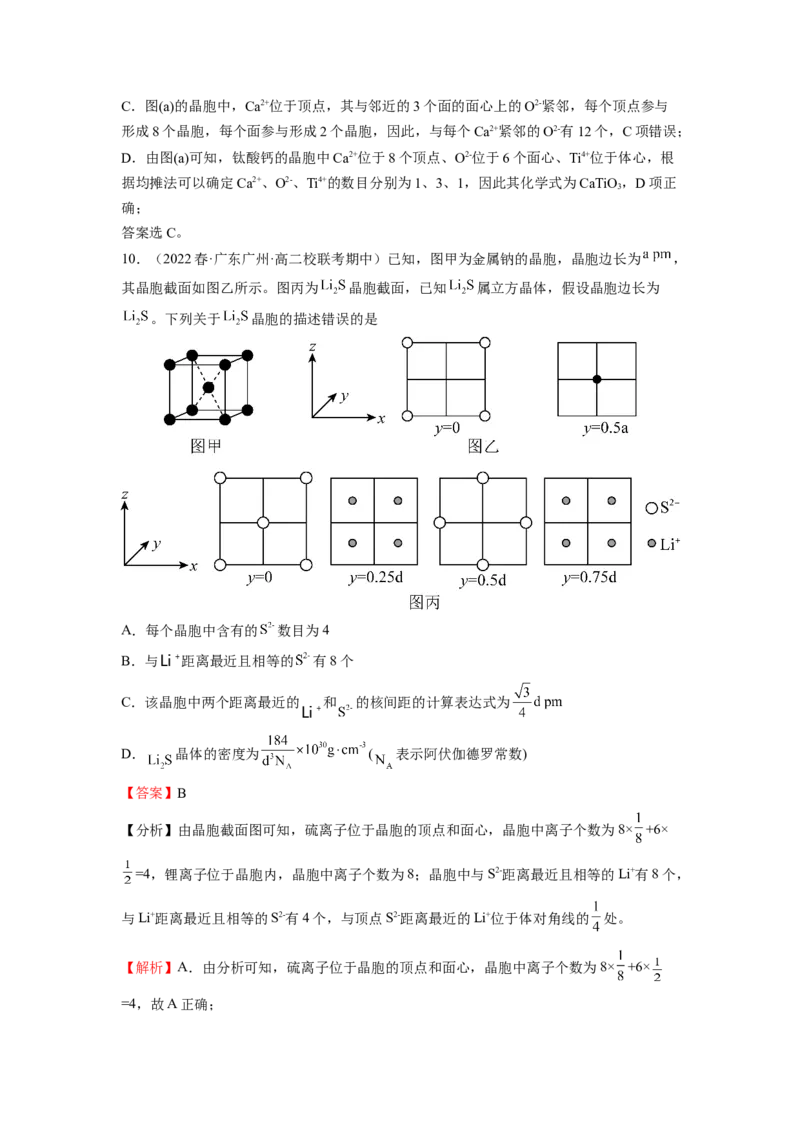
9.(2022春·江苏泰州·高二泰州中学校考开学考试)钙钛矿是以俄罗斯矿物学家Perovski
的名字命名的,最初单指钛酸钙这种矿物[如图(a)],此后,把结构与之类似的晶体(化学式
与钛酸钙相似)统称为钙钛矿物质。某钙钛矿型太阳能光伏电池的有机半导材料的结构如图
(b)所示,其中A为CHNH ,另两种离子为I-和Pb2+。
3
下列说法错误的是
A.CHNH 中含有配位键
3
B.图(b)中,X为I-
C.晶胞中与每个Ca2+紧邻的O2-有6个
D.钛酸钙的化学式为CaTiO
3
【答案】C
【解析】A.类比NH 的成键情况可知,CHNH 中含有H+与N原子上的孤电子对形成的
3
配位键,A项正确;
B.由图(b)可知,A、B、X分别位于晶胞的顶点、体心、面心,根据均摊法可以确定其中
有1个A、1个B和3个X,根据晶体呈电中性可以确定,CHNH 和Pb2+均为1个,有3
3
个I-,故X为I-,B项正确;C.图(a)的晶胞中,Ca2+位于顶点,其与邻近的3个面的面心上的O2-紧邻,每个顶点参与
形成8个晶胞,每个面参与形成2个晶胞,因此,与每个Ca2+紧邻的O2-有12个,C项错误;
D.由图(a)可知,钛酸钙的晶胞中Ca2+位于8个顶点、O2-位于6个面心、Ti4+位于体心,根
据均摊法可以确定Ca2+、O2-、Ti4+的数目分别为1、3、1,因此其化学式为CaTiO ,D项正
3
确;
答案选C。
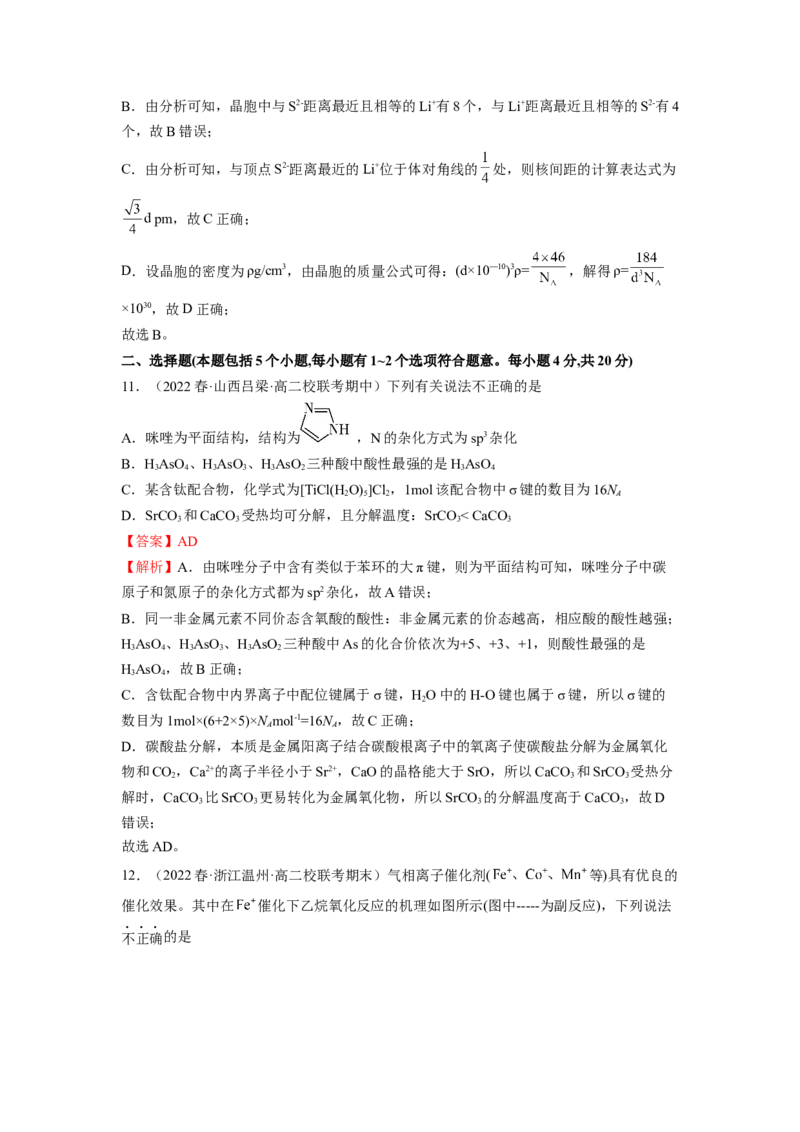
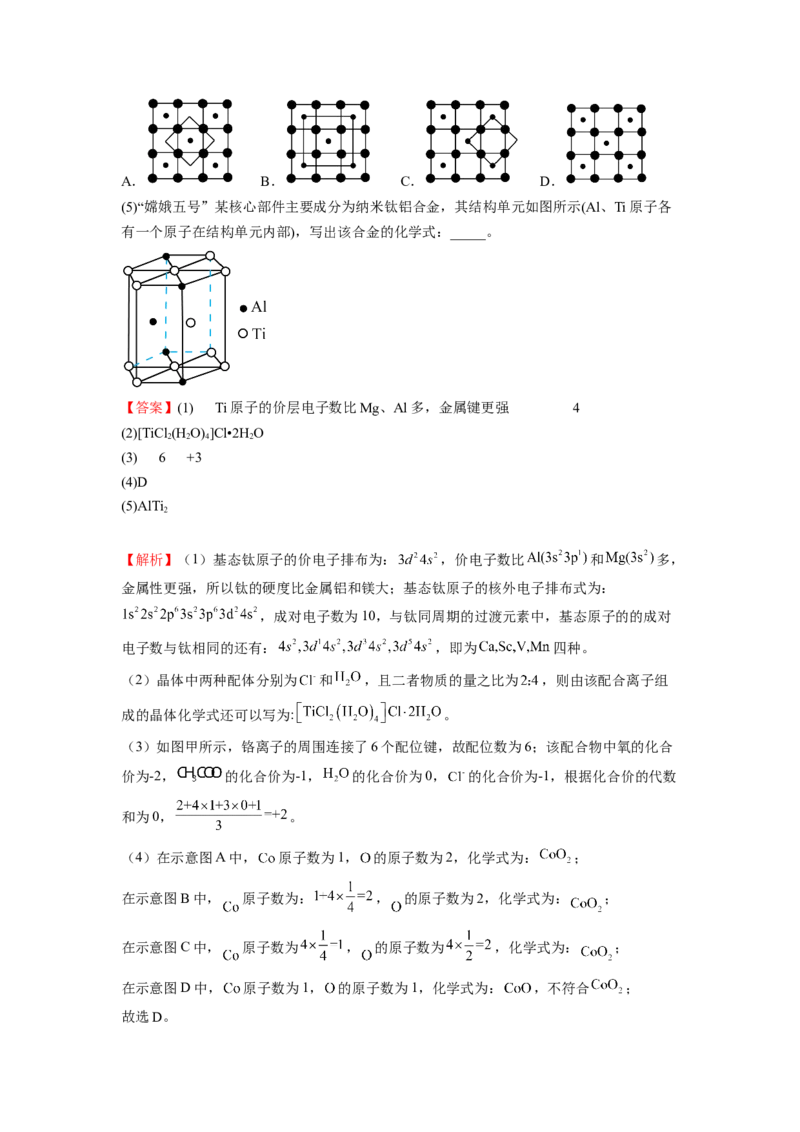
10.(2022春·广东广州·高二校联考期中)已知,图甲为金属钠的晶胞,晶胞边长为 ,
其晶胞截面如图乙所示。图丙为 晶胞截面,已知 属立方晶体,假设晶胞边长为
。下列关于 晶胞的描述错误的是
A.每个晶胞中含有的 数目为4
B.与 距离最近且相等的 有8个
C.该晶胞中两个距离最近的 和 的核间距的计算表达式为
D. 晶体的密度为 ( 表示阿伏伽德罗常数)
【答案】B
【分析】由晶胞截面图可知,硫离子位于晶胞的顶点和面心,晶胞中离子个数为8× +6×
=4,锂离子位于晶胞内,晶胞中离子个数为8;晶胞中与S2-距离最近且相等的Li+有8个,
与Li+距离最近且相等的S2-有4个,与顶点S2-距离最近的Li+位于体对角线的 处。
【解析】A.由分析可知,硫离子位于晶胞的顶点和面心,晶胞中离子个数为8× +6×
=4,故A正确;B.由分析可知,晶胞中与S2-距离最近且相等的Li+有8个,与Li+距离最近且相等的S2-有4
个,故B错误;
C.由分析可知,与顶点S2-距离最近的Li+位于体对角线的 处,则核间距的计算表达式为
pm,故C正确;
D.设晶胞的密度为ρg/cm3,由晶胞的质量公式可得:(d×10—10)3ρ= ,解得ρ=
×1030,故D正确;
故选B。
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题4分,共20分)
11.(2022春·山西吕梁·高二校联考期中)下列有关说法不正确的是
A.咪唑为平面结构,结构为 ,N的杂化方式为sp3杂化
B.HAsO 、HAsO 、HAsO 三种酸中酸性最强的是HAsO
3 4 3 3 3 2 3 4
C.某含钛配合物,化学式为[TiCl(H O) ]Cl ,1mol该配合物中σ键的数目为16N
2 5 2 A
D.SrCO 和CaCO 受热均可分解,且分解温度:SrCO < CaCO
3 3 3 3
【答案】AD
【解析】A.由咪唑分子中含有类似于苯环的大π键,则为平面结构可知,咪唑分子中碳
原子和氮原子的杂化方式都为sp2杂化,故A错误;
B.同一非金属元素不同价态含氧酸的酸性:非金属元素的价态越高,相应酸的酸性越强;
HAsO 、HAsO 、HAsO 三种酸中As的化合价依次为+5、+3、+1,则酸性最强的是
3 4 3 3 3 2
HAsO ,故B正确;
3 4
C.含钛配合物中内界离子中配位键属于σ键,HO中的H-O键也属于σ键,所以σ键的
2
数目为1mol×(6+2×5)×N mol-1=16N ,故C正确;
A A
D.碳酸盐分解,本质是金属阳离子结合碳酸根离子中的氧离子使碳酸盐分解为金属氧化
物和CO,Ca2+的离子半径小于Sr2+,CaO的晶格能大于SrO,所以CaCO 和SrCO 受热分
2 3 3
解时,CaCO 比SrCO 更易转化为金属氧化物,所以SrCO 的分解温度高于CaCO ,故D
3 3 3 3
错误;
故选AD。
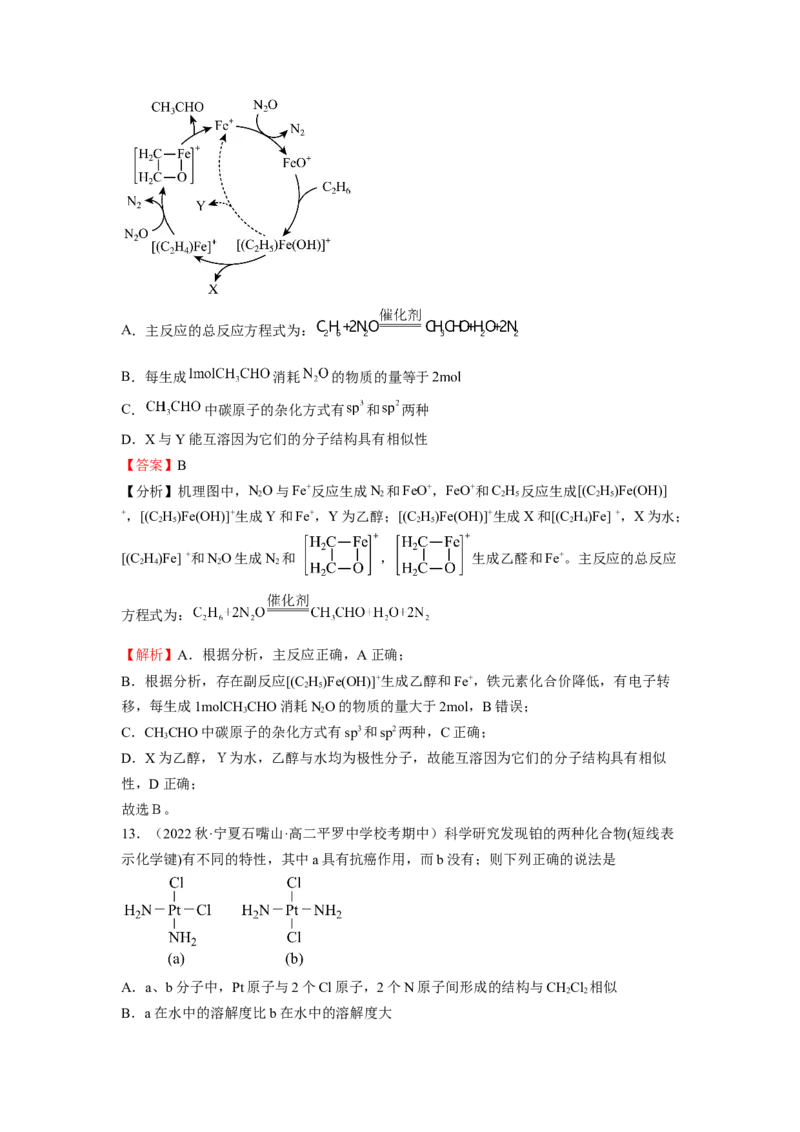
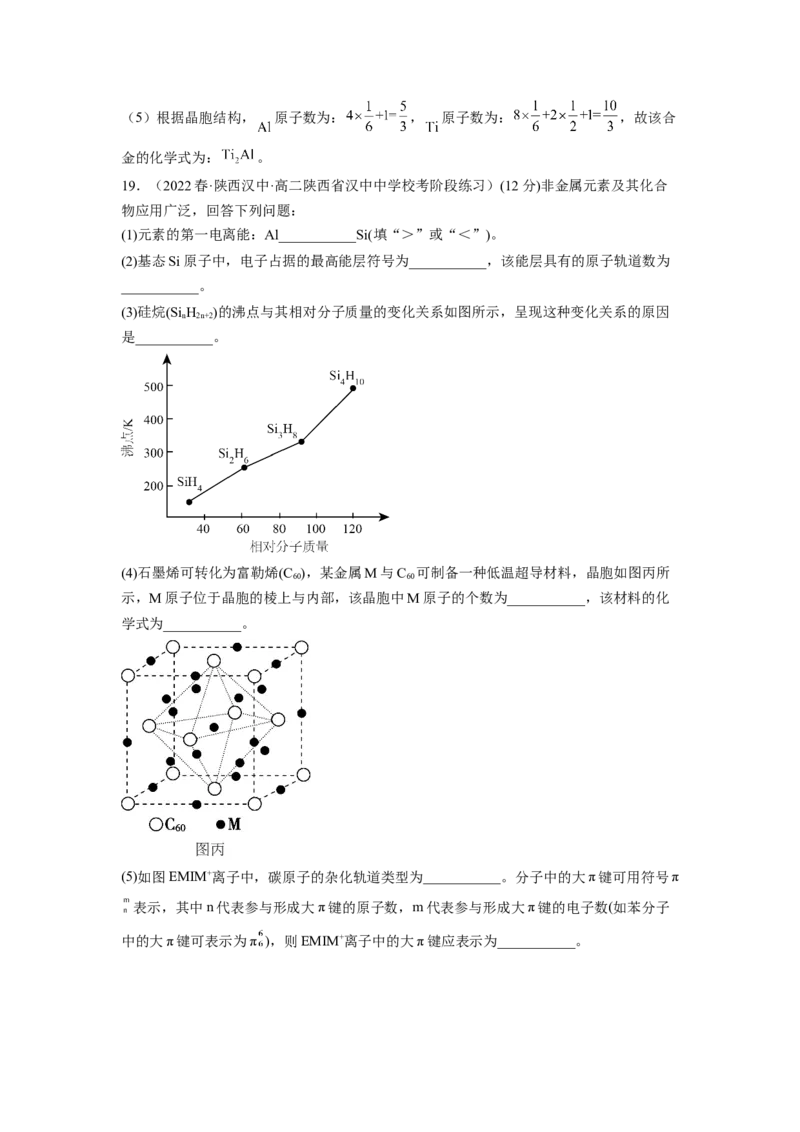
12.(2022春·浙江温州·高二校联考期末)气相离子催化剂( 等)具有优良的
催化效果。其中在 催化下乙烷氧化反应的机理如图所示(图中-----为副反应),下列说法
不正确的是A.主反应的总反应方程式为:
B.每生成 消耗 的物质的量等于
C. 中碳原子的杂化方式有 和 两种
D.X与Y能互溶因为它们的分子结构具有相似性
【答案】B
【分析】机理图中,NO与Fe+反应生成N 和FeO+,FeO+和C H 反应生成[(C H)Fe(OH)]
2 2 2 5 2 5
+,[(C H)Fe(OH)]+生成Y和Fe+,Y为乙醇;[(C H)Fe(OH)]+生成X和[(C H)Fe] +,X为水;
2 5 2 5 2 4
[(C H)Fe] +和NO生成N 和 , 生成乙醛和Fe+。主反应的总反应
2 4 2 2
方程式为:
【解析】A.根据分析,主反应正确,A正确;
B.根据分析,存在副反应[(C H)Fe(OH)]+生成乙醇和Fe+,铁元素化合价降低,有电子转
2 5
移,每生成1molCH CHO消耗NO的物质的量大于2mol,B错误;
3 2
C.CHCHO中碳原子的杂化方式有sp3和sp2两种,C正确;
3
D.X为乙醇,Y为水,乙醇与水均为极性分子,故能互溶因为它们的分子结构具有相似
性,D正确;
故选B。
13.(2022秋·宁夏石嘴山·高二平罗中学校考期中)科学研究发现铂的两种化合物(短线表
示化学键)有不同的特性,其中a具有抗癌作用,而b没有;则下列正确的说法是
A.a、b分子中,Pt原子与2个Cl原子,2个N原子间形成的结构与CHCl 相似
2 2
B.a在水中的溶解度比b在水中的溶解度大C.a、b互为同素异形体
D.a、b是同一物质
【答案】B
【解析】A.a、b的性质不同,说明a、b是不同的分子,则它们的分子结构为平面结构,
存在异构,而CHCl 分子为四面体构型,不存在异构,A项错误;
2 2
B.a为极性分子,b为非极性分子,水为极性分子,根据相似相溶原理,a在水中的溶解
度比b在水中的溶解度大,B项正确;
C.a、b均为化合物,不是同素异形体的关系,C项错误;
D.a、b性质不同,不是同种物质,互为同分异构体,D项错误;
答案选B。
14.(2022春·陕西西安·高二校考期末) 、 、 、 为原子序数依次增大的四种短周
期元素,已知 、 元素的原子序数之和是 、 元素的原子序数之和的3倍,且 、
元素是同主族元素。甲、乙、丙、丁、戊五种二元化合物的组成如下表:
甲 乙 丙 丁 戊
、 、 、 、 C、
物质间存在反应:甲+乙→单质 +丙;丁+戊→单质 (淡黄色固体)+丙。下列说法正确的
是A.甲、乙、丙、丁、戊均为只含极性键的极性分子
B.原子半径: ;电负性:
C.可用酒精洗涤粘在容器内壁上的单质
D.若 甲与 乙恰好反应生成 单质 ,则乙为双原子分子
【答案】D
【分析】根据单质D为淡黄色固体,则D为S元素;A、B、C、D为原子序数依次增大的
四种短周期元素,C、D元素是同主族元素,在C为O元素;C、D元素的原子序数之和是
A、B元素的原子序数之和的3倍,A、B元素的原子序数之和为8,戊为O、S两种元素组
成的化合物,且丁+戊→单质D(淡黄色固体)+丙,其反应方程式为:
2HS+SO=3S↓+2H O、3HS+SO=3H O+4S↓,则A为H元素,B为N元素;甲+乙→单质
2 2 2 2 2 2
B+丙,其反应方程式为:8NH +6NO=7N +12H O、4NH +6NO=5N+6H O,则甲为NH ,
3 2 2 2 3 2 2 3
乙为NO 或NO,丙为HO,丁为HS,戊为SO 或SO 。
2 2 2 3 2
【解析】A.若戊为SO ,则SO 是平面正三角形,含极性键的非极性分子,A错误;
3 3
B.同周期从左到右元素原子半径减小,电负性增大;同主族从上到下元素原子半径增大,
电负性减小,故原子半径:S>N>O;电负性:O>N>S,B错误;
C.D为S单质,硫微溶于酒精,不能达到洗涤目的,应用二硫化碳洗涤,C错误;
D.根据4NH +6NO=5N+6H O,若2mol甲与3mol乙恰好反应生成2.5mol单质B,则乙为
3 2 2
NO,是双原子分子,D正确;故答案为:D。
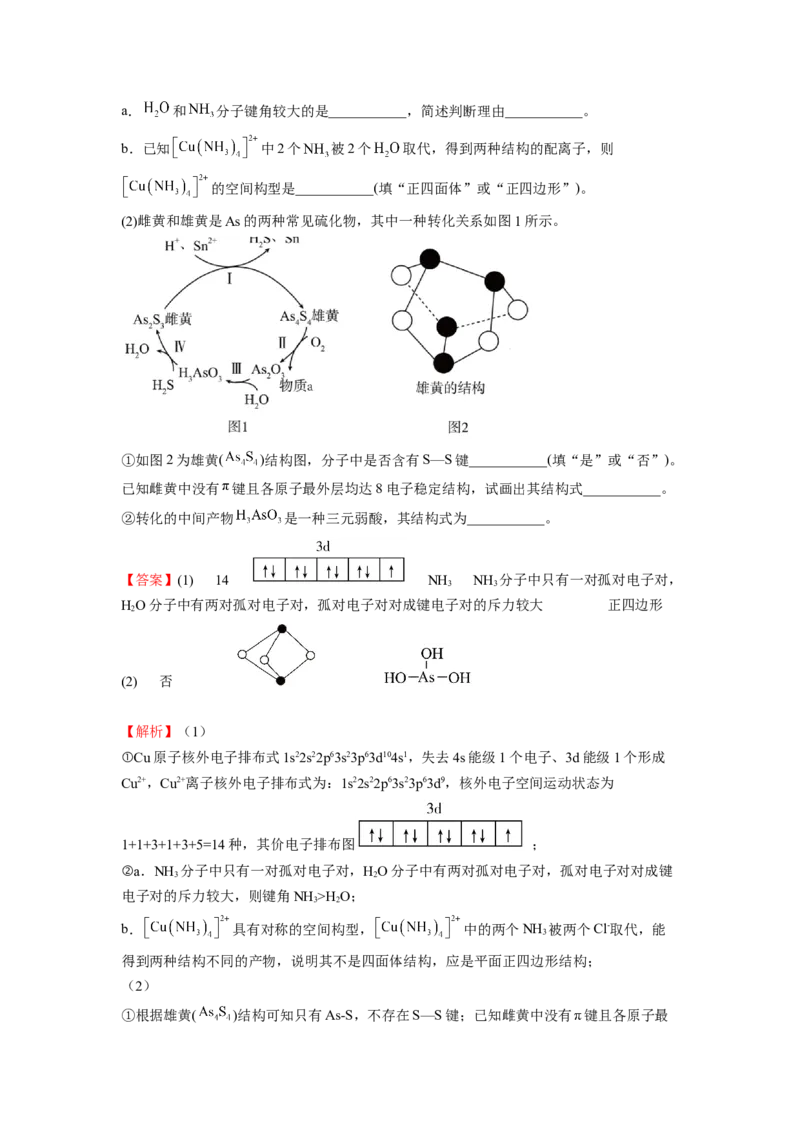
15.(2022·高二课时练习)由短周期前10号元素组成的物质 和 有如图所示的转化。
不稳定,易分解。下列有关说法正确的是( )
A.为使该转化成功进行, 可以是酸性 溶液
B.等物质的量的 、 分子中含有 键的数目均为
C. 分子中含有的 键个数是 分子中含有的 键个数的2倍
D.T、X分子均只含有极性键,无非极性键
【答案】AD
【分析】由球棍模型可知,T为 ,X不稳定,易分解,则X为 ,Y为氧化剂。
【解析】A.由醛变成酸,可以选择氧化性较强的酸性 溶液,A项正确;
B. 的 、 分子中含有 键的数目为 ,等物质的量并不一定是 ,故B错误;
C.X分子中含有的 键个数为5,T分子中含有的 键个数为3,C项错误;
D.T、X分子均只含有极性键,无非极性键,D项正确;
答案选AD。
【点睛】化合物中,单键是 键,双键:一个 键,一个 键;三键:一个 键,两个 键。
三、非选择题(本题包括5个小题,共60分)
16.(2022秋·四川绵阳·高二四川省绵阳江油中学校考阶段练习)(12分)按要求回答下列
问题:
(1)研究发现,在 低压合成甲醇反应( )中,Co氧化物负载的Mn
氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第_______号元素。元
素Mn与O中,基态原子核外未成对电子数较多的是_______。
(2)我国科学家成功合成了世界上首个五氮阴离子盐 。
①氮原子的价电子排布式为_______。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲
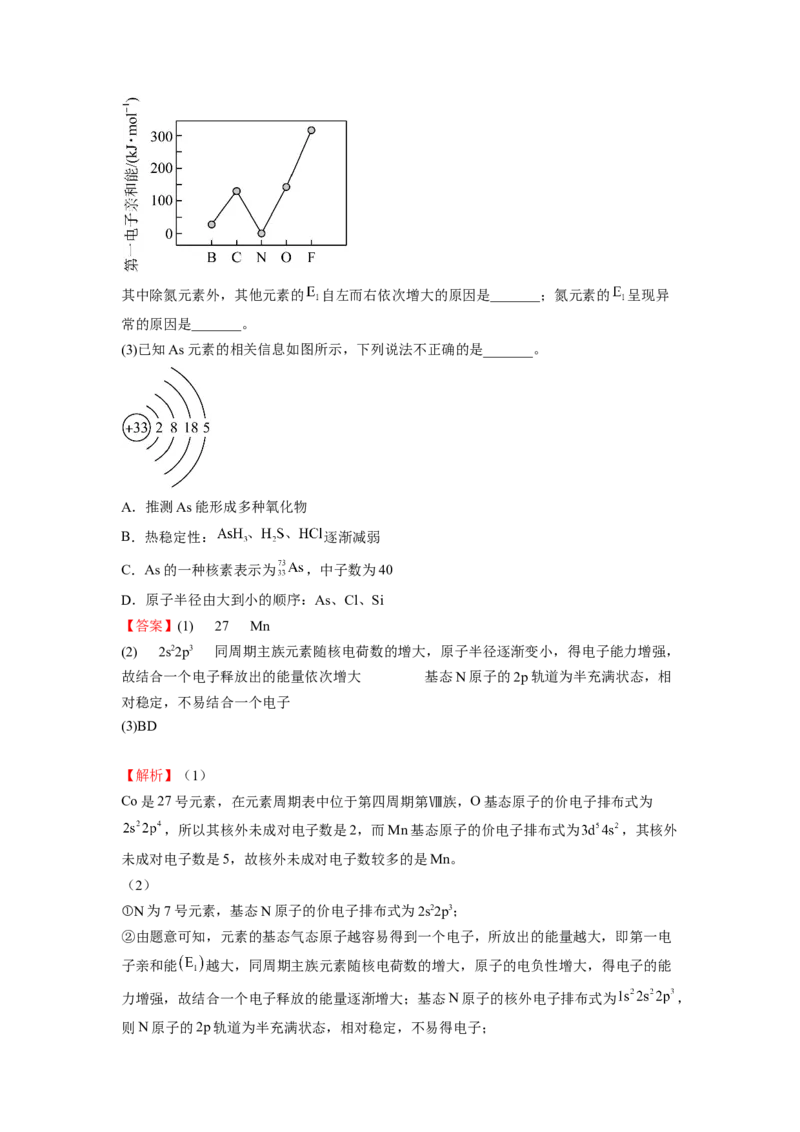
和能 。第二周期部分元素的 变化趋势如图所示。其中除氮元素外,其他元素的 自左而右依次增大的原因是_______;氮元素的 呈现异
常的原因是_______。
(3)已知As元素的相关信息如图所示,下列说法不正确的是_______。
A.推测As能形成多种氧化物
B.热稳定性: 逐渐减弱
C.As的一种核素表示为 ,中子数为40
D.原子半径由大到小的顺序:As、Cl、Si
【答案】(1) 27 Mn
(2) 2s22p3 同周期主族元素随核电荷数的增大,原子半径逐渐变小,得电子能力增强,
故结合一个电子释放出的能量依次增大 基态N原子的2p轨道为半充满状态,相
对稳定,不易结合一个电子
(3)BD
【解析】(1)
Co是27号元素,在元素周期表中位于第四周期第Ⅷ族,O基态原子的价电子排布式为
,所以其核外未成对电子数是2,而Mn基态原子的价电子排布式为 ,其核外
未成对电子数是5,故核外未成对电子数较多的是Mn。
(2)
①N为7号元素,基态N原子的价电子排布式为2s22p3;
②由题意可知,元素的基态气态原子越容易得到一个电子,所放出的能量越大,即第一电
子亲和能 越大,同周期主族元素随核电荷数的增大,原子的电负性增大,得电子的能
力增强,故结合一个电子释放的能量逐渐增大;基态N原子的核外电子排布式为 ,
则N原子的2p轨道为半充满状态,相对稳定,不易得电子;(3)
A.N和As是第ⅤA族元素,As性质与N有相似之处,N能形成
等多种氧化物,据此推测As也能形成 、 等多种氧化物,A正确;
B.非金属性越强,对应的简单氢化物越稳定,则 的稳定性逐渐增强,B
错误;
C.中子数=质量数-质子数,则 的中子数为 ,C正确;
D.一般电子层数越多,原子半径越大,同周期主族元素从左往右原子半径减小,则原子
半径由大到小的顺序为 ,D错误;
故答案选BD。
17.(2022春·江苏泰州·高二泰州中学校考开学考试(12分))按要求回答下列问题。
(1)基态Mn原子的电子排布式为_______。
(2)PCl 的立体构型为_______,中心原子的杂化轨道类型_______。
3
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF BCl BBr BI
3 3 3 3
沸点/K 172 285 364 483
①四种卤化物沸点依次升高的原因是_______。
②B、C、N、O四种元素第一电离能由小到大的顺序为_______。
(4)维生素C的结构简式为 。写出其中的官能团名称_______。
(5)“立方烷”是合成的一种烃,其分子为正方体结构,其碳骨架结构如下图所示,则:
①写出立方烷的分子式_______。
②立方烷的二氯代物有_______种同分异构体。
【答案】(1)[Ar]3d54s2
(2) 三角锥形 sp3
(3) 分子结构相似,相对分子质量增大,分子间作用力逐渐增强 BH O;
3 2
b. 具有对称的空间构型, 中的两个NH 被两个Cl-取代,能
3
得到两种结构不同的产物,说明其不是四面体结构,应是平面正四边形结构;
(2)
①根据雄黄( )结构可知只有As-S,不存在S—S键;已知雌黄中没有 键且各原子最外层均达8电子稳定结构,其结构式为 ;
② 是一种三元弱酸,说明有三个羟基,其结构式为 。