文档内容
新疆喀什市2024-2025学年高一下学期期中质量监测 化学试卷
一、单选题
1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误
的是
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
2.下列气体中,既可以用浓硫酸干燥,又可以用 固体干燥的是
A. B. C. D.
3.中国将与各方携手推动全球环境治理以及可持续发展事业,构建人类命运共同体。下列说法不正确的
A.购物时提倡少用塑料袋以减少白色污染
B.排放到空气中的 、 、 均会形成酸雨
C.为防止电池中的重金属污染土壤,应积极开发废电池的综合利用
D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
4.下列属于放热反应的是
A. 晶体与 晶体反应
B.C与 共热
C.煅烧石灰石(主要成分是 )制生石灰(CaO)
D.燃烧木炭取暖
5.下列反应中硝酸既能表现出酸性又表现出氧化性的是
A.能使紫色石蕊溶液变为红色
B.与铜反应放出一氧化氮气体,生成硝酸铜
C.与碳酸钠反应放出二氧化碳气体,生成硝酸钠
D.与单质硫混合共热时生成硫酸和二氧化氮
6.对下列事实的解释中,正确的是
A.附着在试管内壁上的硫可用CS 洗涤,说明硫易溶于CS
2 2
B.浓硫酸能使蓝色胆矾变为白色,说明浓硫酸具有脱水性C.将SO 通入酸性高锰酸钾溶液,溶液紫色褪去,说明SO 具有漂白性
2 2
D.常温下浓硫酸可以用铁质容器贮存,说明铁与浓硫酸不反应
7.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是
A.在空气中敞口久置的浓硫酸,溶液质量增大(挥发性)
B.在加热条件下铜与浓硫酸反应(脱水性)
C.浓硫酸在白纸上书写的字迹变黑(氧化性)
D.浓硫酸可用来干燥某些气体(吸水性)
8.只用一种试剂,将NH Cl、 、NaSO 、NaCl,4种物质的溶液区分开,这种试剂是
4 2 4
A.NaOH溶液 B.AgNO 溶液 C.BaCl 溶液 D. 溶液
3 2
9.下列说法正确的是
A.因为SO 具有漂白性,所以它能使品红溶液、溴水、酸性KMnO 溶液、石蕊溶液褪色
2 4
B.SO 和Cl 混合使用,将会有更强的漂白能力
2 2
C.SO 、漂白粉、活性炭、NaO 都能使红墨水褪色,其原理相同
2 2 2
D.能使品红溶液褪色的不一定是SO
2
10.下列有关物质检验的实验结论正确的是
选
实验操作及现象 实验结论
项
A. 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有
向某溶液中加入盐酸,将产生的气体通入澄清石灰水中,澄清
B. 该溶液中一定含有
石灰水变浑浊
C. 将气体通入品红溶液中,品红溶液褪色 该气体一定是SO
2
向某溶液中加入浓NaOH溶液并加热,生成的气体使湿润的红
D. 该溶液中一定含有
色石蕊试纸变蓝
A.A B.B C.B D.D
11.下列措施中,不能增大化学反应速率的是
A.Zn与稀硫酸反应制取H 时,加入蒸馏水
2
B.Al在O 中燃烧生成Al O 时,用铝粉替代铝片
2 2 3
C.CaCO 与稀盐酸反应生成CO 时,适当升高温度
3 2
D.用KClO 固体分解制取O 时,固体中添加少量MnO
3 2 2
12.关于如图所示装置的叙述,错误的是( )A.锌是负极,其质量逐渐减小
B.氢离子的铜片表面被还原,产生气泡
C.电子从锌片经导线流向铜片
D.电流从锌片经导线流向铜片
13.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.1molC(金刚石)比1molC(石墨)的总能量高
14.把a、b、c、d4种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连,a为负极;
c、d相连,d上有气泡逸出;a、c相连时,a质量减少;b、d相连,b为正极。则4种金属的活动性顺序由
大到小排列为
A.a>c>d>b B.a>c>b>d C.b>d>c>a D.a>b>c>d
15.羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应:HS(g)+
2
CO(g) COS(g)+HO(g)。下列能充分说明该反应已经达到化学平衡状态的是
2 2
A.⇌正、逆反应速率相等
B.容器内混合气体的密度不再变化
C.HS、CO、COS、HO的浓度相等
2 2 2
D.HS、CO、COS、HO在密闭容器中共存
2 2 2
二、多选题
16.下列说法错误的是
A.化学反应必然伴随发生能量变化
B.化学反应中能量变化的大小与反应物的质量多少无关
C.能量变化必然伴随发生化学反应
D.化学反应中的能量变化主要是由化学键变化引起的
三、填空题
17.一定条件下,在容积为2L的密闭容器中发生反应: 。开始时加入4molA、6molB、2molC,在2min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率: 。
(2)在2min末,B的浓度为 。
(3)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①升高温度,化学反应速率 。
②充人1molB,化学反应速率 。
③将容器的容积变为3L,化学反应速率 。
18.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如
下:
编
电极材料 电解质溶液 电流表指针偏转方向
号
1 Mg、Al 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向Mg
根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中Al电极的作用是否相同? 。
(2)实验3中铝为 极,电极反应式为2Al-6e-=2Al3+;石墨为 极,电极反应式为6H++6e-
=3H ↑;电池总反应的离子方程式为 。
2
(3)实验4中的铝为 极,原因是 。
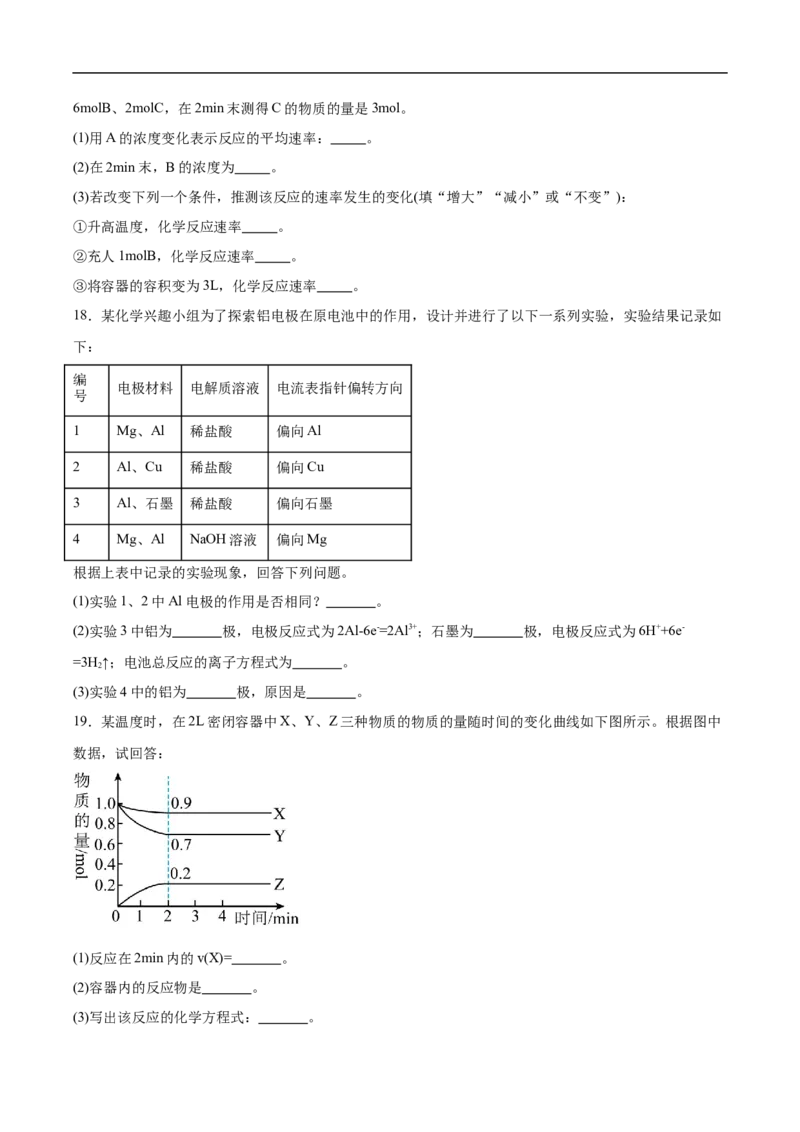
19.某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示。根据图中
数据,试回答:
(1)反应在2min内的v(X)= 。
(2)容器内的反应物是 。
(3)写出该反应的化学方程式: 。(4)Y的转化率: %。
(5)下列哪些说法可以说明反应已达到平衡的是 。
A.相同时间内,生成2molX同时消耗2molX
B.相同时间内,消耗2molZ同时生成1molY
C.相同时间内,生成2molX同时消耗1molY
D.相同时间内,生成2molZ同时消耗1molY
四、解答题
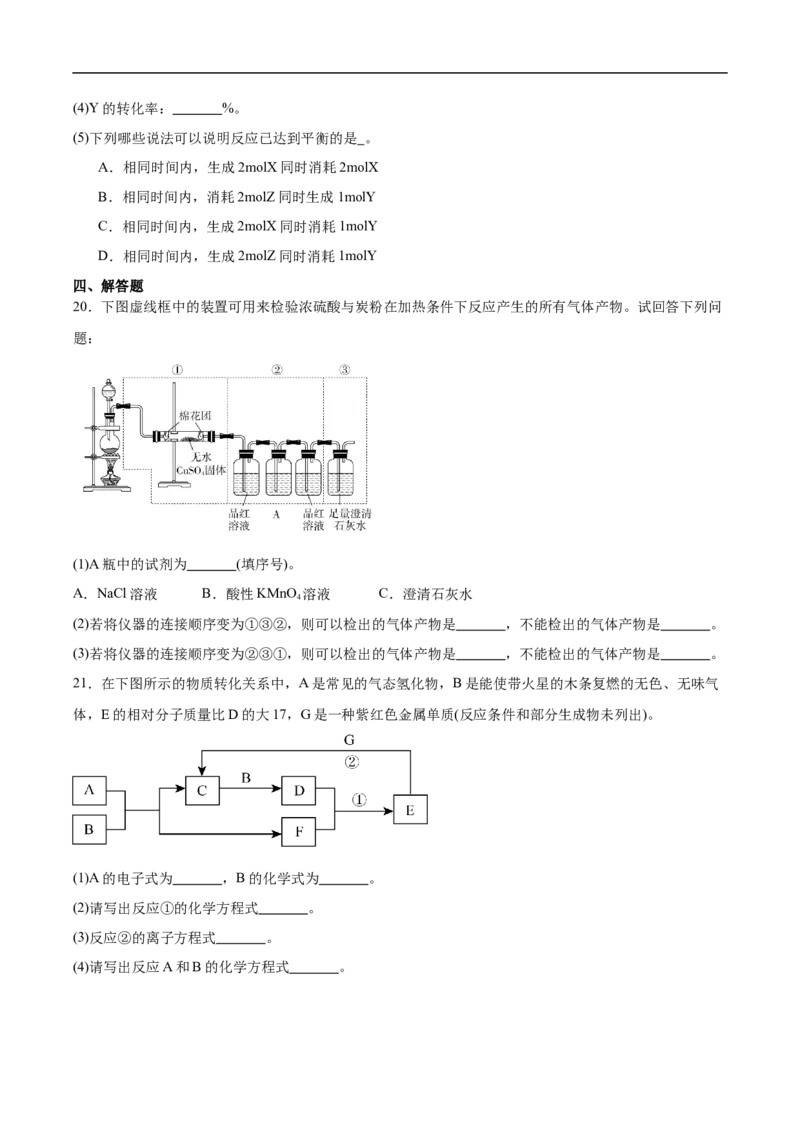
20.下图虚线框中的装置可用来检验浓硫酸与炭粉在加热条件下反应产生的所有气体产物。试回答下列问
题:
(1)A瓶中的试剂为 (填序号)。
A.NaCl溶液 B.酸性KMnO 溶液 C.澄清石灰水
4
(2)若将仪器的连接顺序变为①③②,则可以检出的气体产物是 ,不能检出的气体产物是 。
(3)若将仪器的连接顺序变为②③①,则可以检出的气体产物是 ,不能检出的气体产物是 。
21.在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无味气
体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。
(1)A的电子式为 ,B的化学式为 。
(2)请写出反应①的化学方程式 。
(3)反应②的离子方程式 。
(4)请写出反应A和B的化学方程式 。题号 1 2 3 4 5 6 7 8 9 10
答案 A B B D B A D D D D
题号 11 12 13 14 15 16
答案 A D D A A BC
17.(1)
(2)
(3) 增大 增大 减小
【详解】(1) ,
;
(2) , ,2min末,B物质浓度: ;
(3)①升高温度,化学反应速率增大;
②充人1molB,反应物浓度增大,化学反应速率增大;
③将容器的容积变为3L,容器体积增大,气体反应物浓度减小,化学反应速率减小;
18.(1)不相同
(2) 负极 正极 2Al+6H+=2Al3++3H ↑
2
(3) 负极 Al能和NaOH溶液反应,是一种两性金属,Mg不和NaOH溶液反应
【详解】(1)实验1中电极材料为Mg、Al,电解质溶液为稀盐酸,电流表指针偏向Al,说明Al为正极;
实验2中电极材料为Al、Cu,电解质溶液为稀盐酸,电流表指针偏向Cu,说明Cu为正极,Al为负极,因
此实验1、2中Al电极的作用不相同;
(2)根据实验1、2电流表指针偏向正极可知,实验3中石墨为正极,则铝为负极;由正、负极电极方程
式可得,电池总反应的离子方程式为:2Al+6H+=2Al3++3H ↑;
2
(3)根据实验1、2电流表指针偏向正极可知,实验4中Mg为正极,Al为负极,原因是:Al能和NaOH
溶液反应,是一种两性金属,Mg不和NaOH溶液反应。
19.(1)0.025mol/(L·min)
(2)X、Y
(3)X+3Y 2Z
(4)30 ⇌
(5)A【详解】(1)根据 ,用X表示反应的平均速率= 。
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成
物。
(3)由图象可得,相同时间内△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2,则反应的化学方程式为:
X+3Y⇌2Z。
(4)Y的转化率= 。
(5)A.相同时间内,生成2molX同时消耗2molX,正反应速率等于逆反应速率,说明反应已达到平衡,
A符合题意;
B.相同时间内,消耗Z与生成Y都是逆反应,不能说明正反应速率等于逆反应速率,B不符合题意;
C.相同时间内,生成2molX指的是逆反应,消耗1molY指的是正反应, ,与系数之比
不相等,因此正逆反应速率不相等,C不符合题意;
D.相同时间内,生成2molZ同时消耗1molY都是正反应,不能说明正反应速率等于逆反应速率,D不符
合题意;
故选A。
20.(1)B
(2) H O CO 、SO
2 2 2
(3) CO 、SO HO
2 2 2
【详解】(1)根据分析可知,A瓶中试剂的作用是除去SO ,因此应选用酸性KMnO 溶液,故选B。
2 4
(2)如果将仪器的连接顺序变为①、③、②,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝
色的五水合硫酸铜,能说明有水生成,通过③澄清石灰水,石灰水变浑浊,二氧化硫、二氧化碳都能使澄
清石灰水变浑浊,不可以检出二氧化硫、二氧化碳。
(3)如果将仪器的连接顺序变为②、③、①,通过②中品红溶液褪色,说明有SO ,通过酸性高锰酸钾溶
2
液除去SO ,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过③澄清石灰水,石灰水变浑浊,
2
说明有二氧化碳生成,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不
能说明是生成的水,可能是溶液中的水。
21.(1) O
2
(2)3NO +H O=2HNO +NO
2 2 3(3)3Cu+8H++2 (稀)=3Cu2++2NO↑+4HO
2
(4)
【详解】(1)A为 ,电子式为 ;由分析可知,B为 ;
(2)反应①是 和水的反应,化学方程式为: ;
(3)反应②为铜和稀硝酸的反应生成硝酸铜、一氧化氮和水,离子方程式为:
;
(4)氨气与氧气发生氨的催化氧化反应,化学方程式为: ;