文档内容
2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
专题 02 第二章 海水中的重要元素——钠和氯(B 卷)
(能力提高篇)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Mn 55 Fe 56 Ba 137
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 南朝陶弘景在《本草经集注》中记载有鉴别消石(KNO)与朴消(Na SO )之法:“以火烧之,紫青烟
3 2 4
起,云是真消石也。”该鉴别方法利用的原理是
A.受热升华 B.颜色反应
C.焰色反应 D.丁达尔效应
【答案】C
【解析】鉴别硝石(KNO)和朴硝(Na SO ),由信息可知,Na、K的焰色反应不同,含有钾元素的物质
3 2 4
在火焰上灼烧,火焰呈现紫色(透过蓝色钴玻璃观察),该原理为焰色反应,C正确。
2. 下列各组中的两种物质反应,反应条件(温度或反应物用量)改变,不会引起产物种类改变的是
A.Na和O B.NaOH和CO
2 2
C.NaO 和CO D.NaCO 和盐酸
2 2 2 2 3
【答案】C
【解析】
钠与氧气在常温下与加热或点燃条件下生成的产物不同,常温下生成氧化钠,加热或点燃条件下生成
过氧化钠,A项错误;
氢氧化钠与少量二氧化碳反应生成碳酸钠,与过量二氧化碳反应生成碳酸氢钠,产物不同,B项错误;
过氧化钠与二氧化碳反应生成碳酸钠和氧气,与量无关,C项正确;
NaCO 与少量盐酸反应生成NaHCO 和NaCl,与过量盐酸反应生成CO、HO和NaCl。
2 3 3 2 2
3. 向分别盛有100 mL水、100 mL 0.1 mol·L-1盐酸、100 mL 0.01 mol·L-1NaOH溶液的X、Y、Z三
个烧杯中各投入0.05 mol Na。下列有关说法正确的是
A.三个烧杯中均先发生的离子反应为2Na+2HO===2Na++2OH-+H↑
2 2
B.三个烧杯中钠均在液面上剧烈反应,且X烧杯中的反应最剧烈
C.三个烧杯反应后,溶质的物质的量浓度相同
D.三个烧杯反应后,生成的气体的质量一定相同
【答案】D
【解析】
钠与盐酸反应时钠先与H+反应,离子方程式表示为2Na+2H+===2Na++H↑,A错误;
2三个烧杯中,Y烧杯中的氢离子浓度最大,反应最剧烈,B错误;
X烧杯中生成的溶质为NaOH,Y烧杯中生成的溶质为NaCl、NaOH,Z烧杯中生成NaOH,且Z烧杯
中原溶质为NaOH,故三个烧杯中溶质的物质的量浓度不同,C错误;
因向三个烧杯中加入钠的物质的量相同且钠全部反应完,故生成H 的量相同,D正确。
2
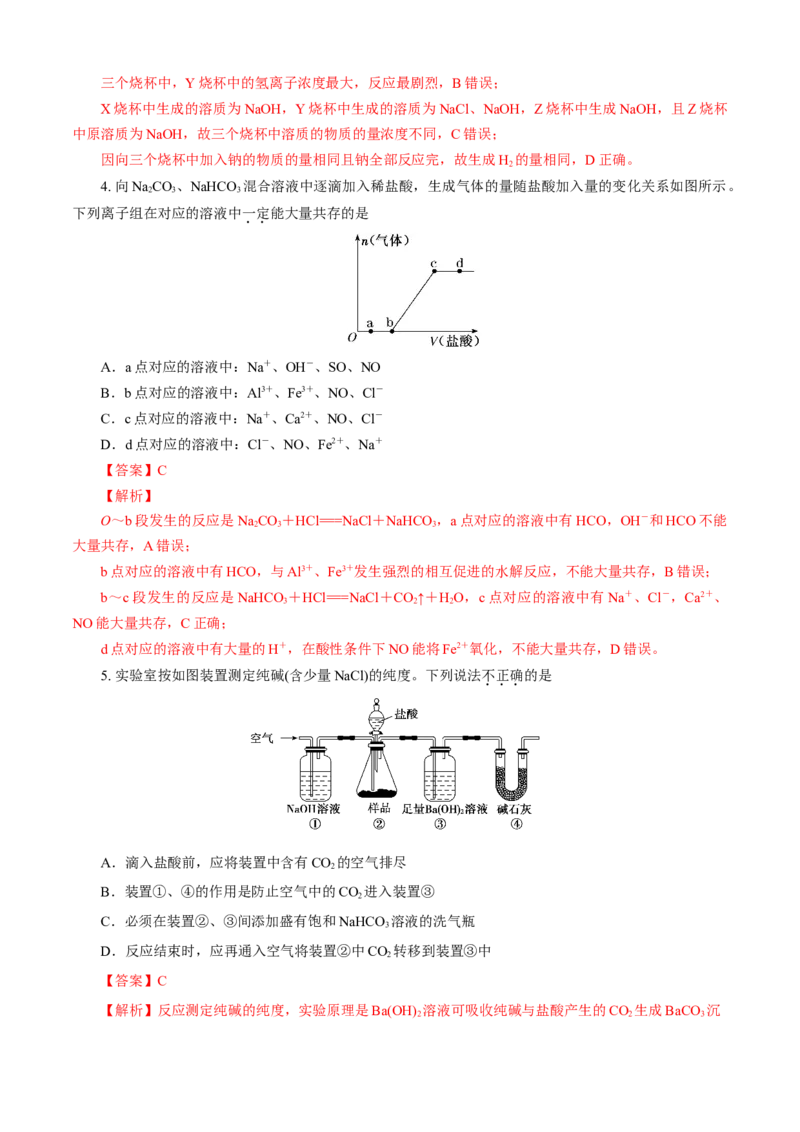
4. 向NaCO 、NaHCO 混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。
2 3 3
下列离子组在对应的溶液中一定能大量共存的是
A.a点对应的溶液中:Na+、OH-、SO、NO
B.b点对应的溶液中:Al3+、Fe3+、NO、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO、Cl-
D.d点对应的溶液中:Cl-、NO、Fe2+、Na+
【答案】C
【解析】
O~b段发生的反应是NaCO +HCl===NaCl+NaHCO ,a点对应的溶液中有HCO,OH-和HCO不能
2 3 3
大量共存,A错误;
b点对应的溶液中有HCO,与Al3+、Fe3+发生强烈的相互促进的水解反应,不能大量共存,B错误;
b~c段发生的反应是NaHCO +HCl===NaCl+CO↑+HO,c点对应的溶液中有Na+、Cl-,Ca2+、
3 2 2
NO能大量共存,C正确;
d点对应的溶液中有大量的H+,在酸性条件下NO能将Fe2+氧化,不能大量共存,D错误。
5. 实验室按如图装置测定纯碱(含少量NaCl)的纯度。下列说法不正确的是
A.滴入盐酸前,应将装置中含有CO 的空气排尽
2
B.装置①、④的作用是防止空气中的CO 进入装置③
2
C.必须在装置②、③间添加盛有饱和NaHCO 溶液的洗气瓶
3
D.反应结束时,应再通入空气将装置②中CO 转移到装置③中
2
【答案】C
【解析】反应测定纯碱的纯度,实验原理是Ba(OH) 溶液可吸收纯碱与盐酸产生的CO 生成BaCO 沉
2 2 3淀,通过测定产生的沉淀的质量计算纯碱的质量,从而测定出纯碱的纯度。
由于装置内空气中含有的CO 对测定结果有影响,因此滴入盐酸前,应将装置中含有CO 的空气排尽,
2 2
A项正确;
空气中含有的CO 对测定结果有影响,装置①、④可以吸收空气中的CO,防止空气中的CO 进入装
2 2 2
置③,B项正确;
由于盐酸容易挥发,装置②中产生的CO 中含有HCl,但HCl的存在对测定结果无影响,装置②、③
2
间不能添加盛有饱和NaHCO 溶液的洗气瓶,否则饱和NaHCO 溶液吸收HCl的同时会生成CO,导致测
3 3 2
得的CO 的质量偏大,C项错误;
2
反应结束时,为了使②中CO 被③中Ba(OH) 溶液充分吸收,应再通入空气将装置②中CO 转移到装
2 2 2
置③中,D项正确。
6. (2020冀州中学月考)过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法
不正确的是
A.NaO 与CO 反应时,NaO 是氧化剂,CO 是还原剂
2 2 2 2 2 2
B.熔融过氧化钠时不可使用石英坩埚
C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D.过氧化钠与二氧化硫反应时可生成硫酸钠
【答案】A
【解析】
NaO 与HO、CO 反应时,都是NaO 自身发生歧化反应,A项错误;
2 2 2 2 2 2
石英的主要成分是SiO ,而NaO 能与SiO 反应生成NaSiO ,故熔融过氧化钠时不可使用石英坩埚,
2 2 2 2 2 3
B项正确;
NaO 具有强氧化性,而C、Al、SO 均具有还原性,故NaO 可与C、Al、SO 发生氧化还原反应,可
2 2 2 2 2 2
将C氧化成CO,将Al氧化成Al O,将SO 氧化成SO,C、D项均正确。
2 2 3 2
7. 现有两瓶失去标签的同浓度的NaCO 和NaHCO 无色溶液,请提出简便的鉴别方法,其中不合理的
2 3 3
是
①用干燥的pH试纸检验,pH大的是NaCO
2 3
②取同量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是NaCO
2 3
③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO
3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO
3
⑤取同量的溶液于两支试管中,滴加BaCl 溶液,生成白色沉淀的是NaCO
2 2 3
⑥取同量的溶液于两支试管中,滴加Ba(OH) 溶液,生成白色沉淀的是NaCO
2 2 3
A.①② B.③⑥
C.④⑤ D.②⑤
【答案】B
【解析】①NaCO 、NaHCO 溶液均因水解呈碱性,同温度相同物质的量浓度两溶液,NaCO 水解程度大于
2 3 3 2 3
NaHCO ,前者溶液中c(OH-)大,pH大,正确;
3
②因NaCO 溶液中c(OH-)大,分别滴加酚酞溶液,红色较深的是NaCO 溶液,正确;
2 3 2 3
③取同量的溶液于两支试管中,加热,均没有气体生成,错误;
④同浓度的两溶液中,分别逐滴加入稀盐酸,NaHCO 开始就有气体放出,正确;
3
⑤向同浓度的两溶液中分别滴加BaCl 溶液,生成白色沉淀的是NaCO,正确;
2 2 3
⑥二者均与Ba(OH) 溶液反应,生成白色沉淀,不能鉴别二者,错误。
2
8. 用下列两种方法制取氯气:
①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应;②用87 g二氧化锰与足量的浓盐酸反应。则所
得氯气
A.②比①多 B.①比②多
C.一样多 D.无法比较
【答案】A
【解析】浓盐酸与MnO 反应的化学方程式为4HCl(浓)+MnO =====MnCl +Cl↑+2HO,随着反应
2 2 2 2 2
进行,盐酸浓度逐渐减小,变为稀盐酸后不再与MnO 反应。①中HCl不能完全反应,产生的Cl 少,②中
2 2
能完全反应,制得Cl 多。故产生Cl ②>①。
2 2
9. 化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述正确的是
A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH,测定结果无影响
D.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解
【答案】B
【解析】
A项,活性炭具有吸附性,可以吸附氯气,若同时使用,漂白效果会减弱,错误;
B项,氯气与烧碱溶液或石灰乳反应均可生成次氯酸盐,正确;
C项,氯水中的次氯酸具有漂白性,不能用pH试纸测定氯水的pH,错误;
D项,不能混用的原因是“84”消毒液中的NaClO与洁厕灵中的HCl反应生成Cl,错误。
2
10. 如图所示,若关闭阀门Ⅰ,打开阀门Ⅱ,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪
色;若关闭阀门Ⅱ,打开阀门Ⅰ,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③亚硫酸钠溶液 ④饱和碳酸氢钠溶液
A.①②③ B.②③④
C.①②④ D.①③④【答案】D
【解析】Cl 与HO反应生成的HClO具有漂白作用。气体通过甲瓶后不能使有色布条褪色,可能有两
2 2
个原因:一是甲瓶中溶液将 Cl 干燥,二是甲瓶中溶液能吸收 Cl 。浓HSO 吸水,NaSO 溶液、饱和
2 2 2 4 2 3
NaHCO 溶液都能与Cl 发生反应。
3 2
11. 已知KMnO 与浓盐酸在常温下反应能产生Cl。若用下图所示的实验装置来制备纯净、干燥的氯气,
4 2
并试验其与金属的反应,每个虚线框表示一个单元装置,其中有错误的是
A.①和②处 B.只有②处
C.②和③处 D.②、③、④处
【答案】D
【解析】
①是制备氯气的装置,②是除去氯气中氯化氢杂质的装置,③是干燥装置,④是用于氯气与金属反应
的装置。
除杂时不能消耗欲保留的气体,因为氯气可与NaOH溶液反应,化学方程式为Cl +2NaOH===NaCl+
2
NaClO+HO,所以②处错误;
2
③中进气管短,出气管却插入液面下,所以无法干燥气体,也不能使气体进入④中与金属反应,所以
③处错误;
④是一个封闭体系,未反应的气体不断蓄积会使容器内压强过大而发生爆炸,所以④处错误。
12. 有NaCO 、AgNO 、BaCl 、HCl和NH NO 五瓶无标签溶液,为鉴别它们取四支试管,每支试管
2 3 3 2 4 3
分别装入上述一种溶液,再向上述四支试管中分别加入少许剩下的一种溶液,下列叙述中错误的是
A.若有三支试管出现沉淀时,则后加入的是AgNO 溶液
3
B.全部没有明显现象时,则后加入的是NH NO
4 3
C.一支试管出现气泡,两支试管出现沉淀时,则后加入的是HCl溶液
D.若只有两支试管出现沉淀时,则后加入的是BaCl 溶液
2
【答案】C
A正确,因为AgNO 溶液与NaCO、BaCl 、HCl均有白色沉淀,和NH NO 溶液不反应;
3 2 3 2 4 3
B正确,NH NO 和上述溶液均不反应;
4 3C错误,盐酸加入后,一种(Na CO)溶液出现气泡,AgNO 溶液出现沉淀,其他没有现象;
2 3 3
D正确,加入BaCl 溶液,则NaCO、AgNO 两种溶液产生沉淀。
2 2 3 3
13. (2020莱州一中质检)将一定量的Cl 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过
2
程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化
如图所示。下列说法不正确的是
A.反应中转移电子的物质的量是0.21 mol
B.ClO的生成可能是由于温度升高引起的
C.苛性钾溶液中KOH的质量是16.8 g
D.一定有3.36 L氯气参加反应
【答案】D
【解析】
氯气和氢氧化钾溶液反应生成KClO、KClO 和KCl,根据图像知n(ClO-)=0.06 mol,n(ClO)=0.03
3
mol,故转移电子的物质的量为0.06 mol×(1-0)+0.03 mol×(5-0)=0.21 mol,故A正确;
根据图像知,氯气和氢氧化钾反应先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和
氢氧化钾反应生成氯酸钾,所以ClO的生成可能是由于温度升高引起的,故B正确;
根据得失电子守恒可知n(Cl-)=0.21 mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO)=0.21
mol+0.06 mol+0.03 mol=0.3 mol,则n(KOH)=0.3 mol,则氢氧化钾质量为0.3 mol×56 g·mol-1=16.8 g,
故C正确;
根据氯原子守恒可知参加反应的氯气为0.15 mol,氯气的状态未知,不能确定其体积,故D错误。
14. 物质的量相同的N、O、CO 混合后,通过NaO 颗粒一段时间,测得体积变为原混合气体体积的
2 2 2 2 2
(同温同压下),此时N、O、CO 的物质的量之比为
2 2 2
A.1∶1∶0 B.6∶9∶0
C.3∶4∶1 D.3∶3∶2
【答案】C
【解析】设反应前N、O、CO 的体积都为3,则反应前总体积为9,反应后总体积为8。
2 2 2
2NaO+2CO===2Na CO+O ΔV
2 2 2 2 3 2
2 1 1
2 1 (9-8)=1
即反应消耗CO 2体积,生成O 1体积,
2 2
故反应后:V(N )=3,V(O )=3+1=4,
2 2
V(CO)=3-2=1。
2
三者的体积比即为物质的量之比,为3∶4∶1。15. (2020郑州一中月考)某学生配制了100 mL 1 mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定
过程中一切操作都正确,但测得溶液的物质的量浓度小于1 mol·L-1。则在配制过程中,下列操作可能导致
溶液浓度偏低的是
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到100 mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度线,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
A.只有②③④ B.只有③④
C.只有①②③ D.①②③④
【答案】D
【解析】
①量筒用蒸馏水洗净后未干燥立即量取浓硫酸,浓硫酸被稀释,所取溶质 HSO 偏少,导致溶液浓度
2 4
偏低。
②未洗涤烧杯,使溶质HSO 损失,导致溶液浓度偏低。
2 4
③少量溶液流到容量瓶外面,使溶质HSO 损失,导致溶液浓度偏低。
2 4
④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失HSO ,导致溶液浓度偏低。
2 4
16. 浓度为2 mol·L-1 的盐酸V L,欲使其浓度变为4 mol·L-1,以下列出的方法中可行的是
A.通入标准状况下的HCl气体44.8 L
B.将溶液加热蒸发浓缩至0.5V L
C.蒸发掉0.5V L水
D.加入10 mol·L-1盐酸0.6V L,再将溶液稀释至2V L
【答案】D
【解析】
A项,浓度为2 mol·L-1的盐酸V L含溶质HCl 2V mol。A项,加入2 mol HCl,体积会发生改变,不可
行;
B项,加热浓缩时HCl和水都要蒸发出去,不可行;
C项,蒸发掉0.5V L水后溶液体积无法求出,不可行;
D项,属于混合溶液的有关计算,加入10 mol·L-1盐酸0.6V L后,溶质HCl的物质的量为8V mol,再
将溶液稀释至2V L,浓度变为4 mol·L-1,可行。
17. (2020雅礼中学月考)三个密闭容器中分别充入H、O、CO 三种气体,以下各种情况下排序正确的
2 2 2
是
A.当它们的压强和体积、温度均相同时,三种气体的质量:m(H )>m(O )>m(CO)
2 2 2
B.当它们的温度和压强均相同时,三种气体的密度:ρ(H )>ρ(O )>ρ(CO)
2 2 2
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(CO)>V(O )>V(H )
2 2 2
D.当它们的温度和密度都相同时,三种气体的压强:p(H )>p(O )>p(CO)
2 2 2
【答案】D
【解析】
同温同压时,同体积的气体物质的量相同,摩尔质量越大,则质量越大,因此 m(CO)>m(O )>
2 2m(H ),A项错误;
2
同温同压下,相对分子质量越大,则密度越大,因此ρ(CO)>ρ(O )>ρ(H ),B项错误;
2 2 2
同温同压下,气体体积比等于物质的量之比,由于三种气体质量相等,因此n(H )>n(O )>n(CO),所
2 2 2
以V(H )>V(O )>V(CO),C项错误;
2 2 2
同温同密度下,气体压强与摩尔质量成反比,故p(H )>p(O )>p(CO),D项正确。
2 2 2
18. (2019年陕西师大附中期中)下列有关实验原理或操作正确的是
A. 用20 mL量筒量取15 mL酒精,加5 mL水,配制质量分数为75%的酒精溶液
B. 在200 mL某硫酸盐溶液中,含有1.5N 个硫酸根离子和N 个金属离子,则该硫酸盐的物质的量浓度为
A A
2.5 mol·L-1
C. 实验中需用950 mL 2.0 mol·L-1 Na CO 溶液,配制时选用的容量瓶的规格和称取的NaCO 的质量分别
2 3 2 3
为950 mL、201.4 g
D. 实验室配制500 mL 0.2 mol·L-1硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO ·7H O),放入小
4 2
烧杯中加水溶解,转移到500 mL容量瓶中,洗涤、稀释、定容、摇匀
【答案】B
【解析】
不能用量筒来配制溶液,应用烧杯,且15 mL酒精的质量不是5 mL水的质量的3倍,A项错误;
1.5N 个硫酸根离子的物质的量为1.5 mol,N 个金属阳离子的物质的量为1 mol,设金属离子的化合价为
A A
+x,根据电荷守恒可知,x=1.5×2=3,故金属阳离子为+3价,所以该硫酸盐可以表示为M(SO ),根据硫酸根离子
2 4 3
守恒可知,硫酸盐为0.5 mol,所以该硫酸盐的物质的量浓度为 =2.5 mol·L-1,B项正确;
容量瓶没有 950 mL 规格,应用 1000 mL 容量瓶进行配制,则 m(Na CO)=cVM=1 L×2 mol·L-1×106
2 3
g·mol-1=212 g,C项错误;
配制500 mL 0.2 mol·L-1硫酸亚铁溶液,需要绿矾(FeSO ·7H O)的物质的量为0.5 L×0.2 mol·L-1=0.1 mol,质
4 2
量为27.8 g,D项错误。
19. (2020齐齐哈尔调研)设N 为阿伏加德罗常数的值,下列说法中不正确的是
A
A.标准状况下,H 和CO混合气体8.96 L在足量O 中充分燃烧消耗O 分子数为0.2N
2 2 2 A
B.一定条件下,2.3 g Na与O 完全反应生成3.6 g产物时失去的电子数为0.1N
2 A
C.25 ℃时,0.1 mol·L-1NaS溶液中含有Na+的数目为0.2N
2 A
D.在反应4Cl +8NaOH===6NaCl+NaClO+NaClO +4HO中,消耗1 mol Cl 时转移的电子总数为
2 3 2 2
1.5N
A
【答案】C
【解析】
标准状况下8.96 L混合气体的物质的量为0.4 mol,而1 mol氢气和1 mol CO燃烧时均消耗0.5 mol氧
气,则0.4 mol混合气体完全燃烧消耗0.2 mol氧气,与两者的比例无关,A正确;2.3 g Na完全反应失去0.1 mol 即0.1N 个电子,与产物无关,B正确;
A
反应4Cl +8NaOH===6NaCl+NaClO+NaClO +4HO转移6 mol电子,消耗4 mol氯气,故当消耗1
2 3 2
mol氯气时转移1.5 mol即1.5N 个电子,D正确。
A
20. T ℃时,NaCl的溶解度为a g/(100 g 水),取该温度下的饱和氯化钠溶液 V mL,测得其密度为ρ
g·cm-3,则下列表达式正确的是
A.w(NaCl)=%
B.n(NaCl)= mol
C.c(NaCl)= mol·L-1
D.n(NaCl)= mol
【答案】D
【解析】
该温度下饱和氯化钠溶液的质量分数w(NaCl)=×100%=%,A项错误;
V mL饱和氯化钠溶液的质量为 ρ g·cm-3×V mL=ρV g,溶液中氯化钠的质量分数为%,则溶液中
n(NaCl)== mol,B项错误,D项正确;
该饱和氯化钠溶液的浓度 c(NaCl)= mol÷(V×10-3L)= mol·L-1,C
项错误。
二、非选择题:本题共5个题,共60分。
21. (8分)
(2019安徽黄山期末)二氧化氯(ClO )是一种在水处理等方面有广泛应用的高效安全消毒剂,并且与 Cl
2 2
相比不会产生对人体有潜在危害的有机氯代物。下列两种方法可制备ClO :
2
方法一:2NaClO+HO+HSO ===2ClO ↑+O↑+NaSO +2HO。
3 2 2 2 4 2 2 2 4 2
方法二:2NaClO+4HCl===2ClO ↑+Cl↑+2NaCl+2HO。
3 2 2 2
(1)关于方法一的下列说法中正确的是______(填字母)。
A.HSO 是氧化剂 B.NaClO 被还原
2 4 3
C.HO 是还原剂 D.ClO 中Cl为+2价
2 2 2
(2)方法二中被还原物质与被氧化物质的物质的量之比是________,若反应中产生的ClO 气体在标准状
2
况下的体积为3.36 L,则转移电子________mol。
(3)某温度下,将Cl 通入NaOH溶液中,反应得到NaCl、NaClO、NaClO 的混合液,经测定Cl-与
2 3
ClO的物质的量浓度之比为9∶1,则所得溶液中c(ClO)∶c(ClO-)=________。
【答案】(1)BC (2)1∶1 0.15 (3)1∶4
【解析】
(1)H SO 中各元素的化合价未发生变化,A项错误;NaClO 中氯元素的化合价是+5,ClO 中氯元素
2 4 3 2
的化合价是+4,反应中NaClO 被还原,B项正确、D项错误;HO 中氧元素的化合价为-1,O 中氧元
3 2 2 2
素的化合价为0,HO 发生氧化反应,作还原剂,C项正确。
2 2
(2)根据“化合价只靠拢不交叉”可知,NaClO 中氯元素的化合价由+5降为+4,HCl中氯元素的化
3
合价由-1升高到0,反应中有一半HCl起酸的作用,氧化剂与还原剂的物质的量之比为1∶1。标准状况下3.36 L ClO 的物质的量为0.15 mol,反应中转移电子0.15 mol。
2
(3)Cl 、NaCl、NaClO、NaClO 中氯元素的化合价分别为0、-1、+1、+5,混合液中Cl-与ClO的
2 3
物质的量浓度之比为9∶1,根据得失电子守恒可知ClO与ClO-的物质的量浓度之比为1∶4。
22. (13分)
在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行
实验,证明过氧化钠可用于制取氧气。
(1)A是用CaCO 制取CO 的装置。写出A中发生反应的化学方程式:_________________________。
3 2
(2)按要求填写表中空格:
仪器编号 盛放的试剂 加入该试剂的目的
B 饱和NaHCO
3
C 与CO 反应,产生O
2 2
D 吸收未反应的CO 气体
2
(3)为了达到实验目的,________(填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装
置;若你认为需要,应选用_______________(若不需要,此空不填)作为吸水剂;若你认为不需要,请
说明理由:__________________________________________________________________。
(4)证明收集到的气体是氧气的方法是_______________________________________________________。
【答案】
(1)CaCO+2HCl===CaCl +CO↑+HO
3 2 2 2
(2)
仪器 加入试剂 加入该试剂的目的
B 除去CO2气体中混入的HCl
C 过氧化钠
D NaOH溶液
(3)不需要,因为水蒸气也能与过氧化钠反应生成氧气,不影响实验目的
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条
伸入试管口,木条复燃,证明试管中收集的气体是氧气
【解析】
(1)A为由CaCO3和盐酸反应生成CO2,方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反
应,产生O2,由于生成的氧气中混有二氧化碳气体,应用NaOH溶液洗气,吸收未反应的CO2气体,用
排水法收集O2,故答案为:
仪器 加入试剂 加入该试剂的目的
B 除去CO2气体中混入的HCl
C 过氧化钠
D NaOH溶液
(3)因为过氧化钠除了与二氧化碳反应生成氧气外,还与水蒸气也反应生成氧气,所以在B装置之后不
需要增加一个吸收水蒸气的装置,故答案为:不需要;因为水蒸气也能与过氧化钠反应生成氧气,不影响
实验目的;
(4)本实验的目的为证明过氧化钠可作供氧剂,收集气体后要验证是否为氧气,为防止倒吸,应先把E
中的导管移出水面,然后关闭分液漏斗活塞,用带火星的木条伸入试管口内,木条复燃,证明试管中收集
的气体是氧气,故答案为:立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
23. (12分)
已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请
回答下列问题:
“84”消毒液
有效成分 NaClO
规格 1000mL
质量分数 25%
密度 1.19 g·cm-3
(1)该“84”消毒液的物质的量浓度约为 mol·L-1(结果保留1位小数)。
(2)某同学取100 mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)= mol·L
-1。
(3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消
毒液。下列说法正确的是 。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84 g·cm-3)
的浓硫酸配制2L2.3 mol·L-1的稀硫酸用于增强“84”消毒液的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
【答案】(1)4.0 (2)0.04 (3)C (4)①4.6 ②250.0
【解析】
(1)由c=得,c(NaClO)= mol·L-1≈4.0 mol·L-1。
(2)稀释前后溶液中NaClO的物质的量不变,则有100mL×10-3L·mL-1×4.0 mol·L-1=100 mL×10-3
L·mL-1×c(NaClO)×100,解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-
1。
(3)选项A,需用托盘天平称取NaClO固体,需用烧杯溶解NaClO,需用玻璃棒进行搅拌和引流,
需用容量瓶和胶头滴管来定容,图示中的a、b不需要,但还需要玻璃棒和胶头滴管;选项B,配制过程中
需要加水,所以洗涤干净后的容量瓶不必烘干;选项C,未洗涤烧杯和玻璃棒将导致配制的溶液中溶质的
物质的量减小,结果偏低;选项D,应选取500mL的容量瓶进行配制,然后取出480 mL即可,所以需要
NaClO的质量为0.5L×4.0 mol·L-1×74.5 g·mol-1=149.0 g。
(4)①根据HSO 的组成可知,溶液中c(H+)=2c(HSO )=4.6 mol·L-1。②2 L 2.3 mol·L-1的稀
2 4 2 4
硫酸中溶质的物质的量为2L×2.3 mol·L-1=4.6 mol,设需要98%(密度为1.84 g·cm-3)的浓硫酸的体积为
VmL,则有=4.6 mol,解得V=250.0。
24. (17分)
某化学实验小组欲用下列装置制备纯净的氯气及含氯化合物,并探究其性质。
(1)欲制备并收集一瓶纯净的氯气,选择甲图中合适的装置,其连接顺序为____________________(按
气流方向,用小写字母表示)。根据选择的装置,写出制备氯气的化学方程式:_______________________。
(2)取氯气与NaOH溶液反应生成的“84”消毒液100 mL,持续通入过量的SO ,溶液中开始出现黄绿
2
色,后黄绿色逐渐褪去。溶液变为黄绿色的可能原因是:①溶液中Cl-与ClO-反应所致,设计实验方案确认这种可能性:______________________________
____________________________________________________________________________________。
②__________________________(用离子方程式表示)所致。
向反应后的溶液中先加入足量稀盐酸,再加入足量氯化钡溶液,经过滤、洗涤、干燥、称量,所得沉
淀的质量为w g,则溶液中NaClO的物质的量浓度为________mol·L-1。
(3)在加热条件下,氯气与 NaOH 溶液反应生成 NaClO 和 NaCl 等,写出反应的离子方程式:
3
______________________________。实验小组设计乙图装置(加热装置略去)验证NaClO 的性质。
3
已知:2NaClO +NaC O +2HSO (稀)===2ClO ↑+2CO↑+2NaSO +2HO;ClO 与氯气的化学性质
3 2 2 4 2 4 2 2 2 4 2 2
相似。
控制装置A中分液漏斗活塞,缓慢滴加稀硫酸,观察到B装置中的现象是________________;装置C
吸收的物质是________。
【答案】
(1)a(或b)、g、h、e、f、i、j、d(或m)
A对应:MnO +4HCl(浓)=====MnCl +Cl↑+2HO
2 2 2 2
B对应:2KMnO +16HCl(浓)===2KCl+2MnCl +5Cl↑+8HO
4 2 2 2
(2)①取少量“84”消毒液于试管中,滴加稀硫酸,观察溶液颜色变为黄绿色
②2ClO-+SO ===Cl+SO
2 2
(3)3Cl +6OH-=====ClO+5Cl-+3HO 溶液变蓝 ClO 和CO
2 2 2 2
【解析】
(1)为制取、收集纯净干燥的氯气,并探究氯气的性质,A、B均可制备氯气,若为A,则反应为:MnO
2
+4HCl(浓)=====MnCl +Cl↑+2HO,若选用B,反应为:2KMnO +16HCl(浓)===2KCl+2MnCl +
2 2 2 4 2
5Cl↑+8HO,所制备的氯气中混有氯化氢气体和水蒸气,故依次选择饱和食盐水除去氯化氢,浓硫酸除去
2 2
水蒸气,为除杂充分,导气管均应长进短出,F中收集干燥的氯气,氯气比空气密度大,故导气管也应长
进短出,氯气污染空气,故选用碱液吸收,则连接顺序为:a(或b)、g、h、e、f、i、j、d(或m);
(2)①随溶液酸性的增强,漂粉精的有效成分和Cl−发生反应。通过进一步实验确认这种可能性,漂粉精
中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,方法为:取少
量“84”消毒液于试管中,滴加硫酸,观察溶液是否变为黄绿色;②ClO-与SO 生成氯气和硫酸根离子,离子方程式为:2ClO-+SO ===Cl+SO;向反应后的溶液中
2 2 2
先加入足量稀盐酸,再加入足量氯化钡溶液,经过滤、洗涤、干燥、称量,所得沉淀的质量为w g,该沉淀
为硫酸钡沉淀,n(BaSO)=w/233mol,根据2ClO− SO BaSO,则溶液中NaC1O的物质的量浓度为
4 4
2×w/233mol/0.1L=20w/233mol/L; ∼ ∼
(3)氯气与NaOH溶液反应生成NaC1O 和NaC1,结合得失电子守恒和质量守恒可得3Cl+6OH-
3 2
=====ClO+5Cl-+3HO;图2中A装置发生反应:2NaClO+NaC O+2HSO (稀)===2ClO ↑+2CO↑+
2 3 2 2 4 2 4 2 2
2NaSO +2HO,C1O 氧化KI为碘单质,使B装置中淀粉显蓝色,生成的C1O 和二氧化碳在C中被氢氧
2 4 2 2 2
化钠吸收。
25. (10分)
(2020莱芜一中检测)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18
g·cm-3。试计算:
(1)所得盐酸的溶质质量分数和物质的量浓度分别是 、 。
(2)取这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1 NaCO 溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反
2 3
应不产生CO 气体,加入稀盐酸的体积最多不超过 mL。
2
(4)将1g不纯的NaOH样品(样品含少量NaCO 和水),放入50 mL 2mol·L-1的盐酸中,充分反应
2 3
后,溶液呈酸性,中和多余的酸又用去40 mL 1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
g固体。
【答案】(1)36.5% 11.8 mol·L-1 (2)1 mol·L-1 (3)2.6 (4)5.85
【解析】(1)n(HCl)==10 mol,
m(HCl)=10 mol×36.5 g·mol-1=365 g,
盐酸的溶质质量分数w=×100%=36.5%;
c(HCl)=
=
=11.8 mol·L-1。
(2)由c(浓)·V(浓)=c(稀)·V(稀)可知,
c(稀)=11.8 mol·L-1×=1 mol·L-1。
(3)n(NaCO )=0.040 L×0.065 mol·L-1=0.0026 mol,设加入稀盐酸的体积最多不超过x mL,则n
2 3
(HCl)=1 mol·L-1×0.001 x L=0.001 x mol,根据化学方程式NaCO +HCl===NaHCO +NaCl得0.0026=
2 3 3
0.001 x,x=2.6。
(4)经过反应,蒸发中和后的溶液,最后所得固体为 NaCl,根据氯原子守恒:n(NaCl)=n
(HCl)=0.050L×2 mol·L-1=0.1 mol,m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。