文档内容
2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
第三章 铁 金属材料(B 卷)
(能力提高篇)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 31 Fe 56
Cu 64 Zn 65
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 用如图所示装置进行铁与水蒸气反应的实验,下列做法不正确的是
A. 试管中的还原铁粉可用绕成团的干净细铁丝代替
B. 可将试管底部的湿棉花移到试管口
C. 用铁丝网罩罩住酒精灯火焰
D. 点燃肥皂泡验证氢气的生成
【答案】B
【解析】
A. 铁粉易堵塞导管口,而绕成团的铁丝与水蒸气反应的接触面积也较大,故A正确;
B. 湿棉花在加热时提供水蒸气,若湿棉花移到试管口部,加热产生的水蒸气不能与铁丝充分反应,故
B错误;
C. 铁丝网罩罩住酒精灯火焰,提高温度,则能使该反应在高温下进行,故C正确;
D. 该反应生成氢气,能燃烧,所以点燃肥皂泡验证氢气的生成,故D正确;
2. 有关铁的氧化物的说法中,不正确的是A. 赤铁矿主要成分是 Fe O,Fe O 是红棕色的,常用作红色油漆和涂料
2 3 2 3
B. Fe O 是黑色晶体,其中 的铁显+2 价, 的铁显+3 价
3 4
C. FeO、Fe O 都不溶于水,但都能和盐酸反应生成相应的盐
2 3
D. FeO 不稳定,在空气中加热迅速被氧化成 Fe O
2 3
【答案】D
【解析】
A. 赤铁矿主要成分是 Fe O,Fe O 是红棕色的固体,可以用作红色油漆和涂料,故A正确;
2 3 2 3
B. Fe O 可以是Fe O FeO,其中 的铁显+2 价, 的铁显+3 价,故B正确;
3 4 2 3
C. FeO、 Fe O 都不溶于水属于碱性氧化物,都能和盐酸反应生成相应的盐,故C正确;
2 3
D. FeO在空气中被氧化生成四氧化三铁,故D错误;
3. 某铁的氧化物,用7.0 mol·L-1的盐酸100 mL在一定条件下恰好完全溶解,所得溶液中再通入 0.56
L标况下的氯气时,刚好使溶液中的Fe2+全部转化为Fe3+,则该氧化物中Fe2+与Fe3+的物质的量之比为
A. 1∶4 B. 2∶1 C. 4∶1 D. 3∶4
【答案】A
【解析】设铁的氧化物用盐酸溶解生成的Fe2+物质的量为x,Fe3+物质的量为y,由溶液中离子电荷守
恒可知:2x+3y=0.1 L×7.0 mol·L-1,由2Fe2++ Cl===2Fe3++ 2Cl-可知x=0.56 L÷22.4 L·mol-1×2=
2
0.05 mol,x=0.05 mol,则y=0.2 mol,该氧化物中x∶y= 0.05 mol∶0.2 mol=1∶4。
4. 有关铁的化合物的说法中,错误的是
A. Fe(OH) 是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色
2
B. 由图标操作可制取Fe(OH)
2
C. Fe O、Fe(OH) 都可以由化合反应制得
3 4 3
D. Fe(OH) 胶体呈红褐色、透明,能发生丁达尔效应
3
【答案】A
【解析】
A. Fe(OH)2是一种白色固体,A错误;
B. 煤油可以避免试管中部分氧气对氢氧化亚铁的氧化,则能减少与氧气接触,故B正确;C. 铁在氧气中燃烧可生成,可通过,化合反应制取,故C正确;
D. 胶体呈红褐色、透明,能发生丁达尔现象,故D正确。
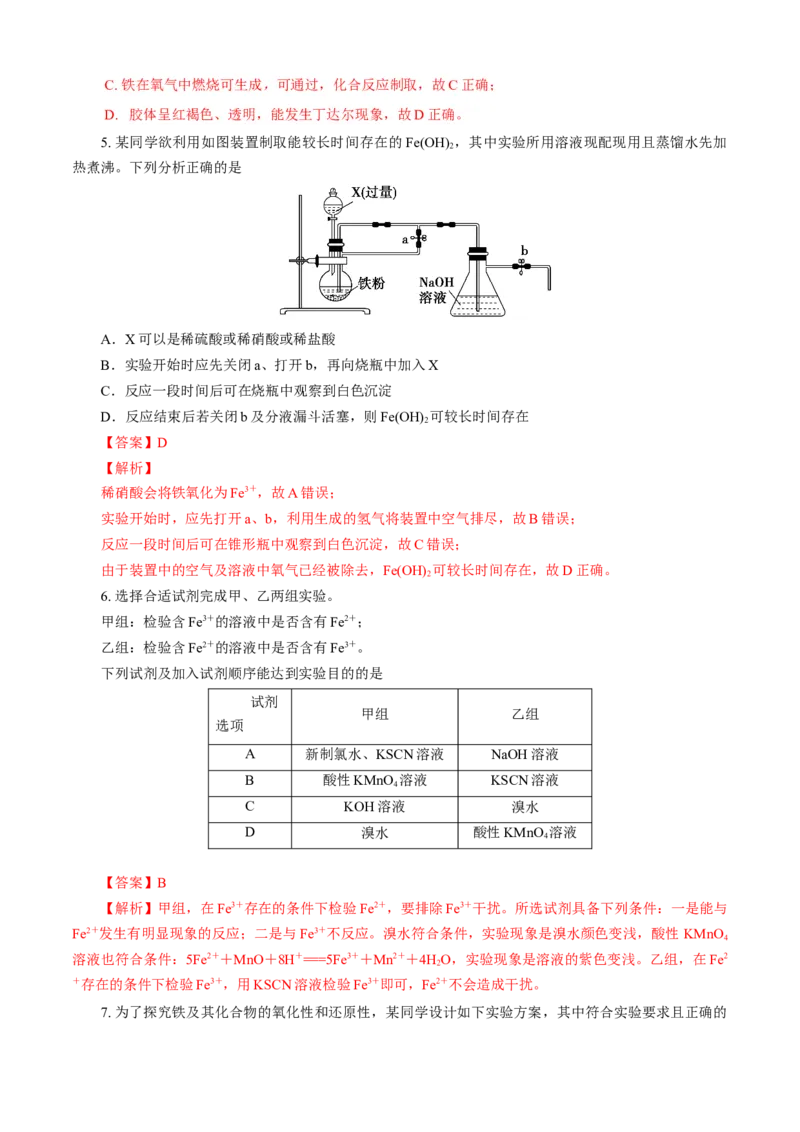
5. 某同学欲利用如图装置制取能较长时间存在的Fe(OH) ,其中实验所用溶液现配现用且蒸馏水先加
2
热煮沸。下列分析正确的是
A.X可以是稀硫酸或稀硝酸或稀盐酸
B.实验开始时应先关闭a、打开b,再向烧瓶中加入X
C.反应一段时间后可在烧瓶中观察到白色沉淀
D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH) 可较长时间存在
2
【答案】D
【解析】
稀硝酸会将铁氧化为Fe3+,故A错误;
实验开始时,应先打开a、b,利用生成的氢气将装置中空气排尽,故B错误;
反应一段时间后可在锥形瓶中观察到白色沉淀,故C错误;
由于装置中的空气及溶液中氧气已经被除去,Fe(OH) 可较长时间存在,故D正确。
2
6. 选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是
试剂
甲组 乙组
选项
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO 溶液 KSCN溶液
4
C KOH溶液 溴水
D 溴水 酸性KMnO 溶液
4
【答案】B
【解析】甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+干扰。所选试剂具备下列条件:一是能与
Fe2+发生有明显现象的反应;二是与Fe3+不反应。溴水符合条件,实验现象是溴水颜色变浅,酸性 KMnO
4
溶液也符合条件:5Fe2++MnO+8H+===5Fe3++Mn2++4HO,实验现象是溶液的紫色变浅。乙组,在Fe2
2
+存在的条件下检验Fe3+,用KSCN溶液检验Fe3+即可,Fe2+不会造成干扰。
7. 为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是
选项 实验操作 实验现象 离子反应 实验结论
在氯化亚铁溶液中 浅绿色溶液变成棕 2Fe2++Cl===2Fe3++2Cl Fe2+具有氧化
A 2
滴加新制氯水 黄色溶液 - 性
在氯化亚铁溶液中 浅绿色溶液变成无
B Fe2++Zn===Fe+Zn2+ Zn具有还原性
加入锌片 色溶液
在氯化铁溶液中加 棕黄色溶液变成浅 铁单质具有还
C Fe3++Fe===2Fe2+
入铁粉 绿色溶液 原性
在氯化铁溶液中加 棕黄色溶液变成蓝 2Fe3++Cu===2Fe2++Cu2 Fe3+具有还原
D
入铜粉 色溶液 + 性
【答案】B
【解析】
A项体现了Fe2+的还原性,错;
C项,离子方程式不正确,应为:2Fe3++Fe===3Fe2+;
D项,D项,体现了Fe3+的氧化性,错误。
8. 下表中对离子方程式书写的评价正确的是
选项 化学反应与离子方程式 评价
将铜屑加入含Fe3+溶液中:
A 正确
Fe3++Cu===Fe2++Cu2+
NaO 与HO反应:
2 2 2
B 错误,氧元素不守恒
NaO+HO===2Na++2OH-+O↑
2 2 2 2
NaOH溶液与氧化铝反应:
C 错误,产物应该是Al(OH)
3
Al O+2OH-===2AlO+HO
2 3 2
向Fe(OH) 中加入足量稀硝酸:
2
D 正确
Fe(OH) +2H+===Fe2++2HO
2 2
【答案】B
【解析】
A应为:2Fe3++Cu===2Fe2++Cu2+;
B应为:2NaO+2HO===4Na++4OH-+O↑;
2 2 2 2
C项离子方程式正确,评价错误;
D项稀硝酸将Fe2+氧化为Fe3+。
9. 已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是
A.A为Fe,B为FeOB.C→D溶液的颜色变化:浅绿色→棕黄色
C.④的离子方程式:Fe+Fe3+===2Fe2+
D.⑤的离子方程式:4Fe(OH) +O+2HO===4Fe(OH)
2 2 2 3
【答案】B
【解析】由“红褐色固体”可知F是Fe(OH) ,从而得出A为Fe,“黑色晶体B”为Fe O ,继而推出
3 3 4
C为FeCl ,D为FeCl ,E为Fe(OH) 。⑤的离子方程式可为 Fe+2Fe3+===3Fe2+,④的离子方程式可为
2 3 2
2Fe2++Cl===2Fe3++2Cl-。
2
10. 在FeCl 、CuCl 、FeCl 的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使
3 2 2
溶液中三种离子的物质的量之比变为1∶2∶4,则参加反应的铁粉与原溶液中Fe3+的物质的量之比为
A. 2∶1 B.1∶2 C.1∶3 D.1∶4
【答案】C
【解析】氧化性Fe3+>Cu2+>Fe2+,加入适量的铁粉,使溶液中Fe3+、Cu2+和Fe2+的物质的量之比变为1∶2∶4,
说明溶液中Fe3+有剩余,则Cu2+没有参加反应,加入的铁粉仅与Fe3+反应。设原溶液中含有Fe3+、Cu2+、Fe2+的
物质的量分别为3 mol、2 mol、1 mol,则反应后Fe3+、Cu2+、Fe2+的物质的量分别为1 mol、2 mol、4 mol,故
反应的Fe3+的物质的量为2 mol,参加反应的Fe的物质的量为1 mol,参加反应的铁粉与原溶液中Fe3+的物质
的量之比为1 mol∶3 mol=1∶3。
11. 某合金与铁的物理性质比较如下:
硬度(金 导电性
其他性质
刚石为100) (银为100)
某合金 2 500 3.00 7.4 2.3 耐腐蚀
铁 1 535 7.86 4.5 17 纯铁耐腐蚀
从以上性能看,该合金不适合制成
A.导线 B.门窗
C.炉具 D.飞机外壳
【答案】A
【解析】从表格中总结,该合金具有密度小、机械性能好的特点,所以适合制作飞机外壳、门窗框。
由于熔点较高,所以适合制作炉具。但是导电性不好,所以不适宜制作导线。
12. 美国“海狼”级潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质。
下列有关说法不正确的是
A.金属性:Na>Al
B.铝钠合金若投入一定量的水中可得到无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入足量氯化铜溶液中,肯定有氢氧化铜沉淀产生,也可能有铜析出
D.m g不同组成的铝钠合金投入足量的盐酸中,若放出的H 越多,则铝的质量分数越小
2
【答案】D【解析】
金属性:Na>Al,A项正确;
铝钠合金投入水中发生反应:2Na+2HO===2NaOH+H↑,2Al+2NaOH+2HO===2NaAlO +3H↑,
2 2 2 2 2
若只得到无色溶液,则n(Al)≤n(Na),B项正确;
铝钠合金投入氯化铜溶液中,钠与水反应生成的氢氧化钠与氯化铜反应会得到氢氧化铜沉淀,铝与氯
化铜溶液反应有铜析出,C项正确;
铝、钠与足量盐酸反应,每得到1 mol氢气,消耗钠46 g,消耗铝18 g,故铝的质量分数越大,得到
的氢气越多,D项错误。
13. 钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、
密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性
能,下列用途不切实际的是
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,制作钛合金装饰门
【答案】A
【解析】
由于其熔点高,不适合做保险丝,A错误;
由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;
由于钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排斥反应,因此可
以用来制造人造骨,C正确;
由于其密度小、可塑性好、易于加工,因此可用于家庭装修,制作钛合金装饰门,D正确。
14. 下列有关物质的性质与其应用不相对应的是
A. MgO、Al O 的熔点很高,可制作耐高温材料
2 3
B. NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂
C. Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
D. 利用钠蒸气放电发光的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光
【答案】B
【解析】
A.耐高温材料应具有熔点高的特点,因MgO、Al2O3熔点高,硬度大,则可用于耐高温材料,故A
正确;
B.碳酸氢钠不稳定,加热或与酸反应都可生成二氧化碳气体,则可用于焙制糕点的膨松剂,但不是
和碱反应的原因,故B错误;
B.Al具有良好的延展性,可制成铝箔,且在表面能生成一层致密的氧化物膜,则具有抗腐蚀性,故
C正确;
D.钠的焰色反应为黄色,因黄色光射程远、透雾能力强,则可用于自造高压钠灯,故D正确。
15. 下列混合物分离(或除杂)的方法正确的是
A.除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤
B.除去BaCO 固体中混有的BaSO:加入过量盐酸后,过滤、洗涤
3 4
C.除去NaHCO 溶液中的NaCO:加入适量稀盐酸
3 2 3
D.除去Al O 中的少量Fe O:加入过量氢氧化钠溶液,过滤、洗涤
2 3 2 3
【答案】A
【解析】
A. Mg与NaOH溶液不反应,Al与NaOH溶液反应生成可溶的NaAlO 和H,A项正确;
2 2
B. 加入盐酸会将BaCO 溶解,BaSO 不溶于盐酸,B项错误;
3 4
C. 加入适量盐酸可能发生的反应有NaCO +2HCl===2NaCl+HO+CO↑、NaHCO +HCl===NaCl+
2 3 2 2 3
HO+CO↑,一方面盐酸的量难以控制,另一方面引入新杂质NaCl,同时NaHCO 可能减少,C项错误;
2 2 3
D. 加入过量NaOH会将Al O 溶解转化为NaAlO ,Fe O 与NaOH溶液不反应,不能将杂质除去,D
2 3 2 2 3
项错误。
16. 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量
相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
【答案】B
【解析】左边中的铝球与氢氧化钠溶液反应:2Al+2NaOH+2HO===2NaAlO +3H↑,有一部分铝溶
2 2 2
解,并产生气体,生成偏铝酸钠;右边铁球浸在硫酸铜溶液中发生反应:Fe+CuSO ===FeSO +Cu,铁球
4 4
表面有红色物质析出,铁球质量增加,Cu2+减少,溶液蓝色变浅,左边消耗OH-,使c(OH-)减小。
17. 等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的
体积比是
A.1∶1 B.3∶4C.2∶3 D.4∶3
【答案】B
【解析】根据反应的化学方程式Fe+2HCl===FeCl +H↑、3Fe+4HO(g)=====Fe O +4H 可知,1
2 2 2 3 4 2
mol Fe与盐酸反应生成1 mol H ,与水蒸气反应生成 mol H,故相同条件下,产生H 的体积比是3∶4。
2 2 2
18. Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中不正确的是
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol H
2
【答案】A
【解析】反应的实质为Mg+2H+===Mg2++H↑,2Al+6H+===2Al3++3H↑。n(H )==0.2 mol,则参
2 2 2
加反应的n(H+)=0.4 mol。若换成稀HSO ,同样产生0.2 mol H ,故B、D正确。由2H+~H~2e-可知,
2 4 2 2
得电子总数为0.2 mol×2=0.4 mol,依据得失电子守恒,故C正确。0.2 mol Mg提供0.4 mol电子,0.2 mol
Al提供0.6 mol电子,则0.2 mol Mg、Al混合物提供的电子数大于0.4 mol、小于0.6 mol,故A不正确。
19. 有Fe和Fe O 的混合物27.2 g,溶于100 mL的稀硫酸中,恰好完全反应,放出2.24 L(标准状况
2 3
下)H ,向反应后的溶液中滴入KSCN溶液,未见红色。混合物中单质Fe的质量为
2
A.5.6 g B.8.4 g
C.11.2 g D.16.8 g
【答案】C
【解析】Fe和Fe O 的混合物中加入稀硫酸,恰好完全反应,放出氢气,反应后的溶液中滴加KSCN
2 3
溶液不显红色,且无固体剩余,则最终溶液中的溶质为FeSO ,反应生成H 的物质的量为=0.1 mol,则:
4 2
Fe + HSO ===FeSO+H↑
2 4 4 2
0.1 mol 0.1 mol 0.1 mol
设原混合物中Fe O 的物质的量为x mol,则:
2 3
Fe + Fe O+3HSO ===3FeSO+3HO
2 3 2 4 4 2
x mol x mol 3x mol
由题意可知,(x+0.1) mol×56 g·mol-1+x mol×160 g·mol-1=27.2 g,解得x=0.1,混合物中m(Fe O)=
2 3
0.1 mol×160 g·mol-1=16 g,m(Fe)=27.2 g-16 g=11.2 g。
20. 将铁加入100 mL某浓度的盐酸中恰好完全反应,反应后生成的气体体积为V L(标准状况下,下同),
将铝加入100 mL 2 mol·L-1 NaOH溶液中恰好完全反应,充分反应后生成的气体体积为 3V L。下列说法正
确的是
A.原铁和铝的物质的量相等
B.原盐酸的浓度为2 mol·L-1
C.铁加入盐酸中发生反应的离子方程式为2Fe+6H+===2Fe3++3H↑
2
D.盐酸与NaOH溶液的物质的量浓度之比为1∶3
【答案】B
【解析】Al与NaOH溶液的反应:
2Al + 2NaOH+2HO===2NaAlO+3H↑
2 2 2
2 mol 2 mol 3 mol
n(Al) 0.1 L×2 mol·L-1 n(H )
2
=,解得n(H )=0.3 mol,
2
=,解得n(Al)=0.2 mol,
由 Al 与 NaOH 溶液反应生成的气体体积为 3V L,得=0.3 mol,解得 V=2.24。再根据 Fe+
2HCl===FeCl +H↑,生成的气体体积为 V L,可求出Fe的物质的量为 0.1 mol,HCl的物质的量为 0.2
2 2
mol,则c(HCl)==2 mol·L-1,B正确;由上述数据分析知铁、铝的物质的量不相等,A错误;Fe与盐酸
反应生成Fe2+,C错误;盐酸与NaOH溶液的物质的量浓度之比为1∶1,D错误。
二、非选择题:本题共5个题,共60分。
21. (10分)
已知有以下物质相互转化:
试回答下列问题:
(1)写出B的化学式:________,D的化学式:________。
(2)写出由E转变成F的化学方程式:____________________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式:_____________________________________;
向G溶液中加入A的有关反应的离子方程式为______________________________________。
【答案】
(1)FeCl KCl
2
(2)4Fe(OH) +O+2HO===4Fe(OH)
2 2 2 3
(3)Fe3++3SCN-===Fe(SCN) 2Fe3++Fe===3Fe2+
3
【解析】 解题的突破口是白色沉淀→红褐色沉淀→G溶液,即为Fe(OH) →Fe(OH) →FeCl 。
2 3 3
D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸
银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐
色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,
氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化
钾。(1)通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl 、KCl;
2
(2)E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为:
4Fe(OH) +O+2HO===4Fe(OH)
2 2 2 3
(3)铁离子和硫氰根离子反应生成硫氰化铁,离子反应方程式为:Fe3++3SCN-===Fe(SCN) ,铁离子
3
和铁反应生成亚铁离子,离子反应方程式为:2Fe3++Fe===3Fe2+。
22. (10分)
某化学兴趣小组按照如下流程进行“由镁铝合金制备硫酸铝晶体”的实验。
(1)向镁铝合金中加NaOH溶液反应的离子方程式为_________________________________________,
金属X的原子结构示意图为__________________,固体A的化学式为________。
(2)写出硫酸铝在水中的电离方程式:_____________________________________;操作②包含的步骤
有蒸发浓缩、________、过滤、洗涤、干燥。
(3)该兴趣小组为测定镁铝合金中各组分的质量分数,设计如图装置,则需要测定的数据有
_______________________、__________________。
【答案】
(1)2Al+2OH-+2HO===2AlO+3H↑ Al(OH)
2 2 3
(2)Al(SO )===2Al3++3SO 冷却结晶(降温结晶)
2 4 3
(3)氢气的体积 镁铝合金的质量(两空顺序可颠倒)
【解析】
(1)向镁铝合金中加入足量NaOH溶液,Al和NaOH溶液反应生成可溶性的NaAlO ,镁不反应,发生
2
反应的离子方程式为2Al+2OH-+2HO===2AlO+3H↑;镁的原子结构示意图为;向滤液中加入稀硫酸调
2 2
节溶液的pH,得到Al(OH) 固体。
3
(2)Al(SO ) 是强电解质,电离方程式为Al (SO )===2Al3++3SO。操作②包含的步骤有蒸发浓缩、冷
2 4 3 2 4 3
却结晶(降温结晶)、过滤、洗涤、干燥。
(3)根据装置图知,需测得氢气体积,根据金属和氢气之间的关系式分析知,还需要测定镁铝合金的质
量。
23. (14分)
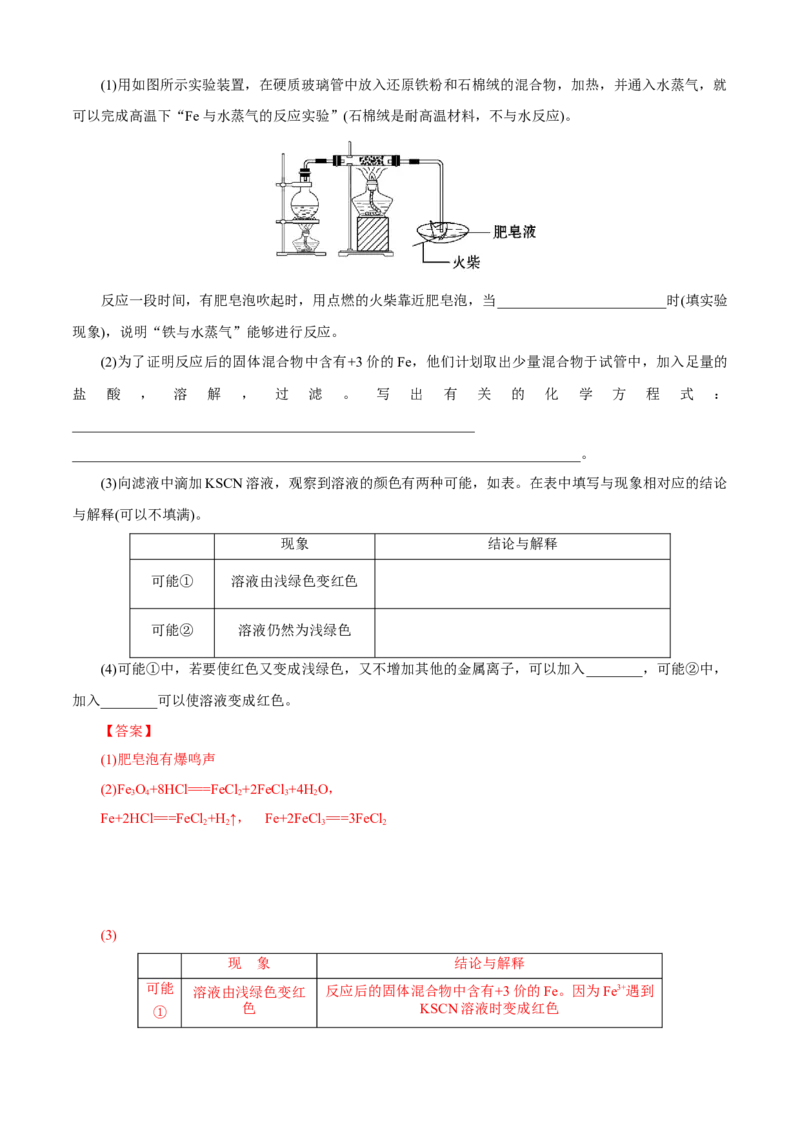
某小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就
可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
反应一段时间,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当________________________时(填实验
现象),说明“铁与水蒸气”能够进行反应。
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的
盐 酸 , 溶 解 , 过 滤 。 写 出 有 关 的 化 学 方 程 式 :
_________________________________________________________
________________________________________________________________________。
(3)向滤液中滴加KSCN溶液,观察到溶液的颜色有两种可能,如表。在表中填写与现象相对应的结论
与解释(可以不填满)。
现象 结论与解释
可能① 溶液由浅绿色变红色
可能② 溶液仍然为浅绿色
(4)可能①中,若要使红色又变成浅绿色,又不增加其他的金属离子,可以加入________,可能②中,
加入________可以使溶液变成红色。
【答案】
(1)肥皂泡有爆鸣声
(2)Fe O+8HCl===FeCl +2FeCl +4H O,
3 4 2 3 2
Fe+2HCl===FeCl +H ↑, Fe+2FeCl ===3FeCl
2 2 3 2
(3)
现 象 结论与解释
可能 溶液由浅绿色变红 反应后的固体混合物中含有+3价的Fe。因为Fe3+遇到
① 色 KSCN溶液时变成红色反应后的固体混合物中可能含有+3价的Fe,也可能
可能
溶液仍然为浅绿色 不含+3价的Fe。因为如果铁粉有剩余,剩余铁粉会
②
与Fe3+反应,将溶液中Fe3+完全还原为Fe2+
(4)铁粉 氯水
【解析】
(1)铁与水蒸气发生反应:3Fe+4H O(g)=====Fe O+4H ,故用点燃的火柴靠近肥皂泡,当肥皂泡有
2 3 4 2
爆鸣声,证明已有氢气生成,反应已开始;
反应后的固体混合物可能是① Fe O ;② Fe、Fe O 。加入足量的盐酸,溶解,过滤,发生反应:
3 4 3 4
Fe O+8HCl===
3 4
FeCl +2FeCl +4H O、Fe+2FeCl ===3FeCl 、Fe+2HCl===FeCl +H ↑,向滤液中滴加KSCN溶液,现象①溶
2 3 2 3 2 2 2
液由浅绿色变红色,则说明反应后的固体混合物中含有+3价的Fe,因为Fe3+遇到KSCN溶液时变成红色;
(2)现象②溶液仍然为浅绿色,则说明反应后的溶液中没有Fe3+,可能是铁粉有剩余,剩余铁粉会与
Fe3+反应,将溶液中Fe3+完全还原为Fe2+;
(3)可能①中,若要使红色又变成浅绿色,又不增加其他的金属离子,可以加入铁粉;可能②中,
加入氯水可以使溶液变成红色。
24. (16分)
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是
________________________________________________________________。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的HO 溶液、锌粒、铜片、0.1 mol·L-1
2 2
FeCl 溶液、KSCN溶液、新制氯水。
2
①若小明计划在0.1 mol·L-1 FeCl 溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应
2
和现象是___________________________________(写离子方程式),溶液由浅绿色变为__________色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验 Fe2+被氧化
的产物Fe3+的存在以获取证据。你认为可选____________________滴入小明所得的混合液中,并通过溶液
出现______________色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl 溶液
2
中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为________________。
(3)小明分析HO 中氧元素显-1价(中间价),并提出疑问:HO 与FeCl 反应时,Fe2+还作氧化剂吗?
2 2 2 2 2
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成__________(填化学符号,下同),
若Fe2+在反应中表现出还原性应转化成__________。
②实际上Fe2+的还原性较强,实验室的FeCl 溶液常因氧化而变质。除杂的方法是______________,
2
相关反应的离子方程式:____________________________。【答案】
(1)因为Fe2+中铁元素化合价处于中间价态,既可以升高也可以降低
(2)①Cl+2Fe2+===2Cl-+2Fe3+ 棕黄
2
②KSCN溶液 红 ③Zn>Fe>Cu
(3)①Fe Fe3+ ②加入适量铁粉 2Fe3++Fe===3Fe2+
【解析】
(1)元素化合价处于最高价只具有氧化性,处于最低价只具有还原性,处于中间价态既可以升高也可
以降低,既具有氧化性又具有还原性;故答案为:因为Fe2+中铁元素化合价处于中间价态,可以升高也可
以降低;
(2)①在0.1 mol·L-1 FeCl 溶液滴入新制氯水,氯气具有强氧化性能源和亚铁离子为铁离子,反应的离子
2
方程式为:Cl+2Fe2+===2Cl−+2Fe3+;溶液颜色从浅绿色变为棕黄(黄)色;故答案为:Cl+2Fe2+===2Cl−
2 2
+2Fe3+;棕黄(黄);
②通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。需要的试剂为硫氰酸钾溶液,发生反应,Fe3+
+3SCN−===Fe(SCN) ,溶液变血红色,故答案为:KSCN溶液;溶液呈血红;
3
③金属单质都具有还原性,分别将铜片、锌粒投入FeCl 溶液中,结果铜片没变化,锌粒逐渐变小,发生反
2
应Zn+Fe2+===Fe+Zn2+;氧化还原反应中还原剂的还原性大于还原产物,锌的还原性大于铁,铁大于铜,
故答案为:Zn、Fe、Cu(或Zn>Fe>Cu);
(3)①若Fe2+在反应中表现出氧化性,化合价降低做氧化剂,只能降到0价为金属铁,若Fe2+在反应中表现
出还原性,铁元素化合价升高为三价,应转化成三价铁离子;故答案为:Fe Fe3+;
②实验室的FeCl 溶液常因氧化而变质,为反之亚铁离子的氧化,需要加入还原铁粉,发生反应2Fe3+
2
+Fe===3Fe2+,所以避免亚铁离子的氧化,需加入过量铁粉,过滤,故答案为:加入过量铁粉,过滤;2Fe3+
+Fe===3Fe2+.
25. (10分)
将6 g 铁粉加入200 mL Fe (SO ) 和CuSO 的混合溶液中,充分反应得到200 mL 0.5 mol/L FeSO 溶液
2 4 3 4 4
和5.2 g固体沉淀物。试计算:
(1)反应后生成铜的质量;
(2)原Fe (SO ) 溶液的物质的量浓度。
2 4 3
【答案】
(1)铜质量为2.56 g
(2)原溶液中Fe (SO ) 物质的量浓度为0.1 mol/L
2 4 3
【解析】
解:Fe + Fe (SO ) = 3FeSO Δm
2 4 3 41 mol 1 mol 3 mol 56 g
n n 3n
1 1 1
Fe + CuSO = FeSO + Cu Δm
4 4
1 mol 1 mol 1 mol 64 g-56 g=8 g
n n n
2 2 2
3n +n=0.5 mol/L×0.2 L=0.1 mol
1 2
56n g/mol-8n g/mol=6 g-5.2 g=0.8 g
1 2
n =0.02 mol n =0.04 mol
1 2
m(Cu)=0.04 mol×64 g/mol=2.56 g
原Fe (SO ) 溶液的物质的量浓度=0.02 mol÷0.2 L=0.1 mol/L
2 4 3