文档内容
2023-2024 学年度第二学期期末试卷
高一化学
可能用到的相对原子质量: H-1 C-12 O-16 Fe-56
一、单项选择题(共14题,每题3分,共42分。每题只有一个选项最符合题意。)
1.“碳中和”是指CO 排放总量与吸收处理总量相等。下列措施不利于我国2060年实现
2
“碳中和”目标的是
A.加强化石燃料的开采使用
B.加强植树造林和荒漠绿化
C.加大风、光、水电的投资
D.加强新能源汽车推广使用
2.《神农本草经》中记载的白矾主要成分为KAl(SO )∙12H O。下列说法正确的是
4 2 2
A.离子半径:r(Al3+)>r(O2﹣) B.碱性:KOH>Al(OH)
3
C.热稳定性:H S>H O D.非金属性:S>O
2 2
3.下列物质性质与用途具有对应关系的是
A.N 的化学性质稳定,可用于金属焊接保护
2
B.SO 具有氧化性,可用于漂白织物
2
C.FeCl 溶液显酸性,可用于刻蚀覆铜板
3
D.NaHCO 受热易分解,可用于治疗胃酸过多
3
阅读下列材料,完成4~6题:
NH 、NH Cl、NO、NO 、HNO 等是氮的重要化合物,工业合成氨的反应为N(g)
3 4 2 3 2
+3H (g) 2NH (g) ΔH=-92.4kJ∙mol-1。NH 可与酸反应制得铵盐,也可通过催化氧化生成
2 3 3
NO,用于生产HNO。浓氨水加到生石灰中,放出大量热量,促进NH ∙H O分解,可用于实
3 3 2
验室制取NH 。
3
4.在指定条件下,下列选项所示的物质间转化能实现的是
A.NO(g) HNO(aq) B.稀硝酸 NO
3 2
C.NO (g) HNO(aq) D.NO (aq) NO (aq)
2 3
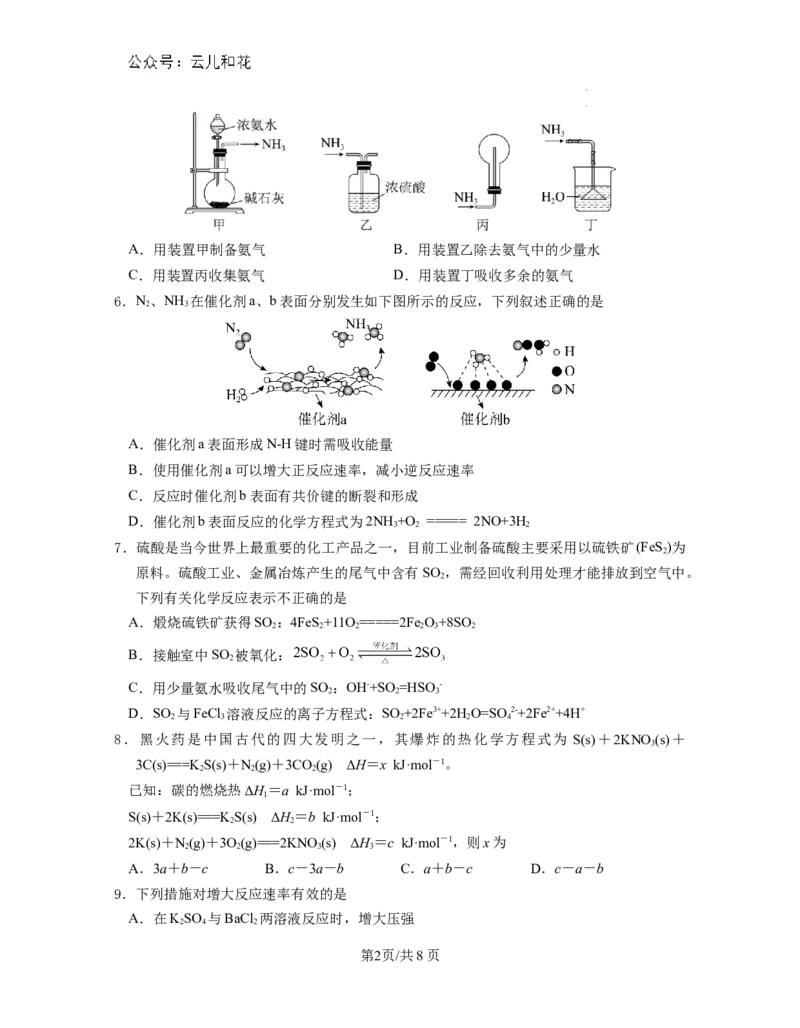
5.下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
第1页/共8页
学学科科网网((北北京京))股股份份有有限限公公司司A.用装置甲制备氨气 B.用装置乙除去氨气中的少量水
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
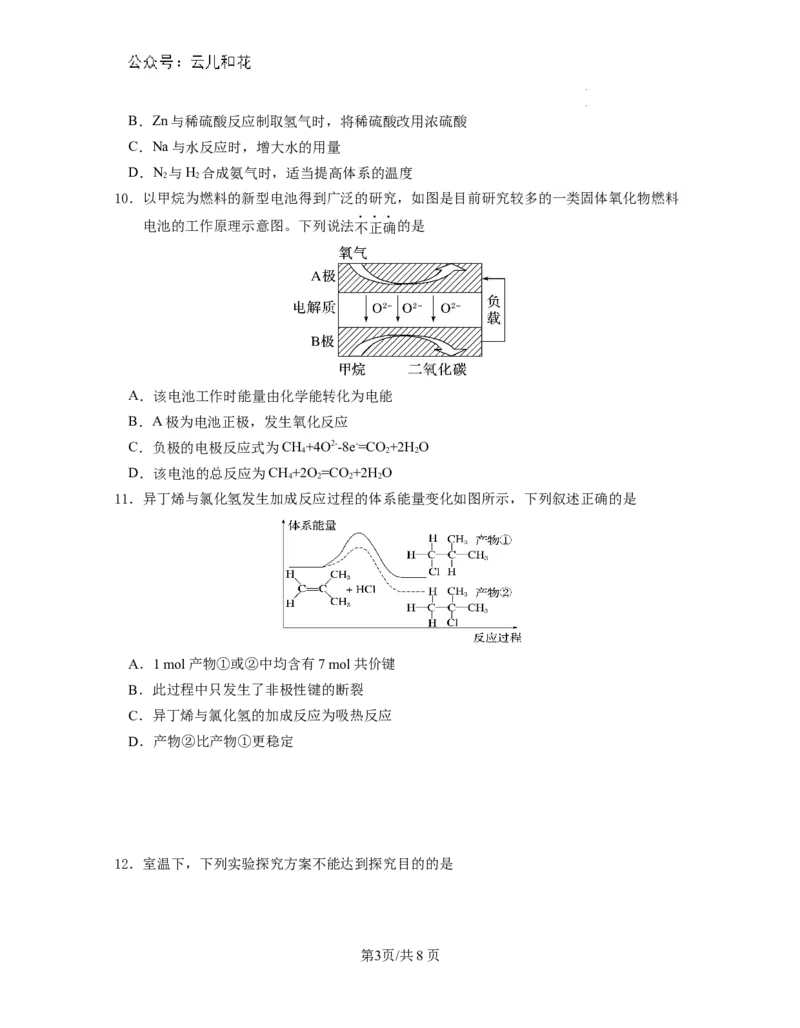
6.N、NH 在催化剂a、b表面分别发生如下图所示的反应,下列叙述正确的是
2 3
A.催化剂a表面形成N-H键时需吸收能量
B.使用催化剂a可以增大正反应速率,减小逆反应速率
C.反应时催化剂b表面有共价键的断裂和形成
D.催化剂b表面反应的化学方程式为2NH +O ===== 2NO+3H
3 2 2
7.硫酸是当今世界上最重要的化工产品之一,目前工业制备硫酸主要采用以硫铁矿(FeS )为
2
原料。硫酸工业、金属冶炼产生的尾气中含有SO ,需经回收利用处理才能排放到空气中。
2
下列有关化学反应表示不正确的是
A.煅烧硫铁矿获得SO :4FeS+11O =====2Fe O+8SO
2 2 2 2 3 2
B.接触室中SO 被氧化:
2
C.用少量氨水吸收尾气中的SO :OH-+SO=HSO -
2 2 3
D.SO 与FeCl 溶液反应的离子方程式:SO +2Fe3++2H O=SO 2-+2Fe2++4H+
2 3 2 2 4
8.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为 S(s)+2KNO(s)+
3
3C(s)===KS(s)+N(g)+3CO(g) ΔH=x kJ·mol-1。
2 2 2
已知:碳的燃烧热ΔH=a kJ·mol-1;
1
S(s)+2K(s)===KS(s) ΔH=b kJ·mol-1;
2 2
2K(s)+N(g)+3O(g)===2KNO(s) ΔH=c kJ·mol-1,则x为
2 2 3 3
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
9.下列措施对增大反应速率有效的是
A.在KSO 与BaCl 两溶液反应时,增大压强
2 4 2
第2页/共8页
学学科科网网((北北京京))股股份份有有限限公公司司B.Zn与稀硫酸反应制取氢气时,将稀硫酸改用浓硫酸
C.Na与水反应时,增大水的用量
D.N 与H 合成氨气时,适当提高体系的温度
2 2
10.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料
电池的工作原理示意图。下列说法不正确的是
A.该电池工作时能量由化学能转化为电能
B.A极为电池正极,发生氧化反应
C.负极的电极反应式为CH+4O2--8e-=CO +2H O
4 2 2
D.该电池的总反应为CH+2O =CO +2H O
4 2 2 2
11.异丁烯与氯化氢发生加成反应过程的体系能量变化如图所示,下列叙述正确的是
A.1 mol产物①或②中均含有7 mol共价键
B.此过程中只发生了非极性键的断裂
C.异丁烯与氯化氢的加成反应为吸热反应
D.产物②比产物①更稳定
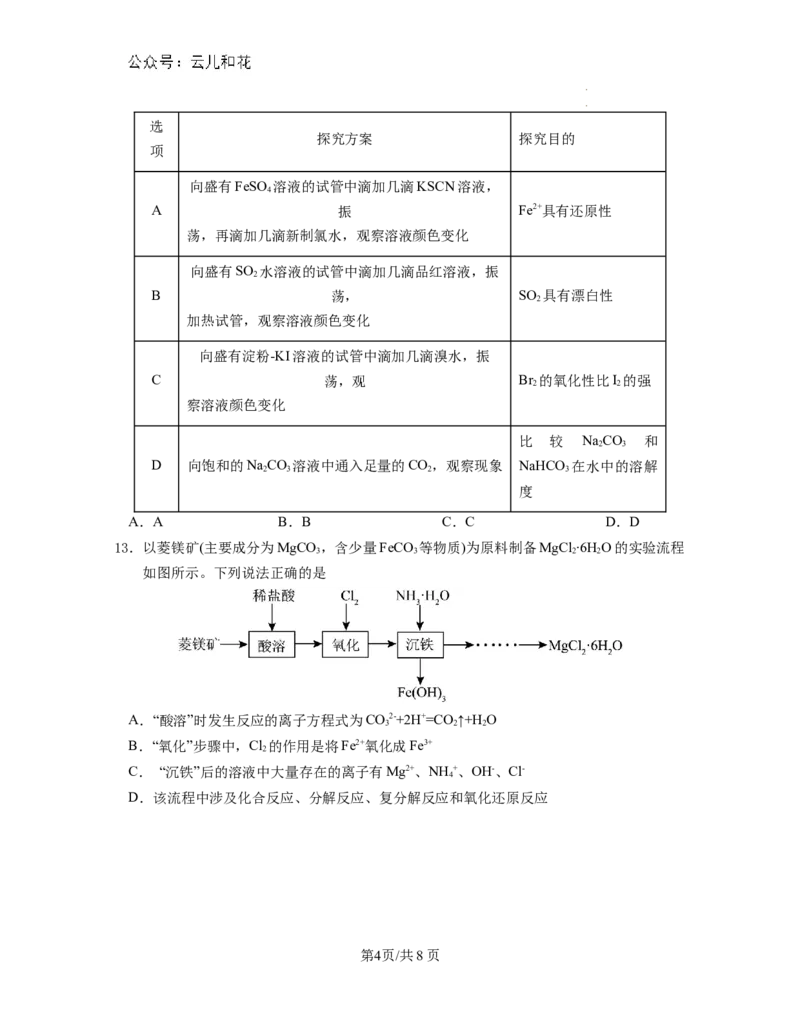
12.室温下,下列实验探究方案不能达到探究目的的是
第3页/共8页
学学科科网网((北北京京))股股份份有有限限公公司司选
探究方案 探究目的
项
向盛有FeSO 溶液的试管中滴加几滴KSCN溶液,
4
A 振 Fe2+具有还原性
荡,再滴加几滴新制氯水,观察溶液颜色变化
向盛有SO 水溶液的试管中滴加几滴品红溶液,振
2
B 荡, SO 具有漂白性
2
加热试管,观察溶液颜色变化
向盛有淀粉-KI溶液的试管中滴加几滴溴水,振
C 荡,观 Br 的氧化性比I 的强
2 2
察溶液颜色变化
比 较 NaCO 和
2 3
D 向饱和的NaCO 溶液中通入足量的CO,观察现象 NaHCO 在水中的溶解
2 3 2 3
度
A.A B.B C.C D.D
13.以菱镁矿(主要成分为MgCO ,含少量FeCO 等物质)为原料制备MgCl ∙6HO的实验流程
3 3 2 2
如图所示。下列说法正确的是
A.“酸溶”时发生反应的离子方程式为CO2-+2H+=CO ↑+H O
3 2 2
B.“氧化”步骤中,Cl 的作用是将Fe2+氧化成Fe3+
2
C. “沉铁”后的溶液中大量存在的离子有Mg2+、NH +、OH-、Cl-
4
D.该流程中涉及化合反应、分解反应、复分解反应和氧化还原反应
第4页/共8页
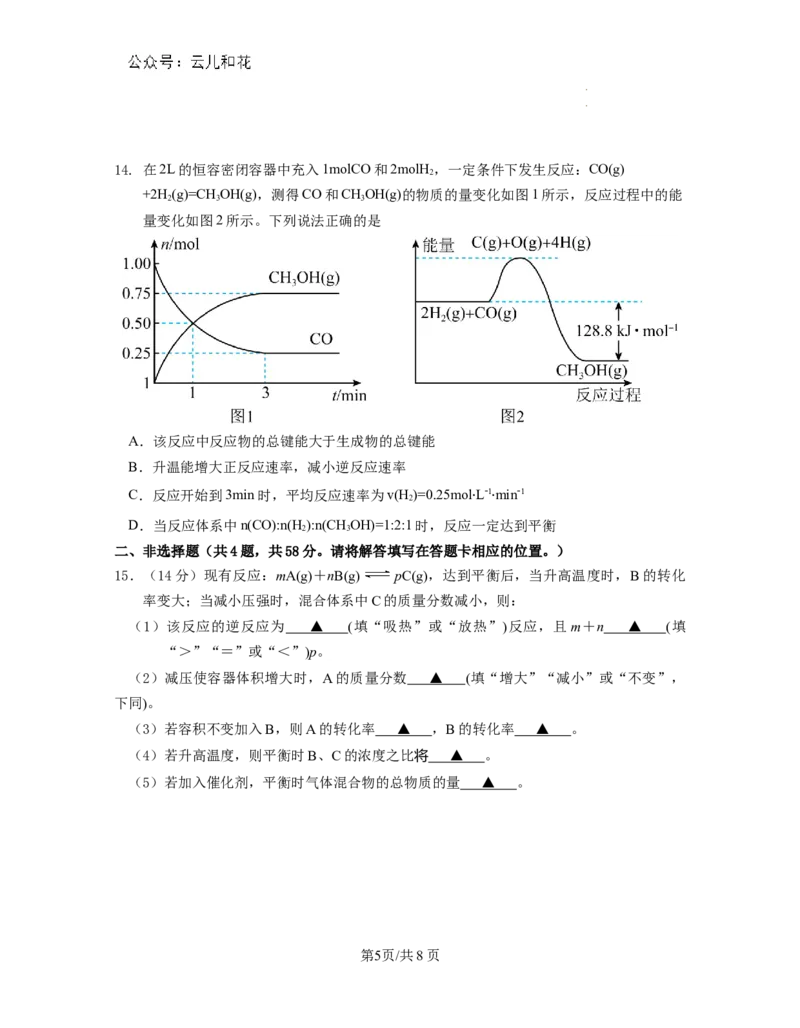
学学科科网网((北北京京))股股份份有有限限公公司司14. 在2L的恒容密闭容器中充入1molCO和2molH ,一定条件下发生反应:CO(g)
2
+2H (g)=CH OH(g),测得CO和CHOH(g)的物质的量变化如图1所示,反应过程中的能
2 3 3
量变化如图2所示。下列说法正确的是
A.该反应中反应物的总键能大于生成物的总键能
B.升温能增大正反应速率,减小逆反应速率
C.反应开始到3min时,平均反应速率为v(H )=0.25mol∙L-1∙min-1
2
D.当反应体系中n(CO):n(H ):n(CHOH)=1:2:1时,反应一定达到平衡
2 3
二、非选择题(共4题,共58分。请将解答填写在答题卡相应的位置。)
15.(14分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化
率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为 ▲ (填“吸热”或“放热”)反应,且m+n ▲ (填
“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数 ▲ (填“增大”“减小”或“不变”,
下同)。
(3)若容积不变加入B,则A的转化率 ▲ ,B的转化率 ▲ 。
(4)若升高温度,则平衡时B、C的浓度之比将 ▲ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量 ▲ 。
第5页/共8页
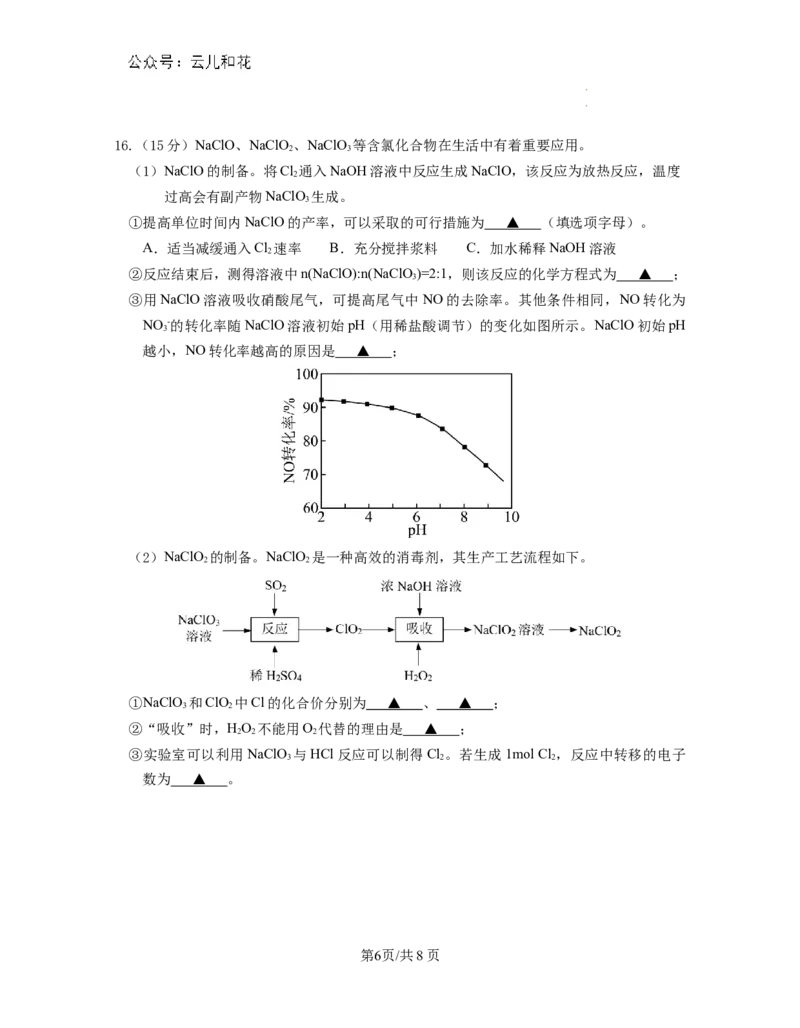
学学科科网网((北北京京))股股份份有有限限公公司司16.(15分)NaClO、NaClO、NaClO 等含氯化合物在生活中有着重要应用。
2 3
(1)NaClO的制备。将Cl 通入NaOH溶液中反应生成NaClO,该反应为放热反应,温度
2
过高会有副产物NaClO 生成。
3
①提高单位时间内NaClO的产率,可以采取的可行措施为 ▲ (填选项字母)。
A.适当减缓通入Cl 速率 B.充分搅拌浆料 C.加水稀释NaOH溶液
2
②反应结束后,测得溶液中n(NaClO):n(NaClO)=2:1,则该反应的化学方程式为 ▲ ;
3
③用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
NO -的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO初始pH
3
越小,NO转化率越高的原因是 ▲ ;
(2)NaClO 的制备。NaClO 是一种高效的消毒剂,其生产工艺流程如下。
2 2
①NaClO 和ClO 中Cl的化合价分别为 ▲ 、 ▲ ;
3 2
②“吸收”时,HO 不能用O 代替的理由是 ▲ ;
2 2 2
③实验室可以利用NaClO 与HCl反应可以制得Cl 。若生成1mol Cl ,反应中转移的电子
3 2 2
数为 ▲ 。
第6页/共8页
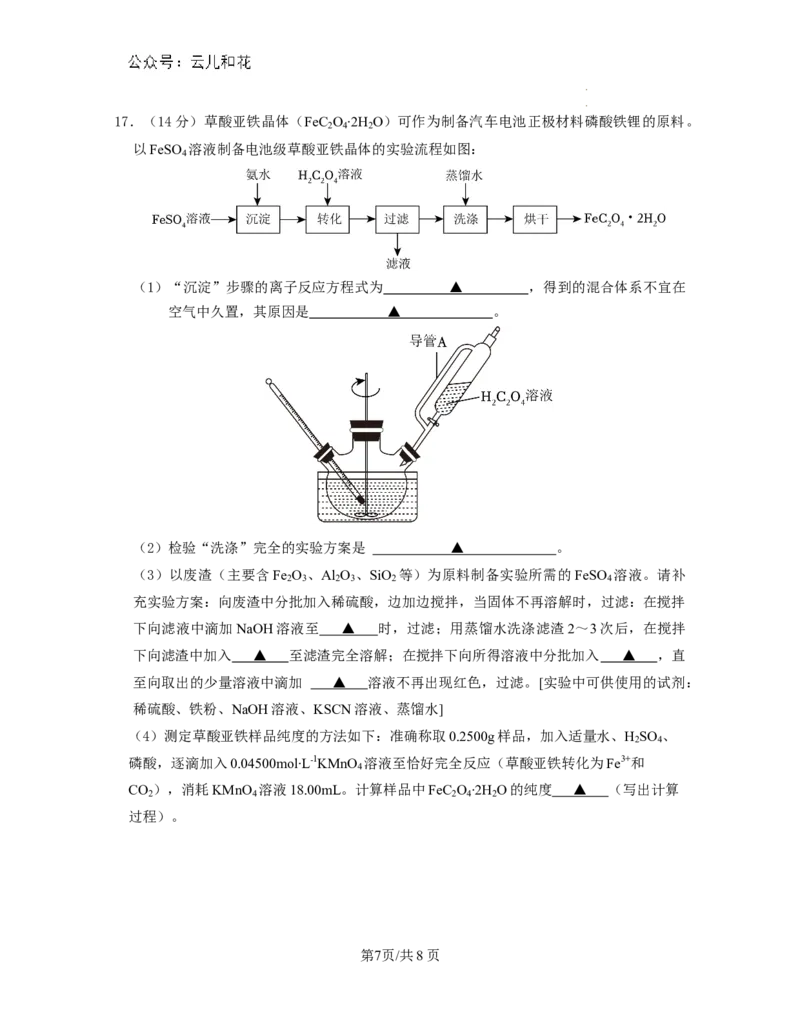
学学科科网网((北北京京))股股份份有有限限公公司司17.(14分)草酸亚铁晶体(FeC O ∙2H O)可作为制备汽车电池正极材料磷酸铁锂的原料。
2 4 2
以FeSO 溶液制备电池级草酸亚铁晶体的实验流程如图:
4
(1)“沉淀”步骤的离子反应方程式为 ▲ ,得到的混合体系不宜在
空气中久置,其原因是 ▲ 。
(2)检验“洗涤”完全的实验方案是 ▲ 。
(3)以废渣(主要含Fe O 、Al O 、SiO 等)为原料制备实验所需的FeSO 溶液。请补
2 3 2 3 2 4
充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌
下向滤液中滴加NaOH溶液至 ▲ 时,过滤;用蒸馏水洗涤滤渣2~3次后,在搅拌
下向滤渣中加入 ▲ 至滤渣完全溶解;在搅拌下向所得溶液中分批加入 ▲ ,直
至向取出的少量溶液中滴加 ▲ 溶液不再出现红色,过滤。[实验中可供使用的试剂:
稀硫酸、铁粉、NaOH溶液、KSCN溶液、蒸馏水]
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、H SO 、
2 4
磷酸,逐滴加入0.04500mol∙L-1KMnO 溶液至恰好完全反应(草酸亚铁转化为Fe3+和
4
CO ),消耗KMnO 溶液18.00mL。计算样品中FeC O ∙2H O的纯度 ▲ (写出计算
2 4 2 4 2
过程)。
第7页/共8页
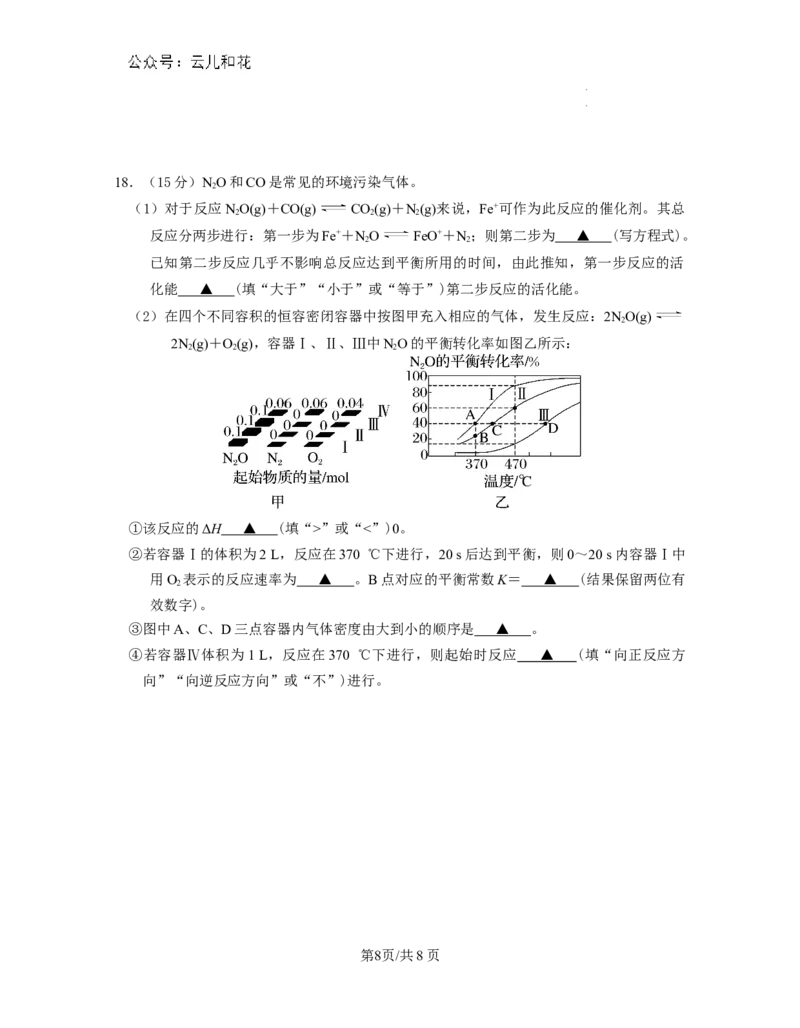
学学科科网网((北北京京))股股份份有有限限公公司司18.(15分)NO和CO是常见的环境污染气体。
2
(1)对于反应NO(g)+CO(g) CO(g)+N(g)来说,Fe+可作为此反应的催化剂。其总
2 2 2
反应分两步进行:第一步为Fe++NO FeO++N;则第二步为 ▲ (写方程式)。
2 2
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活
化能 ▲ (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2NO(g)
2
2N(g)+O(g),容器Ⅰ、Ⅱ、Ⅲ中NO的平衡转化率如图乙所示:
2 2 2
①该反应的ΔH ▲ (填“>”或“<”)0。
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中
用O 表示的反应速率为 ▲ 。B点对应的平衡常数K= ▲ (结果保留两位有
2
效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 ▲ 。
④若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应 ▲ (填“向正反应方
向”“向逆反应方向”或“不”)进行。
第8页/共8页
学学科科网网((北北京京))股股份份有有限限公公司司2023-2024 学年度第二学期期末试卷
高一化学参考答案
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项最符合题目
要求。)
1-5 ABACA 6-10 CCADB 11-14 DDBC
二、非选择题(本题共4小题,共计58分。请将解答填写在答题卡相应的位置。)
15.(14分,每空2分)
(1)放热 > (2)增大 (3)增大 减小
(4)减小 (5)不变
16.(15分)
(1)① B (2分) ②5Cl+10NaOH=7NaCl+2NaClO+NaClO+5H O (3分)
2 3 2
③初始pH越小,NaClO溶液氧化NO生成NO -的反应速率越快 (2分)
3
(2)①+5 +4 (2分+2分)
②“吸收”时HO 作还原剂,而O 在此条件下只能作氧化剂 (2分)
2 2 2
③N (2分)
A
17.(14分)
(1)Fe2++2NH ∙H O=Fe(OH) ↓+2NH+; (3分)
3 2 2 4
Fe(OH) 在空气中易被O 氧化为Fe(OH) ,导致草酸亚铁产率降低; (2分)
2 2 3
(2)取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加 BaCl 溶液,若无白
2
色沉淀生成,则已洗涤完全; (2
分)
(3)沉淀不再减少;稀硫酸;铁粉;KSCN; (1分+1分+1分+1分)
(4)草酸亚铁被酸性高锰酸钾氧化为 Fe3+和 CO ,根据得失电子守恒,得关系式
2
5FeC O ∙2H O~3KMnO (1 分),反应消耗 0.04500 mol∙L-1 KMnO 标准溶液 18.00
2 4 2 4 4
mL,则草酸亚铁的物质的量为 mol=0.00135mol(1 分),
FeC O ∙2H O的纯度为 ×100%=97.20%(1分),
2 4 2
故答案为:97.20%。
第9页/共8页
学学科科网网((北北京京))股股份份有有限限公公司司(注:没有计算过程,只有一个正确答案,给1分;写97.2%也可以,这次不扣分)
18.(15分)
(1)FeO++CO Fe++CO (3分) 大于(2分)
2
(2)① >(2分) ②0.000 5 mol·L-1·s-1 (2分)0.004 4 (2分)
③ D>C>A(2分) ④向逆反应方向 (2分)
第10页/共8页
学学科科网网((北北京京))股股份份有有限限公公司司