文档内容
江苏省南京市2024-2025学年第二学期六校联合体6月期末调研测试
高一化学
可能用到的相对原子质量: H 1 C 12 O 16 Co 59
一、选择题(包括16题,每题3分,共48分。每题只有一个选项符合题意)
1.半导体是人工智能技术发展的核心材料,“中国制造2025”计划中明确提出要大力发展第三代半导体产
业。下列物质中不属于半导体材料的是
A.二氧化硅 B.晶体硅 C.碳化硅(SiC) D.砷化镓(GaAs)
2.NaO 与HO反应生成NaOH和O,下列说法正确的是
2 2 2 2
A.Na+与O2-的电子层结构不同 B.HO的空间构型为直线形
2
C.NaO 的电子式为: D.NaOH仅含离子键
2 2
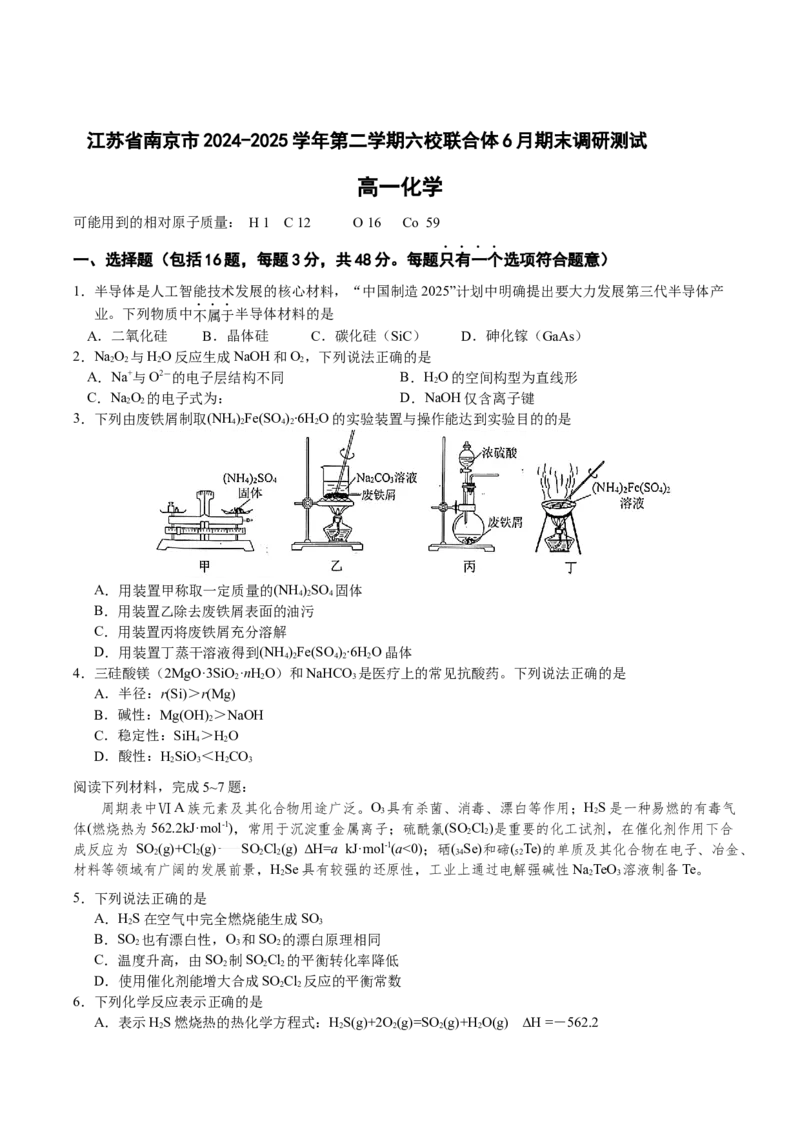
3.下列由废铁屑制取(NH )Fe(SO )∙6H O的实验装置与操作能达到实验目的的是
4 2 4 2 2
A.用装置甲称取一定质量的(NH )SO 固体
4 2 4
B.用装置乙除去废铁屑表面的油污
C.用装置丙将废铁屑充分溶解
D.用装置丁蒸干溶液得到(NH )Fe(SO )∙6H O晶体
4 2 4 2 2
4.三硅酸镁(2MgO·3SiO ·nHO)和NaHCO 是医疗上的常见抗酸药。下列说法正确的是
2 2 3
A.半径:r(Si)>r(Mg)
B.碱性:Mg(OH) >NaOH
2
C.稳定性:SiH>HO
4 2
D.酸性:HSiO<HCO
2 3 2 3
阅读下列材料,完成5~7题:
周期表中ⅥA族元素及其化合物用途广泛。O 具有杀菌、消毒、漂白等作用;HS是一种易燃的有毒气
3 2
体(燃烧热为562.2kJ·mol-1),常用于沉淀重金属离子;硫酰氯(SO Cl)是重要的化工试剂,在催化剂作用下合
2 2
成反应为 SO (g)+Cl (g) SO Cl(g) ∆H=a kJ·mol-1(a<0);硒( Se)和碲( Te)的单质及其化合物在电子、冶金、
2 2 2 2 34 52
材料等领域有广阔的发展前景,HSe具有较强的还原性,工业上通过电解强碱性NaTeO 溶液制备Te。
2 2 3
5.下列说法正确的是
A.HS在空气中完全燃烧能生成SO
2 3
B.SO 也有漂白性,O 和SO 的漂白原理相同
2 3 2
C.温度升高,由SO 制SO Cl 的平衡转化率降低
2 2 2
D.使用催化剂能增大合成SO Cl 反应的平衡常数
2 2
6.下列化学反应表示正确的是
A.表示HS燃烧热的热化学方程式:HS(g)+2O(g)=SO(g)+HO(g) ∆H =-562.2
2 2 2 2 2kJ·mol-1
B.用HS气体沉淀溶液中Pb2+的离子方程式:Pb2++S2-=PbS↓
2
C.电解NaTeO 溶液制备Te:NaTeO + H O=====Te+2NaOH +O ↑
2 3 2 3 2 2
D.硫酰氯(SO Cl)遇水强烈水解生成两种酸:SO Cl+2H O=HSO +2HCl
2 2 2 2 2 2 3
7.下列说法不正确的是
A.硫可形成S、S、S 等不同单质,它们互为同素异形体
2 4 6
B.水的电离方程式为HO+HO HO++OH-
2 2 3
C.HO比HSe稳定是因为HO的沸点更高
2 2 2
D.亚硫酰氯(SOCl )遇水也能剧烈反应,生成能使品红溶液褪色的气体
2
8.氮及其化合物的转化具有重要应用。下列说法不正确的是
A.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
B.侯氏制碱法以HO、NH 、CO、NaCl为原料制备NaHCO 和NH Cl
2 3 2 3 4
C.工业上通过NH 催化氧化等反应过程生产HNO
3 3
D.自然固氮、人工固氮都是将N 转化为NH
2 3
9.下列与盐类水解有关的说法中正确的是
A. 泡沫灭火器的灭火原理:2Al3++3CO+3HO===2Al(OH) ↓+3CO↑
2 3 2
B. 将CHCOONa溶液从20 ℃升温至50 ℃,溶液中增大
3
C. 可溶性铁盐作净水剂的原理:Fe3++3H O===Fe(OH) ↓+3H+
2 3
D. 用TiCl 制备TiO 的反应:TiCl +(x+2)H O=== TiO ·xHO↓+4HCl
4 2 4 2 2 2
10.在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq) Cl(g) 漂白粉(s)
2
B.浓HSO (l) SO (g) BaSO(s)
2 4 2 3
C.Fe O(s) Fe(s,过量) FeCl (s)
2 3 2
D.Cu(s) NO (g) Cu(NO )(aq)
2 3 2
11. 用尿素水解生成的NH 催化还原NO,是柴油机车辆尾气净化的主要方法,反应为:4NH (g)+O(g)
3 3 2
+4NO(g) 4N(g)+6HO(g),下列说法正确的是
2 2
A.上述反应ΔS<0
c4 (N )⋅c6 (H O)
B.上述反应平衡常数 K= 2 2
c4 (N H )⋅c(O )⋅c4 (NO)
3 2
C.上述反应中消耗1mol NH ,转移电子的数目为2×6.02×1023
3
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
12. 下列实验的有关说法正确的是
A. 用pH试纸测得氯水的pH=2
B. 用酸式滴定管量取20.00 mL酸性KMnO 溶液
4
C. 中和滴定时,眼睛应注视滴定管中液面的变化
D. 中和滴定时,滴定管和锥形瓶都需用标准液或待测液润洗
13. 部分弱电解质的电离常数如表所示,下列说法中正确的是
弱电解质 HCOOH HCN HCO
2 3K =4.5×10-7
电离常数(25 ℃) K=1.8×10-4 K=6.2×10-10 a1
a a K =4.7×10-11
a2
A. 25 ℃时,反应HCOOH+CN- HCN+HCOO-的化学平衡常数K=2.9×105
B. 中和等体积、等浓度的HCOOH和HCN,消耗NaOH的量前者小于后者
C. 结合H+的能力:CO<CN-<HCO<HCOO-
D. 2CN-+HO+CO===2HCN+CO
2 2
14. 室温下,下列操作不能达到相应实验目的的是
实验目的 实验操作
比较CHCOOH的K 和 向2 mL 1 mol·L–1 CHCOOH溶液中滴加1 mol·L–1
A 3 a 3
HCO 的K 的大小 NaCO 溶液,观察现象
2 3 a1 2 3
探究CHCOOH是否是弱 用pH计测量相同体积、浓度均为0.1mol·L-1的醋
B 3
电解质 酸、盐酸的pH
检验Fe(NO ) 固体是否 取少量固体溶于蒸馏水,滴加少量稀硫酸,再滴入
C 3 2
变质 KSCN溶液,振荡,观察溶液颜色变化
比较CHCOO-、HCO - 用pH计测量相同体积、浓度均为0.1 mol·L-1 的
D 3 3
水解能力的强弱 CHCOONa和NaHCO 溶液的pH
3 3
15.NH 与O 作用分别生成N 、NO、NO的反应均为放热反应。工业尾气中的NH 可通过催化氧化为N
3 2 2 2 3 2
除去。将一定比例NH 、O 和N 混合气体以一定流速通过装有催化剂的反应管,NH 的转化率,N 的选择
3 2 2 3 2
2n (N )
生成 2 ×100%
性[ n 总转化 (NH 3 ) ]与温度的关系如图所示。
下列说法正确的是
A.其他条件不变,升高温度,NH 的平衡转化率增大
3
B.其他条件不变,在175~ 300℃范围,随着温度的升高,出口处氮气、氮氧化物的量均不断增大
C.催化氧化除去尾气中的NH 应选择反应温度高于250℃
3
D.高效除去尾气中的NH ,需研发低温下NH 转化率高和N 选择性高的催化剂
3 3 2
16.用一定浓度NaOH溶液吸收HS可制备NaS或NaHS。若通入HS所引起的溶液体积变化和HO的挥
2 2 2 2
发可以忽略,溶液中含硫物种的浓度c = c(H S) + c(HS-) + c(S2-)。室温下,HS的电离常数分别为K
总 2 2 a1
=1.1×10-7、K =1.3×10-13。下列说法正确的是
a2A.NaS溶液显碱性的原因:S2-+2H O HS+2OH-
2 2 2
B.NaOH恰好转化为NaS的溶液中:c(H+)+ c(Na+)=c(HS-)+c(S2-)+ c(OH-)
2
C.吸收所得c =c(Na+)的溶液中:c(H S)>c(S2-)
总 2
D.NaOH溶液吸收HS过程中,溶液的温度下降
2
二、非选择题(包括3题,共52分)
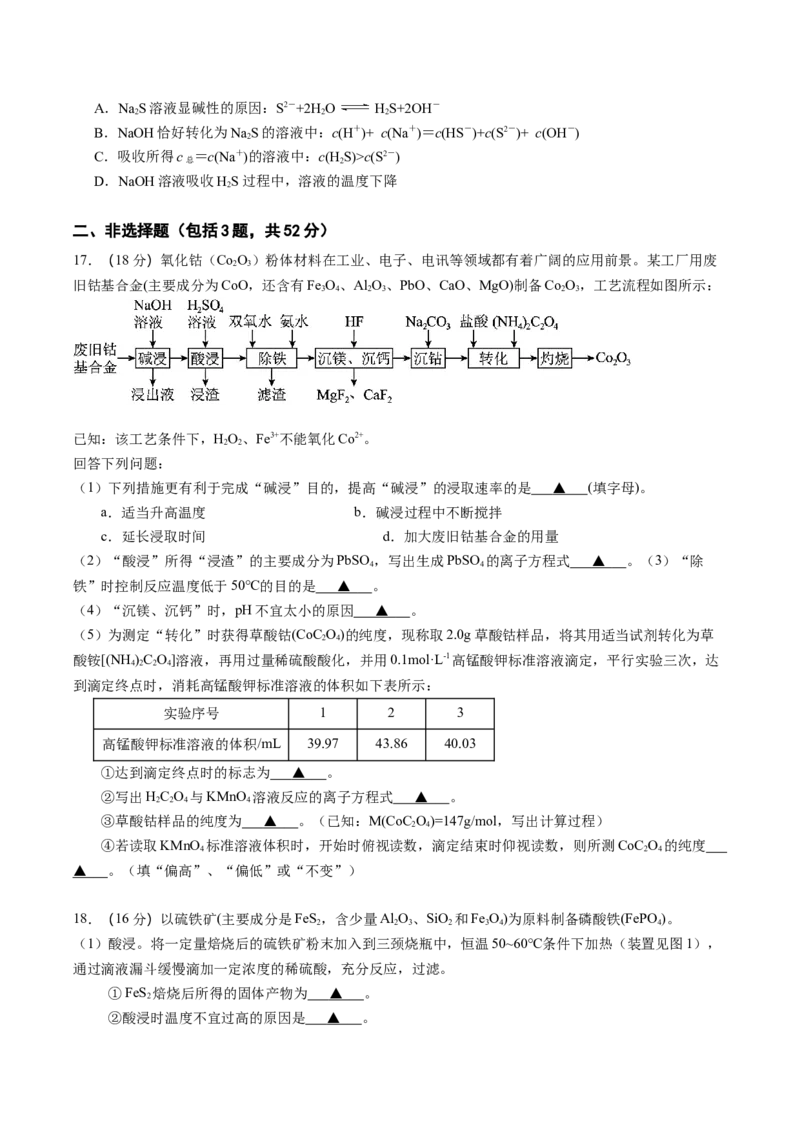
17.(18分)氧化钴(Co O)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某工厂用废
2 3
旧钴基合金(主要成分为CoO,还含有Fe O、Al O、PbO、CaO、MgO)制备Co O,工艺流程如图所示:
3 4 2 3 2 3
已知:该工艺条件下,HO、Fe3+不能氧化Co2+。
2 2
回答下列问题:
(1)下列措施更有利于完成“碱浸”目的,提高“碱浸”的浸取速率的是 ▲ (填字母)。
a.适当升高温度 b.碱浸过程中不断搅拌
c.延长浸取时间 d.加大废旧钴基合金的用量
(2)“酸浸”所得“浸渣”的主要成分为PbSO ,写出生成PbSO 的离子方程式 ▲ 。(3)“除
4 4
铁”时控制反应温度低于50℃的目的是 ▲ 。
(4)“沉镁、沉钙”时,pH不宜太小的原因 ▲ 。
(5)为测定“转化”时获得草酸钴(CoC O)的纯度,现称取2.0g草酸钴样品,将其用适当试剂转化为草
2 4
酸铵[(NH )C O]溶液,再用过量稀硫酸酸化,并用0.1mol·L-1高锰酸钾标准溶液滴定,平行实验三次,达
4 2 2 4
到滴定终点时,消耗高锰酸钾标准溶液的体积如下表所示:
实验序号 1 2 3
高锰酸钾标准溶液的体积/mL 39.97 43.86 40.03
①达到滴定终点时的标志为 ▲ 。
②写出HC O 与KMnO 溶液反应的离子方程式 ▲ 。
2 2 4 4
③草酸钴样品的纯度为 ▲ 。(已知:M(CoC O)=147g/mol,写出计算过程)
2 4
④若读取KMnO 标准溶液体积时,开始时俯视读数,滴定结束时仰视读数,则所测CoC O 的纯度
4 2 4
▲ 。(填“偏高”、“偏低”或“不变”)
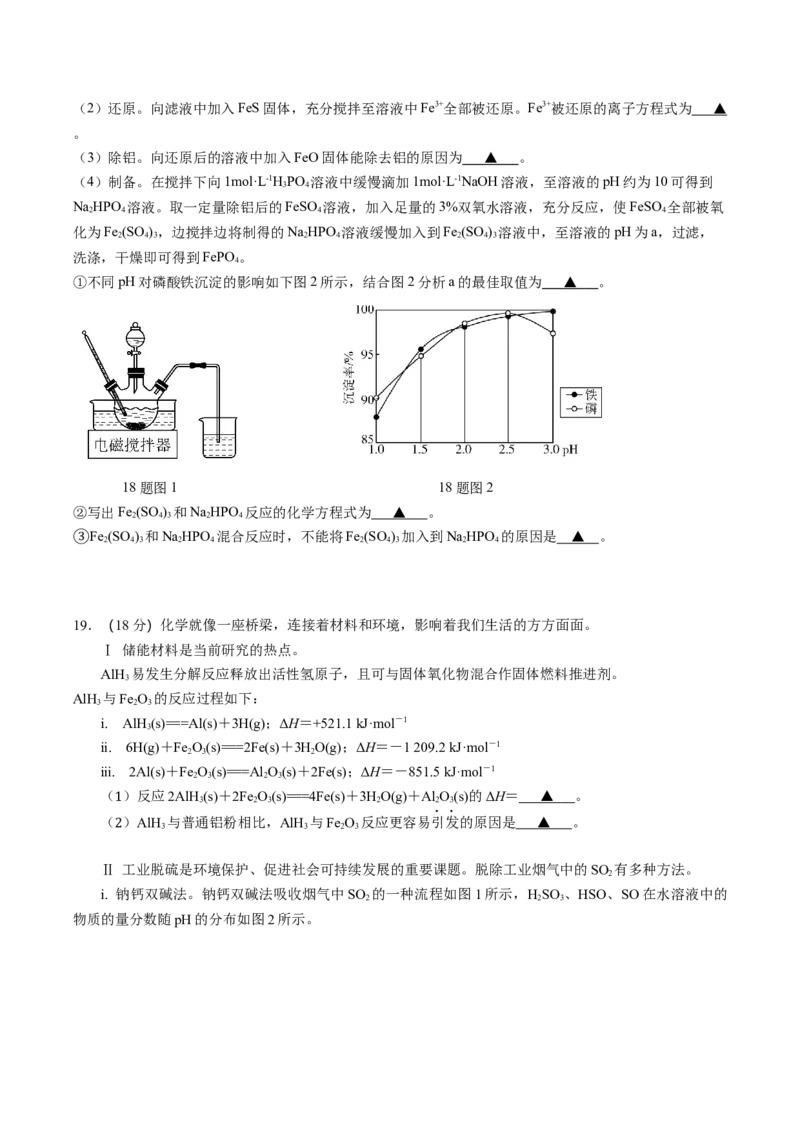
18.(16分)以硫铁矿(主要成分是FeS,含少量Al O、SiO 和Fe O)为原料制备磷酸铁(FePO )。
2 2 3 2 3 4 4
(1)酸浸。将一定量焙烧后的硫铁矿粉末加入到三颈烧瓶中,恒温50~60℃条件下加热(装置见图1),
通过滴液漏斗缓慢滴加一定浓度的稀硫酸,充分反应,过滤。
①FeS 焙烧后所得的固体产物为 ▲ 。
2
②酸浸时温度不宜过高的原因是 ▲ 。(2)还原。向滤液中加入FeS固体,充分搅拌至溶液中Fe3+全部被还原。Fe3+被还原的离子方程式为 ▲
。
(3)除铝。向还原后的溶液中加入FeO固体能除去铝的原因为 ▲ 。
(4)制备。在搅拌下向1mol·L-1HPO 溶液中缓慢滴加1mol·L-1NaOH溶液,至溶液的pH约为10可得到
3 4
NaHPO 溶液。取一定量除铝后的FeSO 溶液,加入足量的3%双氧水溶液,充分反应,使FeSO 全部被氧
2 4 4 4
化为Fe (SO ),边搅拌边将制得的NaHPO 溶液缓慢加入到Fe (SO ) 溶液中,至溶液的pH为a,过滤,
2 4 3 2 4 2 4 3
洗涤,干燥即可得到FePO 。
4
①不同pH对磷酸铁沉淀的影响如下图2所示,结合图2分析a的最佳取值为 ▲ 。
18题图1 18题图2
②写出Fe (SO ) 和NaHPO 反应的化学方程式为 ▲ 。
2 4 3 2 4
Fe (SO ) 和NaHPO 混合反应时,不能将Fe (SO ) 加入到NaHPO 的原因是 ▲ 。
2 4 3 2 4 2 4 3 2 4
③
19.(18分)化学就像一座桥梁,连接着材料和环境,影响着我们生活的方方面面。
Ⅰ 储能材料是当前研究的热点。
AlH 易发生分解反应释放出活性氢原子,且可与固体氧化物混合作固体燃料推进剂。
3
AlH 与Fe O 的反应过程如下:
3 2 3
ⅰ. AlH (s)===Al(s)+3H(g);ΔH=+521.1 kJ·mol-1
3
ⅱ. 6H(g)+Fe O(s)===2Fe(s)+3HO(g);ΔH=-1 209.2 kJ·mol-1
2 3 2
ⅲ. 2Al(s)+Fe O(s)===AlO(s)+2Fe(s);ΔH=-851.5 kJ·mol-1
2 3 2 3
( )反应2AlH(s)+2Fe O(s)===4Fe(s)+3HO(g)+Al O(s)的ΔH= ▲ 。
3 2 3 2 2 3
( )AlH 与普通铝粉相比,AlH 与Fe O 反应更容易引发的原因是 ▲ 。
1 3 3 2 3
2
Ⅱ 工业脱硫是环境保护、促进社会可持续发展的重要课题。脱除工业烟气中的SO 有多种方法。
2
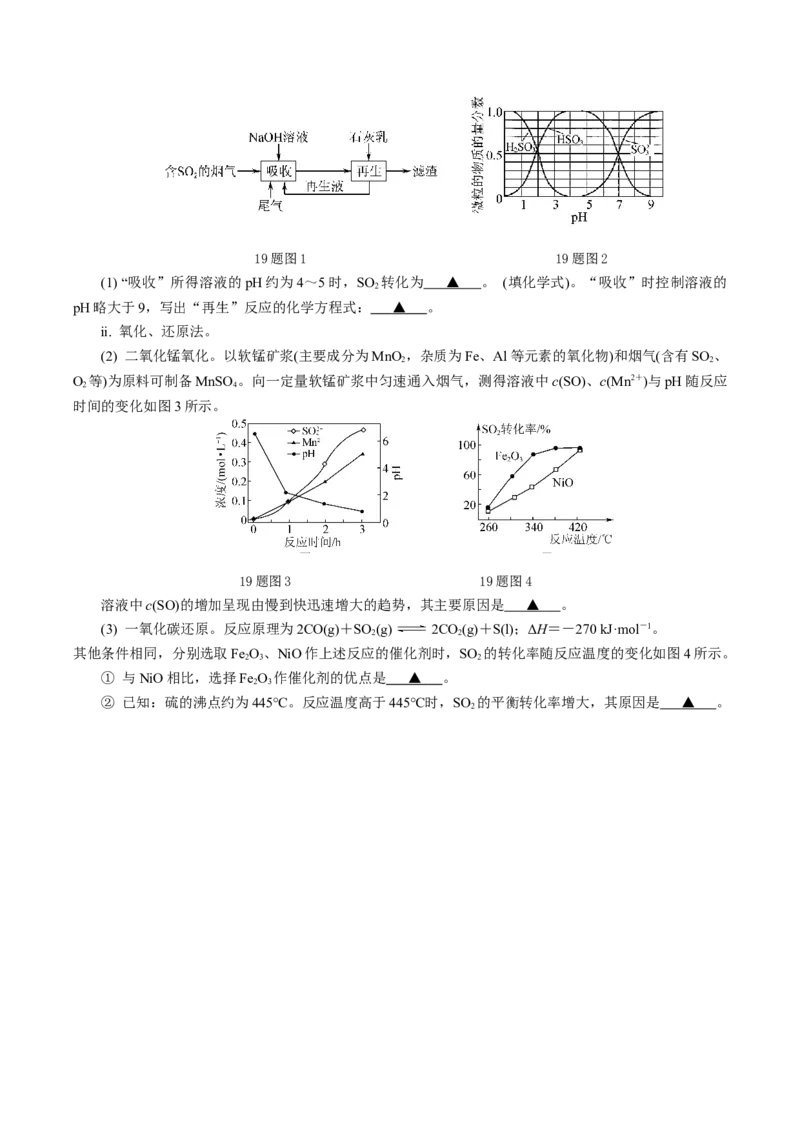
ⅰ. 钠钙双碱法。钠钙双碱法吸收烟气中SO 的一种流程如图1所示,HSO 、HSO、SO在水溶液中的
2 2 3
物质的量分数随pH的分布如图2所示。19题图1 19题图2
(1) “吸收”所得溶液的pH约为4~5时,SO 转化为 ▲ 。 (填化学式)。“吸收”时控制溶液的
2
pH略大于9,写出“再生”反应的化学方程式: ▲ 。
ⅱ. 氧化、还原法。
(2) 二氧化锰氧化。以软锰矿浆(主要成分为MnO ,杂质为Fe、Al等元素的氧化物)和烟气(含有SO 、
2 2
O 等)为原料可制备MnSO 。向一定量软锰矿浆中匀速通入烟气,测得溶液中c(SO)、c(Mn2+)与pH随反应
2 4
时间的变化如图3所示。
19题图3 19题图4
溶液中c(SO)的增加呈现由慢到快迅速增大的趋势,其主要原因是 ▲ 。
(3) 一氧化碳还原。反应原理为2CO(g)+SO (g) 2CO(g)+S(l);ΔH=-270 kJ·mol-1。
2 2
其他条件相同,分别选取Fe O、NiO作上述反应的催化剂时,SO 的转化率随反应温度的变化如图4所示。
2 3 2
① 与NiO相比,选择Fe O 作催化剂的优点是 ▲ 。
2 3
② 已知:硫的沸点约为445℃。反应温度高于445℃时,SO 的平衡转化率增大,其原因是 ▲ 。
22024-2025 学年第二学期六校联合体 6 月期末调研测试
高一化学参考答案
一、选择题(包括16题,每题3分,共48分。)
题号 1 2 3 4 5 6 7 8
答案 A C B D C C C D
题号 9 10 11 12 13 14 15 16
答案 D D B B A C D C
17.(共18分)
(1)ab (2分,漏选得1分)
(2)PbO + 2H+ + SO 2-= PbSO +H O (2分)
4 4 2
(3)防止双氧水分解及氨水的挥发与分解(合理即可) (2分,双氧水1分,氨水1分)
(4)pH太小,氢离子浓度过大,抑制HF的电离,c(F-)减小,镁、钙沉淀不完全
(2分,答到:“抑制HF的电离或c(F-)减小即可得2分)
(5)①当滴加最后半滴高锰酸钾标准溶液时,溶液颜色由无色变为浅紫红色,且 内不变色(2分,答
全得2分,否则为0分,颜色变为:浅红或红色均可)
5HC O + 2MnO -+ 6H+ = 10CO↑+2Mn2+ + 8H O(2分)
2 2 4 4 2 2
V(KMnO )=0.04L
② 4
n(KMnO)= 0.1mol·L-1×0.04L=0.004mol (1分)
③ 4
n (CoC O)= n(H C O)=2.5n(KMnO)=0.004×2.5mol=0.01mol (1分)
2 4 2 2 4 4
m (CoC O)=0.01mol ×147g·mol-1=1.47g (1分)
2 4
w(CoC O)=73.5% (1分) (共4分)
2 4
④偏高(2分)
18.(共16分)
(1)①Fe O (2分)
2 3
②避免温度过高,Fe3+水解生成Fe(OH) ,损失铁元素
3
(2分,此次答到Fe3+水解程度增大或水解生成Fe(OH) ,即可给2分)
3
(2)FeS +2Fe3+ = S +3Fe2+ (2分)
(3)加入FeO消耗溶液中的H+促使Al3+转化为Al(OH) 沉淀、不引入杂质离子
3
(3分,答到1点给1分,答到2点给3分)
(4)① 2.5(2分)
Fe (SO )+2Na HPO =2FePO↓+2Na SO +H SO (3分)
2 4 3 2 4 4 2 4 2 4
NaHPO 溶液呈碱性,防止生成Fe(OH) (2分)
② 2 4 3
19.(共18分)
③
Ⅰ
(1)-1 018.5 kJ·mol-1(2分)
(2)AlH 分解得到活性H与Fe O 反应大量放热引发铝热反应(反应ⅲ);AlH 分解得到Al更容易与Fe O
3 2 3 3 2 3反应(颗粒小、无氧化膜) (3分,答到任意一点即可的3分)
Ⅱ
(1)NaHSO(2分)
3
Ca(OH) +NaSO ===CaSO +2NaOH(2分,“↓”视而不见)
2 2 3 3
(2)生成的Mn2+催化O 氧化SO 生成HSO 的反应(3分,答到生成的Mn2+对反应有催化作用即可)
2 2 2 4
(3)①在相对较低温度可获得较高SO 的转化率,从而节约大量能源(3分)
2
②当温度高于445 ℃后,硫变成气态,其过程需要吸热,使反应变为吸热反应,升高温度,平衡正
向移动,SO 的平衡转化率增大(3分)
2