文档内容
2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
第三章 铁 金属材料(A 卷)
(基础强化篇)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Fe 56 Cu 64 Zn 65
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 下列关于铁与水反应的描述不正确的是
A.红热的铁能与水蒸气反应,用排水法收集产生的气体并点燃,能听到轻微爆鸣声
B.铁与水蒸气的反应是氧化还原反应
C.常温下,Fe与HO不反应,但在空气中O、HO的共同作用下能发生氧化反应
2 2 2
D.铁与水蒸气反应的固体产物是黑色的FeO
2. 中国每年要进口5亿吨左右的铁矿石,占世界海上铁矿石贸易量的一半以上,关于铁矿石的说法正确
的是
A. 赤铁矿的主要成分是Fe O
3 4
B. 铁矿石的主要成分与铁锈的主要成分相同
C. 磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变血红色
D. FeO俗称铁红
3. 向一定质量的FeO、Fe、Fe O 的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,
3 4
放出标准状况下的气体224 mL,在溶液中加入KSCN溶液无红色出现。若用足量的CO在高温下还原相同
质量的此混合物,能得到铁的质量为
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
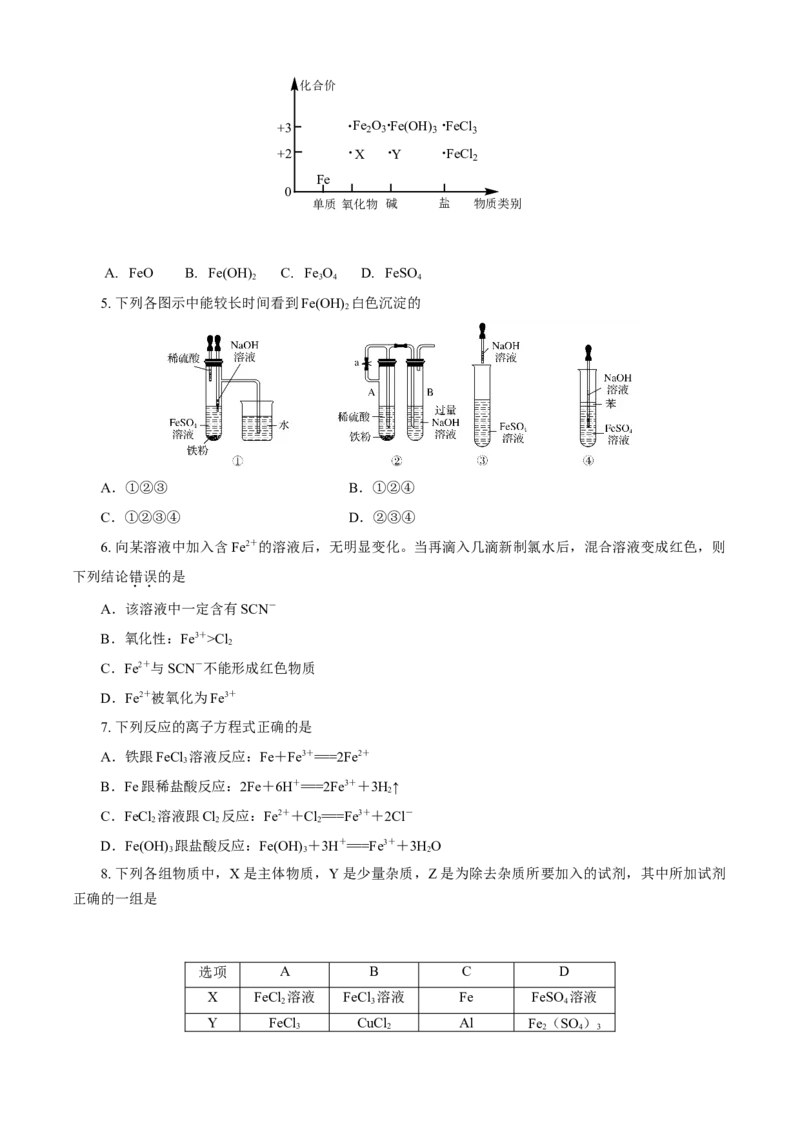
4. 以物质的类别为横坐标,化合价为纵坐标绘制的图象叫价类图。如图是铁的价类图,Y物质为化合价
+3 Fe 2 O 3 Fe(OH) 3 FeCl 3
+2 X Y FeCl
2
Fe
0
单质 氧化物 碱 盐 物质类别
A. FeO B. Fe(OH) C. Fe O D. FeSO
2 3 4 4
5. 下列各图示中能较长时间看到Fe(OH) 白色沉淀的
2
A.①②③ B.①②④
C.①②③④ D.②③④
6. 向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则
下列结论错误的是
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl
2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氧化为Fe3+
7. 下列反应的离子方程式正确的是
A.铁跟FeCl 溶液反应:Fe+Fe3+===2Fe2+
3
B.Fe跟稀盐酸反应:2Fe+6H+===2Fe3++3H↑
2
C.FeCl 溶液跟Cl 反应:Fe2++Cl===Fe3++2Cl-
2 2 2
D.Fe(OH) 跟盐酸反应:Fe(OH) +3H+===Fe3++3HO
3 3 2
8. 下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂
正确的一组是
选项 A B C D
X FeCl 溶液 FeCl 溶液 Fe FeSO 溶液
2 3 4
Y FeCl CuCl Al Fe (SO )
3 2 2 4 3Z Cl Fe NaOH溶液 Cu
2
9. 设N 代表阿伏加德罗常数的值,下列说法正确的是
A
A.1 mol Na在空气中完全燃烧,转移的电子数为2N
A
B.常温下,2.3 g钠投入水中,产生0.05N 个氢分子
A
C.0.1 mol Fe与足量水蒸气反应生成H 的分子数为0.1N
2 A
D.0.1 mol Fe与足量盐酸反应,转移0.3 mol电子
10. 制印刷电路时常用氯化铁溶液做腐蚀液,有关反应为2FeCl +Cu===2FeCl +CuCl 。向盛有氯化铁
3 2 2
溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中不可能出现的是
A.有铜粉无铁粉
B.有铁粉无铜粉
C.铁粉、铜粉都有
D.铁粉、铜粉都无
11. 下列关于铁和铁合金的有关说法错误的是
A.工业上用一氧化碳将铁矿石中的铁还原出来
B.不锈钢抗腐蚀性能好,长期使用绝对不会生锈
C.制造铁轨、船舶、桥梁的碳素钢是铁和碳的合金
D.使用铁锅炒菜能为人体提供微量的铁元素
12. 下列有关厨房中铝制品的使用,你认为合理的是
A.盛放食醋 B.烧煮开水 C.用金属丝擦洗表面的污垢 D.用碱水洗涤
13. 储氢合金是一类新型合金,如铁系储氢合金、钛系储氢合金。储氢合金既能在一定条件下吸收
H,又能在一定条件下放出H,该循环中发生变化:H 2H。下列说法错误的是
2 2 2
A.储氢合金的吸氢和放氢都是物理变化
B.温度和压强都会影响储氢合金的吸氢和放氢
C.铁系储氢合金可以做成纳米合金
D.铁系储氢合金和钛系储氢合金可以用磁铁进行鉴别
14. 下列物质中既能跟稀HSO 反应,又能跟氢氧化钠溶液反应的两性物质是
2 4
①NaHCO
3
②Al
2
O
3
③Al
A.①② B.②③ C.①③ D.只有②
15. 铝既能与硫酸溶液反应,又能与烧碱溶液反应,下列说法不正确的是
A.两个反应都是氧化还原反应
B.铝与硫酸反应时,硫酸作氧化剂
C.铝与烧碱溶液反应时,氢氧化钠作氧化剂
D.两个反应都有气体生成16. 下列说法正确的是
A. Al O 难溶于水,不跟水反应,所以它不是Al(OH) 对应的氧化物
2 3 3
B. 因为Al O 是金属氧化物,所以它是碱性氧化物
2 3
C. Al O 能跟所有的酸碱溶液反应
2 3
D. Al O 能跟强的酸碱溶液反应
2 3
17. 铁粉在高温条件下可与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了 32
g,则参加反应的铁粉的质量是
A.28 g B.56 g
C.84 g D.112 g
18. 将适量铁粉放入氯化铁溶液中,完全反应后,溶液中的 Fe3+和Fe2+浓度相等。则已反应的Fe3+和
未反应的Fe3+的物质的量之比是
A.2∶3 B.3∶2
C.1∶2 D.1∶1
19. Mg、Zn、Al、Fe四种金属单质分别与足量的稀硫酸反应,放出 H 的物质的量与投入金属的质量
2
的关系如图所示,则①②③④所表示的金属分别是
A.Al、Mg、Fe、Zn B.Fe、Zn、Mg、Al
C.Mg、Al、Zn、Fe D.Zn、Fe、Mg、Al
20. 将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·cm-3,该溶液中溶质的质量分
数为
A. % B. %
C. % D. %
二、非选择题:本题共5个题,共60分。
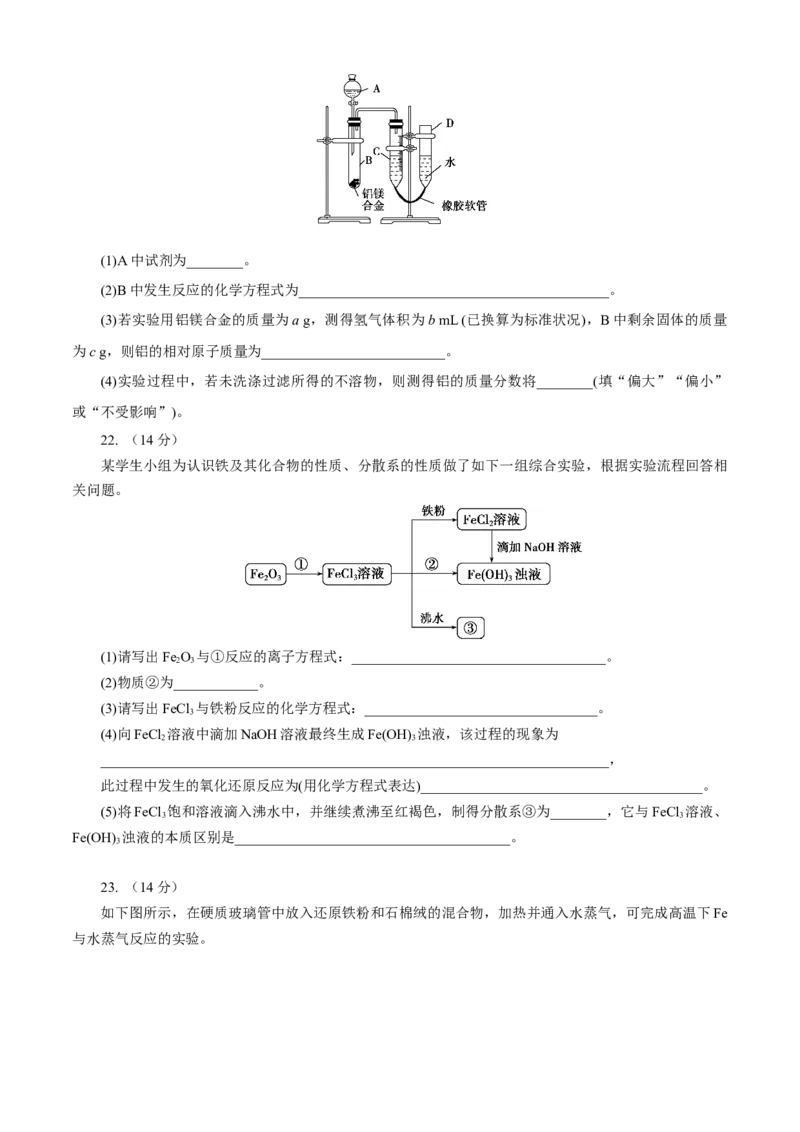
21. (8分)
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。(1)A中试剂为________。
(2)B中发生反应的化学方程式为____________________________________________。
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL (已换算为标准状况),B中剩余固体的质量
为c g,则铝的相对原子质量为__________________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”
或“不受影响”)。
22. (14分)
某学生小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相
关问题。
(1)请写出Fe O 与①反应的离子方程式:____________________________________。
2 3
(2)物质②为____________。
(3)请写出FeCl 与铁粉反应的化学方程式:_________________________________。
3
(4)向FeCl 溶液中滴加NaOH溶液最终生成Fe(OH) 浊液,该过程的现象为
2 3
________________________________________________________________________,
此过程中发生的氧化还原反应为(用化学方程式表达)________________________________________。
(5)将FeCl 饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为________,它与FeCl 溶液、
3 3
Fe(OH) 浊液的本质区别是_______________________________________。
3
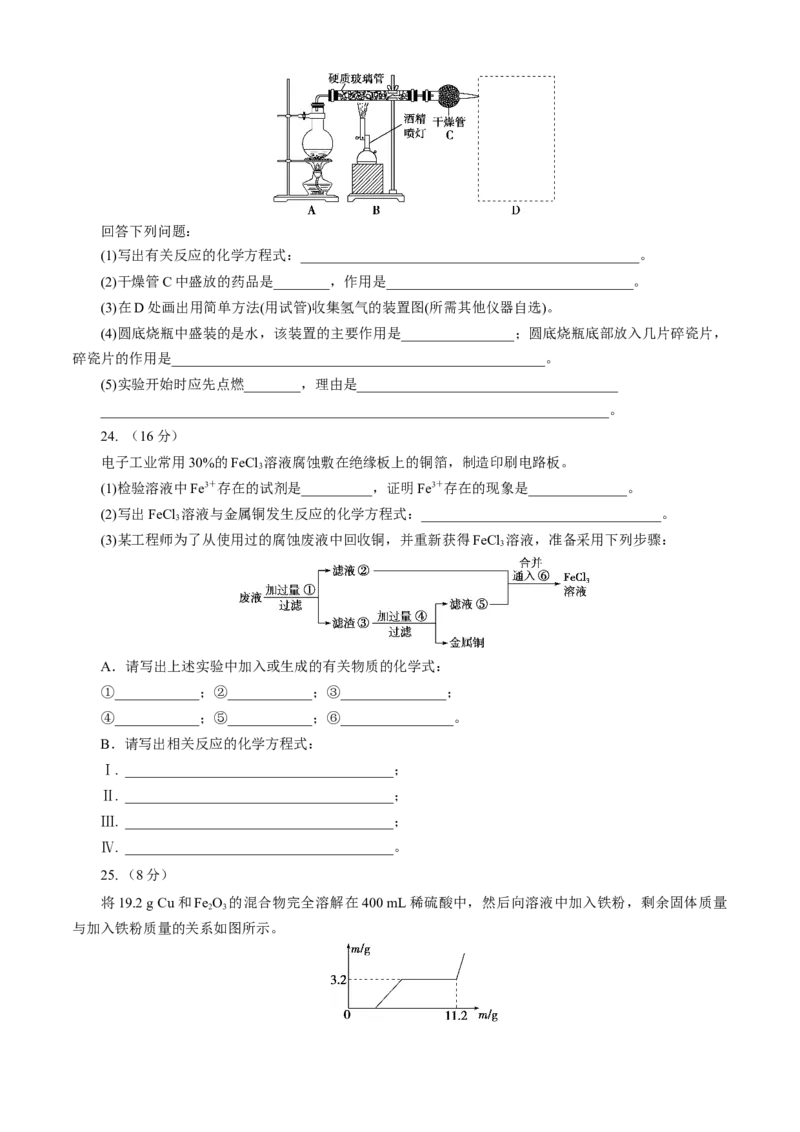
23. (14分)
如下图所示,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,可完成高温下Fe
与水蒸气反应的实验。回答下列问题:
(1)写出有关反应的化学方程式:________________________________________________。
(2)干燥管C中盛放的药品是________,作用是___________________________________。
(3)在D处画出用简单方法(用试管)收集氢气的装置图(所需其他仪器自选)。
(4)圆底烧瓶中盛装的是水,该装置的主要作用是________________;圆底烧瓶底部放入几片碎瓷片,
碎瓷片的作用是_____________________________________________________。
(5)实验开始时应先点燃________,理由是_____________________________________
________________________________________________________________________。
24. (16分)
电子工业常用30%的FeCl 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
3
(1)检验溶液中Fe3+存在的试剂是__________,证明Fe3+存在的现象是______________。
(2)写出FeCl 溶液与金属铜发生反应的化学方程式:__________________________________。
3
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl 溶液,准备采用下列步骤:
3
A.请写出上述实验中加入或生成的有关物质的化学式:
①____________;②____________;③_______________;
④____________;⑤____________;⑥________________。
B.请写出相关反应的化学方程式:
Ⅰ. ______________________________________;
Ⅱ. ______________________________________;
Ⅲ. ______________________________________;
Ⅳ. ______________________________________。
25. (8分)
将19.2 g Cu和Fe O 的混合物完全溶解在400 mL稀硫酸中,然后向溶液中加入铁粉,剩余固体质量
2 3
与加入铁粉质量的关系如图所示。(1)计算混合物中n(Cu)∶n(Fe O)。
2 3
(2)计算稀硫酸的物质的量浓度。