文档内容
2020-2021 学年高一化学必修第一册同步单元 AB 卷(新教材人教版)
第四章 物质结构 元素周期律(A 卷)
(基础强化篇)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 Li 7 Be 9 B 11 C 12 N 14 O 16 F 19 Na 23 Mg 24 Al 27 Si
28
P 31 S 32 Cl 35.5 K 39 Ca 40
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 下面关于多电子原子的核外电子的运动规律的叙述正确的是
①核外电子是分层运动的 ②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动 ④能量低的电子在离核近的区域内运动
A.①④ B.②③ C.①③ D.②④
2. 下列各表分别是元素周期表的一部分,表中的数字表示元素的原子序数,各表中数字所表示的元素
在周期表的位置与周期表的结构相符的是
3. 简单原子的原子结构可用下图形象地表示:
其中·表示质子或核外电子,○表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同位素
B.①②③属于不同的元素
C.①②③是三种化学性质不同的粒子
D.①②③具有相同的质量数
4. 已知R2-的核内有n个中子,R原子的质量数为M,则m g R2-含有电子的物质的量为
A. mol B. mol
C. mol D. mol
5. 下列有关碱金属的说法不正确的是
A.均为第ⅠA族元素,最外层均有1个电子B.单质的还原性:Li>Na>K>Rb>Cs
C.碱性:LiOH<NaOH<KOH<RbOH<CsOH
D.由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
6. 下列关于卤族元素在周期表中由上到下性质发生递变的叙述中,正确的是
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离
子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.①③⑤
7. 下列事实不能作为实验判断依据的是
A.钠和镁分别与冷水反应,判断钠和镁的金属性强弱
B.铁投入CuSO 溶液中能置换出铜,钠投入CuSO 溶液中不能置换出铜,判断钠与铁的金属性强弱
4 4
C.酸性HCO<HSO ,判断硫与碳的非金属性强弱
2 3 2 4
D.Br 与I 分别与足量的H 反应,判断溴与碘的非金属性强弱
2 2 2
8. 下列有关性质的比较,不能用元素周期律解释的是
A.酸性:HNO>HCO
3 2 3
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)
2
D.热稳定性:NaCO>NaHCO
2 3 3
9. 电子层数相同的X、Y、Z三种元素,原子序数都小于18,已知最高价氧化物对应水化物的酸性
HXO>H YO >H ZO,则下列判断错误的是
4 2 4 3 4
A.原子半径:X>Y>Z
B.气态氢化物的稳定性:HX>H Y>ZH
2 3
C.非金属性:X>Y>Z
D.阴离子的还原性:Z3->Y2->X-
10. 已知下列原子的半径:
原子 N S O Si
半径r/(10-10 m) 0.75 1.02 0.74 1.17
根据以上数据,磷原子的半径可能是
A.1.10×10-10m B.0.80×10-10m
C.1.20×10-10m D.0.70×10-10m
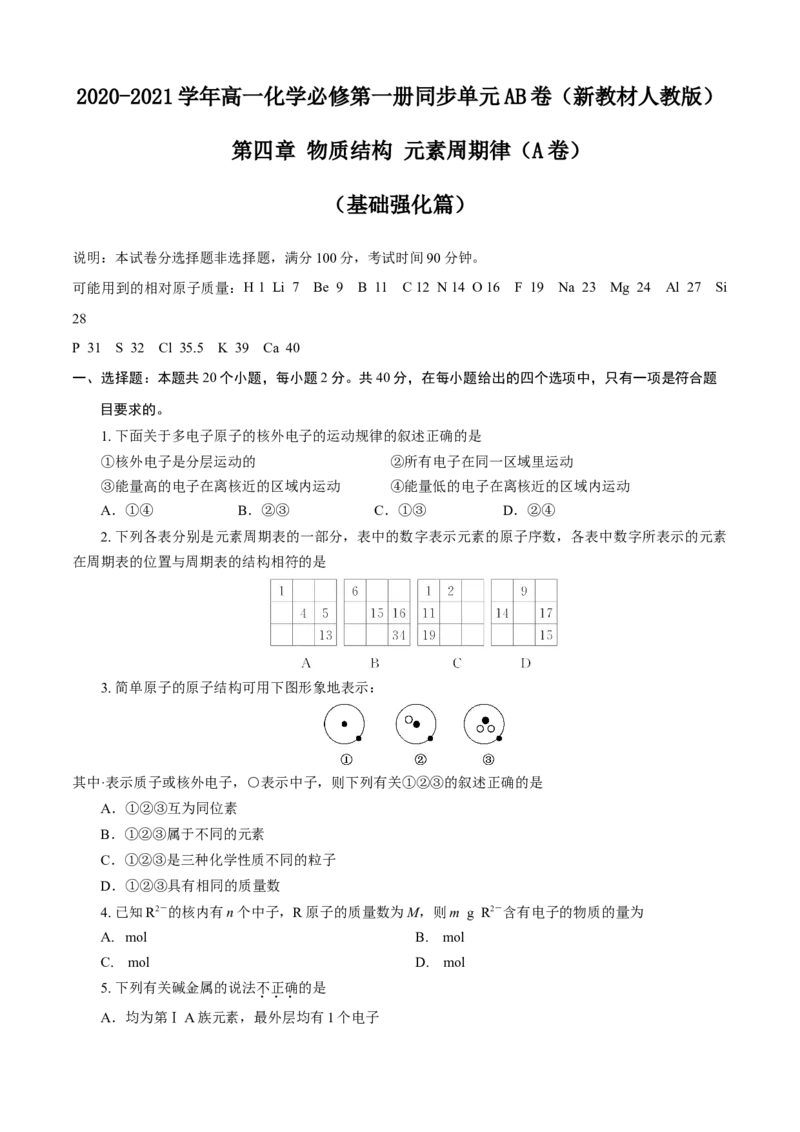
11. 如图是部分短周期元素化合价与原子序数的关系图,下列说法中正确的是A.原子半径:Z>Y>X
B.气态氢化物的稳定性:RZ>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
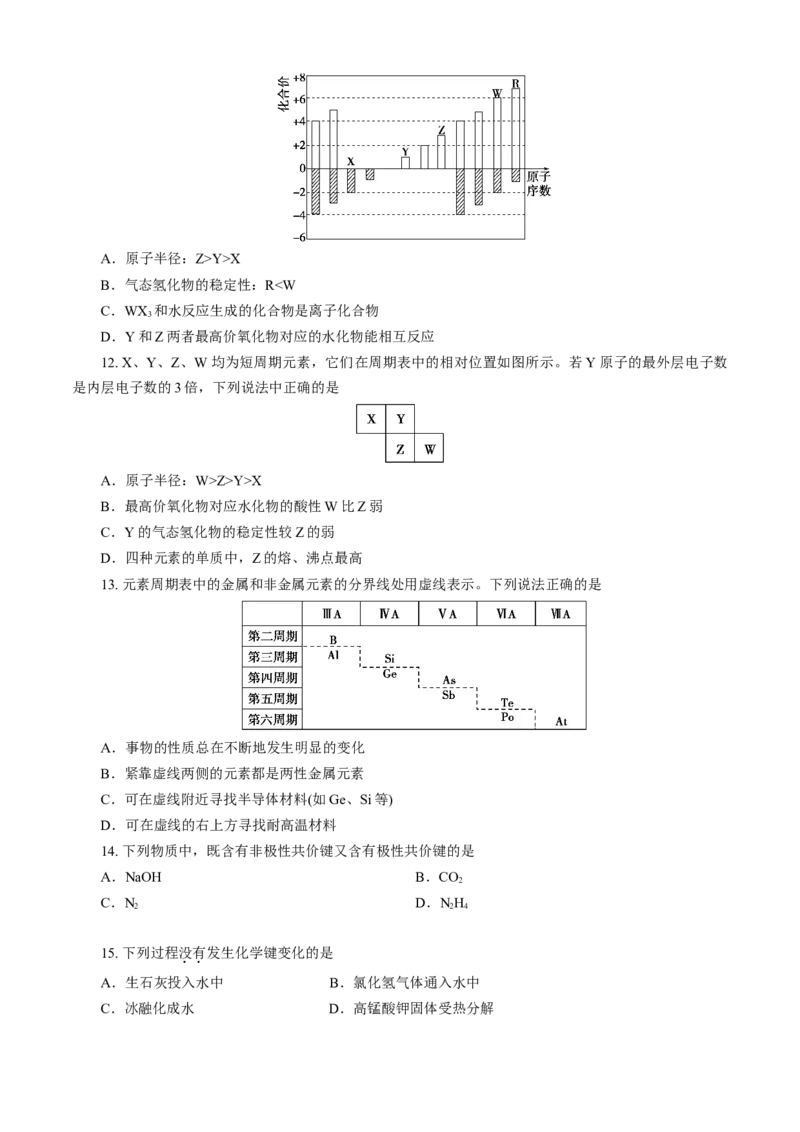
13. 元素周期表中的金属和非金属元素的分界线处用虚线表示。下列说法正确的是
A.事物的性质总在不断地发生明显的变化
B.紧靠虚线两侧的元素都是两性金属元素
C.可在虚线附近寻找半导体材料(如Ge、Si等)
D.可在虚线的右上方寻找耐高温材料
14. 下列物质中,既含有非极性共价键又含有极性共价键的是
A.NaOH B.CO
2
C.N D.NH
2 2 4
15. 下列过程没有发生化学键变化的是
A.生石灰投入水中 B.氯化氢气体通入水中
C.冰融化成水 D.高锰酸钾固体受热分解16. 下列说法不正确的是
A. 干冰升华和液氧气化时,都只需克服分子间作用力
B. N 和ClO两种分子中,每个原子的最外层都具有8电子稳定结构
2 2
C. HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
D. 石墨转化为金刚石,既有化学键的断裂,又有化学键的形成
17. 下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合生成稳定化合
物的是
A.6与16 B.8与14
C.10与19 D.11与17
18. 下列化学用语正确的是
A.CO 分子的电子式为
2
B.核内质子数为117、核内中子数为174的核素Ts可表示为Ts
C.Cl-的结构示意图为
D.HClO的结构式为H—Cl—O
19. 短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层
只有一个电子,Z位于元素周期表ⅢA族,W与X属于同一主族。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)
B.由X、Y组成的化合物中均不含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱
D.X的简单气态氢化物的热稳定性比W的强
20. 原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构
与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性强弱顺序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
二、非选择题:本题共5个题,共60分。
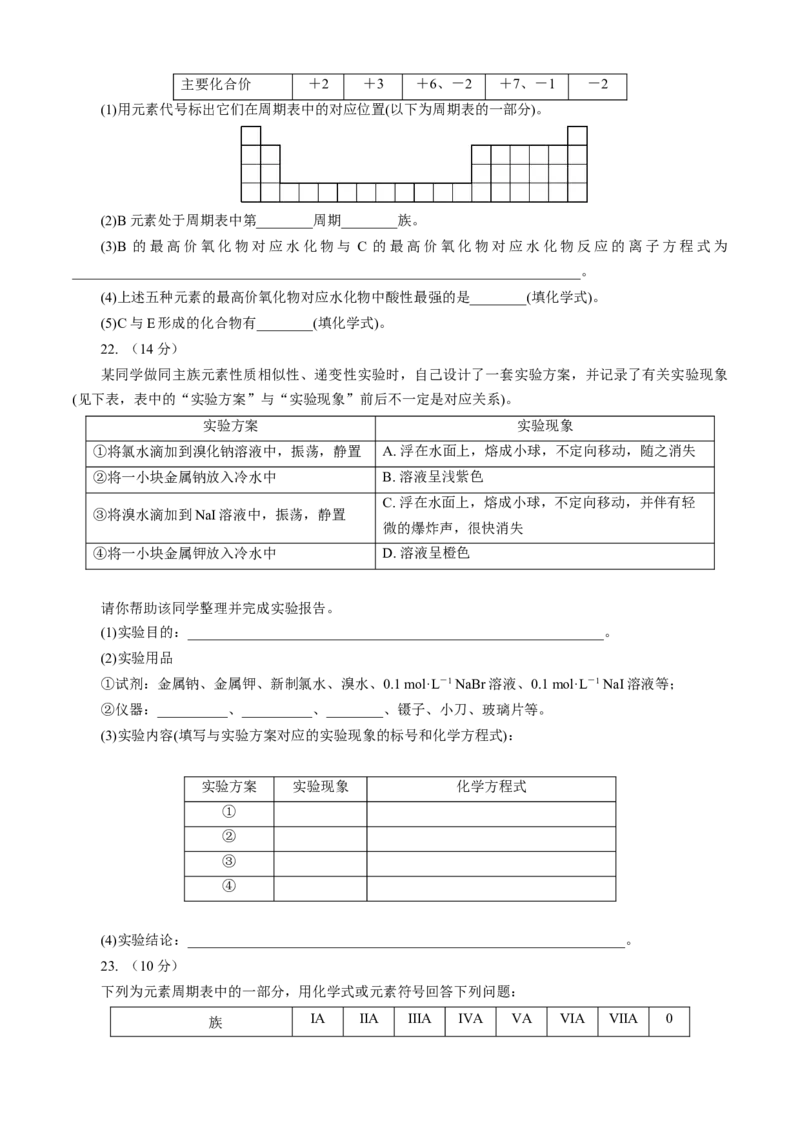
21. (10分)
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半
径及主要化合价(已知铍的原子半径为0.089 nm):
元素代号 A B C D E
原子半径/nm 0.16 0.143 0.102 0.099 0.074主要化合价 +2 +3 +6、-2 +7、-1 -2
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
(2)B元素处于周期表中第________周期________族。
(3)B 的最高价氧化物对应水化物与 C 的最高价氧化物对应水化物反应的离子方程式为
________________________________________________________________________。
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式)。
(5)C与E形成的化合物有________(填化学式)。
22. (14分)
某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象
(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验方案 实验现象
①将氯水滴加到溴化钠溶液中,振荡,静置 A. 浮在水面上,熔成小球,不定向移动,随之消失
②将一小块金属钠放入冷水中 B. 溶液呈浅紫色
C. 浮在水面上,熔成小球,不定向移动,并伴有轻
③将溴水滴加到NaI溶液中,振荡,静置
微的爆炸声,很快消失
④将一小块金属钾放入冷水中 D. 溶液呈橙色
请你帮助该同学整理并完成实验报告。
(1)实验目的:___________________________________________________________。
(2)实验用品
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液等;
②仪器:__________、__________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
实验方案 实验现象 化学方程式
①
②
③
④
(4)实验结论:______________________________________________________________。
23. (10分)
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
族周期
二 ⑥ ⑩
三 ① ③ ⑤ ⑦ ⑨
四 ② ④ ⑧
(1)①③⑤中,最高价氧化物对应的水化物的碱性最强的是________(填化学式)。
(2)②③④中,形成的简单离子半径由大到小的顺序是________________。
(3)①和⑧的最高价氧化物对应的水化物化学式分别为________和________。①和⑧两元素形成化合物
的化学式为________,该化合物的溶液与元素⑦的单质反应的离子方程式为_________________________。
(4)⑦⑧⑩ 三种元素形成的气态氢化物最稳定的是________________,三者非金属性强弱顺序为
________________________________________。
24. (14分)
(1)现有下列 10 种物质:① O ;② H ;③ NH NO ;④ NaO ;⑤ Ba(OH) ;⑥ CH ;⑦ CO ;
2 2 4 3 2 2 2 4 2
⑧NaF;⑨NH ;⑩I。
3 2
其中既含离子键又含非极性键的是________(填序号,下同);既含离子键又含极性键的是________;
只含共价键的是____________;只含离子键的是________。
(2)X、Y两种主族元素能形成XY 型化合物,已知XY 中共有38个电子。若XY 为常见元素形成的离
2 2 2
子化合物,则其电子式为____________________________________;
若XY 为共价化合物,则其结构式为_____________________________________。
2
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化
铝是________(填“共价化合物”或“离子化合物”),可以证明该判断正确的实验依据是
_____________________。
(4)现有a~g七种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
①元素的原子间最容易形成离子键的是________(填字母,下同),容易形成共价键的是________。
A.c和f B.b和g C.d和g D.b和e
②写出a~g七种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式:________。
25. (12分)
短周期A、B、C、D、E、F六种元素的原子序数依次增大。在周期表中,A的原子半径最小。B元素
的原子最外层电子数是内层电子数的两倍。C为地壳中含量最多的元素。D是原子半径最大的短周期主族
元素。D的单质在加热条件下与C的单质充分反应,可以得到与E单质颜色相同的固态化合物。D与F形
成的化合物DF是常用的调味品。试根据以上叙述回答下列问题:
(1)写出下列元素的名称:A__________,B__________,C__________,D__________。
(2)E在元素周期表中的位置:_______________________。(3)F的离子结构示意图:_______________。
(4)A、B组成的最简单化合物的名称是________。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为
________________________________________________________________________。
(6)能说明E的非金属性比F的非金属性________(填“强”或“弱”)的事实是
________________________________________________________________________(举一例)。