文档内容
班级 姓名 学号 分数
第 08 单元 化学与可持续发展
(A卷·夯实基础)
(时间:75分钟,满分:100分)
一、选择题(本题共16小题,每小题3分,共48分)
1.化学与环境密切相关,下列有关说法正确的是
A.CO、NO、NO 都是大气污染物,在空气中都能稳定存在
2
B.大气中SO 含量的增加会导致温室效应加剧
2
C.汽车尾气的主要污染成分包括NO、CO和N
2
D.NO可用于某些疾病的治疗
【答案】D
【详解】A.CO、NO、NO 都是大气污染物,一氧化碳和二氧化氮在空气中能稳定存在,一氧化氮和氧气
2
反应,不能在空气中稳定存在,故A错误;
B.大气中SO 含量的增加会导致酸雨,故B错误;
2
C.汽车尾气的主要污染成分不包括N,故C错误;
2
D.NO的生物学特性有促使血红蛋白和肌球蛋白迅速强力抑制其血管舒张作用,则可用于心血管疾病的治
疗,故D正确。
答案选D。
2.2022北京冬奥会是我国提出“2030碳达峰、2060碳中和”目标后的首个世界级体育盛会,冬奥会承诺
碳排放将全部中和。下列技术中不能促进碳中和的是
A.在火力发电中,对烟尘采用脱硫除尘处理减少空气污染
B.张北风电、太阳能发电实现绿色用电
C.“平原用电、山地用氢”的原则,在各赛区推广电动汽车、氢燃料电池汽车
D.中科院首次实现了从二氧化碳到淀粉的从头全合成
【答案】A
3.下列说法不正确的是
A.自然界中存在游离态的金属单质
B.金属活动性不同,冶炼方法也有所不同
C.地球上金属矿物资源是取之不尽的,因此,应加大开采金属矿物的速度,以满足经济发展的需要
D.废旧金属的回收利用,有利于环境保护
1 / 14
学科网(北京)股份有限公司【答案】C
【解析】A.少数化学性质不活泼的金属,在自然界中以游离态存在,如金和铂等,故A正确;
B.金属活动性不同,冶炼方法也有所不同,如钾钙钠镁铝用电解法,锌铁锡铅用热还原法,铜用热分解
法或热还原法,汞用热分解法,故B正确;
C.矿产资源是不可再生的自然资源,不是取之不尽的,应合理的开采金属矿物,故C错误;
D.废旧金属的回收利用,实现资源再利用,有利于环境保护,故D正确;
答案选C。
4.下列有关判断正确的是
A.金属阳离子被还原,一定会得到金属单质
B.金属冶炼过程中,金属化合物得到电子发生氧化反应
C.通过铝热反应可以在野外焊接钢轨
D.海带中含有碘单质,能使淀粉变蓝
【答案】C
【详解】A.金属阳离子被还原,不一定会得到金属单质,如铁离子与铜单质反应生成亚铁离子和铜离子,
反应中铁离子被还原为亚铁离子,没有得到铁单质,故A错误;
B.金属冶炼过程中,金属化合物中的金属阳离子得到电子发生还原反应生成金属单质,故B错误;
C.铝和铁的氧化物在高温下能发生铝热反应生成氧化铝和铁,熔化的铁可以用于野外焊接钢轨,故C正
确;
D.海带中含有碘离子,不含有碘单质,不能使淀粉变蓝,故D错误;
故选C。
5.下列有关金属的工业制法中正确的是
A.制钛:用金属钠置换氯化钛(TiCl )溶液中的钛
4
B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铜:电解硫酸铜溶液
【答案】B
【解析】A.金属钠性质非常活泼,会与溶液中的水反应,而不能与氯化钛发生置换反应,应该是钠与熔
融的氯化钛(TiCl )发生置换反应产生NaCl、Ti,A不符合题意;
4
B.金属铁性质比较活泼,可以用焦炭和空气反应产生的CO在高温下与铁矿石中铁的氧化物发生氧化还
原反应制取铁,B符合题意;
C.用海水为原料制得精盐,再电解熔融的NaCl制取金属钠,若电解纯净的NaCl溶液,反应产生
NaOH、H、Cl,不能制得金属钠,C不符合题意;
2 2
D.电解硫酸铜溶液,反应产生Cu、HSO 、O,尽管可以制取得到Cu,但制取成本较高,在工业上一般
2 4 2
2 / 14
学科网(北京)股份有限公司不采用。工业上炼铜一般采用湿法炼铜或火法,而不采用电解方法冶炼,D不符合题意;
故合理选项是B。
6.我国在“煤变油”技术上已取得了重大突破,达到5吨煤可以合成1吨成品油的水平。下列有关叙述错
误的是( )
A.煤的组成元素主要是C,还含有少量的H、N、S、O等元素
B.“煤变油”的方法之一是使煤与H 作用生成液态有机物
2
C.煤之所以能变“油”,是因为煤中含有大量的汽油、柴油和煤焦油
D.煤变成成品油需要经过一系列工艺流程,发生复杂的物理、化学变化才能实现
【答案】C
【解析】本题考查煤的组成及综合利用。煤之所以能变“油”,是通过煤的液化将煤中的有机物转化为可
燃性液体燃油,并不是因为煤中含有汽油、柴油和煤焦油。
7.下列说法正确的是
A.石油分馏塔从上到下的分馏产品依次是汽油、石油气、煤油、润滑油、柴油、重油
B.石油的各种分馏产品具有固定的沸点
C.石油裂化的目的是提高汽油等轻质油的产量和质量
D.石油裂解的主要目的是得到甲烷、丙烷等气态烷烃
【答案】C
【详解】A.石油分馏塔从上到下的分馏产品依次是石油气、汽油、煤油、柴油、润滑油、重油,A错误;
B.石油的各种分馏产品仍然是混合物,因此不具有固定的沸点,B错误;
C.裂化的目的是将C 以上的烷烃裂化为C -C 的烷烃和烯烃,得到裂化汽油,因而可以提高汽油的产量
18 5 11
和质量,C正确;
D.石油裂解是以裂化得到的汽油为原料,进行深度裂化,得到乙烯等化工基础原料,D错误;
故合理选项是C。
8.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
【答案】D
【解析】灼烧海带应用坩埚,A项错误;过滤时应用玻璃棒引流,B项错误;苯的密度比水的小,萃取了
单质碘的苯层在上层,应从分液漏斗的上口倒出,C项错误。
9.空气吹出法是工业规模海水提溴的常用方法,流程如下:
浓缩海水氯气粗产品溴通空气和水蒸气溴蒸气二氧化硫物质X氯气产品溴
① ② ③ ④
下列说法错误的是
3 / 14
学科网(北京)股份有限公司A.①中发生的主要反应为Cl+2Br-=Br +2Cl-
2 2
B.物质X为HBrO
C.②③的目的是富集溴元素
D.空气吹出法利用了溴易挥发的性质
【答案】B
【分析】浓缩海水中通入氯气将溴离子置换成溴单质,再通入空气和水蒸气将溴形成蒸汽,用二氧化硫吸
收生成HBr和HSO ,HBr再与氯气生成溴单质。
2 4
【详解】A.浓缩海水中通入氯气将溴离子置换成溴单质,发生反应为Cl+2Br-=Br +2Cl-,故A正确;
2 2
B.溴与二氧化硫反应生成HBr和HSO ,所以物质X为HBr和HSO ,故B错误;
2 4 2 4
C.②通入空气和水蒸气将溴形成蒸汽,与③二氧化硫反应,目的是富集溴元素,故C正确;
D.溴易挥发,空气吹出法利用了溴易挥发的性质形成溴蒸汽再被二氧化硫吸收,故D正确;
故答案为B。
10.加热聚丙烯废塑料可以得到炭、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废塑料的
再利用。下列叙述中不正确的是( )
A.聚丙烯的链节是—CH—CH—CH—
2 2 2
B.装置乙的试管中可收集到芳香烃
C.装置丙中的试剂可吸收烯烃以制取卤代烃
D.最后收集的气体可作燃料
【答案】A
【解析】A.聚丙烯的链节是—CH—CH(CH )—,故A错误;B.加热聚丙烯废塑料可以得到芳香烃苯和
2 3
甲苯,苯和甲苯的沸点较高,故B正确;C.烯烃可以与溴单质发生加成反应生成卤代烃,故 C正确;D.最
后收集的气体为氢气和甲烷,可作燃料,故D正确。
11.下列说法不正确的是
A.应当研制、推广和使用低毒、无公害的化学农药
B.开发新农药时,要全面正确地掌握药物的性质及其对人体、环境的影响
C.农药能杀灭病虫害,但也能影响人类的健康,因此应杜绝农药的使用
D.有害农药的滥用会导致了粮食、果品、蔬菜等的污染
【答案】C
【解析】A.农药本身有毒,在杀灭病虫害的同时,也带来了对环境的污染和对人体健康的危害,所以农
4 / 14
学科网(北京)股份有限公司业应当应当研制、推广和使用低毒、无公害的化学农药,故A正确;
B.物质的用途决定于物质的性质,只有全面、正确了解物质的性质,才能合理利用它,故B正确;
C.农药的作用是能杀灭病虫害,不能杜绝使用农药,应合理使用,故C错误;
D.如果农药不合理使用,如大量滥用,导致了粮食、果品、蔬菜、食品的污染,故D正确;
故选:C。
12.下列有关合理用药的说法中正确的是
A.非处方药的包装上印有“OTC”标识
B.每日早、中、晚三次与每隔8小时一次,服药效果相同
C.一次忘记服药,下次可以增加一倍剂量服用
D.长期服用阿司匹林可预防某些疾病,没有副作用
【答案】A
【解析】A.OTC是非处方药的标志,A项正确;
B.每日早、中、晚三次不等于每隔8小时一次,服药时一定要严格执行规定的时间,不能随便更改,B项
错误;
C.一次服用药物的用量是经过严格的科学实验和大量的临床研究确定的,不可随便增加,C项错误;
D.药物不能长期服用,避免药物对人体产生不良作用或危害,D项错误;
答案选A。
13.科学合理地使用食品添加剂能保障食品质量与安全。下列说法错误的是
A.“甜味剂”甜蜜素(C H NHSONa)属于糖类
6 11 3
B.“膨松剂”碳酸氢铵受热能放出氨气和二氧化碳
C.“防腐剂”亚硝酸钠长期超量食用容易引发人体细胞癌变
D.“增稠剂”MG(C H COOCH CHOHCH OH)水解可生成甘油
17 35 2 2
【答案】A
【解析】A.糖类为多羟基醛、多羟基酮以及能水解生成它们的物质,含有C、H、O元素,而甜蜜素
(C H NHSONa)含有Na、S元素,不属于糖类,故A错误;
6 11 3
B.碳酸氢铵在加热时或酸性条件下会分解成水,氨气和二氧化碳气体,由于快速释放,氨气在成品里残
留很少,不会在成品里尝出氨味,所以可用于制作糕点时的膨松剂,故B正确;
C.亚硝酸钠是—种防腐剂和增色剂,但在食品中过量时会对人体产生危害,故C正确;
D.C H COOCH CHOHCH OH水解可以生成丙三醇即甘油,故D正确;
17 35 2 2
故选A。
14.下列对食品的处理符合食品安全要求的是
5 / 14
学科网(北京)股份有限公司A.使用“瘦肉精”激素饲料养的猪,猪肉的瘦肉率更高、营养价值更高
B.用福尔马林浸泡的海产品保鲜时间更长,味道更鲜美
C.添加工业染料“苏丹红”后的饲料喂养的鸭子产下的红心鸭蛋,营养价值更高
D.酱油中加铁、粮食制品中加赖氨酸营养更全面
【答案】D
【解析】A.瘦肉精让猪的单位经济价值提升不少,但它有很危险的副作用,轻则导致心律不整,严重一
点就会导致心脏病,对人体有害,故A错误;
B.福尔马林可使病菌中的蛋白质变性死亡,但不能用福尔马林(35%~40%甲醛水溶液)浸泡海产品,危害
人体健康,可处理生物标本,故B错误;
C.苏丹红具有致癌性,对人体的肝肾器官具有明显的毒性作用,故C错误;
D.酱油中加铁可补充人体必需的铁元素,粮食制品中加赖氨酸营养更全面,故D正确;
故选D。
15.环境保护与资源利用与我们生活息息相关,下列说法不正确的是
A.燃煤中加氧化钙可减少酸雨的形成及温室气体的排放
B.对含NO 、NO的废气处理后再排放
2
C.一定条件下,将CO 转化为淀粉,实现CO 的资源化利用
2 2
D.研发新型催化剂将CO 分解成碳和O,同时吸收热量
2 2
【答案】A
【解析】A.氧化钙与二氧化硫反应生成亚硫酸钙,燃煤中加氧化钙可减少酸雨的形成,但氧化钙与二氧
化碳反应生成碳酸钙,碳酸钙高温分解又生成二氧化碳,燃煤中加氧化钙不能减少温室气体的排放,A错
误;
B.NO 、NO对环境有污染,应对含NO 、NO的废气处理后再排放,B正确;
2 2
C.一定条件下,将CO 转化为淀粉,可减少二氧化碳的量,实现CO 的资源化利用,达到碳中和的目的,
2 2
C正确;
D.CO 分解成碳和O,为吸热反应,需要吸收能量,D正确;
2 2
答案选A。
16.绿色化学的“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所
用的所有原材科尽可能多的转化到最终产物中,以下反应最符合绿色化学的“原子经济性”要求的是
O SO
2 3
A.利用SO 与 反应制备 B.甲烷与氯气反应制取四氯化碳
2
C.以铜和浓硝酸为原科制取硝酸铜 D.一定条件下,用乙烯与水反应制取乙醇
6 / 14
学科网(北京)股份有限公司【答案】D
【解析】根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;
即生成物质只有一种,据此判断。
O SO
2 3
A.利用SO 与 反应制备 ,该反应属于可逆反应,不符合“绿色化学”的思想,故A错误;
2
B.甲烷与氯气制备四氯化碳:产物有多种,不符合“绿色化学”的思想,故B错误;
C.以铜和浓硝酸为原料制取硝酸铜,生成硝酸铜、水、二氧化氮,有污染,故C错误;
D.乙烯与水发生加成反应制取乙醇:反应物中原子全部转化为产物,且产物只有一种,符合“绿色化
学”的思想,故D正确;
故选D。
二、非选择题(本题共5小题,共52分)
17.(10分)有四种常见药物:①阿司匹林( )②青霉素③胃舒平[Al(OH) ]④麻黄碱。
3
请回答:
(1)某同学胃酸过多,应选用的药物是_______(填序号),抗酸药的成分Al(OH) 中和胃酸过多的离子方程式
3
为________。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___________(填序号,下同)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___________。
(4)阿司匹林药品标签上贴有OTC,它表示___________。
(5)滥用药物会导致不良后果,如过量服用___________(填序号)会出现水杨酸中毒,应立即停药,并静脉注
射NaHCO 溶液,试写出该药物和NaHCO 反应的离子方程式:____________。
3 3
【答案】(1) ③ Al(OH) +3H+=Al3++3H O
3 2
(2)④
(3)②
(4)非处方药
(5) ① +HCO-→ +CO
2
↑+H
2
O
3
SO NO
18.(10分)酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。 2 、 x是形成
7 / 14
学科网(北京)股份有限公司SO NO
酸雨的主要物质。研究 2 、 x等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
pH
(1)酸雨是指 小于_______的雨水。
(2)你认为减少酸雨的产生可采取的措施有_______(填序号)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰
(3)开发新能源可有效减少酸雨。下列能源不属于新能源的有_______(填序号)。
①太阳能 ②风能 ③地热能 ④海洋能 ⑤氢能 ⑥石油 ⑦无烟煤
NO NO NO
(4) x主要来源于汽车尾气。通过 传感器可监测汽车尾气中 含量,其工作原理如下图。据此回答:
NiO电极为_______(填“正极”或“负极”);其电极反应式为_______。
SO NH HSO O NH HSO SO
2 4 3 2 4 3 2
(5)可用氨水将 转化为 ,再用 氧化成 来脱除烟气中的 ,原理是_______、
_______(用离子方程式表示)。
【答案】(1)5.6
(2)①③
(3)⑥⑦
NO-2e-+O2-=NO
(4) 负极 2
SO +NH H O=NH++HSO- 2HSO-+O =2H++2SO2-
(5) 2 3 2 4 3 3 2 4
【解析】(1)酸雨是指pH<5.6的雨水。
(2)①未经脱硫的煤燃烧会产生二氧化硫,少用煤作燃料,可减少二氧化硫的排放,从而减少酸雨,①正确;
②把工厂烟囱造高,不能减少SO 、NO 的排放,不能减少酸雨,②错误;
2 x
③使用脱硫煤,可减少二氧化硫的排放,从而减少酸雨,③正确;
④在已酸化的土壤中加石灰,不会减少空气中SO 、NO 的含量,不能减少酸雨,④错误;
2 x
答案选①③。
(3)新能源一般是指在新技术基础上加以开发利用的可再生能源,包括太阳能、生物质能、水能、风能、地
8 / 14
学科网(北京)股份有限公司热能、海洋能、氢能、沼气、酒精、甲醇等,石油和无烟煤为化石燃料,是不可再生能源,答案选⑥⑦。
(4)由图示可知,NO在NiO电极上转化为了NO ,氮元素化合价升高,失电子,则NiO电极为负极,电极
2
NO-2e-+O2-=NO
反应式为: 2。
(5)二氧化硫为酸性氧化物,过量的二氧化硫与氨水反应生成亚硫酸氢铵,反应的离子方程式为:
SO +NH H O=NH++HSO-
2 3 2 4 3,亚硫酸氢铵有还原性,能与氧气发生氧化还原反应生成硫酸氢铵,反应的离
2HSO-+O =2H++2SO2-
子方程式为: 3 2 4 。
19.(8分)感冒是一种常见的病,病人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些
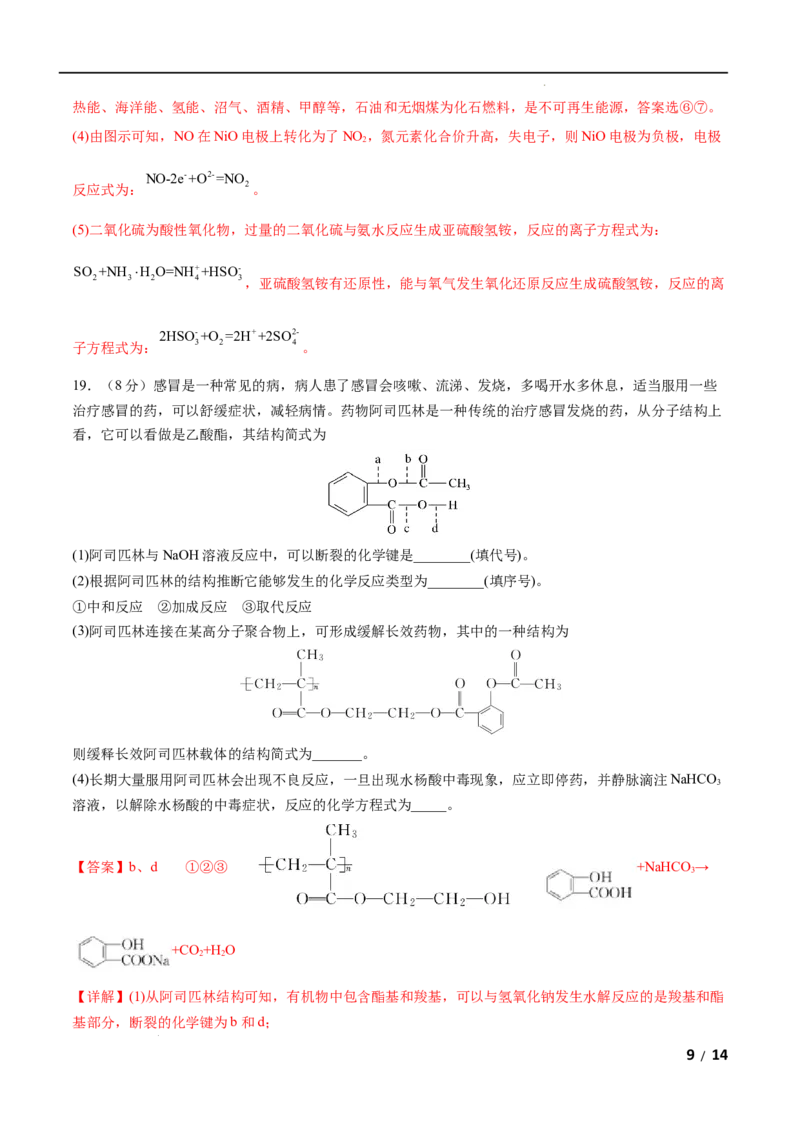
治疗感冒的药,可以舒缓症状,减轻病情。药物阿司匹林是一种传统的治疗感冒发烧的药,从分子结构上
看,它可以看做是乙酸酯,其结构简式为
(1)阿司匹林与NaOH溶液反应中,可以断裂的化学键是________(填代号)。
(2)根据阿司匹林的结构推断它能够发生的化学反应类型为________(填序号)。
①中和反应 ②加成反应 ③取代反应
(3)阿司匹林连接在某高分子聚合物上,可形成缓解长效药物,其中的一种结构为
则缓释长效阿司匹林载体的结构简式为_______。
(4)长期大量服用阿司匹林会出现不良反应,一旦出现水杨酸中毒现象,应立即停药,并静脉滴注NaHCO
3
溶液,以解除水杨酸的中毒症状,反应的化学方程式为_____。
【答案】b、d ①②③ +NaHCO→
3
+CO +H O
2 2
【详解】(1)从阿司匹林结构可知,有机物中包含酯基和羧基,可以与氢氧化钠发生水解反应的是羧基和酯
基部分,断裂的化学键为b和d;
9 / 14
学科网(北京)股份有限公司(2)阿司匹林的结构式中含羧基和苯环,可以发生中和反应、加成反应和取代反应,故选①②③;
(3)缓释长效药物是阿司匹林与载体发生酯化反应形成的,所以载体的结构简式为
;
(4)水杨酸结构式为 ,与碳酸氢钠反应的方程式为 +NaHCO→
3
+CO +H O。
2 2
【点睛】
酯基在碱性条件下水解,羧基也会和碱反应。
20.(10分)铝和铝合金是一类重要的金属材料。回答下列问题:
(1)除去镁粉中混有少量铝粉,应加入的试剂为___________,然后经过滤、洗涤、干燥。
(2)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H 在同温同压下的体积之比是
2
___________。
(3)某同学在实验室用铝土矿(含有Al O 和SiO,不考虑其他杂质)制取金属铝的流程如下:
2 3 2
①Al O 与稀硫酸反应的离子方程式为___________。
2 3
②滤液II中溶质的用途之一是___________。
③电解熔融的Al O 除得到金属铝之外,还可得到的气体产物是___________(填化学式)。工业上在电解熔
2 3
融的Al O 时,还加入了冰晶石(NaAlF)作熔剂,其作用是降低Al O 的熔点。冰晶石在物质的分类中属于
2 3 3 6 2 3
___________(填字母)。
a.酸 b.碱 c.盐 d.氧化物
【答案】氢氧化钠溶液 1:1 Al O+6H+=2Al3++3HO 用作肥料 O c
2 3 2 2
【分析】铝土矿(含有Al O 和SiO,不考虑其他杂质)用硫酸溶解,二氧化硅不反应,过滤分离,滤液主要
2 3 2
含有硫酸铝,向滤液中加入氨水,反应生成氢氧化铝沉淀,过滤分离,滤液Ⅱ中主要含有硫酸铵,氢氧化
铝烘干、灼烧分解生成氧化铝,电解熔融氧化铝生成铝单质与氧气,据此解答。
【详解】(1)铝和氢氧化钠溶液反应,镁不与氢氧化钠溶液反应,除去镁粉中混有的少量铝粉,应加入的试
剂是氢氧化钠溶液。
(2)2Al+6HCl=2AlCl +3H↑,2Al+2NaOH=2NaAlO +3H↑,通过化学方程式可以看出,等质量的两份铝分
3 2 2 2
别与足量的盐酸、氢氧化钠溶液反应,金属是不足的,所以生成氢气的物质的量相等,所得H 的体积之比
2
10 / 14
学科网(北京)股份有限公司是:1:1;
(3)①Al O 与稀硫酸反应生成硫酸铝和水,反应的离子方程式为Al O+6H+=2Al3++3HO;
2 3 2 3 2
②滤液Ⅱ中主要含有硫酸铵,用途之一是:用作肥料;
3
③电解熔融氧化铝生成铝单质与氧气,冰晶石(NaAlF)是由钠离子和AlF 组成,属于盐,故答案为
3 6 6
c。
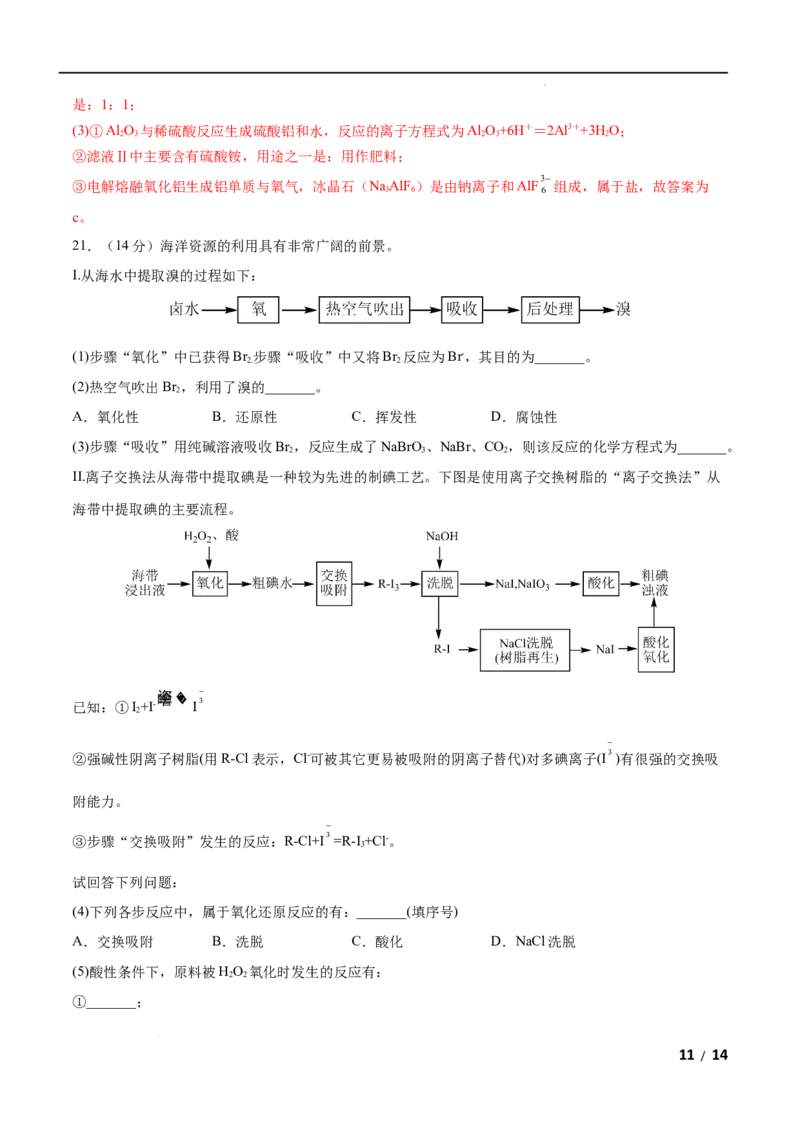
21.(14分)海洋资源的利用具有非常广阔的前景。
I.从海水中提取溴的过程如下:
(1)步骤“氧化”中已获得Br 步骤“吸收”中又将Br 反应为Br-,其目的为_______。
2. 2
(2)热空气吹出Br ,利用了溴的_______。
2
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤“吸收”用纯碱溶液吸收Br ,反应生成了NaBrO 、NaBr、CO,则该反应的化学方程式为_______。
2 3 2
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从
海带中提取碘的主要流程。
已知:①I+I-
噲垐��
I3
2
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I3)有很强的交换吸
附能力。
③步骤“交换吸附”发生的反应:R-Cl+I3=R-I +Cl-。
3
试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
A.交换吸附 B.洗脱 C.酸化 D.NaCl洗脱
(5)酸性条件下,原料被HO 氧化时发生的反应有:
2 2
①_______;
11 / 14
学科网(北京)股份有限公司②I+I-
噲垐��
I3
。
2
依据整个生产流程分析是否可以加过量HO;_______(填“是”或“否”)。并说明理由:_______。
2 2
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的
氧化剂。若某企业在酸性条件下选择NaNO 为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,
2
则添加氧化剂与NaI的质量比应不少于_______。
【答案】(1)富集溴
(2)C
3Br +3Na CO =5NaBr+NaBrO +3CO
(3) 2 2 3 3 2
(4)BC
(5)
2I-+H
2
O
2
+2H+=I
2
+2H
2
O
否 HO 会将I-全部氧化生成I,无法进行反应I+I-
噲垐��
I3
,从
2 2 2 2
而导致后续反应无法进行
(6)23∶50
【解析】Ⅰ.卤水经过氧化后得到Br ,此时得到的Br 浓度较低,利用热空气将Br 吹出,用纯碱吸收
2. 2 2
Br ,生成NaBrO 、NaBr,对吸收后的溶液进行处理得到溴;
2 3
Ⅱ. 海带浸出液中加入酸和过氧化氢,将I-氧化成I,交换吸附得到R-I,用NaOH溶液进行洗脱得到
2 3
NaI、NaIO 和R-I,NaI、NaIO 酸化后得到粗碘浊液,R-I用NaCl洗脱得到NaI,酸化氧化后得到粗碘浊
3 3
液。
(1)“氧化”步骤中已获得的Br 的含量较低,在“吸收”中又将Br 反应为Br-是为了富集溴,故答案为:富
2. 2
集溴;
(2)溴易挥发,利用热空气吹出Br ,利用了溴的挥发性,故选C,故答案为:C;
2
(3)用纯碱溶液吸收Br ,反应生成了NaBrO 、NaBr、CO,Br元素化合价由0价变为-1价、+5价,根据得
2 3 2
3Br +3Na CO =5NaBr+NaBrO +3CO
失电子守恒、质量守恒可得反应的化学方程式为 2 2 3 3 2 ,故答案为:
3Br +3Na CO =5NaBr+NaBrO +3CO
2 2 3 3 2 ;
(4)A.“交换吸附”发生的反应为R-Cl+I3=R-I +Cl-,该反应中没有元素的化合价发生变化,不属于氧化
3
还原反应,故A不符合题意;
B.NaOH洗脱时,生成NaI、NaIO 和R-I,I元素的化合价发生变化,属于氧化还原反应,故B符合题意;
3
12 / 14
学科网(北京)股份有限公司IO-
C.酸化时,I-和 3发生归中反应生成I,属于氧化还原反应,故C符合题意;
2
D.NaCl洗脱时交换金属阳离子,没有元素的化合价发生变化,不是氧化还原反应,故D不符合题意;
答案选BC,故答案为:BC;
2I-+H O +2H+=I +2H O
(5)酸性条件下,原料被HO 氧化时,I-被氧化生成I,发生的反应为 2 2 2 2 ;根据整个
2 2 2
流程进行分析可知,不能加足量HO,若加入足量的HO,HO 会将I-全部氧化生成I,无法进行反应
2 2 2 2 2 2 2
I+I-
噲垐��
I3
,从而导致后续反应无法进行,故答案为:
2I-+H
2
O
2
+2H+=I
2
+2H
2
O
;否;足量的HO 会将I-
2 2 2
全部氧化生成I,无法进行反应I+I-
噲垐��
I3
,从而导致后续反应无法进行;
2 2
(6)酸性条件下选择NaNO 为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则生成的无色气体
2
2I-+2NO-+4H+=I +2NO2H O
为NO,则“酸化氧化”时发生的反应为 2 2 2 ,该反应中NaNO 为氧化剂,与
2
NaI以1:1的比例进行反应,即还原1molNaI需要1mol NaNO ,为了使NaI充分反应,NaNO 与NaI的质
2 2
量比不能少于69:150=23:50,故答案为:23:50。
13 / 14
学科网(北京)股份有限公司14 / 14
学科网(北京)股份有限公司