文档内容
班级 姓名 学号 分数
第 08 单元 化学与可持续发展
(B 卷•提升能力)
(时间:75分钟,满分:100分)
一、选择题(本题共18小题,每小题3分,共54分)
1.能作防腐剂又能用调味剂的物质是
A.甲醛 B.苏打 C.食盐 D.亚硝酸钠
【答案】C
【解析】A.甲醛有毒,不能作调味剂,A错误;
B.苏打是碳酸钠,不能作防腐剂,也不能作调味剂,B错误;
C.食盐是氯化钠,可以杀菌,既能作防腐剂,也能作调味剂,C正确;
D.亚硝酸钠是一种常用的食品添加剂,具有防腐和增色作用,但不是调味剂,D错误;
故选C。
2.下列有关化肥施用的说法正确的是
①为保证农作物高产应大量施用化肥
②为减少对环境造成的污染施肥越少越好
③根据土壤的酸碱性和农作物生长选择化肥种类
④根据化肥本身的性质确定施肥方法
A.①③④ B.③④ C.②③④ D.②③
【答案】B
【解析】①化肥可提高农作物产量,但应合理使用,①错误;
②化肥应合理使用,过多、过少都不好,②错误;
③要根据土壤结构、土壤的酸碱性以及农作物的生长选择化肥种类,③正确;
④要根据化肥本身的性质确定施肥方法,如硝酸铵的含氮量较高,施用时要防止烧苗,④正确;
综上分析,正确的为③④,答案选B。
3.近年来,食品安全问题越来越引起社会的广泛关注,下列做法你认为合理的是( )
A.在鸭子的饲料中添加苏丹红,可以产出蛋黄特红的红心鸭蛋
B.我国应禁止使用味精
C.为了提高奶制品中蛋白质的含量添加三聚氰胺
1 / 15
学科网(北京)股份有限公司D.在食品包装袋里加一小包氧化亚铁防止食品被氧化
【答案】D
【详解】A.苏丹红是有毒物质,A不合理;
B.味精是一种常用的增味剂,合理使用味精能提高食物的鲜味,B不合理;
C.三聚氰胺是化工原料,不能用作食品添加剂,C不合理;
D.氧化亚铁能与包装袋内的氧气发生反应,从而防止食品被氧化,D合理;
答案为D。
4.汽车尾气中的污染物有固体悬浮微粒、一氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等。下
列说法中正确的是
A.固体悬浮微粒是造成雾霾天气的一种重要因素
B.一氧化碳、氮氧化物是酸雨形成的主要因素
C.含铅化合物没有毒性
D.汽车尾气中主要有毒物质是SO
2
【答案】A
【解析】A.固体悬浮微粒悬浮在空中,会引发雾霾天气,A正确;
B.酸雨的形成与一氧化碳无关,SO 、氮氧化物是酸雨形成的主要因素,B错误;
2
C.含铅化合物是重金属化合物,是有毒性的,能够造成重金属污染,C错误;
D.汽车尾气中主要有毒物质是氮氧化物,D错误;
故答案为:A。
5.2022年4月22日是第53个世界地球日,其主旨是提高民众对现有环境问题的意识,通过绿色低碳生活,
改善地球的整体环境。下列做法符合这一主旨的是
A.垃圾分类处理,实现资源的再利用 B.城市街道中的落叶就地焚烧,以改善城市环境
C.废旧电池掩埋处理,可以节约处理费用 D.施用大量农药,提高农作物的产量
【答案】A
【解析】A.垃圾分类处理,实现资源的再利用,有利于改善环境,A符合题意;
B.落叶就地焚烧易产生有害气体,污染空气,B不符合题意;
C.废旧电池含有重金属,直接掩埋处理会造成土壤污染,C不符合题意;
D.施用大量农药,会造成地下水的污染,D不符合题意;
答案选A。
6.下列说法错误的是
A.活泼金属钠的冶炼是通过电解其盐溶液制得
2 / 15
学科网(北京)股份有限公司B.对废旧金属的最好处理方法是回收、再利用
C.提炼金属要经过矿石的富集、冶炼、精炼三步
D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
【答案】A
【解析】A.活泼金属钠的冶炼是通过电解熔融的NaCl制得。若电解盐溶液,由于H+放电能力比Na+强,
不能发生产生H,A错误;
2
B.废旧金属进行回收、利用,可以节约大量矿产资源,同时也可以节省大量能量,也会减少对环境的污
染,故对废旧金属的最好处理方法是回收、再利用,B正确;
C.根据金属提炼步骤分析,先要富集提高金属元素的含量,然后冶炼得到粗产品,最后再进行精炼,C
正确;
D.还原剂有焦炭、一氧化碳、氢气或活泼金属等常用作金属冶炼时的还原剂,D正确;
故合理选项是A。
7.下列各组金属最适合用H 或CO把它从化合物中还原出来的是
2
A.K、Mg B.Fe、Al C.Fe、Cu D.Hg、Ag
【答案】C
【详解】金属的冶炼方法与金属活动性强弱有关。在金属活动性顺序表中,排在最前边的K、Ca、Na、
Mg、Al用电解方法冶炼;
在Al之后到Cu,包括Cu,采用热还原方法冶炼;
在Cu之后的金属用热分解方法冶炼;
对选项的金属进行观察可知:能够用H 或CO把它从化合物中还原出来的是Fe和Cu,故合理选项是C;
2
答案选C。
8.下列关于金属冶炼的说法正确的是
A.电解饱和食盐水制取钠 B.热还原法制取汞、银
C.利用铝热反应制取钒、铬、锰 D.利用热分解法制取铜
【答案】C
【解析】A.电解饱和食盐水得到氢氧化钠、氢气和氯气,得不到金属钠,可利用电解熔融氯化钠制取金
属钠,A错误;
B.利用热分解法制取汞、银,即加热氧化汞分解制取汞,加热氧化银分解制取银,B错误;
C.铝是较活泼的金属,具有较强的还原性,可利用铝热反应制取钒、铬、锰,C正确;
D.利用热还原法制取铜,即用一氧化碳或氢气还原氧化铜制取铜,D错误;
答案选C。
3 / 15
学科网(北京)股份有限公司9.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO 全部通入足量澄清石灰水中,得
2
到0.75 g的沉淀。这种铁的氧化物的化学式是( )
A.FeO B.Fe O
2 3
C.Fe O D.FeO和Fe O
3 4 2 3
【答案】B
【解析】CO和铁的氧化物反应时,氧化物中的一个氧原子可以生成一个CO 分子,每一个CO 分子可以
2 2
生成一个CaCO 分子,所以有下列的关系式,假设0.4 g该氧化物中含O的质量为x
3
O~CO~CaCO
2 3
16 100
x 0.75 g
解得x=0.12 g
n(Fe)∶n(O)=∶=2∶3。
10.若将海水淡化后的水作为饮用水使用,下列方法在原理上完全不可行的是( )
A.利用太阳能使海水蒸馏淡化
B.加明矾使海水中的盐分沉淀而淡化
C.将海水缓慢凝固以获得淡化的饮用水
D.海水通过离子交换树脂,以除去所含杂质离子
【答案】B
【解析】明矾净水是利用Al3+水解生成的Al(OH) 胶体的吸附作用而除去水中的一些悬浮物,并不能除去
3
海水中的多数杂质离子而使海水淡化,B项不可行;利用太阳能使海水蒸馏淡化,是极有研究价值的一种
淡化途径。海水缓慢凝固后可结成冰,在这个过程中可以除去海水中的杂质离子而使海水淡化。将海水通
过离子交换树脂是一种已被应用的海水淡化方法。
11.某课外小组将灼烧的海带灰浸泡后过滤,得到澄清的滤液,他们设计了如下几个方案,你认为能证明
灼烧的海带灰中含有碘元素的是( )
A.取适量滤液,蒸干,观察是否有紫黑色固体生成
B.取适量滤液,加入酸化的HO 溶液,再加入淀粉溶液,呈蓝色,证明含有碘元素
2 2
C.取适量滤液,向其中加入淀粉溶液,无明显现象,证明不含碘元素
D.取适量滤液,加入苯,振荡、静置,苯层无色,证明不含碘元素
【答案】B
【解析】海带灰中碘元素以I-形式存在,应先加入氧化剂将其氧化为I,再加入淀粉溶液检验。
2
12.下列关于煤气、液化石油气和天然气的说法正确的是 ( )
4 / 15
学科网(北京)股份有限公司A.煤气主要成分是氢气、甲烷、乙烯和一氧化碳
B.液化石油气是将甲烷压缩后成为液态的燃料
C.北京奥运会“祥云”火炬和家用打火机所用燃料均为丙烷,它是液化石油气的成分之一
D.家用液化石油气与天然气成分相同,但纯度不同
【答案】C
【解析】焦炉气的主要成分为氢气、甲烷、乙烯和一氧化碳,而煤气的主要成分则为氢气和一氧化碳,A错;
液化石油气的主要成分为丙烷和丁烷,B、D错误。
13.下列关于化石燃料的加工说法正确的是( )
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
【答案】C
【解析】石油裂化主要得到更多的液态轻质油,A错误;石油的分馏是指在加热条件下将石油分成不同沸
点范围的产物的过程属于物理变化,B错误;煤的干馏是将煤隔绝空气加强热的过程,其产物有焦炭、煤
焦油、粗氨水和焦炉气,C正确;由煤制取煤气的过程中,煤中的碳与水蒸气反应生成一氧化碳和氢气,
两者的混合物被称为“水煤气”,这个过程发生的是化学变化,D错误。
14.下列属于物理变化的是
①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯制备聚乙烯 ⑥将氧气转化为臭氧
⑦乙烯催熟果实 ⑧将苯加入溴水中 ⑨海水蒸馏制取淡水
A.①②③④ B.①②⑤⑦ C.①⑧⑨ D.①②⑥⑨
【答案】C
【解析】有新物质生成的变化为化学变化,没有新物质生成的变化为物理变化,化学变化与物理变化的本
质区别在于有无新物质生成,据此抓住化学变化和物理变化的区别结合事实进行分析判断即可。
①石油的分馏是利用物质沸点不同将各馏分分离开来,没有新物质生成,为物理变化;
②煤的干馏是指将煤隔绝空气加强热使之分解的过程,有新物质生成,属于化学变化;
③石油的裂化是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较
低的烃的过程,有新物质生成,属于化学变化;
④铝热反应为铝与某些金属氧化物高温下发生的置换反应,有新物质生成,属于化学变化;
⑤由乙烯制备聚乙烯,有新物质聚乙烯生成,属于化学变化;
⑥氧气转变为臭氧,有新物质臭氧生成,属于化学变化;
5 / 15
学科网(北京)股份有限公司⑦乙烯催熟果实,有新物质生成,属于化学变化;
⑧将苯加入溴水中,苯将溴从溴水中萃取出来,没有新物质生成,为物理变化;
⑨海水蒸馏制取淡水,只是分离混合物,没有新物质生成,为物理变化;
综上分析,属于物理变化的有①⑧⑨,答案选C。
15.有关煤的综合利用如图所示。下列说法正确的是
A.①是将煤在空气中加强热使其分解的过程
B.煤中含有苯、甲苯、二甲苯等有机物,可通过分馏获得苯
C.②是放热的过程
D.B为甲醇或乙酸时,原子利用率均可达到100%
【答案】D
【解析】A.①是煤的干馏,即煤在隔绝空气的情况下加强热的过程称为煤的干馏,A错误;
B.煤是由无机物和有机物组成的复杂的混合物,通过干馏得到苯、甲苯、二甲苯等有机物,B错误;
C.反应②是碳和水蒸气反应生成一氧化碳和氢气,为吸热反应,C错误;
催化剂 催化剂
D.根据CO+2H CHOH,2CO+2H CHCOOH,可知原子全部转化为想要的生成物,利用率
2 3 2 3
均达到100%,D正确;
故选D。
16.海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法不正确的是
A.在工业上,试剂1一般选用石灰乳
B.海水提溴的方法是“空气吹出法”,包括氧化、吹出、吸收等环节
6 / 15
学科网(北京)股份有限公司C.在工业上,电解熔融MgCl 冶炼金属镁
2
D.在粗盐提纯中,应先加盐酸调pH值,再加沉淀剂除杂质
【答案】D
【解析】海水提纯可得到粗盐,苦卤中加入稀硫酸、氯气,发生反应:Cl+2Br-=2Cl-+Br ,经富集,可蒸
2 2
馏分离出溴,分离后的溶液中含有钾离子、镁离子,加入试剂1得到氢氧化镁沉淀,试剂1可为石灰乳。
A.煅烧贝壳得到氧化钙,氧化钙溶于水得到石灰乳,工业上,一般采用石灰乳作为镁离子的沉淀剂,因
为石灰乳廉价且原料来源广泛,可就地取材制备石灰乳,A正确;
B.工业上常采用“空气吹出法”进行海水提溴,包括氧化:用氯气氧化海水中的溴离子,吹出:用空气
将生成的溴吹出,吸收:用二氧化硫作还原剂使溴转化为氢溴酸,使其与空气分离,再利用氯气将氢溴酸
氧化为溴后蒸馏分离,B正确;
C.镁的活动性较强,工业上常采用电解熔融氯化镁的方法冶炼金属镁,C正确;
D.粗盐提纯中,加氯化钡、碳酸钠、氢氧化钠除杂,过滤后滤液含碳酸钠、氢氧化钠,再加盐酸调节pH
值,不能先加盐酸,D错误;
答案选D。
17.饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶:
上述过程说法错误的是
A.操作①利用了物质的溶解性
B.操作②为过滤
C.操作③封口的目的是隔绝空气
D.抗氧化剂作为食品添加剂,可大量添加以延长饮料茶的保质期
【答案】D
【详解】A.成品茶中加入热水,利用其溶解度随着温度升高而增大的原理,A正确;
B.茶叶有不溶物,通过过滤分离除去茶渣,B正确;
C.封罐可以隔绝空气,防止氧化变质,C正确;
D.抗氧化剂能延长茶的保质期,但不能大量使用,D错误;
故选D。
CuFeS
18.有人提出利用黄铜矿(主要成分为 2)冶炼铜的炉渣冶炼铁。黄铜矿冶炼铜的步骤大致可分为:
7 / 15
学科网(北京)股份有限公司①富集,将硫化物矿石进行浮选;
高温
2CuFeS +4O CuS+3SO+2FeO
②焙烧,主要反应为 2 2 2 2 (炉渣);
1200C
2Cu S3O 2Cu O2SO
③制粗铜,1200℃发生的主要反应为 2 2 2 2,
1200C
2Cu OCu S 6CuSO
2 2 2;
④电解精炼铜。
下列判断不正确的是
A.利用冶炼铜的炉渣可冶炼铁
6molCu 12molO
B.不计损耗时,冶炼出 ,共消耗 2
O Cu O Cu S
C.反应③中氧化剂为 2、 2 、 2
D.黄铜矿冶炼铜产生的尾气可造成酸雨
【答案】B
FeO FeO Fe
【详解】A.炉渣的主要成分为 ,利用 可冶炼出 ,故A正确;
B.由反应过程可知 6CuFeS 2 12O 2 ~3Cu 2 S~3O 2 ~6Cu ,故不计损耗时,冶炼出 6 molCu ,共消耗
O (123)mol15mol
2的物质的量为( ,故B错误;
O Cu O Cu S
C.分析反应③中各种元素的价态变化可知, 2、 2 、 2 均作氧化剂,故C正确;
SO
D.由反应原理可知,产生的尾气主要成分为 2可造成酸雨,故D正确;
答案选B。
二、非选择题(本题共4小题,共46分)
19.(11分)工业上用铝土矿(主要成分为A1 O,还有少量的Fe O,SiO 等杂质)提取氧化铝作冶炼铝
2 3 2 3 2
的原料,提取的操作过程如下:
8 / 15
学科网(北京)股份有限公司(1)I和II步骤中分离溶液和沉淀的操作是:_______;
(2)沉淀M中除含有泥沙外,一定还含有_______,固体N是_______;
(3)滤液X中,含铝元素的溶质的化学式为_______,它属于_______(填“酸”、“碱”或“盐”)类物质;
(4)请写出步骤Ⅱ的相关方程式_______;
(5)实验室里常往AlCl 溶液中加入_______(填“氨水”或“NaOH溶液”)来制取A1(OH) 。
3 3
【答案】(1)过滤
(2) Fe O Al O
2 3 2 3
(3) NaAlO 盐
2
(4)NaAlO +CO +2H O=Al(OH) ↓+NaHCO
2 2 2 3 3
(5)氨水
【解析】铝土矿中加浓NaOH溶液,Al O 和SiO 能和NaOH溶液反应生成溶于水的盐,Fe O 不反应,过
2 3 2 2 3
滤后在沉淀M中。滤液中通入二氧化碳气体,控制一定的反应条件,使 NaAlO 反应生成沉淀Al(OH) ,
2 3
而NaSiO 不反应,得到的沉淀Al(OH) 加热分解得到氧化铝。
2 3 3
(1)分离沉淀和溶液的操作是过滤。
(2)由以上分析可知,沉淀M中有Fe O,固体N是Al O。
2 3 2 3
(3)AlO 和NaOH反应生成溶于水的NaAlO ,则滤液X中含铝元素的溶质为NaAlO ,它是由金属离子和
2 3 2 2
酸根离子组成的盐。
(4)步骤Ⅱ发生了NaAlO 和CO、HO的反应,化学方程式为:2NaAlO +CO +3H O=2Al(OH) ↓+Na CO。
2 2 2 2 2 2 3 2 3
(5)向AlCl 溶液中加入氨水可以制取Al(OH) ,不用AlCl 和NaOH反应,因为生成的Al(OH) 是两性氢氧
3 3 3 3
化物,会溶于过量的强碱。
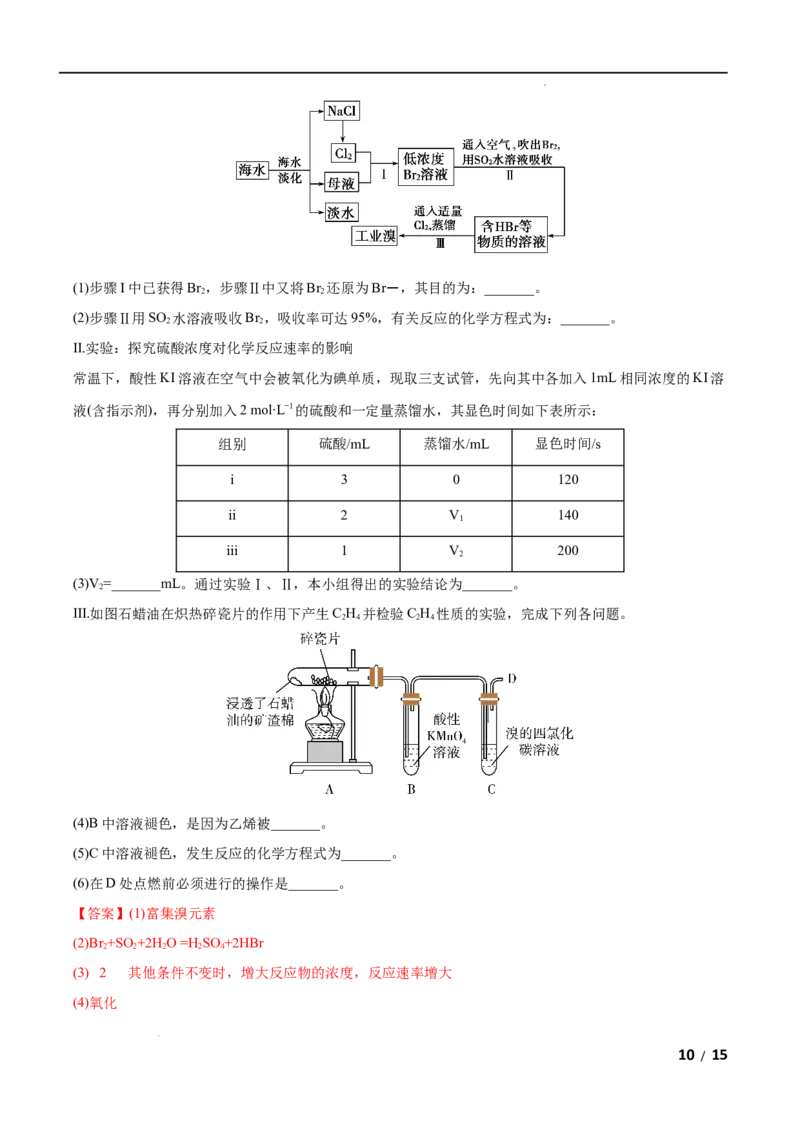
20.(12分)海洋是巨大的资源宝库,可以提取到我们需要的食盐、溴和碘。
I.从海水中提取食盐和溴的过程如下:
9 / 15
学科网(北京)股份有限公司(1)步骤I中已获得Br ,步骤Ⅱ中又将Br 还原为Br-,其目的为:_______。
2 2
(2)步骤Ⅱ用SO 水溶液吸收Br ,吸收率可达95%,有关反应的化学方程式为:_______。
2 2
Ⅱ.实验:探究硫酸浓度对化学反应速率的影响
常温下,酸性KI溶液在空气中会被氧化为碘单质,现取三支试管,先向其中各加入1mL相同浓度的KI溶
液(含指示剂),再分别加入2 mol∙L−1的硫酸和一定量蒸馏水,其显色时间如下表所示:
组别 硫酸/mL 蒸馏水/mL 显色时间/s
i 3 0 120
ii 2 V 140
1
iii 1 V 200
2
(3)V =_______mL。通过实验Ⅰ、Ⅱ,本小组得出的实验结论为_______。
2
Ⅲ.如图石蜡油在炽热碎瓷片的作用下产生C H 并检验C H 性质的实验,完成下列各问题。
2 4 2 4
(4)B中溶液褪色,是因为乙烯被_______。
(5)C中溶液褪色,发生反应的化学方程式为_______。
(6)在D处点燃前必须进行的操作是_______。
【答案】(1)富集溴元素
(2)Br +SO+2H O =H SO +2HBr
2 2 2 2 4
(3) 2 其他条件不变时,增大反应物的浓度,反应速率增大
(4)氧化
10 / 15
学科网(北京)股份有限公司(5)CH =CH +Br →
2 2 2
(6)检验乙烯的纯度
【解析】海水提取溴单质,主要先浓缩海水得到,将氯气通入到海水中得到低浓度的Br 溶液,再用热空
2
气吹出,再用二氧化硫水溶液吸收,得到含HBr的溶液,再用氯气氧化得到工业溴。
探究硫酸浓度对化学反应速率的影响,要固定变量,只能改变其中一个变量,其他量不能变。
石蜡油在炽热碎瓷片的作用下产生C H,乙烯能使溴水、酸性高锰酸钾溶液褪色,前者发生加成反应,后
2 4
者发生氧化反应。
(1)步骤I中已获得Br ,但得到的是低浓度的Br 溶液,步骤Ⅱ中又将Br 还原为Br-,其目的为富集溴元
2 2 2
素;故答案为:富集溴元素。
(2)步骤Ⅱ用SO 水溶液吸收Br ,吸收率可达95%,两者反应生成硫酸和氢溴酸,则有关反应的化学方程
2 2
式为:Br +SO+2H O =H SO +2HBr;故答案为:Br +SO+2H O =H SO +2HBr。
2 2 2 2 4 2 2 2 2 4
(3)要使得KI的浓度一定,因此混合后溶液的总体积相同才能使得KI的浓度相等,因此V=3+0−1=2mL,
2
V=1mL,那句表格分析实验Ⅰ、Ⅱ,KI浓度相同,而硫酸浓度不同即酸性不同,酸性越强,是显色时间
1
越短,反应速率越快,则本小组得出的实验结论为其他条件不变时,增大反应物的浓度,反应速率增大;
故答案为:2;其他条件不变时,增大反应物的浓度,反应速率增大。
(4)B中溶液褪色,是因为乙烯被被酸性高锰酸钾氧化而褪色;故答案为:氧化。
(5)C中溶液褪色是乙烯和溴水发生加成反应而褪色,其发生反应的化学方程式为CH=CH +Br →
2 2 2
;故答案为:CH=CH +Br → 。
2 2 2
(6)在D处点燃前必须进行的操作是检验乙烯的纯度;故答案为:检验乙烯的纯度。
21.(13分)煤是一种常用的燃料,由于煤燃烧产生的废气中含有SO 、NO 和NO等多种有害气体和烟
2 2
尘,会对环境造成污染,因此需要对煤进行加工后再燃烧或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出煤燃烧废气中有关物质转化为硝酸的化学方程式:_______、_______。
②下列关于硝酸型酸雨的说法,其中没有道理的是_______ ( 填序号) 。
a.使水中的浮游生物致死,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
11 / 15
学科网(北京)股份有限公司c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
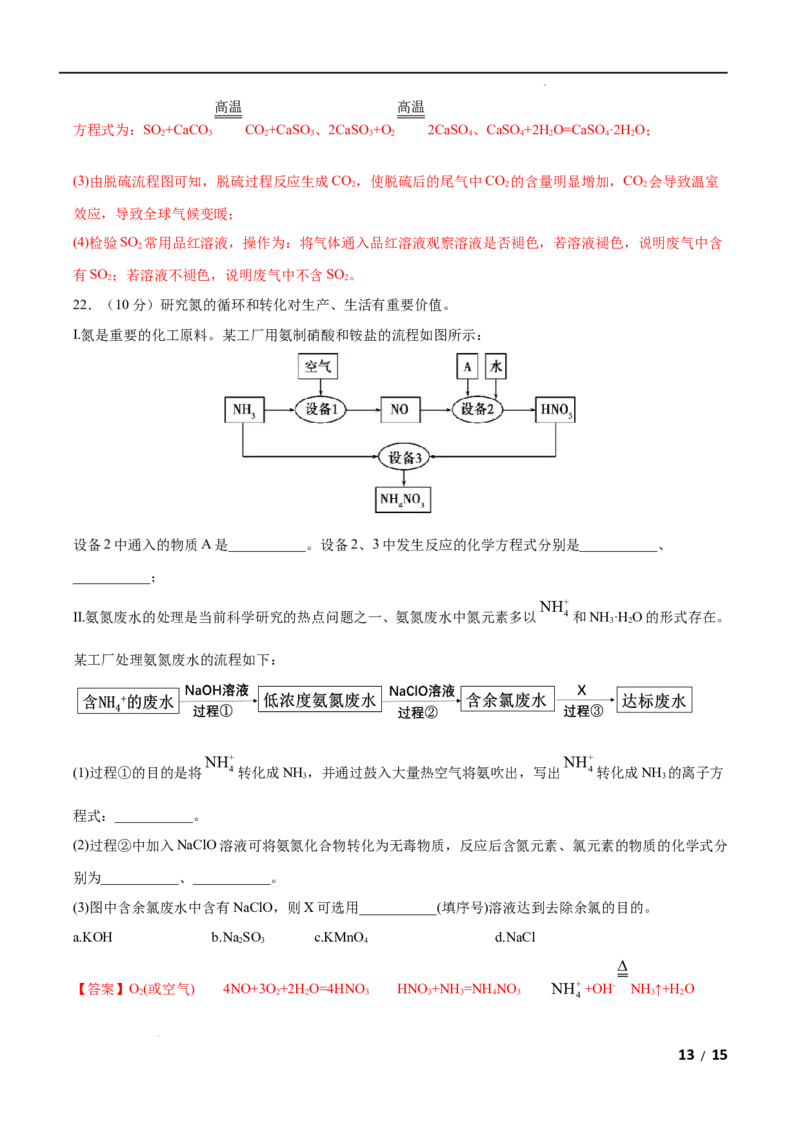
(2)对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图如图,试结合图中信息分别写出废气脱硫并形
成副产物(CaSO、CaSO 和石膏)的过程中所发生的主要化学反应的化学方程式:
3 4
①_______;
②_______;
③_______。
(3)脱硫以后,在废气中含量明显增加的气体是_______(写物质名称),它对环境的负面影响是_______。
(4)检验脱硫后废气中是否含有SO 的简单方法是_______。
2
【答案】(1) 2NO+O=2NO 3NO +H O=2HNO +NO c
2 2 2 2 3
高温 高温
(2) SO +CaCO CO+CaSO 2CaSO+O 2CaSO CaSO+2H O=CaSO·2H O
2 3 2 3 3 2 4 4 2 4 2
(3) CO 使“温室效应”加剧,导致全球气候变暖
2
(4)将气体通入品红溶液观察溶液是否褪色,若溶液褪色,说明废气中含有SO ;若溶液不褪色,说明废气
2
中不含SO 。
2
【解析】(1)①煤燃烧废气中NO与O 反应产生NO ,NO 溶于水反应产生HNO,有关物质转化为硝酸的
2 2 2 3
化学方程式为:2NO+O =2NO,3NO +H O=2HNO +NO;
2 2 2 2 3
②a.硝酸是强酸,具有强氧化性,能杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统,a
正确;b.硝酸具有酸性,电线,铁轨,桥梁,含有金属铁等,它们能和硝酸反应,房屋含有金属和硅酸
盐,它们也能和硝酸反应,会造成严重损害,b正确;c.导致臭氧层空洞的是氟氯烃,不是硝酸,c错误;
d.硝酸中含有氮元素,硝酸与土壤中的矿物质发生作用转化为硝酸盐,可向植物提供氮肥,d正确;
故合理选项是c;
(2)由脱硫流程图可知:脱硫过程中SO 和CaCO 反应生成CO 和CaSO,CaSO 在空气中不稳定,很容易
2 3 2 3 3
转化为CaSO,进而形成副产物石膏CaSO·2H O,则脱硫并形成副产物的过程中所发生的主要反应的化学
4 4 2
12 / 15
学科网(北京)股份有限公司高温 高温
方程式为:SO +CaCO CO+CaSO 、2CaSO+O 2CaSO、CaSO+2H O=CaSO·2H O;
2 3 2 3 3 2 4 4 2 4 2
(3)由脱硫流程图可知,脱硫过程反应生成CO,使脱硫后的尾气中CO 的含量明显增加,CO 会导致温室
2 2 2
效应,导致全球气候变暖;
(4)检验SO 常用品红溶液,操作为:将气体通入品红溶液观察溶液是否褪色,若溶液褪色,说明废气中含
2
有SO ;若溶液不褪色,说明废气中不含SO 。
2 2
22.(10分)研究氮的循环和转化对生产、生活有重要价值。
Ⅰ.氮是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示:
设备2中通入的物质A是___________。设备2、3中发生反应的化学方程式分别是___________、
___________;
NH+
Ⅱ.氨氮废水的处理是当前科学研究的热点问题之一、氨氮废水中氮元素多以 4和NH ·H O的形式存在。
3 2
某工厂处理氨氮废水的流程如下:
NH+ NH+
(1)过程①的目的是将 4转化成NH ,并通过鼓入大量热空气将氨吹出,写出 4转化成NH 的离子方
3 3
程式:___________。
(2)过程②中加入NaClO溶液可将氨氮化合物转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分
别为___________、___________。
(3)图中含余氯废水中含有NaClO,则X可选用___________(填序号)溶液达到去除余氯的目的。
a.KOH b.Na SO c.KMnO d.NaCl
2 3 4
【答案】O(或空气) 4NO+3O +2H O=4HNO HNO+NH=NHNO NH++OH- NH ↑+H O
2 2 2 3 3 3 4 3 4 3 2
13 / 15
学科网(北京)股份有限公司N NaCl b
2
【分析】I.氨气和氧气通入设备1中,在该设备中氨气被催化氧化生成NO和水;之后进入设备2,得到
硝酸,NO被氧化,则A为应为氧气;硝酸进入设备3和氨气反应生成硝酸铵。
II.含铵根的废水和NaOH溶液反应生成NH ,之后将铵根浓度较低的废水与NaClO溶液混合,NaClO具
3
有强氧化性,将-3价的N元素氧化无毒的N,自身被还原成Cl-;再添加适量的还原剂将过量的次氯酸钠
2
除去,得到达标废水。
【详解】I.根据分析可知NO转化为硝酸,需要氧化剂,则设备2中通入的物质A是O(或空气);设备2
2
中发生的反应为:4NO+3O +2H O=4HNO ,设备3中硝酸与氨气发生反应生成硝酸铵,其化学方程式为:
2 2 3
HNO+NH=NHNO ,故答案为:O(或空气);4NO+3O +2H O=4HNO ;HNO+NH=NHNO ;
3 3 4 3 2 2 2 3 3 3 4 3
+
II.(1)过程①的目的是将NH +转化为NH ,并通过鼓入大量空气将氨气吹出,使NH4转化为NH ,反应的
4 3 3
离子方程式为NH++OH- NH ↑+H O;
4 3 2
(2)根据分析可知,过程②加入NaClO溶液可将氨氮转化为无毒物质,反应的方程式为:3NaClO+
2NH =3NaCl+N +3H O,所以含氮元素、氯元素的物质化学式为N、NaCl;
3 2 2 2
(3)根据分析可知X应为还原剂,a.KOH为碱性溶液,不符合题意;b.NaCl和次氯酸反应生成有毒的氯气,
不符合题意;c.高锰酸钾为强氧化剂,不符合题意; d.NaSO 有较强还原性,且产物无污染,符合题意;
2 3
故答案选b。
14 / 15
学科网(北京)股份有限公司15 / 15
学科网(北京)股份有限公司