文档内容
1994 年福建高考化学真题及答案
可能用到的数据
相对原子质量(原子量):H-1C-12 N-14 O-16
Na-23 Mg-24 Al-27 Cl-35.5
K-39Ca-40 Cu-64 Ag-108
一、选择题(本题包括5小题,每小题2分,共10分,每小题只有一个选项符合题
意)
1.下列气体不会造成大气污染的是( )
(A)二氧化硫 (B)氮气 (C)一氧化碳 (D)一氧化氮
2.少量下列化学药品应保存水里的是( )
(A)金属钾 (B)白磷 (C)硫磺 (D)苯
3.锌钡白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是( )
(A)ZnCO和BaCl (B)ZnCl和BaCO
3 2 2 3
(C)ZnS和BaSO (D)ZnCO和Ba(NO)
4 3 3 2
4.下列反应起了氮的固定作用的是 ( )
(A)N与H在一定条件下反应生成NH (B)NO与O反应生成NO
2 2 3 2 2
(C)NH经催化氧化生成NO (D)由NH制碳铵和硫铵
3 3
5.下列物质中,导电性能最差的是( )
(A)熔融氢氧化钠 (B)石墨棒 (C)盐酸溶液 (D)固态氯化钾
二、选择题(本题包括14小题,第每小题3分,共42分,每小题有一个或两个选项符
合题意,若正确答案只包括一个选项,多选,该题为0分,若若正确答案包括两个选
项,只选一个且正确的给1分,选两个且正确的给3分.但只要选错一个,该小题就为0
分.)
m+ n-
6.已知元素X、Y的核电荷数分别是a和b,它们的离子X 和Y 的核外电子排布相
同,则下列关系式正确的是 ( )
(A)a=b+m+n(B)a=b-m+n (C)a=b+m-n (D)a=b-m-n
7.分别燃烧下列各组物质中的两种有机化合物,所得CO 和HO的物质的量之比相
2 2
同的有( )
(A)乙烯、丁二烯 (B)乙醇、乙醚(CH—O—CH)
2 5 2 5
(C)苯、苯酚 (D)醋酸、葡萄糖
8.下列说法正确的是( )
(A)漂白粉的有效成份是氯酸钠 (B)氟化氢在空气中呈现白雾,这种白雾有剧毒
(C)碘化钾水溶液能使淀粉变蓝 (D)氟气通入水中有氧气生成
9.下列反应适用于实验室制备氧气的是 ( )
(A)只有① (B)①和② (C)①和③ (D)①③④
10.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的
总量,可向盐酸中加入适量的( )
(A)NaOH(固体) (B)HO (C)NHCl(固体) (D)CHCOONa(固体)
2 4 3
11.在氯化铵溶液中,下列关系式正确的是( )
A.c(Cl-) >c(NH+) >c(H+) >c(OH-)
4
B.c(NH+)>c(Cl-) >c(H+) >c(OH-)
4
C.c(NH+)=c(Cl-) >c(H+) =c(OH-)
4
第1页 | 共7页D.c(NH+)=c(Cl-) >c(H+) >c(OH-)
4
12.设N代表阿佛加德罗常数的值,下列说法正确的是( )
A
(A)2.4g金属镁变成镁离子时失去的电子数目为0.1N
A
(B)2g氢气所含原子数目为N
A
5
(C)在25℃,压强为1.01×10 Pa时,11.2升氮气所含的原子数目为N
A
(D)17g氨气所含电子数目为10N
A
13.在Ph=1的无色透明溶液中不能大量共存的离子组是( )
A.Al3+ Ag+ NO- Cl- B.Mg2+ NH+ NO- Cl-
3 4 3
C.Ba2+ K+ S2- Cl- D.Zn2+ Na + NO- SO2-
3 4
14. 下列离子方程式不正确的是( )
(A)碳酸氢钙溶液跟盐酸反应:
Ca(HCO) +2H + =Ca2++2HO+2CO↑
3 2 2 2
- -
(B)碘化钾溶液跟适量溴水反应: 2I +Br=I+2Br
2 2
+ -
(C)将金属钠加入水中: Na+2HO=Na +2OH +H↑
2 2
(D)将氯气通入氯化亚铁溶液中: 2Fe2++Cl=2Fe3++2Cl -
2
15.在一定温度下,向足量的饱和NaCO 溶液中加入1.06克无水NaCO,搅拌后静
2 3 2 3
置,最终所得晶体的质量 ( )
(A)等于1.06克 (B)大于1.06克而小于2.86克
(C)等于2.86克 (D)大于2.86克
16.X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶
解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化
性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为 ( )
(A)X>Z>Y>M(B)X>Y>Z>M
(C)M>Z>X>Y (D)X>Z>M>Y
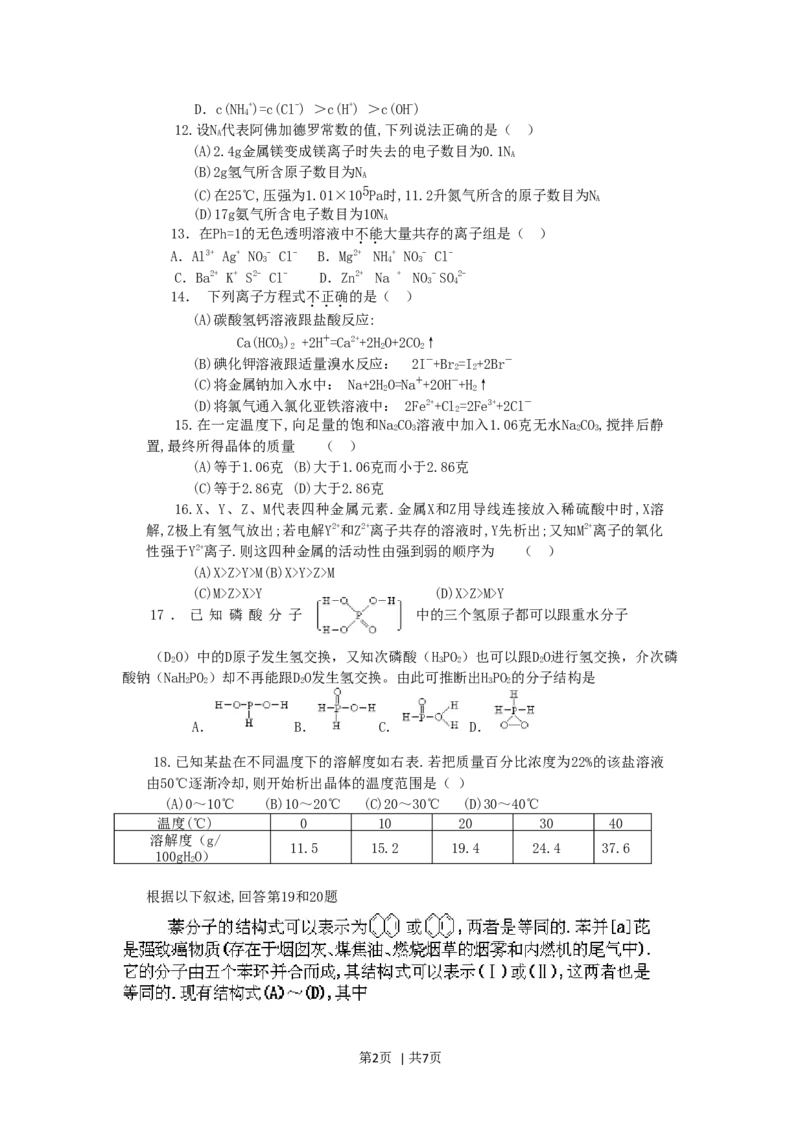
17 . 已 知 磷 酸 分 子 中的三个氢原子都可以跟重水分子
(DO)中的D原子发生氢交换,又知次磷酸(HPO)也可以跟DO进行氢交换,介次磷
2 3 2 2
酸钠(NaHPO)却不再能跟DO发生氢交换。由此可推断出HPO的分子结构是
2 2 2 3 2
A. B. C. D.
18.已知某盐在不同温度下的溶解度如右表.若把质量百分比浓度为22%的该盐溶液
由50℃逐渐冷却,则开始析出晶体的温度范围是( )
(A)0~10℃ (B)10~20℃ (C)20~30℃ (D)30~40℃
温度(℃) 0 10 20 30 40
溶解度(g/
11.5 15.2 19.4 24.4 37.6
100gHO)
2
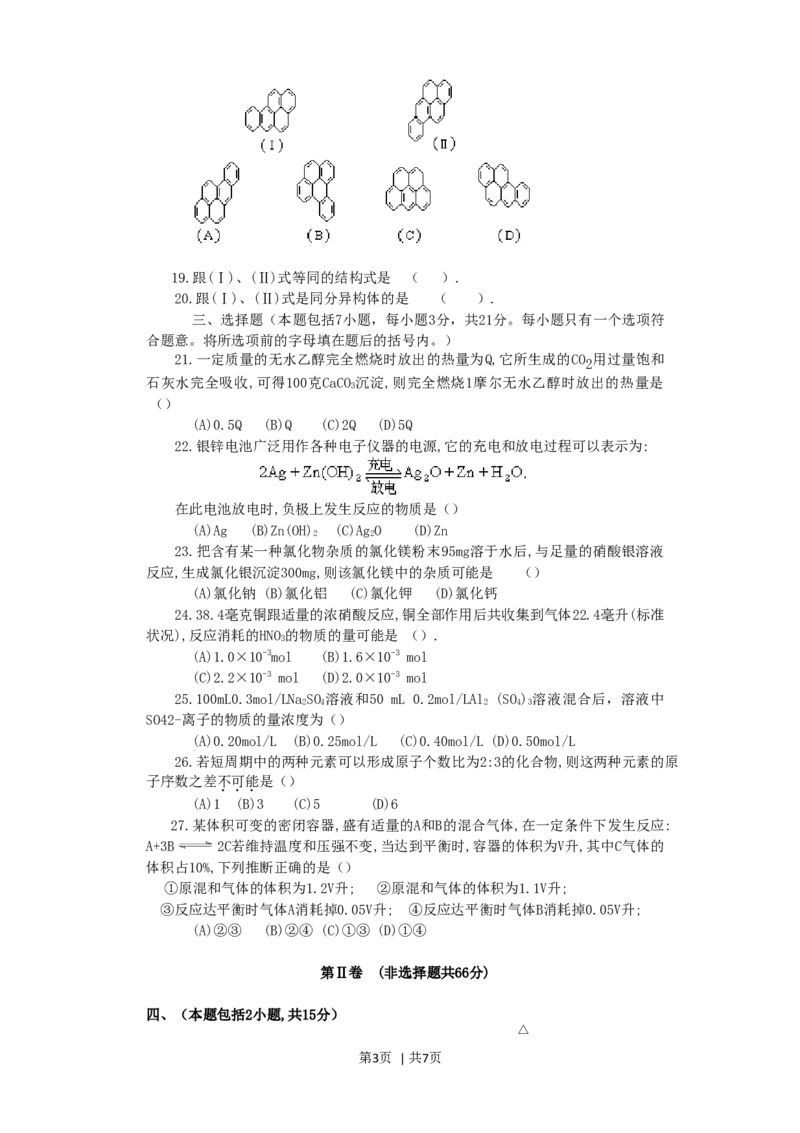
根据以下叙述,回答第19和20题
第2页 | 共7页19.跟(Ⅰ)、(Ⅱ)式等同的结构式是 ( ).
20.跟(Ⅰ)、(Ⅱ)式是同分异构体的是 ( ).
三、选择题(本题包括7小题,每小题3分,共21分。每小题只有一个选项符
合题意。将所选项前的字母填在题后的括号内。)
21.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO 用过量饱和
2
石灰水完全吸收,可得100克CaCO 沉淀,则完全燃烧1摩尔无水乙醇时放出的热量是
3
()
(A)0.5Q (B)Q (C)2Q (D)5Q
22.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是()
(A)Ag (B)Zn(OH) (C)AgO (D)Zn
2 2
23.把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的硝酸银溶液
反应,生成氯化银沉淀300mg,则该氯化镁中的杂质可能是 ()
(A)氯化钠 (B)氯化铝 (C)氯化钾 (D)氯化钙
24.38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4毫升(标准
状况),反应消耗的HNO的物质的量可能是 ().
3
(A)1.0×10-3mol (B)1.6×10-3 mol
(C)2.2×10-3 mol (D)2.0×10-3 mol
25.100mL0.3mol/LNaSO 溶液和50 mL 0.2mol/LAl (SO) 溶液混合后,溶液中
2 4 2 4 3
SO42-离子的物质的量浓度为()
(A)0.20mol/L (B)0.25mol/L (C)0.40mol/L (D)0.50mol/L
26.若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原
子序数之差不可能是()
(A)1 (B)3 (C)5 (D)6
27.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:
A+3B 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的
体积占10%,下列推断正确的是()
①原混和气体的体积为1.2V升; ②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升; ④反应达平衡时气体B消耗掉0.05V升;
(A)②③ (B)②④ (C)①③ (D)①④
第Ⅱ卷 (非选择题共66分)
四、(本题包括2小题,共15分)
△
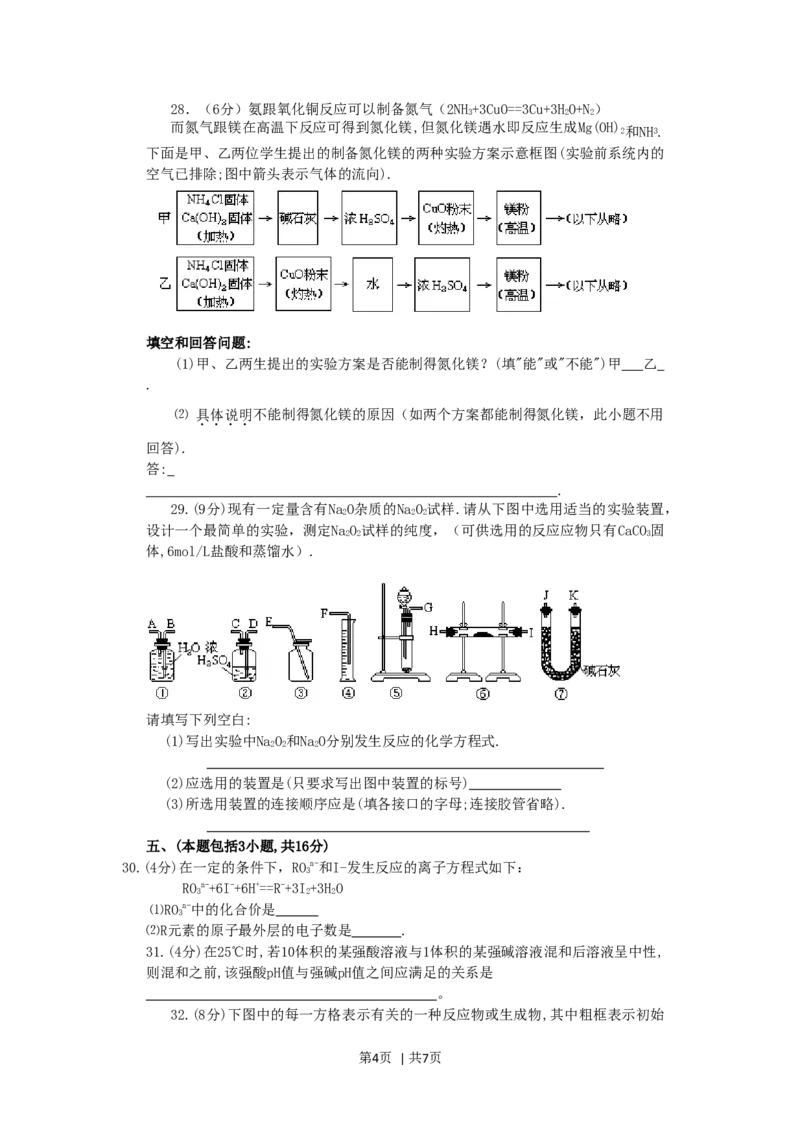
第3页 | 共7页28.(6分)氨跟氧化铜反应可以制备氮气(2NH+3CuO==3Cu+3HO+N)
3 2 2
而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即反应生成Mg(OH)
2和NH3.
下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的
空气已排除;图中箭头表示气体的流向).
填空和回答问题:
(1)甲、乙两生提出的实验方案是否能制得氮化镁?(填"能"或"不能")甲 乙
.
⑵ 具体说明不能制得氮化镁的原因(如两个方案都能制得氮化镁,此小题不用
回答).
答:
.
29.(9分)现有一定量含有NaO杂质的NaO 试样.请从下图中选用适当的实验装置,
2 2 2
设计一个最简单的实验,测定NaO 试样的纯度,(可供选用的反应应物只有CaCO 固
2 2 3
体,6mol/L盐酸和蒸馏水).
请填写下列空白:
(1)写出实验中NaO和NaO分别发生反应的化学方程式.
2 2 2
(2)应选用的装置是(只要求写出图中装置的标号)
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略).
五、(本题包括3小题,共16分)
30.(4分)在一定的条件下,ROn-和I-发生反应的离子方程式如下:
3
ROn-+6I-+6H+==R-+3I+3HO
3 2 2
⑴ROn-中的化合价是
3
⑵R元素的原子最外层的电子数是 .
31.(4分)在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,
则混和之前,该强酸pH值与强碱pH值之间应满足的关系是
。
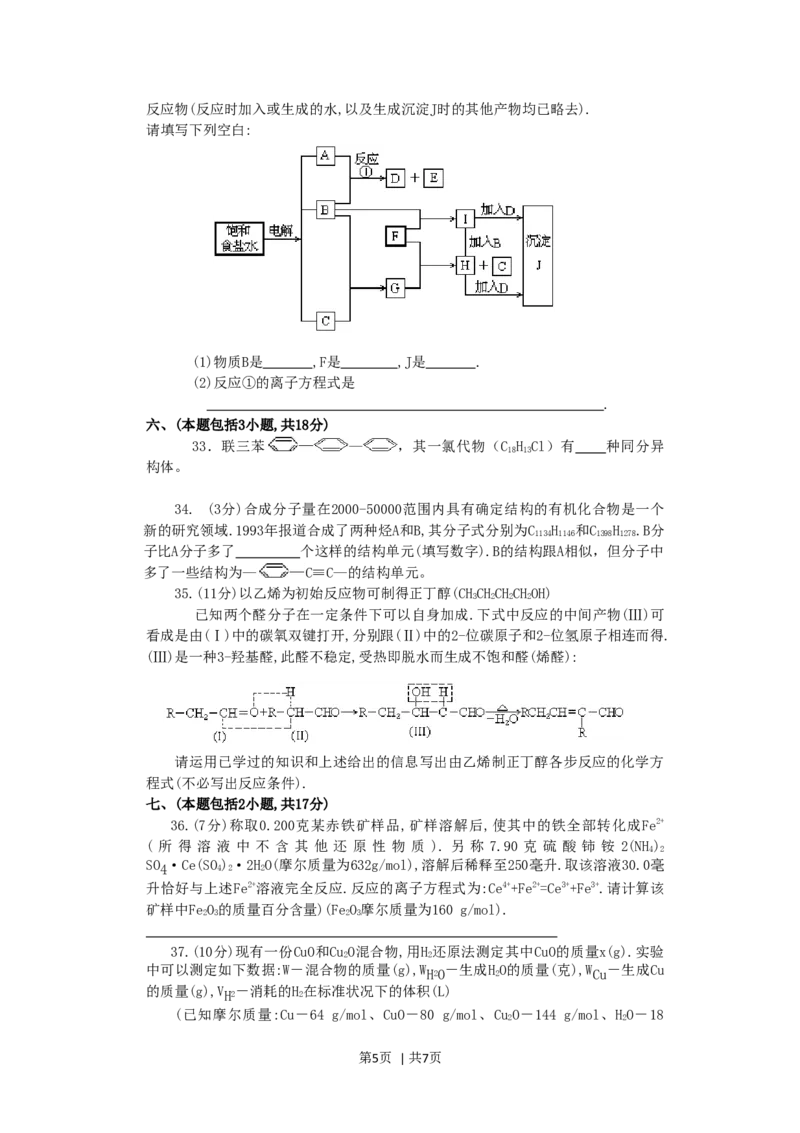
32.(8分)下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始
第4页 | 共7页反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).
请填写下列空白:
(1)物质B是 ,F是 ,J是 .
(2)反应①的离子方程式是
.
六、(本题包括3小题,共18分)
33.联三苯 — ,其一氯代物(C H Cl)有 种同分异
18 13
构体。
34. (3分)合成分子量在2000-50000范围内具有确定结构的有机化合物是一个
新的研究领域.1993年报道合成了两种烃A和B,其分子式分别为C H 和C H .B分
1134 1146 1398 1278
子比A分子多了 个这样的结构单元(填写数字).B的结构跟A相似,但分子中
多了一些结构为— C≡C—的结构单元。
35.(11分)以乙烯为初始反应物可制得正丁醇(CHCHCHCHOH)
3 2 2 2
已知两个醛分子在一定条件下可以自身加成.下式中反应的中间产物(Ⅲ)可
看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得.
(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方
程式(不必写出反应条件).
七、(本题包括2小题,共17分)
36.(7分)称取0.200克某赤铁矿样品,矿样溶解后,使其中的铁全部转化成Fe2+
( 所 得 溶 液 中 不 含 其 他 还 原 性 物 质 ). 另 称 7.90 克 硫 酸 铈 铵 2(NH)
4 2
SO ·Ce(SO)·2HO(摩尔质量为632g/mol),溶解后稀释至250毫升.取该溶液30.0毫
4 4 2 2
升恰好与上述Fe2+溶液完全反应.反应的离子方程式为:Ce4++Fe2+=Ce3++Fe3+.请计算该
矿样中FeO的质量百分含量)(FeO摩尔质量为160 g/mol).
2 3 2 3
37.(10分)现有一份CuO和CuO混合物,用H 还原法测定其中CuO的质量x(g).实验
2 2
中可以测定如下数据:W-混合物的质量(g),W -生成HO的质量(克),W -生成Cu
H2O 2 Cu
的质量(g),V -消耗的H在标准状况下的体积(L)
H2 2
(已知摩尔质量:Cu-64 g/mol、CuO-80 g/mol、CuO-144 g/mol、HO-18
2 2
第5页 | 共7页g/mol)
⑴为了计算x至少需要测定上述数据中 个,这几数据的组合共有
种,请将这些组合一一填入下表空格中.
说明:①选用W、W(HO)、W( 、V(H)表示,不必列出具体计算式.
2 Cu) 2
②每个空格中填一种组合,有几种组合就填几种,不必填满.
⑵从上述组合选写一零点含W的求x的计算式:
x=
参考答案
一、1.B 2.B 3.C 4.A 5.D
二、6.A 7.C,D 8.B,D 9.C 10.B,D
11.A 12.D 13.A,C 14.A,C 15.D
16.A 17.B 18.A,D 19.B
三、20.D21.C 22.D 23.B 24.C
25.C 26.D 27.A
四、28.(6分)
(1)甲不能,乙能 (2)甲方案中反应产生的NH全部被HSO吸收,不能进行后续反应.
3 2 4
29.方法1
(1)2NaO+2HO=4NaOH+O↑
2 2 2 2
NaO+HO=2NaOH
2 2
(2)⑤①④
(3)(G)接(A)(B)接(F)
方法2
(1)2NaO+2CO=2NaCO+O
2 2 2 2 2 2
NaO+CO=NaCO
2 2 2 2
(2)⑤②⑥⑦①④
(3) (G)接 (D)(C) 接 (H)(I)[或(I)(H)] 接(J)(K) 〔或(K)(J)〕 接(A)
(B) 接(F) (方法2全答对也只有6分)
五、30.(1)+5 (2)7
-
+
31.强酸的pH值与强碱的pH值之和等于15(注:若答"强酸的[H ]与强碱的[OH ]之比为
1:10",以及其他未用pH值表达的,均为零分.)
32.(1)Cl (或氯气),Fe(或铁),Fe(OH) (或氢氧化铁)
2 3
- - -
(2)Cl +2OH =ClO +Cl +H O
2 2
33.略 34.略
第6页 | 共7页37.解:(1)2,5
第7页 | 共7页