文档内容
2024—2025 高一上期期中试卷
化学试题
时间75分钟总分100分
原子量:H-1 0-16 Na-23 C1-35.5 K-39 Mn-55
一、单选题(每题3分,共48分)
1.化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基
础自然科学。下列说法正确的是 ( )。
A.意大利科学家阿伏加德罗于 1869 年发现元素周期律,使化学的研究变得有规
律可循
B.科学的元素概念、燃烧的氧化学说、原子和分子学说等,奠定了近代化学的基
础
C.人们可以利用先进的技术和设备通过化学变化制造出新的原子
D.化学是一门以实验为基础的自然科学,所有的化学结论均是通过实验总结出
来的
2.下列物质中,能够导电且为电解质的是 ( )
A.稀硫酸 B.熔融的NaCI C.Al D.NH
3
3.下列对溶液、胶体和浊液的认识正确的是 ( )
A.胶体是一种纯净物
B.胶体与溶液的本质区别是是否有丁达尔效应
C.胶体粒子能透过滤纸D.将饱和氯化铁溶液滴入氢氧化钠溶液中加热,可得氢氧化铁胶体
4.下列有关物质的分类正确的是 ( )
A.纯净物:稀盐酸、硫酸
B.碱性氧化物:氧化铁、氧化钙
C.酸性氧化物:一氧化碳、三氧化硫
D.强酸:碳酸、硝酸
5.关于分散系,下列叙述中正确的是 ( )
A.云、雾属于液溶胶
B.分散质粒子直径小于1nm的是溶液
C,胶体粒子对光线折射产生丁达尔效应
D.乳浊液和悬浊液不属于分散系
6.下列离子方程式书写正确的是 ( )
A.疏酸铜溶液与氢氧化钡溶液反应:SO 2-+Ba2+=BaSO ↓
4 4
B.铁与稀硫酸的反应:2Fe+6H+=2Fe3++3H ↑
2
C.足量的CO,与氢氧化钠溶液的反应:CO +OH- =HCO -
2 3
D.氧化铁溶于足量盐酸中:FeO+2H+=Fe2++H O
2
7.下列各组中的离子,能在澄清透明溶液中大量共存的是 ( )
A.K+、H+、SO 2-、OH- B.Na+、Cu2+、CI-、so2-
4
C.Na+、Ca2+、co2-、No- D.Na+、H+、CI-、Co2-
3
8.下列变化中,必须加入适当的还原剂才能实现的是 ( )
①K Cr 0 →CrCl ②S0 →H S0 ;③FeCl →FeCl ,:④Cu0→Cu;⑤NaC1→Cl
2 2 7 3; 3 2 2 2 3 2
A.①④ B.②④ C.①③⑤ D.①③④9.已知:①2KMnO +16HCl=2KC1+2MnCI +5Cl ↑+8H O;②Cl +2FeCl =2FeCl
4 2 2 2 2 2 3;
③2KI+2FeCl =2KCl+I +2FeCl 。则下列判断正确的是 ( )
3 2 2
A.氧化性:MnO ->Cl >Fe3+>I
4 2 2
B.①中氧化剂和还原剂的物质的量之比为1:8
C.Fe3+只有氧化性,Fe2+只有还原性
D.由信息推测:Cl2+2I-=2Cl-+I 反应不可以进行
2
10.下列物质与其用途不符合的是 ( )
A.煤油:保存金属钠
B.Na O:潜水艇中的供氧剂
2
C.Na CO :造纸
2 3
D.NaHCO :焙制糕点
3
11.焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这
与高中化学中“焰色试验”知识相关。下列说法中正确的是 (
)
A.利用焰色试验可区分NaCl与Na CO 固体
2 3
B.焰色试验中发生的变化为化学变化
C.透过蓝色钻玻璃观察到焰色为紫色,则待测液一定为钾盐
D.不可以用稀硫酸代替稀盐酸洗涤焰色试验中用到的铂丝
12.下列物质的性质与用途具有对应关系的是 ( )
A.Ca(ClO) 易溶于水,可用于制作漂白粉
2
B.盐酸具有挥发性,可用于除水垢
C.漂白粉具有强氧化性,可用于消毒杀菌D.Cl 具有强氧化性,氯水可用作自来水消毒
2
13.二氧化氯 C1O 的熔点-59℃,沸点 11℃,易溶于水,是一种常用的饮用水消
2
毒剂,消毒时会产生Cl- 和少量的ClO -,关于二氧化氯的说法不正确的是( )
2
A.易液化 B.实验室不能用排水法收集
C.消毒时利用其强还原性 D.氯的化合价为十4
14.下列溶液中Cl-的物质的量浓度与其他三项不同的是 ( )
A,10ml0.30mol.L-1的NaClO溶液
B.20ml0.15mol.L-1的CaCl 溶液
2
C.10ml0.30mol.L-1的NaCl溶液
D.30ml0.10mol.L-1的AlCl ,溶液
3
15.将 30mL0.5mol/LNaOH 溶液加水稀释到 500mL,稀释后取出 30mL,取出液中
NaOH的物质的量浓度为 ( )
A.0.3mol/L B.0.03mol/L C.0.05mol/L D.0.04mol/L
16.用 NA 表示阿伏加德罗常数,下列叙述正确的是 (
)
A.常温常压下,7.8gNa O 中含有0.2N 个Na+
2 2 A
B.0.5mol/L的MgCl 溶液中含有N 个Cl-
2 A
C.常温常压下,N 个CO 分子占有的体积为22.4L
A 2
D.常温常压下,O 和O 的混合物共64g,所含氧原子数目为2N
2 3 A
二、填空题(每空2分,共52分)
17.将少量饱和FeCl 溶液分别滴加到下列物质中,得到三种分散系,回答下列间
3
题:甲:饱和FeCl 溶液滴加到NaOH溶液中;
3
乙:饱和FeCl 溶液滴加到冷水中;
3
丙:饱和FeCl 溶液逐滴滴加到沸水中。
3
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为 。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结
论 。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化,先出现和甲中相
同的现象原因为 。
(4)向丙中加入电极通电后,Fe(OH) 胶体粒子向电源 的方向移动(填
3
“ 阴 极 ” 或 “ 阳 极 ” ) 。 若 要 胶 体 发 生 聚 沉 , 可 以 采 取 的 措 施 是
。(任写两条)
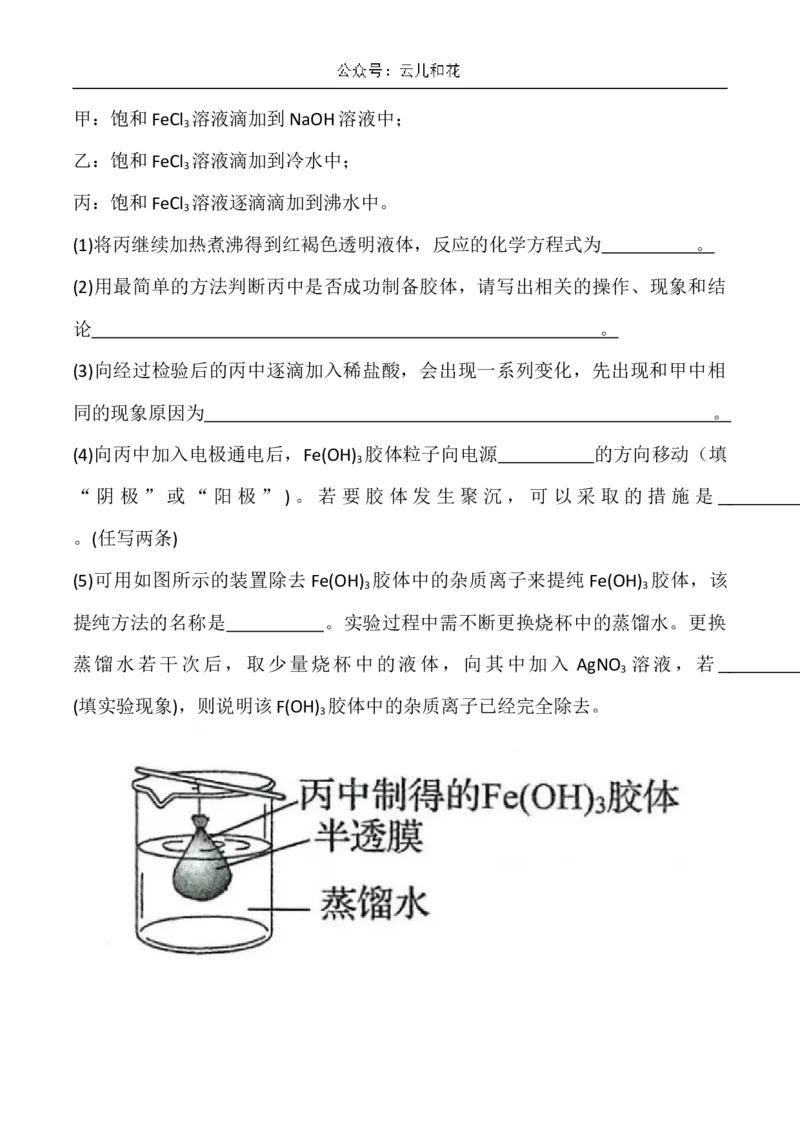
(5)可用如图所示的装置除去 Fe(OH) 胶体中的杂质离子来提纯 Fe(OH) 胶体,该
3 3
提纯方法的名称是 。实验过程中需不断更换烧杯中的蒸馏水。更换
蒸馏水若干次后,取少量烧杯中的液体,向其中加入 AgNO 溶液,若
3
(填实验现象),则说明该F(OH) 胶体中的杂质离子已经完全除去。
318.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)西汉的《准南万毕术》有“曾青得铁则化为铜”的记载。说明早在西汉时期,
我国劳动人民早发现铁能从某些含铜(+2价)化合物的溶液中置换出铜。写出该氧
化还原反应的离子方程式:
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,
发生如下反应:2KNO +3C+S=K S+N ↑+3CO ↑。其中 (写元素符号)
3 2 2 2
的化合价降低,得到还原产物。
(3)中国古代著作中有“银针验毒”的记录,其原理为 4Ag+2H S+O =2X+2H 0,则X
2 2 2
的化学式是 其中HS在该反应中 (填标号)。
A,发生氧化反应
B.发生还原反应
C,既发生氧化反应又发生还原反应
D.既没发生氧化反应又没发生还原反应
(4)已知反应:① C1 +2I-=2Cl-+I ② I +S0 +2H 0=2I-+S02-+4H+,反应①中被还原的元
2 2; 2 2 2
素是 (写元素符号),反应②中失去电子的原子是 (写原子
名称)。
19. I.氯是一种富集在海水中的元素,图是几种含氯产品。(1)储氯钢瓶中应贴的标签为 (填字母代号)。
A.易燃品 B.有毒品 C.爆炸品
(2)“威猛先生”洁厕灵使用注意事项中特别说明在使用时切勿与漂白剂一同使
用,
否则会产生有害气体。“84 消毒液”的有效成分是次氯酸钠,写出“84 消毒
液”
与“威猛先生”洁厕灵(有效成分为盐酸)混合后反应的离子方程式
。
(3)漂白粉的有效成分是 (填化学式),写出漂白粉起漂白作用的化
学方程式 。
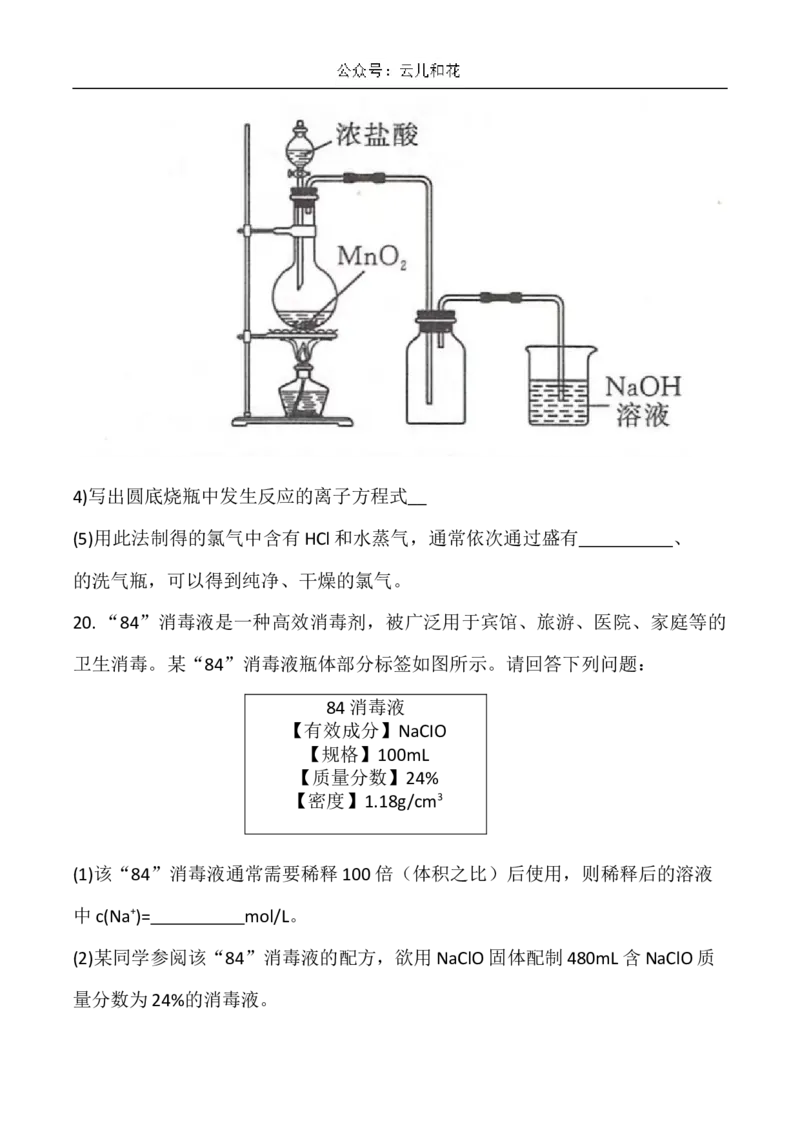
Ⅱ实验室中常用MO 氧化浓盐酸的方法制取氯气,实验装置如图所示。
24)写出圆底烧瓶中发生反应的离子方程式
(5)用此法制得的氯气中含有HCl和水蒸气,通常依次通过盛有 、
的洗气瓶,可以得到纯净、干燥的氯气。
20. “84”消毒液是一种高效消毒剂,被广泛用于宾馆、旅游、医院、家庭等的
卫生消毒。某“84”消毒液瓶体部分标签如图所示。请回答下列问题:
84消毒液
【有效成分】NaCIO
【规格】100mL
【质量分数】24%
【密度】1.18g/cm3
(1)该“84”消毒液通常需要稀释100倍(体积之比)后使用,则稀释后的溶液
中c(Na+)= mol/L。
(2)某同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质
量分数为24%的消毒液。①配制该溶液需要的仪器除了天平、烧杯、500L的容量瓶外,还缺少的玻璃仪
器是 。
②下列操作中,容量瓶不具备的功能是 (填序号)。
a.配制一定体积准确浓度的标准溶液
b.长时间贮存溶液
C.用来加热溶解固体溶质
③容量瓶上除标有温度外,还标有以下三项中的 (填序号)。
a.容量 b.浓度 c.刻度线
④该同学配制此溶液需称量NaCIO固体的质量为 g。
(3)下列情况,导致所配溶液的物质的量浓度偏高的是 (填序号)。
a.定容时俯视刻度线
b.移液前,容量瓶内有蒸馏水
c.定容时水多用胶头滴管吸出
高三化学答案
一、单选题(每题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C B B C B C C A B D
题号 11 12 13 14
答案 C D C D
二、填空题(每题2分,共58分)
15. Ca(ClO) SiO KAl(SO ) = K+ + Al3+ + 2SO 2- 2SO 2- +2Ba2++Al3++4OH- = 2BaSO↓ +
2 2 4 2 4 4 4
AlO-+ 2H O 2Al3+ + 3Ba2+ + 6OH- + 3SO 2- = 2Al(OH) ↓ + 3BaSO ↓
2 2 4 3 4
1.5N
A16.(1)氧化性
(2)K SO
2 4
(3)取少许待测液于试管中,先加入HNO 酸化,再加入AgNO 溶液,若出现白色沉淀,则含有Cl-,反之
3 3
则无。
(4) A
(5) 12.5 500mL容量瓶 CD
17.(1)
(2)富集溴元素
(3)C
(4)
(5)C
(6) 水浴加热 温度过高,大量水蒸气被蒸出,溴蒸气中水的含量增加;温度过低,溴不能完全被
蒸出,产率低
18. A 2Na O+2H SO =2Na SO +O ↑+2H O O aedfgh 偏小 2HO
2 2 2 4 2 4 2 2 2 2 2
2HO+O↑ 碱性条件
2 2