文档内容
第一章 化学反应的热效应
第一节 反应热
一、反应热 焓变
(一)反应热及其测定
1、体系与环境
被研究的物质系统称为 体系 ,与体系相互影响的其他部分称为 环境 。
2、反应热
在等温条件下,化学反应体系向环境 释放 或从环境 吸收 的热量,称为化学反应的热
效应,简称 反应热 。
3、实验探究:中和反应反应热的测定
(1)测定原理:环境温度不变时,根据测得的体系的 温度 变化和有关物质的 比热容
等来计算反应热。即利用公式: Q = cm Δ t 进行计算。
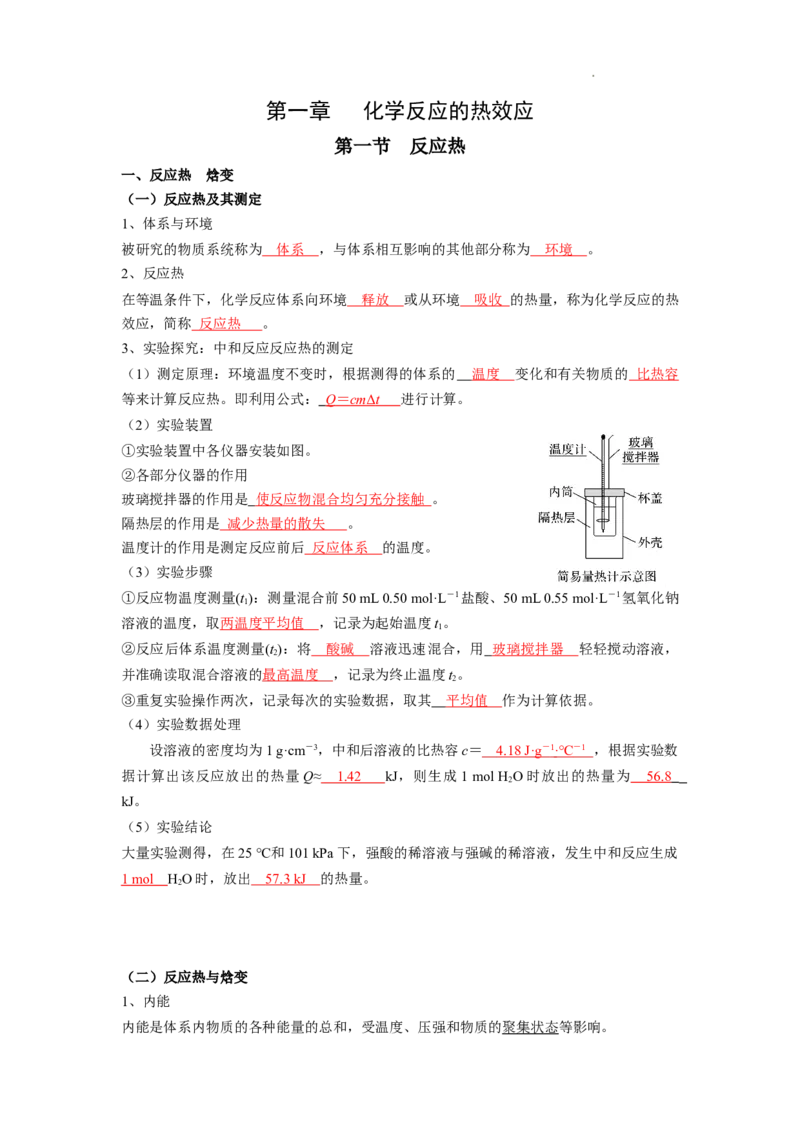
(2)实验装置
①实验装置中各仪器安装如图。
②各部分仪器的作用
玻璃搅拌器的作用是 使反应物混合均匀充分接触 。
隔热层的作用是 减少热量的散失 。
温度计的作用是测定反应前后 反应体系 的温度。
(3)实验步骤
①反应物温度测量(t):测量混合前50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1氢氧化钠
1
溶液的温度,取两温度平均值 ,记录为起始温度t。
1
②反应后体系温度测量(t):将 酸碱 溶液迅速混合,用 玻璃搅拌器 轻轻搅动溶液,
2
并准确读取混合溶液的最高温度 ,记录为终止温度t。
2
③重复实验操作两次,记录每次的实验数据,取其 平均值 作为计算依据。
(4)实验数据处理
设溶液的密度均为1 g·cm-3,中和后溶液的比热容c= 4.18 J· g - 1 ·℃ - 1 ,根据实验数
据计算出该反应放出的热量Q≈ 1.42 kJ,则生成1 mol H O时放出的热量为 56. 8
2
kJ。
(5)实验结论
大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成
1 mol HO时,放出 57.3 kJ 的热量。
2
(二)反应热与焓变
1、内能
内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
学科网(北京)股份有限公司3、焓与焓变
(1)焓(H):是一个与内能有关的 物理量 。
(2)焓变( H):在恒压下,化学反应过程中 吸收或释放 的热量称为该反应的焓变。
常用单位kJ/mol 或 kJ·mol-1。
△
(3)反应热与焓变的关系
在 等压 条件下进行的化学反应的反应热等于反应的 焓变 ,因此常用 Δ H 表示反
应热。
(4)焓变与吸热反应和放热反应的关系
①放热反应:反应体系向环境 释放 能量,反应体系的焓 减小 ,ΔH为负值,即
ΔH<0。
②吸热反应:反应体系从环境中 吸收 能量,反应体系的焓 增大 ,ΔH为正值,即
ΔH>0。
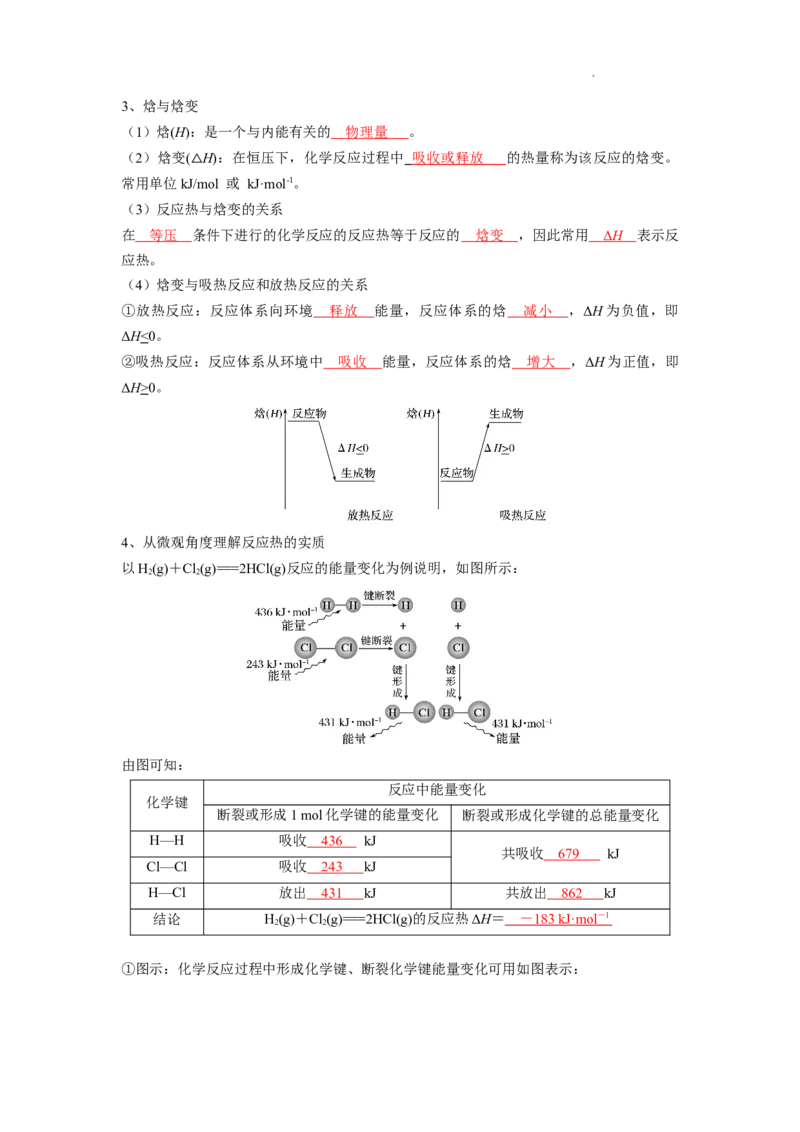
4、从微观角度理解反应热的实质
以H(g)+Cl(g)===2HCl(g)反应的能量变化为例说明,如图所示:
2 2
由图可知:
反应中能量变化
化学键
断裂或形成1 mol化学键的能量变化 断裂或形成化学键的总能量变化
H—H 吸收 436 kJ
共吸收 679 kJ
Cl—Cl 吸收 243 kJ
H—Cl 放出 431 kJ 共放出 862 kJ
结论 H(g)+Cl(g)===2HCl(g)的反应热ΔH= - 183 kJ·mo l - 1
2 2
①图示:化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:
学科网(北京)股份有限公司其中, E 表示反应物断裂化学键吸收的总热量, E 表示生成物形成化学键放出的总
1 2
热量,E 与E 的差值表示 反应热 。上述反应过程表示该反应为 放热 反应。
1 2
②焓变计算公式:ΔH=E (断键)-E (成键)
总 总
二、热化学方程式
1、定义:表明反应所 释放 或 吸收 的热量的化学方程式。
2、意义:不仅表示化学反应中的 物质 变化,也表明了化学反应中的 能量 变化。
实例:已知25 ℃、101 kPa下,热化学方程式为2H(g)+O(g)===2HO(l) ΔH=-571.6
2 2 2
kJ·mol-1,其表示在25 ℃、101 kPa, 2 mol H 与 1 mol O 完全反应生成 2 mol 液
2 2
态水 时放出的热量是 571.6 kJ 。
3、热化学方程式的书写方法
(1)热化学方程式中各物质化学式前的化学计量数只表示其 物质的量 ,可以是整数或
分数。
(2)标注反应的 温度 和 压强 。没有特殊说明是指 25 ℃ 、 101 kPa 。不用标明反
应条件(如“加热”“高温”“催化剂”等)。
(3)标注各物质 聚集状态 。在物质后面用括号标注各物质的聚集状态: 气体 用
“g”, 液体 用“l”,固体 用“s”, 溶液 用“aq”。
(4)标注ΔH的 正负 。化学方程式后面空一格标注ΔH,若为放热反应,ΔH为“ -
”;若为吸热反应,ΔH为“ + ”。
(5)计算ΔH的数值。根据化学方程式中的 化学计量数 计算写出ΔH的数值。ΔH单位
是kJ·mol-1。
4、ΔH的单位中“mol-1”的含义
对一个化学反应,ΔH的单位中“mol-1”不是指每摩尔具体 物质 ,而是指“ 每摩尔反
应 ”。因此ΔH必须与化学方程式一一对应。
三、燃烧热
1、概念:在101 kPa时, 1 mol 纯物质完全燃烧生成 指定产物 时所放出的热量。
2、单位: kJ·mo l - 1 或 kJ/mol 。
3、意义:甲烷的燃烧热为890.3 kJ·mol-1,或ΔH= - 890.3 kJ·mo l - 1 ,它表示25 ℃、
101 kPa时, 1 mo l 甲烷完全燃烧生成 1 mol CO (g) 和 2 mol H O(l) 时 放出 890.3
2 2
kJ的热量。
4、热化学方程式的书写
书写表示燃烧热的热化学方程式时,以燃烧 1 mol 可燃物为标准来配平其余物质的化学
计量数,同时可燃物要完全燃烧且生成 指定产物 。例如:
学科网(北京)股份有限公司H(g)+O(g)===HO(l) ΔH=-285.8 kJ·mol-1
2 2 2
5、燃烧热的热化学方程式是否正误
“一看”可燃物的化学计量数是否为1。
“二看”元素完全燃烧生成的物质是否为指定产物。
“三看”ΔH是否为“-”及单位是否正确。
第二节 反应热的热计算
一、盖斯定律
1、盖斯定律:一个化学反应,不管是 一步 完成的还是 分几步 完成的,其反应热是
相同 的。换句话说,化学反应的反应热只与反应体系的 始态 和 终态 有关,而与反应
的 途径 无关。
2、盖斯定律的计算方法
(1)“虚拟路径”法:若反应物A变为生成物D,可以有两个途径。
①由A 直接 变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH、ΔH、ΔH。
1 2 3
如图所示:
则有ΔH= Δ H + Δ H + Δ H 。
1 2 3
(2)加合法:加合法就是运用所给热化学方程式通过 加减乘除 的方法得到所求的热化
学方程式。
例:根据如下两个反应,选用上述两种方法,计算出C(s)+O(g)===CO(g)的反应热ΔH。
2
Ⅰ:C(s)+O(g)===CO(g) ΔH=-393.5 kJ·mol-1
2 2 1
Ⅱ:CO(g)+O(g)===CO(g) ΔH=-283.0 kJ·mol-1
2 2 2
反应C(s)+O(g)====CO (g)的途径可设计如下:
2 2
则ΔH= Δ H - Δ H = - 110.5 kJ·mol-1。
1 2
二、反应热的计算
1、根据热化学方程式计算
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)===cC(g)+dD(g) ΔH
学科网(北京)股份有限公司a b c d |ΔH|
n(A) n(B) n(C) n(D) Q
则====
2、根据反应物、生成物的键能计算
ΔH=反应物的 键能总和 -生成物的 键能总和 。
3、根据物质的燃烧热数值计算
Q(放)=n(可燃物)×|ΔH(燃烧热)|。
4、根据盖斯定律计算
将两个或两个以上的热化学方程式包括其ΔH 相加或相减 ,得到一个新的热化学方
程式及其ΔH。
5、ΔH大小比较时注意事项
(1)吸热反应的ΔH为“+”,放热反应的ΔH为“-”,所以 吸热反应 的ΔH一定大
于 放热反应 的ΔH。
(2)放热反应的ΔH为“-”,所以放热越多,ΔH越小。
学科网(北京)股份有限公司