文档内容
第一章《物质及其变化》测试卷
一、单选题(共15小题)
1.下列说法正确的是( )
A. 金属氧化物都是碱性氧化物
B. 盐电离出的阳离子不一定有金属离子
C. 由不同种元素组成的物质一定是化合物
D. 非金属氧化物都是酸性氧化物
2.下列电离方程式错误的是( )
A. NaHCO ===Na++H++
3
B. NaHSO ===Na++H++
4
C. H SO ===2H++
2 4
D. CH COOH CH COO﹣+H+
3 3
3.顺式Pt(NH ) Cl (相对分子质量为300)是临床广泛使用的抗肿瘤药物。下列有关该物质的
3 2 2
说法中正确的是 ( )
A. 由4种元素组成
B. 该物质由NH 和PtCl 组成,属于混合物
3 2
C. Pt的化合价为+4价
D. 铂元素(相对原子质量为195)的质量分数为75%
4.将mmol Cu S和足量稀HNO 反应,生成Cu(NO ) 、H SO 、NO和H O。则参加反应的
2 3 3 2 2 4 2
硝酸中被还原的硝酸的物质的量是( )
A. 4mmol
B. 10mmol
10m
C. mol
32m
D. mol
3
5.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶
叶”和“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟指的是( )
A. 元素
B. 单质
C. 分子
D. 氧化物
6.下列各组物质间的反应中,不属于离子反应的是( )
A. Zn和H SO (稀)反应
2 4
B. NaCl溶液和AgNO 溶液反应
3
C. C和O 反应
2
D. Fe和CuSO 溶液反应
4
7.下列应用或事实与胶体的性质无关的是( )
A. 清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线
B. 向FeCl 溶液中滴加NaOH溶液出现红褐色沉淀
3
C. 肾功能衰竭等疾病引起的尿中毒,可利用半透膜进行血液透析
D. 在海水与河水交界处,易形成三角洲
8.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴
影部分关系的是( )
A. A
B. B
C. C
D. D
9.下列碱性透明溶液中,能大量共存的离子组是( )
A. K+、Na+、MnO 、Cl- B. K+、Ag+、NO 、Cl-
C. Ba2+、Na+、Cl-、SO D. Na+、Cu2+、NO 、Cl-10.向100 mL FeI 溶液中逐渐通入Cl ,其中n(I )、n(Fe3+)随通入n(Cl )的变化如图所示,
2 2 2 2
下列说法不正确的是( )
A. 氧化性强弱:I <Fe3+
2
B.n(Cl )=0.12 mol时,溶液中的离子主要有Fe2+、Fe3+、Cl-
2
C. 由图可知,该FeI 溶液的浓度为1 mol·L-1
2
D.n(Cl )∶n(FeI )=1∶2时,反应的离子方程式为:2Fe2++Cl ===2Fe3++2Cl-
2 2 2
11.下列各组物质的溶液反应,可以用同一离子方程式表示的是( )
A. HCl+Na CO ;HCl+NaHCO
2 3 3
B. NaOH+HCl;Ba(OH) +H SO
2 2 4
C. BaCl +H SO ;Ba(OH) +Na SO
2 2 4 2 2 4
D. CaCO +HCl;Na CO +H SO
3 2 3 2 4
12.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是
( )
A. F 、K、HCl
2
B. Cl 、Al、H
2 2
C. NO 、Na、Br
2 2
D. O 、SO 、H O
2 2 2
13.某种飞船以N H 和N O 为动力源,发生反应:2N H +N O ===3N +4H O,反应温度
2 4 2 4 2 4 2 4 2 2
可高达2 700 ℃,对于该反应,下列说法中正确的是( )
A. 该反应属于置换反应
B. N H 是氧化剂
2 4
C. N O 是还原剂
2 4
D. N 既是氧化产物又是还原产物
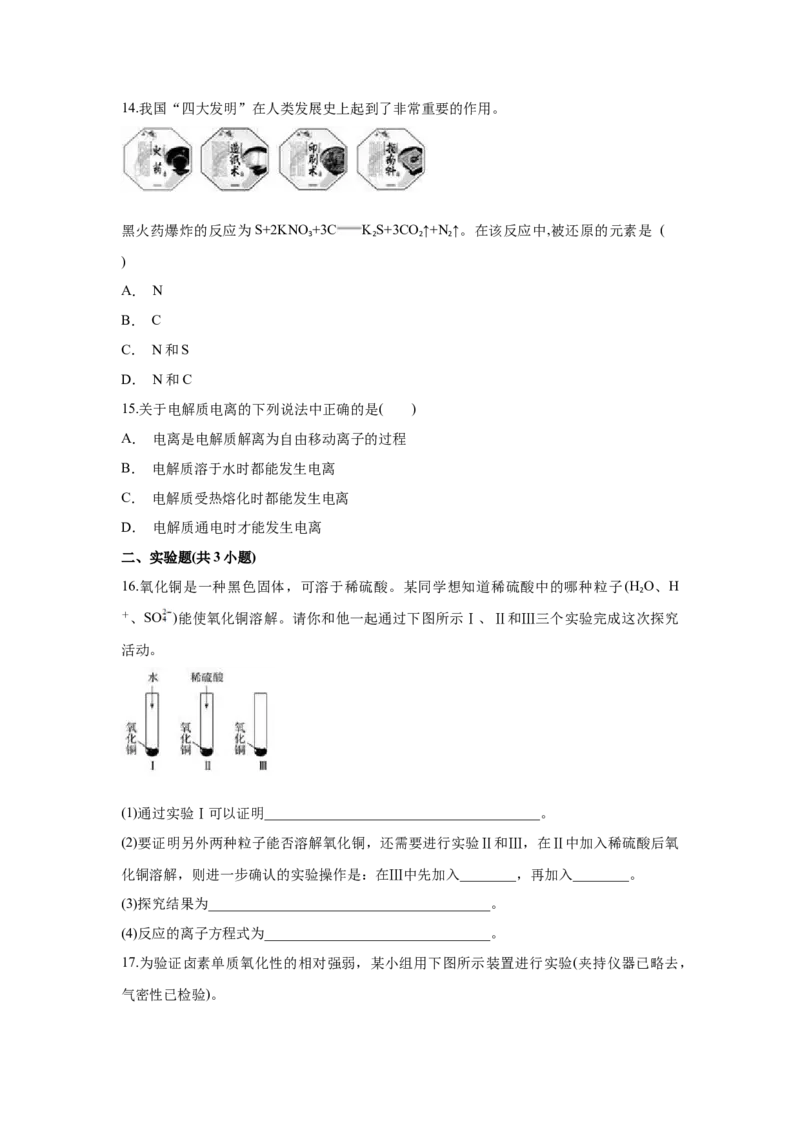
214.我国“四大发明”在人类发展史上起到了非常重要的作用。
黑火药爆炸的反应为S+2KNO +3C K S+3CO ↑+N ↑。在该反应中,被还原的元素是 (
3 2 2 2
)
A. N
B. C
C. N和S
D. N和C
15.关于电解质电离的下列说法中正确的是( )
A. 电离是电解质解离为自由移动离子的过程
B. 电解质溶于水时都能发生电离
C. 电解质受热熔化时都能发生电离
D. 电解质通电时才能发生电离
二、实验题(共3小题)
16.氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H O、H
2
+、SO )能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究
活动。
(1)通过实验Ⅰ可以证明_______________________________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧
化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(3)探究结果为________________________________________。
(4)反应的离子方程式为________________________________。
17.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,
气密性已检验)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
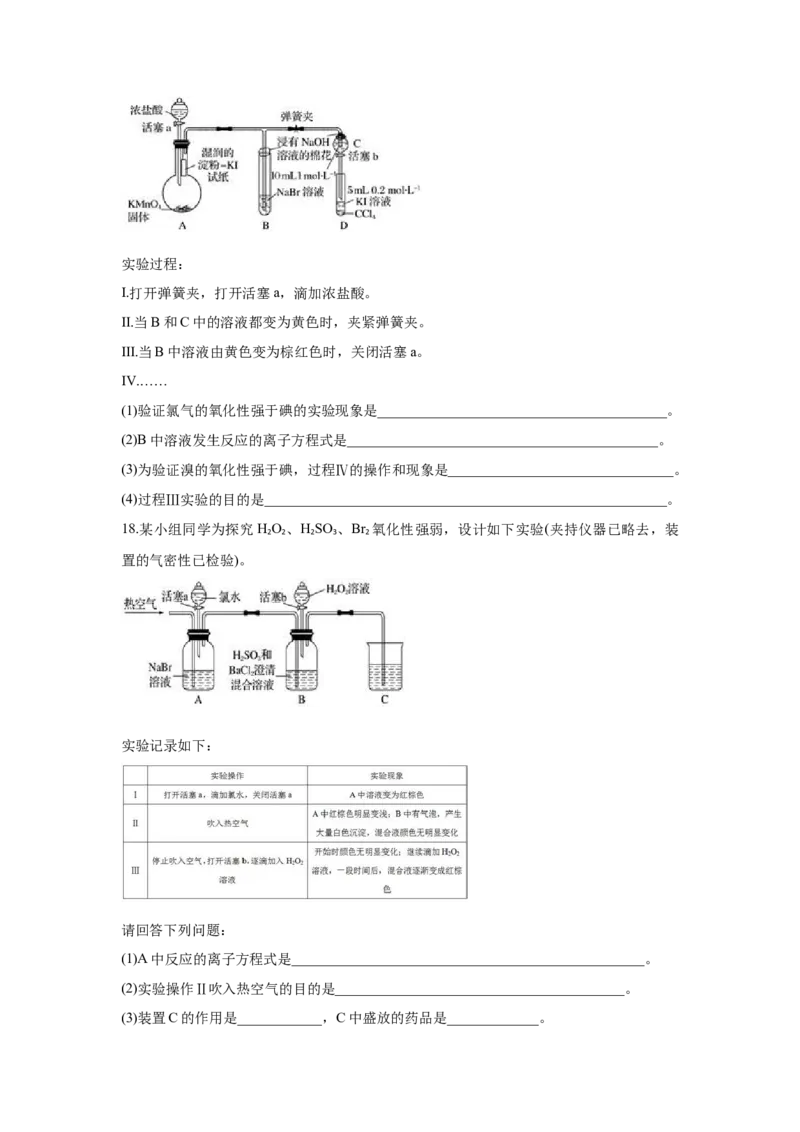
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
18.某小组同学为探究H O 、H SO 、Br 氧化性强弱,设计如下实验(夹持仪器已略去,装
2 2 2 3 2
置的气密性已检验)。
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由
是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
三、计算题(共3小题)
19.写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。
(2)加热氯酸钾分解制取氧气。
20.已知反应:3Cu+8HNO (稀)===3Cu(NO ) +2NO↑+4H O。
3 3 2 2
(1)参加反应的HNO 和作为氧化剂的HNO 的个数比为________。
3 3
(2)若有64 g Cu被氧化,则被还原的HNO 的质量是________。
3
21.已知反应:3Cu+8HNO (稀)===3Cu(NO ) +2NO↑+4H O。
3 3 2 2
(1)参加反应的HNO 和作为氧化剂的HNO 的个数比为________。
3 3
(2)若有64 g Cu被氧化,则被还原的HNO 的质量是________。
3
四、填空题(共3小题)
22.填写下表:(类别填“酸”“碱”或“盐”)
23.下列4组物质,能起反应的写出化学方程式;属于离子反应的,还要写出离子方程式;
不能起反应的,说明不能起反应的原因。
(1)硫酸溶液与氯化钡溶液:_______________________________________;
(2)稀硫酸与碳酸钠溶液:_______________________________________;
(3)硝酸钠溶液与氯化钾溶液:_______________________________________;
(4)碳酸钙和盐酸:_______________________________________________________;
(5)氢氧化钾溶液和醋酸(CH COOH)溶液:___________________________________;
3
(6)三氯化铁溶液和氢氧化钾溶液:__________________________________________。
24.单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示。限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化
学方程式表示(所写化学方程式不得重复)。
①C+O CO ;
2 2
②________________________________________________________________________;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________;
⑦________________________________________________________________________。答案解析
1.【答案】B
【解析】金属氧化物不一定是碱性氧化物(如七氧化二锰为酸性氧化物);盐电离出的阳离
子不一定是金属离子(如铵盐电离出的阳离子为铵根离子);由不同种元素组成的物质可能
是混合物(如氧、氢元素组成的氧气、氢气的混合气体);非金属氧化物不一定是酸性氧化
物(如一氧化氮、一氧化碳等)。
2.【答案】A
【解析】碳酸氢根离子为弱酸的酸式根离子不能拆写,碳酸氢钠为强电解质,完全电离,
电离方程式:NaHCO ===Na++ ,A错误;
3
NaHSO 在溶液中电离生成Na+和H+、 ,电离方程式:NaHSO ===Na++H++ ,B
4 4
正确;
硫酸为强电解质,完全电离出氢离子与硫酸根离子,电离方程式H SO ===2H++ ,C正
2 4
确;
乙酸为弱电解质,部分电离,电离方程式:CH COOH CH COO﹣+H+,D正确。
3 3
3.【答案】A
【解析】选 A。顺式 Pt(NH ) Cl 是由铂、氮、氢、氯 4 种元素组成的,A 正确;顺式
3 2 2
Pt(NH ) Cl 属于化合物,B错误;NH 化合价代数和为0,氯元素显-1价,设铂元素的化合价是x,
3 2 2 3
根据在化合物中正负化合价代数和为零,可得:x+(-1)×2=0,则x=+2价,C错误;顺式Pt(NH ) Cl
3 2 2
195
的相对分子质量为300,铂元素的质量分数为 ×100%=65%,D错误。
300
4.【答案】C
【解析】mmol Cu S共失去电子:2mmol+8mmol=10mmol,Cu S每失去3 mol 电子可还
2 2
10m
原1 mol HNO ,故被还原的HNO 为 mol。
3 3 3
5.【答案】A
【解析】题给各物质中含有的碘、铁、钙、硒和氟都是指元素。
6.【答案】C【解析】 A项、B项、D项中的反应都是在溶液中进行的反应,且每一组中都有拆写出
的离子参与反应,所以都是离子反应;C与O 反应无论产物是CO还是CO ,都不是在溶
2 2
液中进行的反应,故不属于离子反应。
7.【答案】B
【解析】大气是胶体,故当有阳光穿过时有美丽的光线,是胶体的丁达尔效应,和胶体的
性质有关,故A不选;
向FeCl 溶液中滴加NaOH溶液生成的是氢氧化铁沉淀,而不是氢氧化铁胶体,故B选;
3
血液是胶体,不能透过半透膜,故可以利用半透膜除去血液中的毒素,和胶体的性质有关
故C不选;
河水是胶体,海水是电解质溶液,故当河水遇到海水时,会产生胶体的聚沉,从而形成三
角洲,故和胶体的性质有关,故D不选。
故选B。
8.【答案】B
【解析】①NaCl属于盐酸盐,不是硫酸盐,④(NH ) SO 属于硫酸盐,不是盐酸盐,A
4 2 4
错误;各项均符合,B正确;①NaCl属于盐酸盐,不是硫酸盐,C错误;④(NH ) SO
4 2 4
属于硫酸盐,不是盐酸盐,D错误。
9.【答案】A
【解析】 有色不等于不透明,如有色玻璃,所以不必排除有色离子的干扰。溶液显碱性
B中,Ag+与Cl-不能大量共存:Ag++Cl-===AgCl↓,且Ag+与OH-也不能大量共存:Ag
++OH-===AgOH↓、2AgOH===Ag O+H O(AgOH不稳定);C中,Ba2+与SO 不能大量
2 2
共存:Ba2++SO ===BaSO ↓;D 中,Cu2+与 OH-不能大量共存:Cu2++2OH-
4
===Cu(OH) ↓。
2
10.【答案】D
【解析】A.由图可知,向100 mL FeI 溶液中逐渐通入Cl ,先生成I ,后生成Fe3+,根据
2 2 2
氧化还原反应的“先后规律”,则还原性:I->Fe2+,由此可知氧化性:I <Fe3+,故A正
2
确;B.由图可知,n(Cl )=0.1 mol时,I-完全反应,n(Cl )=0.15 mol时,Fe2+完全反应,
2 2
所以当n(Cl )=0.12 mol时,溶液中的离子主要有Fe2+、Fe3+、Cl-,故B正确;C.由图可
2
知,n(Cl )=0.1 mol时,I-完全反应,由方程式2I-+Cl ===2Cl-+I 可知,消耗的I-为0.2
2 2 2
mol,故该FeI 溶液的浓度为1 mol·L-1,故C正确;D.n(Cl )∶n(FeI )=1∶2时,氯气与碘离
2 2 2
子反应,反应的离子方程式为:2I-+Cl ===2Cl-+I ,故D错误。
2 211.【答案】C
【解析】A项,前者为2H++CO2
−===CO ↑+H
O,后者为H++HCO−
===CO ↑+H O,
3 2 2 3 2 2
两者不同;B 项,前者为 H++OH-===H O,后者为 Ba2++2OH-+2H++SO2 −
2 4
===BaSO ↓+2H O,两者不同;C项,两反应均为
Ba2++SO2
−===BaSO ↓;D项,前者为
4 2 4 4
CaCO +2H+===Ca2++CO ↑+H O,后者为CO2 −+2H+===CO ↑+H O,两者不同。
3 2 2 3 2 2
12.【答案】A
【解析】F 的最高价为0价,只有氧化性,金属钾只有还原性,而HCl既有氧化性又有还
2
原性。
13.【答案】D
【解析】A错,该反应的反应物中无单质,不属于置换反应;B错,N H 中N元素的化合
2 4
价为-2,在反应中失电子变为0价,因此N H 是还原剂;C错,N O 中N元素的化合价
2 4 2 4
为+4,在反应中得到电子变为0价,因此N O 是氧化剂;D对,-2价的N和+4价的N
2 4
均生成0价的N,因此N 既是氧化产物又是还原产物。
2
14.【答案】C
【解析】被还原的元素就是反应过程中化合价降低的元素。
15.【答案】A
【解析】
16.【答案】(1)水不能使氧化铜溶解
(2)可溶性硫酸盐 稀硫酸
(3)H+能溶解氧化铜,而H O、SO 两种粒子都不能使CuO溶解
2
(4)CuO+2H+===Cu2++H O
2
【解析】以学生非常熟悉的CuO与H SO 的反应为起点,去探究硫酸中的 H+、SO 和
2 4
H O三种粒子中哪种粒子使CuO溶解。在Ⅲ中应先加入可溶性的硫酸盐,以证明CuO的溶
2
解过程中SO 不起作用,然后再加入稀硫酸,从而证明CuO溶解是硫酸中的H+起作用。
另外加入硝酸、盐酸等均可使CuO溶解。
17.【答案】(1)湿润的淀粉KI试纸变蓝
(2)Cl +2Br-===Br +2Cl-
2 2(3)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl 层溶
4
液变为紫红色
(4)确认C的黄色溶液中无Cl ,排除Cl 对溴置换碘实验的干扰
2 2
【解析】A中滴加浓盐酸后,发生反应:2KMnO +16HCl(浓)===2KCl+2MnCl +5Cl ↑+
4 2 2
8H O,生成的黄绿色气体是Cl ,在A、B、C中分别发生反应:Cl +2KI===2KCl+I 、
2 2 2 2
Cl +2NaBr===2NaCl+Br 、Cl +2NaBr===2NaCl+Br ,由于B、C中生成了Br 而溶液变
2 2 2 2 2
为黄色,打开活塞b,C中生成的Br 在D中发生反应:Br +2KI===2KBr+I 。过程Ⅲ实
2 2 2
验,当B中黄色溶液继续通入过量Cl 时,溶液变为棕红色,以此为对照,说明 C中黄色
2
溶液无Cl ,从而排除Cl 对溴置换碘实验的干扰。
2 2
18.【答案】(1)2Br-+Cl ===Br +2Cl-
2 2
(2)吹出单质Br
2
(3)吸收尾气 NaOH溶液
(4)H O +2Br-+2H+===Br +2H O
2 2 2 2
(5)氧化性:H O >Br >H SO
2 2 2 2 3
(6)①不干扰,无论热空气是否参加氧化H SO ,只要观察到产生白色沉淀的同时无明显颜
2 3
色变化,即能证明Br 氧化了H SO
2 2 3
② H SO 有剩余(H O 浓度小或Br-与H O 反应慢等因素都可)
2 3 2 2 2 2
【解析】(1)氯水中的Cl 置换Br-。
2
(2)利用Br 的挥发性,吹入热空气使Br 挥发。
2 2
(3)因为Cl 、Br 有毒,所以C中盛放NaOH溶液,除去尾气中的有毒气体,防止污染环境。
2 2
(4)混合液逐渐变成红棕色,说明H O 把Br-氧化为Br ,可得离子方程式。
2 2 2
(5)根据氧化剂的氧化性大于氧化产物的氧化性,可知:H O >Br >H SO 。
2 2 2 2 3
(6)①溶液无明显颜色变化,说明Br 参加了反应,即氧化了H SO 。
2 2 3
②实验操作Ⅲ发生的反应为H O 氧化Br-,开始时颜色无明显变化,说明反应受到了影响,
2 2
H SO 有剩余、H O 浓度小、Br-与H O 反应慢等都是可能因素。
2 3 2 2 2 219.【答案】
【解析】
20.【答案】(1)4∶1 (2)42 g
【解析】从反应方程式可知3 mol Cu被氧化时,参加反应的HNO 为8 mol,但其中只有
3
2 mol HNO 得到电子被还原(从化合价分析可以判断),因此3 mol Cu还原2 mol HNO ,即
3 3
应按3Cu~2HNO 这一关系式进行计算。
3
64g
n(Cu)= =1 mol,
64g·mol−1
3Cu―→2HNO
3
3 mol 2 mol
2
1 mol mol
3
2
m(HNO )=63 g·mol-1× mol=42 g。
3 3
21.【答案】(1)4∶1 (2)42 g
【解析】从反应方程式可知3 mol Cu被氧化时,参加反应的HNO 为8 mol,但其中只有
3
2 mol HNO 得到电子被还原(从化合价分析可以判断),因此3 mol Cu还原2 mol HNO ,即
3 3
应按3Cu~2HNO 这一关系式进行计算。
3
64g
n(Cu)= =1 mol,
64g·mol−1
3Cu―→2HNO
3
3 mol 2 mol2
1 mol mol
3
2
m(HNO )=63 g·mol-1× mol=42 g。
3 3
22.【答案】
【解析】 硝酸属于酸,电离方程式是HNO ===H++NO ;MgCl 属于盐,电离方程式是
3 2
MgCl ===Mg2++2Cl-;熟石灰属于碱,电离方程式是Ca(OH) ===Ca2++2OH-。
2 2
23.【答案】(1)H SO +BaCl ===BaSO ↓+2HCl,SO2 −+Ba2+=== BaSO ↓
2 4 2 4 4 4
(2)H SO +Na CO ===Na SO +H O+CO
↑,2H++CO2
−=== H O+CO ↑
2 4 2 3 2 4 2 2 3 2 2
(3)硝酸钠和氯化钾混合溶液中离子浓度不发生变化,不能反应
(4)CaCO +2HCl===CaCl +CO ↑+H O ,CaCO +2H+===Ca2++CO ↑+H O
3 2 2 2 3 2 2
(5) KOH+CH COOH===CH COOK+H O,OH-+CH COOH===CH COO-+H O
3 3 2 3 3 2
(6) FeCl +3KOH===Fe(OH) ↓+3KCl,Fe3++3OH-===Fe(OH) ↓
3 3 3
【解析】(1)硫酸和氯化钡反应生成硫酸钡沉淀,H SO +BaCl ===BaSO ↓+2HCl,其中硫
2 4 2 4
酸、氯化钡和氯化氢均完全电离,离子方程式SO2 −+Ba2+===BaSO ↓;(2)稀硫酸和碳酸钠
4 4
反应生成二氧化碳气体,H SO +Na CO ===Na SO +H O+CO ↑,离子方程式 2H++
2 4 2 3 2 4 2 2
CO2
−===H O+CO ↑;
3 2 2
(3)硝酸钠和氯化钾混合溶液中离子浓度不发生变化,不能反应;
(4)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO +2HCl===CaCl +
3 2
CO ↑+H O,离子方程式为CaCO +2H+===Ca2++CO ↑+H O;
2 2 3 2 2
(5)氢氧化钾溶液和醋酸(CH COOH)溶液反应生成醋酸钾和水,化学方程式为 KOH+
3
CH COOH===CH COOK+H O,离子方程式为OH-+CH COOH===CH COO-+H O;
3 3 2 3 3 2
(6)氯化铁溶液与氢氧化钾溶液反应生成氢氧化铁沉淀和氯化钾,化学方程式为 FeCl +
3
3KOH===Fe(OH) ↓+3KCl,离子反应方程式为Fe3++3OH-===Fe(OH) ↓。
3 324.【答案】②CO +H O===H CO ③CO +Ca(OH) ===CaCO ↓+H O
2 2 2 3 2 2 3 2
④Fe+2HCl===FeCl +H ↑ ⑤CaO+2HCl===CaCl +H O
2 2 2 2
⑥Ca(OH) +2HCl===CaCl +2H O ⑦CaO+H O===Ca(OH)
2 2 2 2 2
【解析】属于同一类的物质必定符合同一分类标准,就会具有某些共同的性质,利用一类
物质和另一类物质之间的关系,就可以找出物质之间转化的方法:
非金属 酸性氧化物→碱盐→水酸;金属→氮气碱性氧化物→酸盐→水碱,该题对各
类物质之间的转化限定了8种物质,从这8种物质中选出符合条件的物质进行各类物质间
的转化。