文档内容
衡阳县四中 2024-2025 学年下学期高一第一次月考卷
化 学
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准
考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答
案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在
试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
Cl∶35.5 K∶39
一、单选题(每题3分,共42分)
1.纵观古今,化学与环境、材料、生产、生活关系密切,下列说法不正确的是
( )
A.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅
B.“神舟”系列飞船使用的碳纤维材料、光导纤维都是新型无机非金属材料
C.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
D.“神舟”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分不是硅酸
盐
2.下列化学用语表示正确的是( )
A.中子数为10的氧原子:
B. 的空间结构为直线形
C. 的结构示意图:D. 的形成过程:
3.下列实验操作规范且能达到目的的是( )
A. B. C. D.
4.设 为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下, 由 和 组成的混合气体中含有的原子总数为
B. 与 反应,生成的 分子数为
C.常温下,将 铝片投入足量的浓硫酸中,铝失去的电子数为
D. 与 完全反应转移电子数为
5.下列离子方程式书写正确的是( )
A. 与过量稀硝酸反应:
B . 向 碳 酸 氢 铵 溶 液 中 滴 加 少 量 溶 液 :
C.向 溶液中加入过量浓氨水:
D. 与 溶液反应:
6.汽车尾气处理装置中可发生反应: ,下列对该反应的
说法正确的是( )
A.NO 被氧化 B.CO是氧化剂
2C.该条件下,还原性:COZ>W>X
B.Y的最高价氧化物的水化物和W的氧化物反应生成的是最高价含氧酸盐
C.X单质和Y单质发生反应的产物中阴、阳离子个数比为2∶1
D.X分别与Y、W均可形成具有漂白性的化合物,且漂白原理相同
9.下列物质之间的转化不合理的是( )
A.
B.
C.
D.
10.下列实验操作和现象得出的实验结论正确的是( )
实验操作 实验现象 实验结论
SO 有 氧 化
A 将SO 通入盛有2 mL新制氯水的试管中 新制氯水褪色 2
2 性
铁无明显变化 金 属 活 动
B 常温下,将铁片、铜片分别插入浓硝酸中
铜片剧烈反应 性:Cu>Fe
取少量待测液于试管中,加入浓 NaOH 溶
C 试纸变蓝 溶液中含有
液并加热,将湿润的红色石蕊试纸靠近试管口
用pH计分别测量同浓度的HCl和H S溶液 Cl 的非金属
D 2 HCl酸性较强
的pH,HCl溶液pH更小 性强于S
11.工业制备高纯硅的原理示意图如下:
下列说法错误的是( )
A.硅在自然界中主要以氧化物和硅酸盐形式存在
B.反应①为
C.反应③中的 不可用焦炭代替
D.上述流程中能循环利用的物质有 、HCl
12.工业上以铬铁矿(FeCr O ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
2 4
(Na Cr O ·2H O)的工艺流程如下,已知焙烧的目的是将 FeCr O 转化为
2 2 7 2 2 4
Na CrO ,并将Al、Si氧化物转化为可溶性钠盐。下列说法错误的是( )
2 4
A.在焙烧阶段可用小苏打代替纯碱
B.浸取后所得滤渣主要成分是Fe O
2 3
C.在上述流程中可得到副产品Na SO
2 4
D.母液中无可循环利用的成分
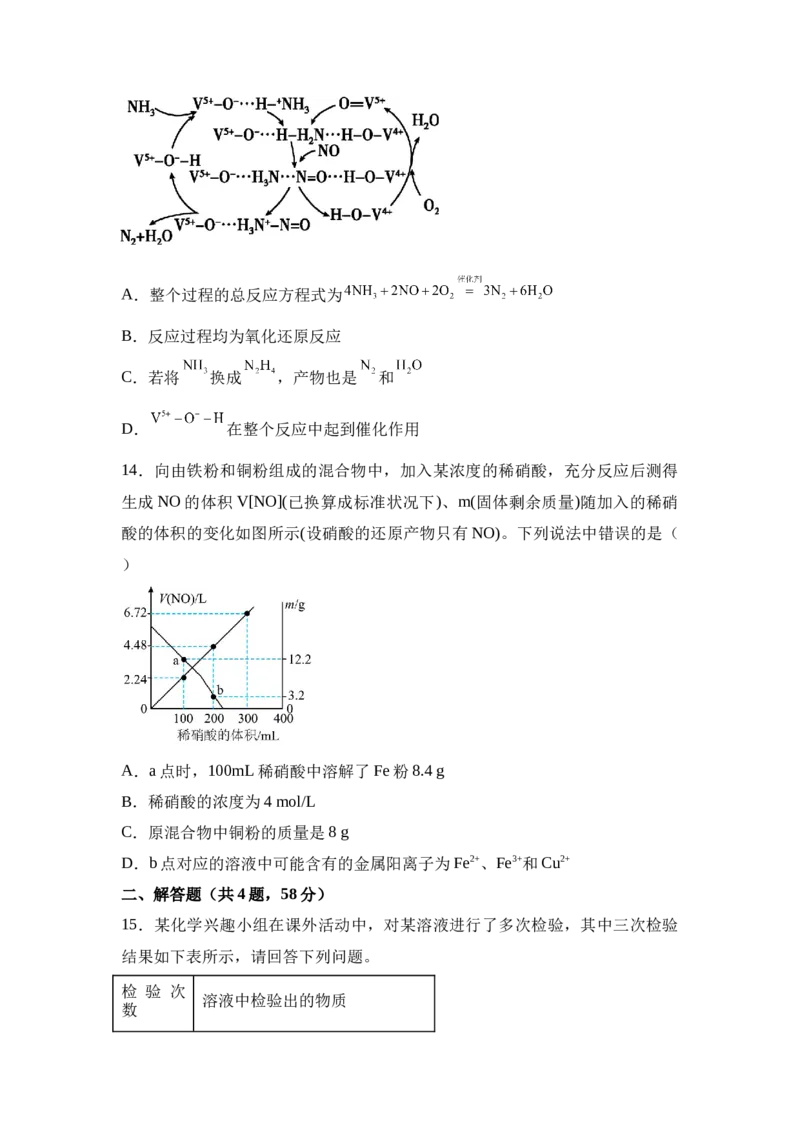
13.某课题组设计一种脱除烟气中NO的方法,下列说法不正确的是( )A.整个过程的总反应方程式为
B.反应过程均为氧化还原反应
C.若将 换成 ,产物也是 和
D. 在整个反应中起到催化作用
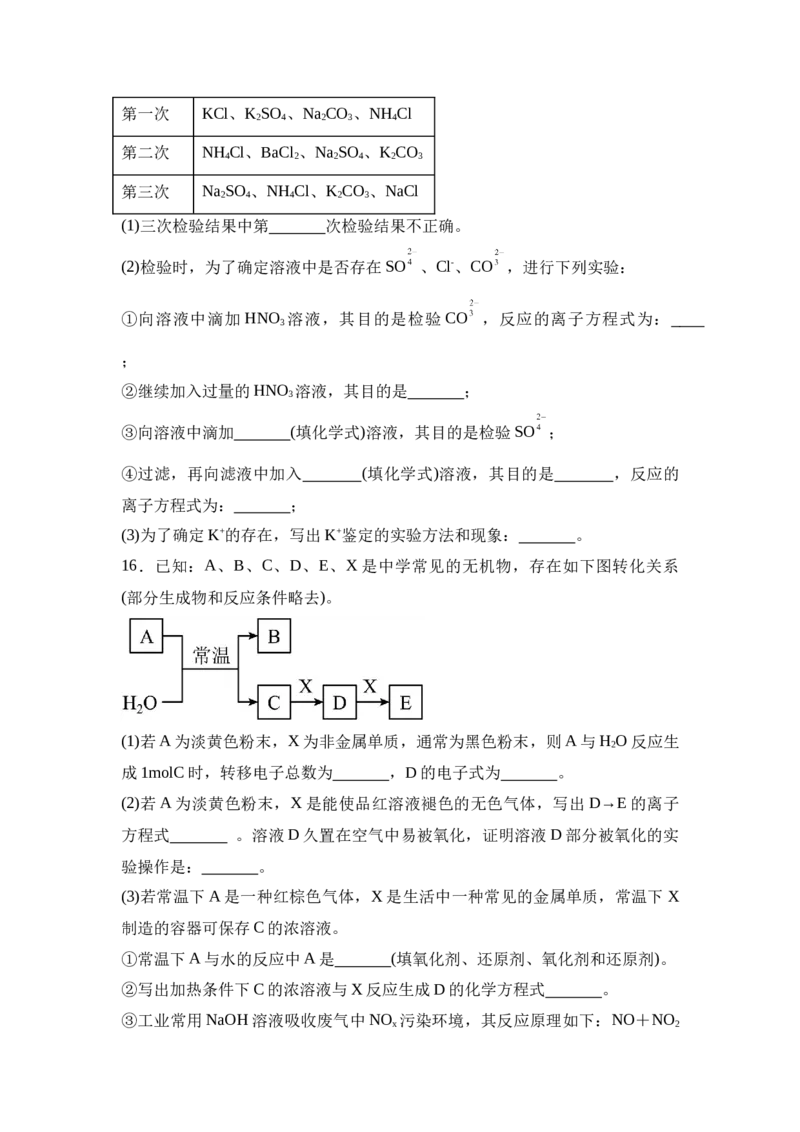
14.向由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得
生成NO的体积V[NO](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝
酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中错误的是(
)
A.a点时,100mL稀硝酸中溶解了Fe粉8.4 g
B.稀硝酸的浓度为4 mol/L
C.原混合物中铜粉的质量是8 g
D.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+和Cu2+
二、解答题(共4题,58分)
15.某化学兴趣小组在课外活动中,对某溶液进行了多次检验,其中三次检验
结果如下表所示,请回答下列问题。
检 验 次
溶液中检验出的物质
数第一次 KCl、K SO 、Na CO 、NH Cl
2 4 2 3 4
第二次 NH Cl、BaCl 、Na SO 、K CO
4 2 2 4 2 3
第三次 Na SO 、NH Cl、K CO 、NaCl
2 4 4 2 3
(1)三次检验结果中第 次检验结果不正确。
(2)检验时,为了确定溶液中是否存在SO 、Cl-、CO ,进行下列实验:
①向溶液中滴加 HNO 溶液,其目的是检验 CO ,反应的离子方程式为:
3
;
②继续加入过量的HNO 溶液,其目的是 ;
3
③向溶液中滴加 (填化学式)溶液,其目的是检验SO ;
④过滤,再向滤液中加入 (填化学式)溶液,其目的是 ,反应的
离子方程式为: ;
(3)为了确定K+的存在,写出K+鉴定的实验方法和现象: 。
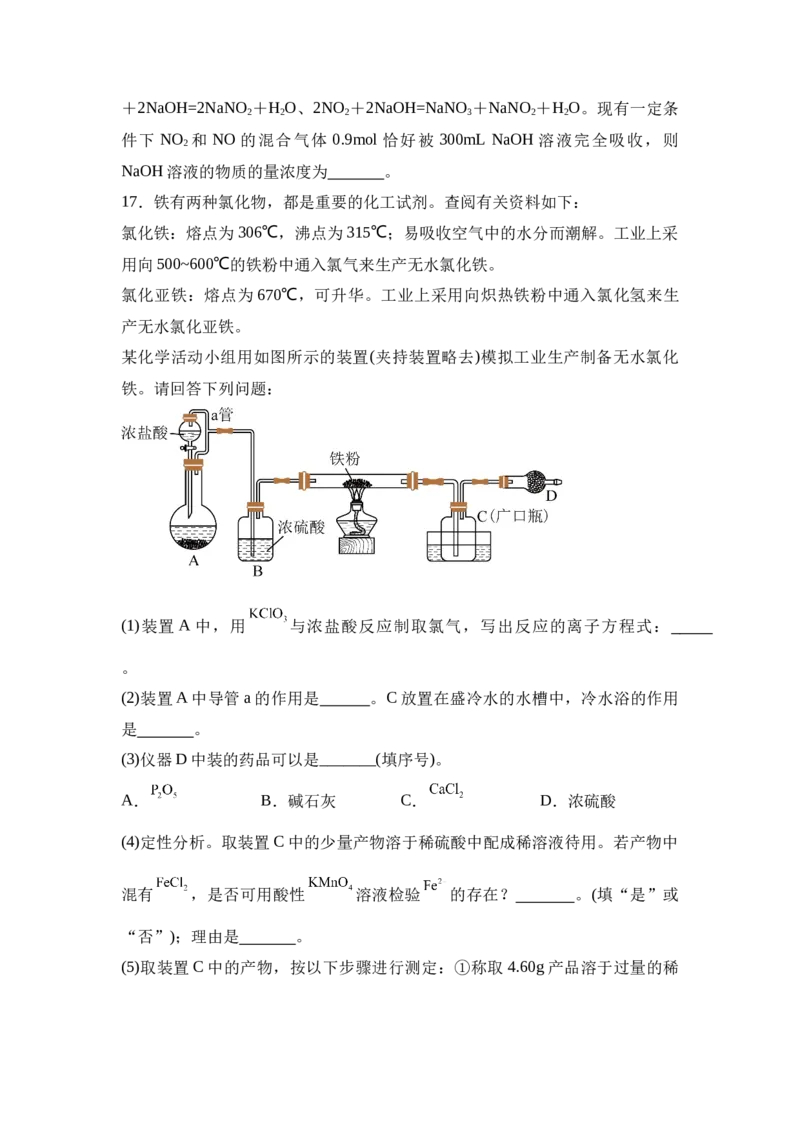
16.已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系
(部分生成物和反应条件略去)。
(1)若A为淡黄色粉末,X为非金属单质,通常为黑色粉末,则A与H O反应生
2
成1molC时,转移电子总数为 ,D的电子式为 。
(2)若A为淡黄色粉末,X是能使品红溶液褪色的无色气体,写出D→E的离子
方程式 。溶液D久置在空气中易被氧化,证明溶液D部分被氧化的实
验操作是: 。
(3)若常温下A是一种红棕色气体,X是生活中一种常见的金属单质,常温下 X
制造的容器可保存C的浓溶液。
①常温下A与水的反应中A是 (填氧化剂、还原剂、氧化剂和还原剂)。
②写出加热条件下C的浓溶液与X反应生成D的化学方程式 。
③工业常用NaOH溶液吸收废气中NO 污染环境,其反应原理如下:NO+NO
x 2+2NaOH=2NaNO +H O、2NO +2NaOH=NaNO +NaNO +H O。现有一定条
2 2 2 3 2 2
件下 NO 和 NO 的混合气体 0.9mol 恰好被 300mL NaOH 溶液完全吸收,则
2
NaOH溶液的物质的量浓度为 。
17.铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采
用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生
产无水氯化亚铁。
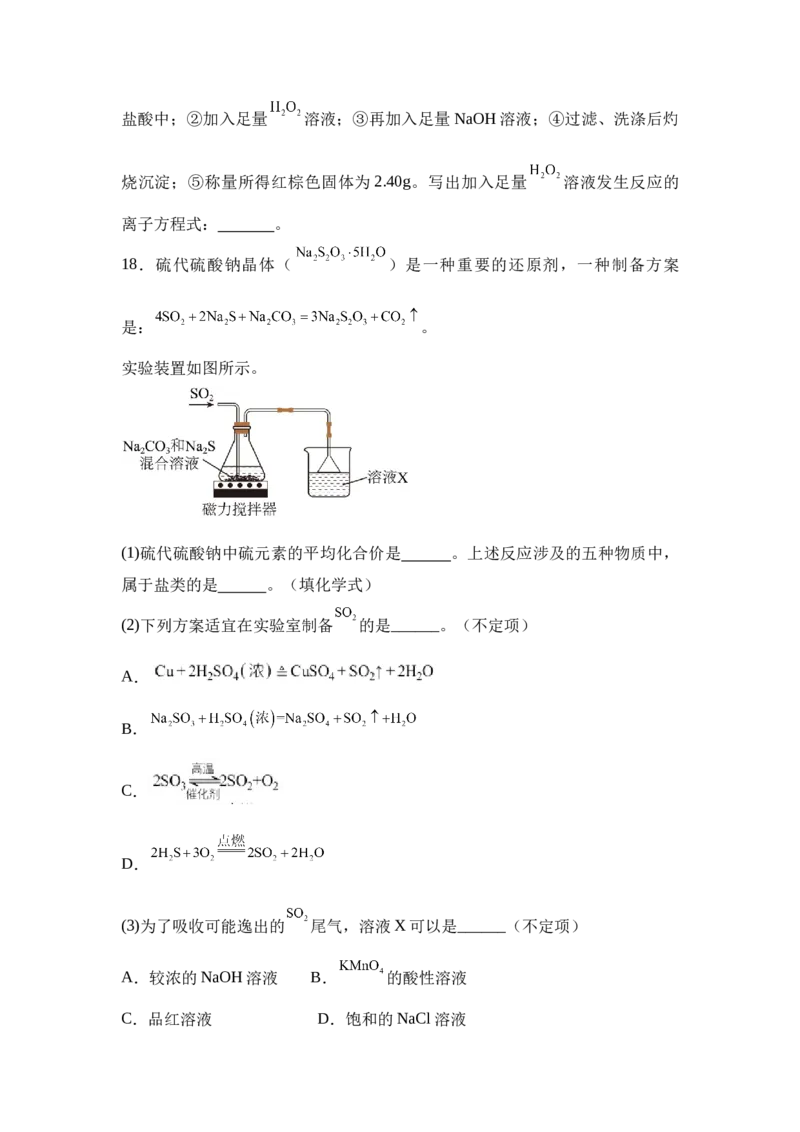
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化
铁。请回答下列问题:
(1)装置 A 中,用 与浓盐酸反应制取氯气,写出反应的离子方程式:
。
(2)装置A中导管a的作用是 。C放置在盛冷水的水槽中,冷水浴的作用
是 。
(3)仪器D中装的药品可以是_______(填序号)。
A. B.碱石灰 C. D.浓硫酸
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中
混有 ,是否可用酸性 溶液检验 的存在? 。(填“是”或
“否”);理由是 。
(5)取装置C中的产物,按以下步骤进行测定:①称取 4.60g产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼
烧沉淀;⑤称量所得红棕色固体为2.40g。写出加入足量 溶液发生反应的
离子方程式: 。
18.硫代硫酸钠晶体( )是一种重要的还原剂,一种制备方案
是: 。
实验装置如图所示。
(1)硫代硫酸钠中硫元素的平均化合价是 。上述反应涉及的五种物质中,
属于盐类的是 。(填化学式)
(2)下列方案适宜在实验室制备 的是______。(不定项)
A.
B.
C.
D.
(3)为了吸收可能逸出的 尾气,溶液X可以是______(不定项)
A.较浓的NaOH溶液 B. 的酸性溶液
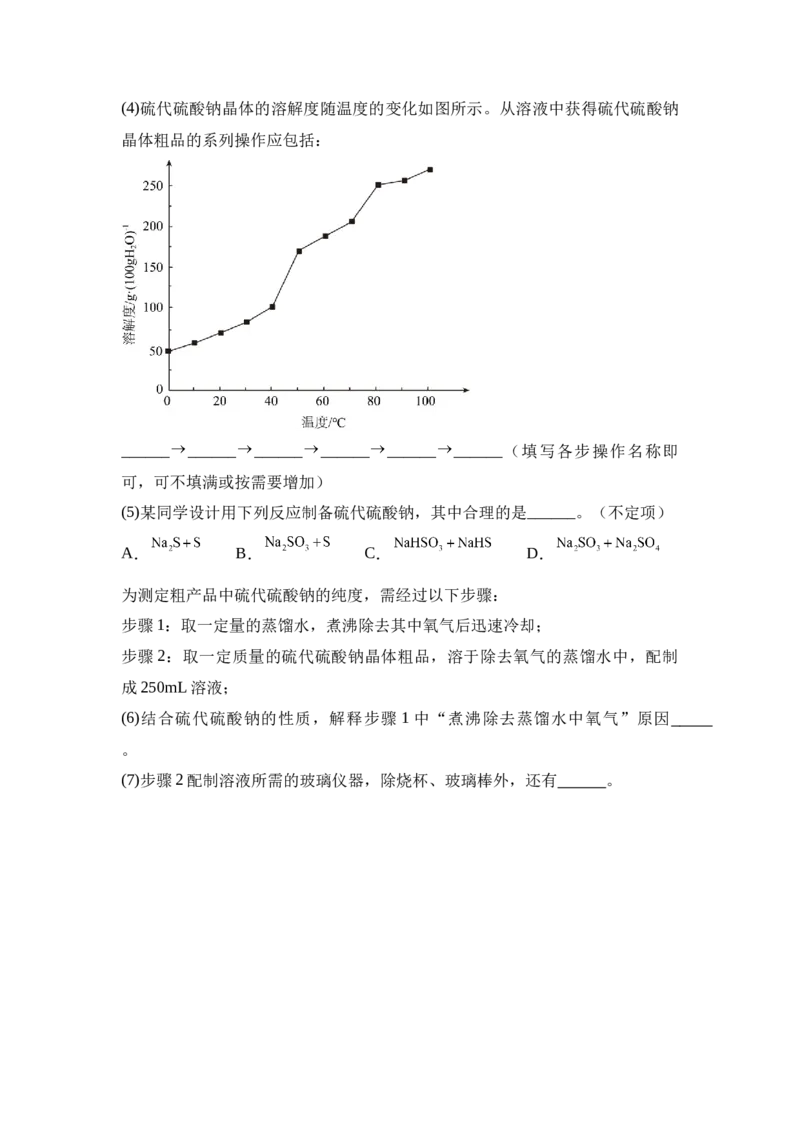
C.品红溶液 D.饱和的NaCl溶液(4)硫代硫酸钠晶体的溶解度随温度的变化如图所示。从溶液中获得硫代硫酸钠
晶体粗品的系列操作应包括:
______ ______ ______ ______ ______ ______(填写各步操作名称即
可,可不填满或按需要增加)
(5)某同学设计用下列反应制备硫代硫酸钠,其中合理的是______。(不定项)
A. B. C. D.
为测定粗产品中硫代硫酸钠的纯度,需经过以下步骤:
步骤1:取一定量的蒸馏水,煮沸除去其中氧气后迅速冷却;
步骤2:取一定质量的硫代硫酸钠晶体粗品,溶于除去氧气的蒸馏水中,配制
成250mL溶液;
(6)结合硫代硫酸钠的性质,解释步骤 1 中“煮沸除去蒸馏水中氧气”原因
。
(7)步骤2配制溶液所需的玻璃仪器,除烧杯、玻璃棒外,还有 。化学参考答案
1.【答案】A
2.【答案】D
3.【答案】C
4.【答案】A
5.【答案】D
6.【答案】D7.【答案】C
8.【答案】A
9.【答案】D
10.【答案】C
11.【答案】B
12.【答案】D
13.【答案】B
14.【答案】D
15.【答案】(1)二(2分)
(2)CO +2H+=CO ↑+H O(2 分) 除尽 CO (2 分) Ba(NO ) (1
2 2 3 2
分) AgNO (1分) 检验Cl-(2分) Cl-+Ag+=AgCl↓(2分)
3
(3)利用焰色试验,透过蓝色钴玻璃观察火焰是否为紫色(2分)
16.【答案】(1)1.204 1024(或2N )(2分) (2分)
A
(2) (2分) 取少量溶液于试管中,加入足量氯化钡
溶液产生白色沉淀,往沉淀中再加入盐酸,沉淀部分溶解且产生无色有刺激性
气味气体,说明溶液D部分氧化(2分)
(3)氧化剂和还原剂(2 分) (2
分) 3mol/L(2分)17.【答案】(1) (2分)
(2)平衡气压,便于浓盐酸顺利流下(2分) 将氯化铁蒸气冷凝成固体便于
收集(2分)
(3)B(2分)
(4)否(2分) 酸性 具有强氧化性,会将氯离子氧化为氯气自身而褪
色,会对亚铁离子检验带来干扰(2分)
(5) (2分)
18.【答案】(1)+2(2分) Na CO 、Na S、Na S O (2分)
2 3 2 2 2 3
(2)AB(2分)
(3)AB(2分)
(4)蒸发浓缩→冷却结晶→过滤→洗涤→干燥(2分)
(5)BC(2分)
(6)防止硫代硫酸钠被氧化(2分)
(7)250mL容量瓶、胶头滴管(2分)