文档内容
班级 姓名 学号 分数
第二章 化学反应速率与化学平衡(A卷·知识通关练)
核心知识1 化学反应速率的计算和比较
1.下列有关化学反应速率的说法中正确的是
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加来表示
C.某反应速率为0.5mol·L-1·s-1,就是指在单位时间内反应物和生成物的浓度变化都为0.5mol/L
D.化学反应速率是用来衡量化学反应进行快慢的尺度
2.已知:4A(g)+5B(g)=4C(g)+6D(g),如果反应速率分别用V(A)、V(B)、V(C)、V(D)表示,正确的关系是
A.4/5V(B)=V(C) B.5/6V(B)=V(D) C.2/3V(A)=V(D) D.4/5V(A)=V(B)
3.一定条件下在一容积恒为2L的容器内发生应:2A(g)+B(g) 2C(g),已知起始投入4molA(g)和
2molB(g),经2s后测得C的浓度为0.6mol·L-1,并且2s后各组⇌分浓度不再改变。下列说法正确的是
A.2s后反应物A和B完全转化为C
B.2s内用物质B表示的平均反应速率为0.6mol·L-1·s-1
C.2s内用物质A表示的平均反应速率为0.3mol·L-1·s-1
D.2s时物质B的浓度为0.5mol·L-1
4.在5L容器中发生3A+B2C的反应,若最初加入A、B都是4mol,6s内B的平均速率是0.02
molL-1s-1
,则6s末容器中A的物质的量为
A.1.8mol B.2.2mol C.2.8mol D.3.4mol
核心知识2 影响化学反应速率的因素
5.100mL6mol/LH SO 跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总
2 4
量。可向反应物中加入适量的
A.碳酸钠(固体) B.水 C.硫酸铜溶液 D.硫酸铵(固体)
6.(2021·广西玉林市·高二月考)下列有关化学反应速率的说法中,正确的是
A.汽车尾气中的CO和NO可以缓慢反应生成N 和CO,减小压强,反应速率减慢
2 2
B.用铁片和稀硫酸反应制取H 时,改用铁片和浓硫酸可以加快产生H 的速率
2 2
C.二氧化硫的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢
1 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.100mL2mol·L-1的盐酸与锌反应时,加入适量的NaCl溶液,生成H 的速率不变
2
7.(2021·四川省夹江中学校高二期中)向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量
的SO 和O,开始反应时,按反应速率由大到小排列顺序正确的是
2 2
(甲)在500oC时,10mol SO 和5 mol O 反应;
2 2
(乙)在450oC时,8mol SO 和5mol O 反应;
2 2
(丙)在500oC时,8mol SO 和5mol O 反应;
2 2
(丁)在500oC时,用VO 作催化剂,10mol SO 和5mol O 反应
2 5 2 2
A.甲、丙、丁、乙 B.丁、甲、丙、乙 C.丙、甲、乙、丁 D.乙、丁、丙、甲
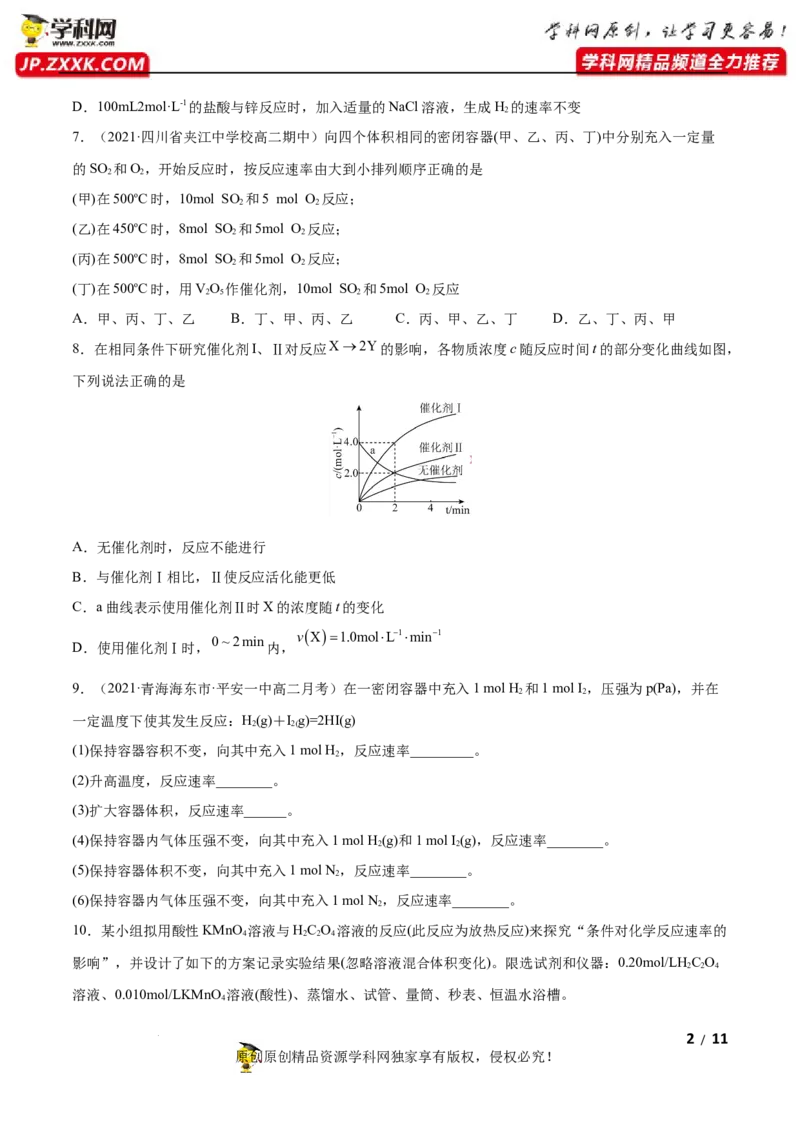
8.在相同条件下研究催化剂I、Ⅱ对反应X2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,
下列说法正确的是
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
vX1.0molL1min1
0~2min
D.使用催化剂Ⅰ时, 内,
9.(2021·青海海东市·平安一中高二月考)在一密闭容器中充入1 mol H 和1 mol I ,压强为p(Pa),并在
2 2
一定温度下使其发生反应:H(g)+I g)=2HI(g)
2 2(
(1)保持容器容积不变,向其中充入1 mol H ,反应速率_________。
2
(2)升高温度,反应速率________。
(3)扩大容器体积,反应速率______。
(4)保持容器内气体压强不变,向其中充入1 mol H (g)和1 mol I (g),反应速率________。
2 2
(5)保持容器体积不变,向其中充入1 mol N ,反应速率________。
2
(6)保持容器内气体压强不变,向其中充入1 mol N ,反应速率________。
2
10.某小组拟用酸性KMnO 溶液与HC O 溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的
4 2 2 4
影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol/LHC O
2 2 4
溶液、0.010mol/LKMnO 溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
4
2 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司物理量 V(0.20mol/LHC O 溶 V(蒸馏 V(0.010mol/L酸性
2 2 4 m(MnSO )/g T/℃ 乙
编号 液)/mL 水)/mL KMnO 溶液)/mL 4
4
① 2.0 0 4.0 0 50
② 2.0 0 4.0 0 25
③ 1.5 a 4.0 0 25
④ 2.0 0 4.0 0.1 25
已知:2KMnO +5HC O+3HSO =KSO +2MnSO +10CO↑+8HO,回答下列问题:
4 2 2 4 2 4 2 4 4 2 2
(1)KMnO 溶液用___________酸化(填名称);写出上述反应的离子方程式:___________;
4
(2)上述实验①②是探究___________对化学反应速率的影响;上述实验②④是探究___________对化学反应
速率的影响。
(3)若上述实验②③是探究浓度对化学反应速率的影响,则a为___________;表格中的“乙”填写t/s,其
测量的是___________。
核心知识3 活化能
11.下列说法不正确的是
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.其他条件不变时,浓度增大不能增大活化分子百分数
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
12.下列关于化学反应速率的说法正确有几个
①有气体参加的化学反应,若增大压强可增加活化分子数目,从而使反应速率增大
②其他条件不变,温度越高,化学反应速率越快
③其他条件不变,升高温度能增大反应物分子中活化分子的百分数
④增大反应物浓度,可增大活化分子的百分数,从而使单位时间内有效碰撞次数增多
⑤如果使用催化剂,可使反应物所有分子间的碰撞机会增多,则反应速率加快
⑥如果使反应物分子的能量增加,则活化分子百分数增大,有效碰撞次数增多
⑦如果活化分子百分数未变,但增加单位体积内活化分子数,可以使有效碰撞次数增多
A.3个 B.4个 C.5个 D.6个
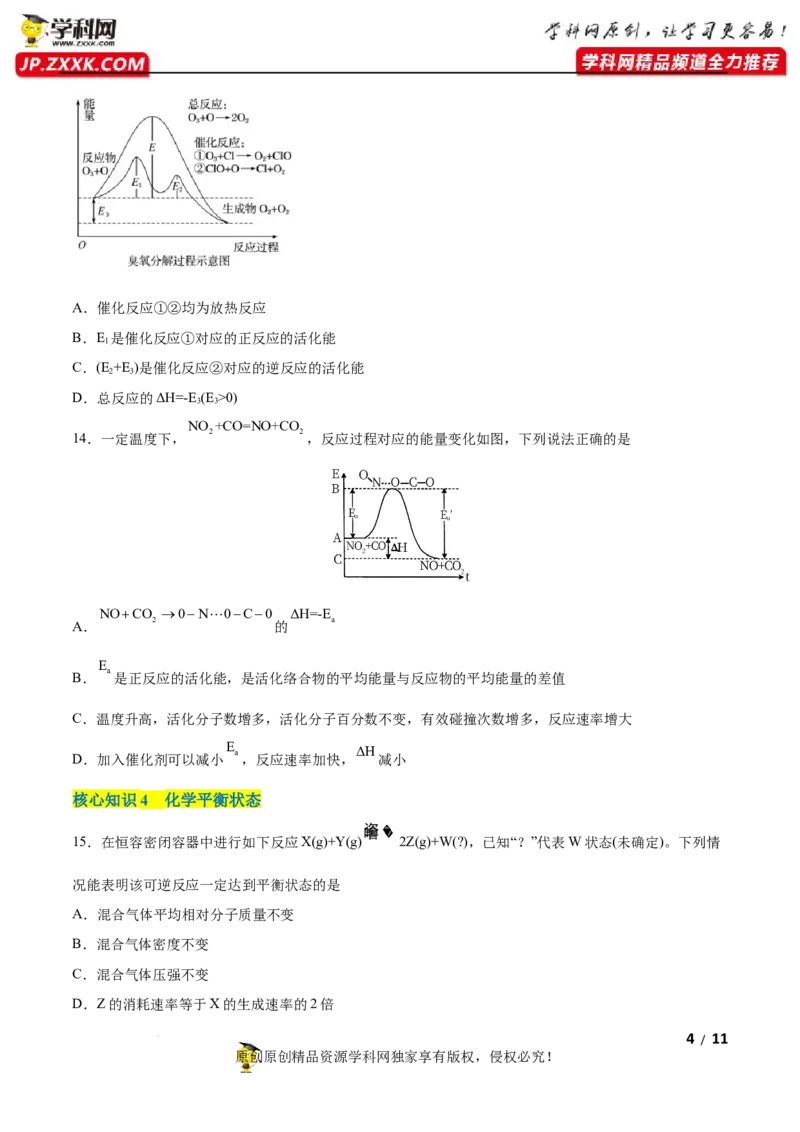
13.(2021·浙江高二月考)臭氧层中O 分解过程如图所示,下列说法不正确的是
3
3 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.催化反应①②均为放热反应
B.E 是催化反应①对应的正反应的活化能
1
C.(E +E)是催化反应②对应的逆反应的活化能
2 3
D.总反应的ΔH=-E (E >0)
3 3
NO +CO=NO+CO
2 2
14.一定温度下, ,反应过程对应的能量变化如图,下列说法正确的是
NOCO 0N 0C0 ΔH=-E
2 a
A. 的
E
a
B. 是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值
C.温度升高,活化分子数增多,活化分子百分数不变,有效碰撞次数增多,反应速率增大
E
a ΔH
D.加入催化剂可以减小 ,反应速率加快, 减小
核心知识4 化学平衡状态
噲垐��
15.在恒容密闭容器中进行如下反应X(g)+Y(g) 2Z(g)+W(?),已知“?”代表W状态(未确定)。下列情
况能表明该可逆反应一定达到平衡状态的是
A.混合气体平均相对分子质量不变
B.混合气体密度不变
C.混合气体压强不变
D.Z的消耗速率等于X的生成速率的2倍
4 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
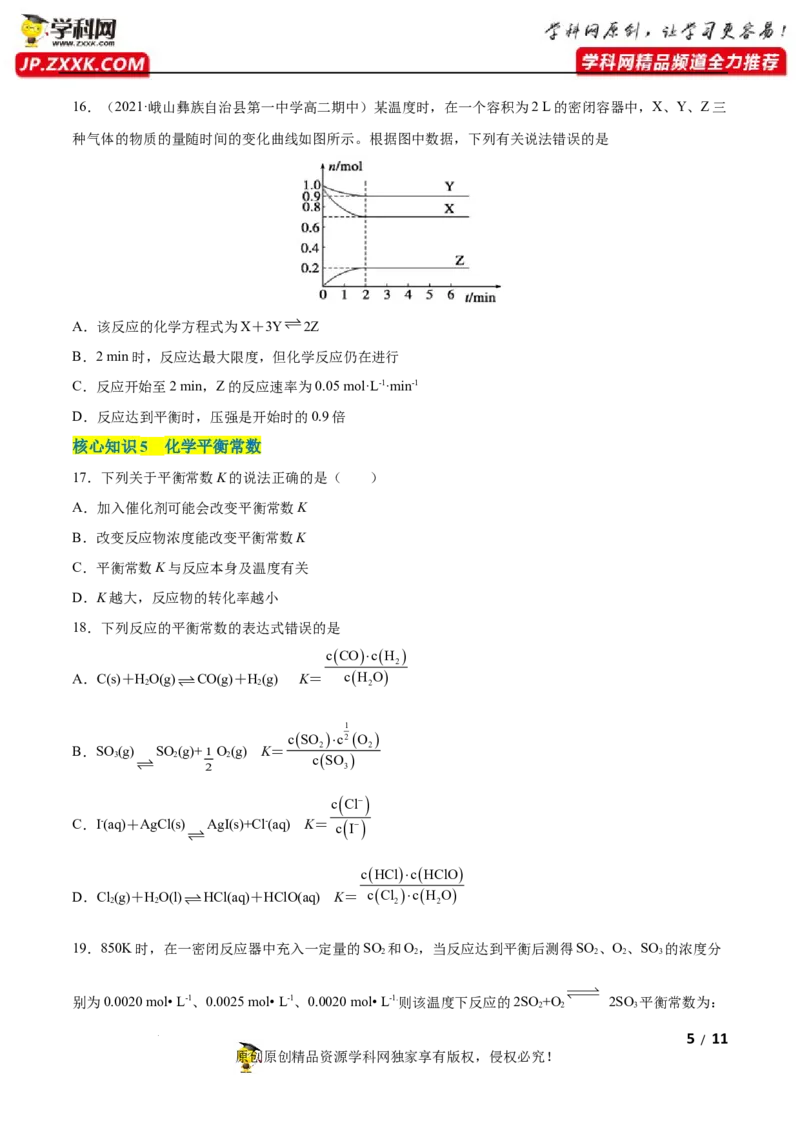
学科网(北京)股份有限公司16.(2021·峨山彝族自治县第一中学高二期中)某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三
种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是
A.该反应的化学方程式为X+3Y2Z
B.2 min时,反应达最大限度,但化学反应仍在进行
C.反应开始至2 min,Z的反应速率为0.05 mol·L-1·min-1
D.反应达到平衡时,压强是开始时的0.9倍
核心知识5 化学平衡常数
17.下列关于平衡常数K的说法正确的是( )
A.加入催化剂可能会改变平衡常数K
B.改变反应物浓度能改变平衡常数K
C.平衡常数K与反应本身及温度有关
D.K越大,反应物的转化率越小
18.下列反应的平衡常数的表达式错误的是
cCOcH
2
A.C(s)+HO(g) CO(g)+H(g) K= cH O
2 2 2
1
cSO c2O
B.SO (g) SO (g)+1 O(g) K= 2 2
3 2 2 cSO
2 3
c
Cl
C.I-(aq)+AgCl(s) AgI(s)+Cl-(aq) K=
c
I
cHClcHClO
D.Cl(g)+HO(l) HCl(aq)+HClO(aq) K= cCl cH O
2 2 2 2
19.850K时,在一密闭反应器中充入一定量的SO 和O,当反应达到平衡后测得SO 、O、SO 的浓度分
2 2 2 2 3
别为0.0020 mol• L-1、0.0025 mol• L-1、0.0020 mol• L-1.则该温度下反应的2SO +O
2SO 平衡常数为:
2 2 3
5 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.25 B.0.0025 C.40 D.400
14.已知反应 2NH N+3H ,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应N +
3 2 2 2
3H 2NH 的平衡常数⇌为
2 3
A.⇌4 B.2 C.1 D.0.5
催化剂
2SO (g)+O (g) 2SO (g)
20.在一定温度下的密闭容器中存在如下反应: 2 2 Δ 3 ,已知
c 始 SO 2 =0.4molL-1 , c 始 O 2 1molL1 ,经测定该反应在该温度下的平衡常数 K=19 ,则此反应中 SO 2
的转化量为( )
0.24molL1 0.28molL1
A. B.
0.32molL1 0.26molL1
C. D.
核心知识6 影响化学平衡的因素
21.下列说法正确的是
①增加水的量或升高温度,都可以加快镁跟水的反应速率
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
③在可变体积的容器中进行3H(g)+N(g) 2NH (g)反应,充入氦气化学反应速率一定不改变
2 2 3
④对于反应3KSCN(aq)+FeCl (aq) Fe(SC⇌N) (aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后
3 3
正反应速率增大 ⇌
A.①② B.①④ C.②④ D.无
22.在容积固定的密闭容器中,发生反应N(g)+3H(g) 2NH (g)+Q(Q>0),改变条件,其平衡移动方向正
2 2 3
确的是
⇌
A.增大压强,往正反应方向移动 B.加入催化剂,往正反应方向移动
C.升高温度,往正反应方向移动 D.移走氮气,往正方向方向移动
23.有一处于平衡状态的反应X(s)+3Y(g)2Z(g)(正反应是放热反应)。为了使平衡向生成Z的方向移动,
应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
24.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为
6 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司
2CO(g)+6H(g) CHCHOH(g)+3H O(g)。下列叙述正确的是
2 2 3 2 2
A.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量
B.当v(CO)=2v(CH CHOH)时,反应一定达到平衡状态
2 3 2
C.移去水蒸气,可增大正反应速率
D.恒压,充入惰性气体,化学反应速率增大
25.在固定容积的密闭容器中,发生反应:2X(g)+Y(s)
Z(g)+W(g),其化学平衡常数与温度的关系
如表:
T/℃ 700 800 900 1000 1200
K 0.6 0.9 1.3 1.8 2.7
对该反应而言,下列说法正确的是
A.增大压强,平衡向正反应方向移动
B.温度不变,增加X的量,K增大
C.达平衡后,加入催化剂,反应物转化率增大
D.该反应的正反应为吸热反应
cCO cH O
2
26.高温下,某反应达到平衡,平衡常数K= cCO 2 cH 2 ,恒容时,温度升高,H 2 浓度减小。下列说
法正确的是
A.该反应的化学方程式为CO+HO CO+H
2 2 2
B.恒温恒容下,增大H 浓度平衡常⇌数K减小
2
C.平衡移动时,K值一定变化
D.该反应的正反应是吸热反应
27.已知化学反应
①:Fe(s)+CO (g)FeO(s)+CO(g),其化学平衡常数为K
2 1
②:Fe(s)+H O(g)FeO(s)+H (g),其化学平衡常数为K
2 2 2
在温度973 K和1173 K的情况下,K、K 的值分别如下:
1 2
K
K K
1 2
温度
973 K 1.47 2.38
7 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司1173 K 2.15 1.67
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO(g)+H(g)CO(g)+HO(g),请你写出该反应的平衡常数K 的表达式:K=_______。
2 2 2 3 3
推断出反应③是_______(填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_______(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
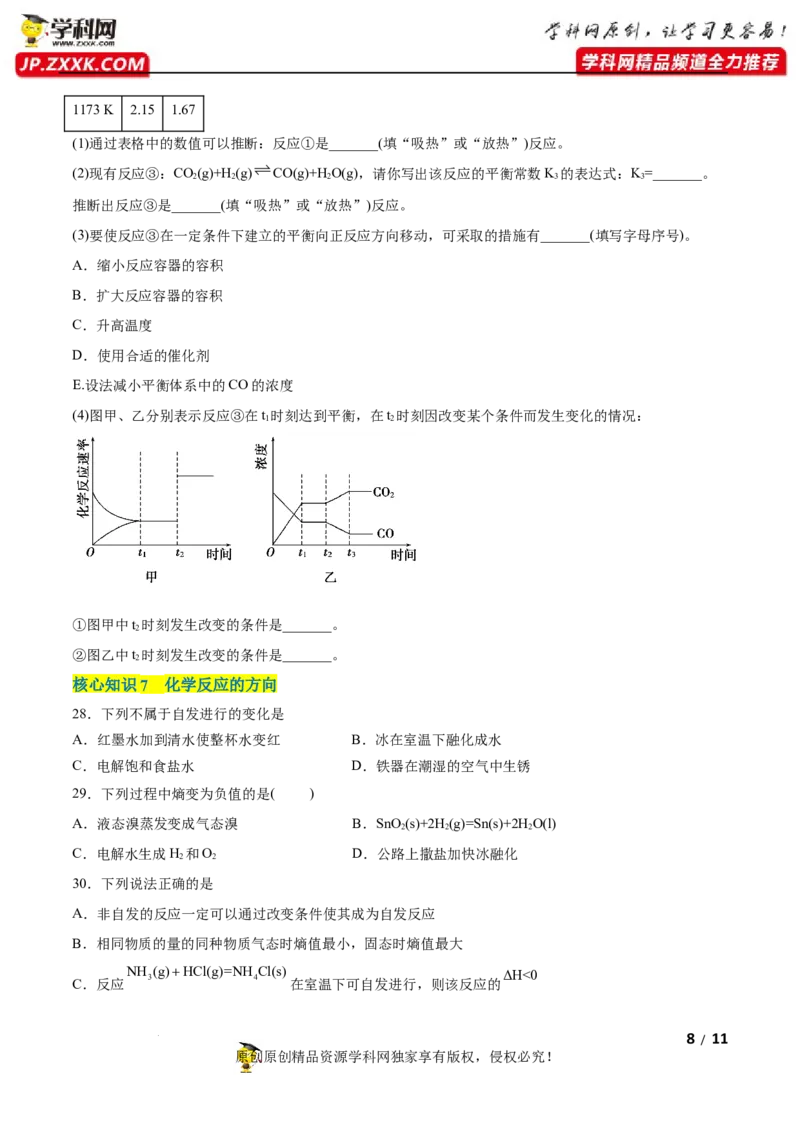
(4)图甲、乙分别表示反应③在t 时刻达到平衡,在t 时刻因改变某个条件而发生变化的情况:
1 2
①图甲中t 时刻发生改变的条件是_______。
2
②图乙中t 时刻发生改变的条件是_______。
2
核心知识7 化学反应的方向
28.下列不属于自发进行的变化是
A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水
C.电解饱和食盐水 D.铁器在潮湿的空气中生锈
29.下列过程中熵变为负值的是( )
A.液态溴蒸发变成气态溴 B.SnO (s)+2H(g)=Sn(s)+2HO(l)
2 2 2
C.电解水生成H 和O D.公路上撒盐加快冰融化
2 2
30.下列说法正确的是
A.非自发的反应一定可以通过改变条件使其成为自发反应
B.相同物质的量的同种物质气态时熵值最小,固态时熵值最大
NH (g)HCl(g)=NH Cl(s) ΔH<0
3 4
C.反应 在室温下可自发进行,则该反应的
8 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.恒温恒压下,ΔH<0且ΔS>0的反应一定不能自发进行
31.自由能的变化GH TS是判断反应进行方向的复合判据。G0时,反应能自发进行。已知工
业上常利用 CH 4 和 H 2 O 来制备水煤气,化学方程式为 CH 4 g+H 2 Og=COg+3H 2 g , H 0 则下列说
法正确的是( )
A.S 0,高温下该反应能自发进行 B.S 0,高温下该反应能自发进行
C.S 0,低温下该反应能自发进行 D.S 0,任何温度下该反应都能自发进行
核心知识8 化学反应的调控
催化剂
32.氨催化氧化的反应为:4NH
(g)+5O(g)Δ 4NO(g)+6H
O(g),∆H<0。下列有关说法正确的是
3 2 2
A.该反应∆S<0
B.催化剂降低了正、逆反应的活化能
C.升高温度,该反应的平衡常数增大
D.适当降低反应温度或使用高效催化剂均能提高氨气的平衡转化率
NH
33.合成氨反应达到平衡时, 3的体积分数与温度、压强的关系如图所示,据此分析合成氨工业中最有
前途的研究方向是( )
A.提高分离技术 B.研制耐高压的合成塔
N H
C.研制低温催化剂 D.探索不用 2和 2合成氨的新途径
34.下列关于工业合成氨的叙述错误的是( )
A.在动力、设备,材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中,N、H 的循环利用可降低成本
2 2
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
9 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司NH
35.下表所列实验数据是在不同温度和压强下达到平衡状态时,混合物中 3的含量(体积分数)的变化
VN :VH =1:3
情况[投料比 2 2
0.1 10 20 30 60 100
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.2 52.0 64.2 71.0 84.2 92.6
400 0.4 25.1 38.2 47.0 65.2 79.8
500 0.1 10.6 19.1 26.4 42.2 57.5
600 0.05 4.5 9.1 13.8 23.1 31.4
(1)比较200℃和300℃时的数据,可判断出升高温度,平衡向_____(填“正反应”或“逆反应”)方向移动,
合成氨的正反应为_________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨的适宜条件是_________(填序号)
A 高温、高压 B 高温、低压 C 低温、高压 D 低温、低压
30MPa N
(3)500℃、 时, 2的转化率为__________。
(4)工业中实际生产氨时,考虑到浓度对化学平衡及反应速率的影响,常采取的措施有:__________。
10 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司11 / 11
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司