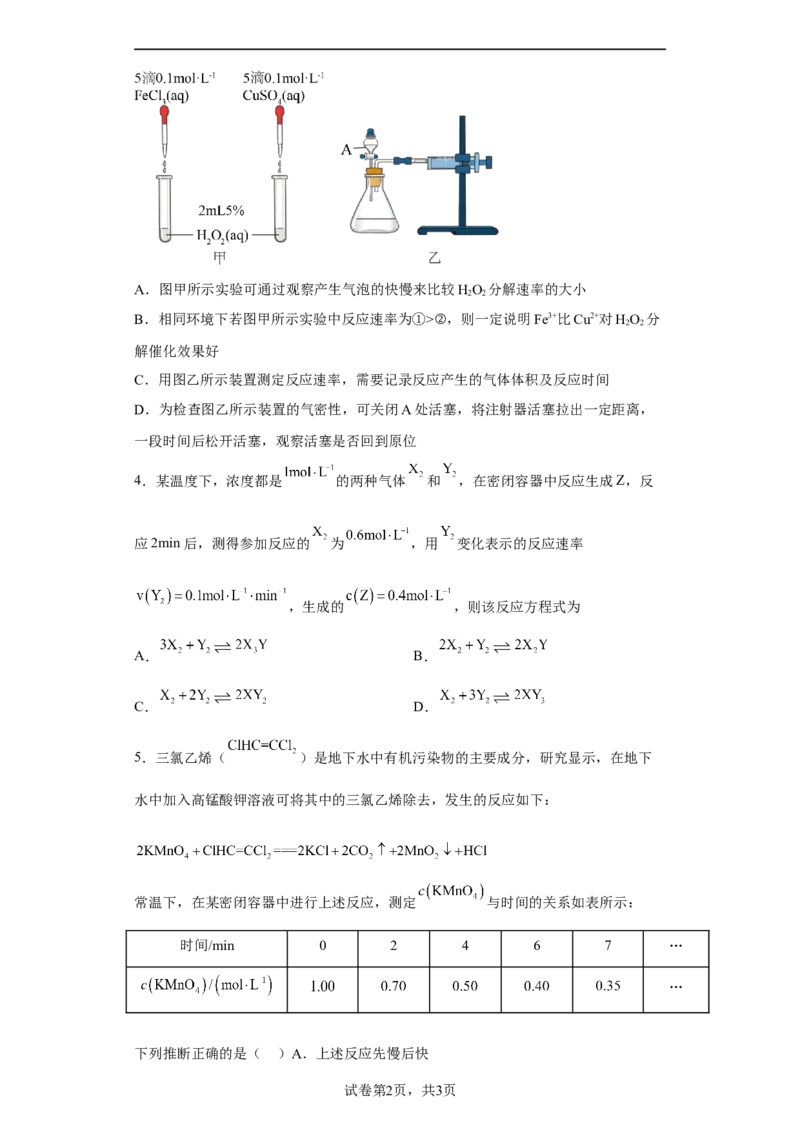文档内容
人教版(2019)必修第二册第六章第二节化学反应的速率与
限度课时训练三
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在一密闭容器中进行如下反应: ,已知反应过程中某
一时刻 、 、 ,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡
时,可能存在的数据是
A. 为0.4mol/L、 为0.2mol/L B. 为0.25mol/L
C. 、 均为0.15mol/L D. 为0.4mol/L
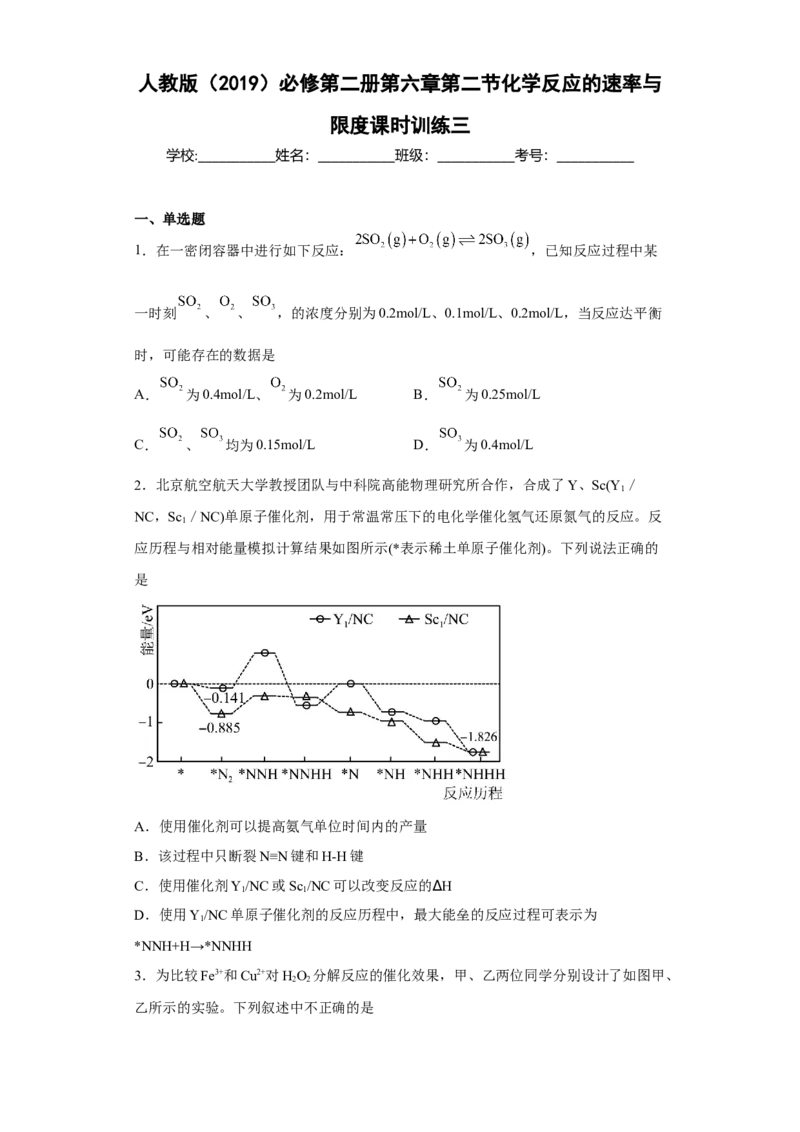
2.北京航空航天大学教授团队与中科院高能物理研究所合作,合成了Y、Sc(Y /
1
NC,Sc /NC)单原子催化剂,用于常温常压下的电化学催化氢气还原氮气的反应。反
1
应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法正确的
是
A.使用催化剂可以提高氨气单位时间内的产量
B.该过程中只断裂N≡N键和H-H键
C.使用催化剂Y/NC或Sc /NC可以改变反应的∆H
1 1
D.使用Y/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为
1
*NNH+H→*NNHH
3.为比较Fe3+和Cu2+对HO 分解反应的催化效果,甲、乙两位同学分别设计了如图甲、
2 2
乙所示的实验。下列叙述中不正确的是A.图甲所示实验可通过观察产生气泡的快慢来比较HO 分解速率的大小
2 2
B.相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对HO 分
2 2
解催化效果好
C.用图乙所示装置测定反应速率,需要记录反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,
一段时间后松开活塞,观察活塞是否回到原位
4.某温度下,浓度都是 的两种气体 和 ,在密闭容器中反应生成Z,反
应2min后,测得参加反应的 为 ,用 变化表示的反应速率
,生成的 ,则该反应方程式为
A. B.
C. D.
5.三氯乙烯( )是地下水中有机污染物的主要成分,研究显示,在地下
水中加入高锰酸钾溶液可将其中的三氯乙烯除去,发生的反应如下:
常温下,在某密闭容器中进行上述反应,测定 与时间的关系如表所示:
时间/min 0 2 4 6 7 …
…
下列推断正确的是( )A.上述反应先慢后快
试卷第2页,共3页B. 内,
C.若高锰酸钾完全反应,所用时间为
D.随着反应的进行, 逐渐降低
6.在不同条件下,用 氧化一定浓度 溶液的过程中所测得的实验数据如图所示。
下列分析或推测不合理的是( )
A. 内, 的氧化率随时间延长而逐渐增大
B.由曲线②和③可知,pH越大, 的氧化速率越快
C.由曲线①和③可知,温度越高, 的氧化速率越快
D.氧化过程的离子方程式为
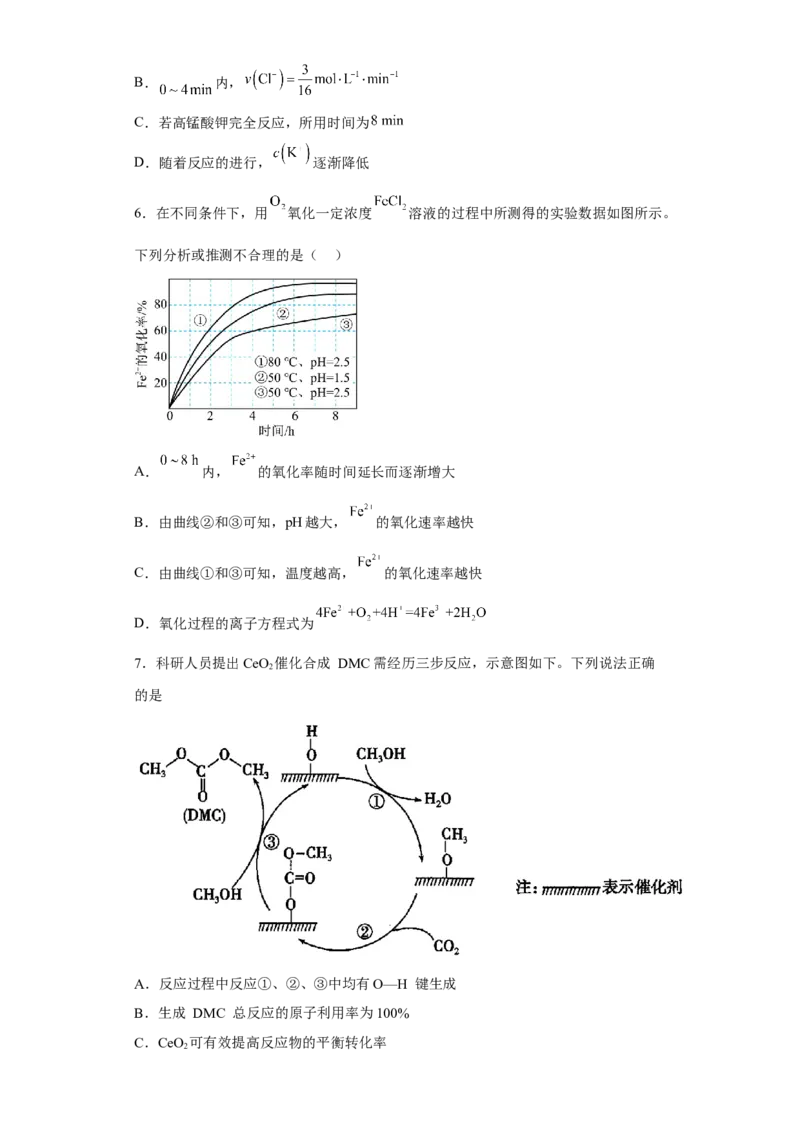
7.科研人员提出CeO 催化合成 DMC需经历三步反应,示意图如下。下列说法正确
2
的是
A.反应过程中反应①、②、③中均有O—H 键生成
B.生成 DMC 总反应的原子利用率为100%
C.CeO 可有效提高反应物的平衡转化率
2D.DMC 与过量 NaOH 溶液反应生成 NaCO 和甲醇
2 3
8.苯乙烯与溴苯在一定条件下发生Heck反应:
溴苯用量(mmol) 100 100 100 100 100 100 100
催化剂用量(mmol) 2 2 2 2 2 2 2
反应温度(℃) 100 100 100 100 120 140 160
反应时间(h) 10 12 14 16 14 14 14
产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0
根据上表数据,下列说法正确的是A.最佳反应温度为100 ℃ B.最佳反应时间为
16h
C.温度过高时催化剂活性可能降低 D.反应产物是顺式结构
9.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体
积忽略不计),在恒定温度下使其达到分解平衡:H
2
NCOONH
4
(s)⇌2NH
3
(g)+CO
2
(g)。
能判断该反应已经达到化学平衡的是
①v(NH
3
)
正
=2v(CO
2
)
逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器混合气体的总物质的量不变
⑥密闭容器中 CO 的体积分数不变
2
⑦混合气体总质量不变
A.①②⑤⑦ B.①②③⑤⑦ C.①②③⑤⑥ D.全部
10.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体
积忽略不计),在恒定温度下使其达到分解平衡:HNCOONH (s) 2NH (g)+CO (g)。下
2 4 3 2
列能判断该反应已经达到化学平衡的个数有 ⇌
①v(NH
3
)
正
=2v(CO
2
)
逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器混合气体的总物质的量不变
试卷第4页,共3页⑥密闭容器中CO 的体积分数不变
2
⑦混合气体总质量不变
A.4个 B.5个 C.6个 D.7个
11.在一定温度下,可逆反应2NO 2NO+O 在体积固定的密闭容器中进行,反应达
2 2
到平衡状态的标志是
①单位时间内生成n mol O ,同进生成2n mol NO
2 2
②单位时间内生成n mol O ,同进生成2n mol NO
2
③用NO 、NO、O 的物质的量浓度变化表示的反应速率之比为2∶2∶1
2 2
④混合气体的密度不再改变
⑤混合气体的颜色不再改变
A.①⑤ B.①③⑤ C.②④ D.以上全部
12.在密闭容器中进行反应 , 、 、 的起始浓度分别为
、 、 ,当平衡时,下列数据肯定不正确的是
A. 的物质的量为 , 的物质的量为
B. 的物质的量为
C. 的物质的量为 , 的物质的量为
D. 的物质的量为
13.一定温度下在一定体积的密闭容器中,下列叙述能作为可逆反应N(g)+3H(g)
2 2
2NH (g)达到平衡状态标志的是
3
①NH 的生成速率与NH 的消耗速率相等
3 3
②单位时间内断裂3molH—H键,同时断裂2molN—H键
③混合气体的总压强不再变化
④混合气体的平均相对分子质量不再变化
⑤混合气体的密度保持不变
⑥N 、H 和NH 的分子数之比为1∶3∶2
2 2 3
A.①③④ B.①④⑤ C.③④⑥ D.②⑤⑥
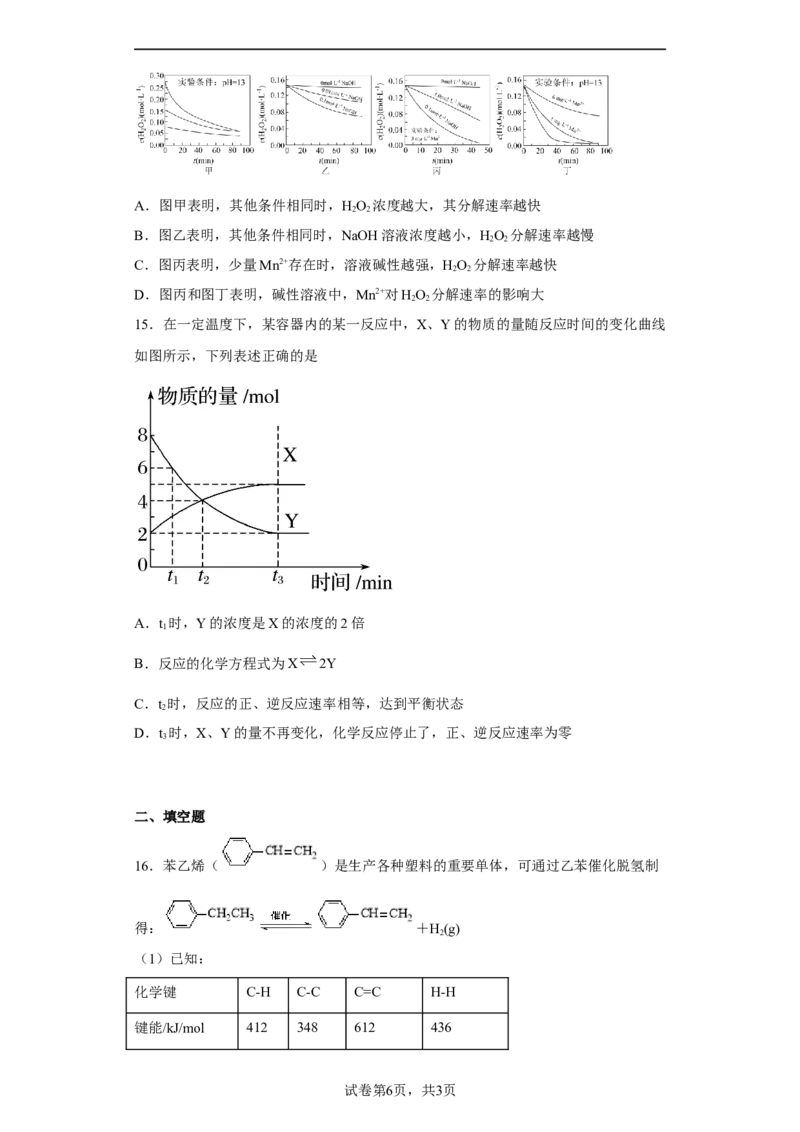
14.HO 分解速率受多种因素影响。实验测得 70 ℃时不同条件下HO 浓度随时间的
2 2 2 2
变化如图所示。下列说法不正确的是A.图甲表明,其他条件相同时,HO 浓度越大,其分解速率越快
2 2
B.图乙表明,其他条件相同时,NaOH溶液浓度越小,HO 分解速率越慢
2 2
C.图丙表明,少量Mn2+存在时,溶液碱性越强,HO 分解速率越快
2 2
D.图丙和图丁表明,碱性溶液中,Mn2+对HO 分解速率的影响大
2 2
15.在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线
如图所示,下列表述正确的是
A.t 时,Y的浓度是X的浓度的2倍
1
B.反应的化学方程式为X 2Y
C.t 时,反应的正、逆反应速率相等,达到平衡状态
2
D.t 时,X、Y的量不再变化,化学反应停止了,正、逆反应速率为零
3
二、填空题
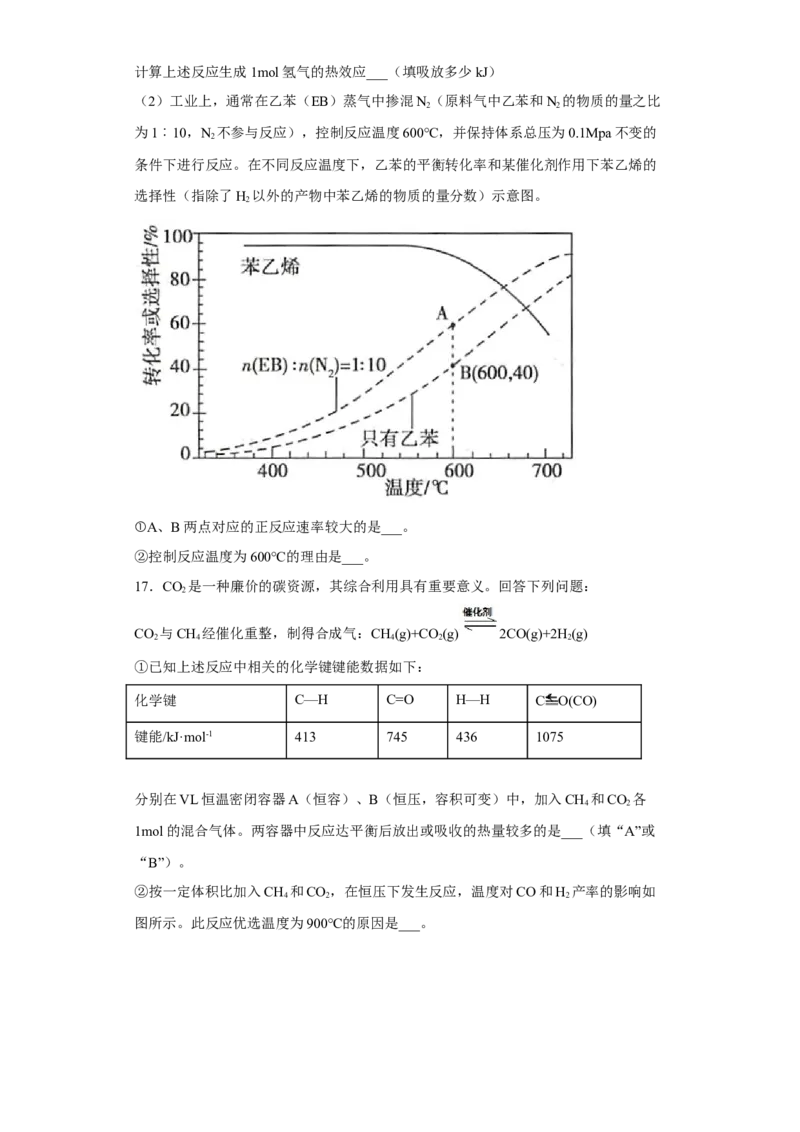
16.苯乙烯( )是生产各种塑料的重要单体,可通过乙苯催化脱氢制
得: +H(g)
2
(1)已知:
化学键 C-H C-C C=C H-H
键能/kJ/mol 412 348 612 436
试卷第6页,共3页计算上述反应生成1mol氢气的热效应___(填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N(原料气中乙苯和N 的物质的量之比
2 2
为1︰10,N 不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的
2
条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的
选择性(指除了H 以外的产物中苯乙烯的物质的量分数)示意图。
2
①A、B两点对应的正反应速率较大的是___。
②控制反应温度为600℃的理由是___。
17.CO 是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
2
CO 与CH 经催化重整,制得合成气:CH(g)+CO (g) 2CO(g)+2H(g)
2 4 4 2 2
①已知上述反应中相关的化学键键能数据如下:
化学键 C—H C=O H—H C O(CO)
键能/kJ·mol-1 413 745 436 1075
分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH 和CO 各
4 2
1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___(填“A”或
“B”)。
②按一定体积比加入CH 和CO,在恒压下发生反应,温度对CO和H 产率的影响如
4 2 2
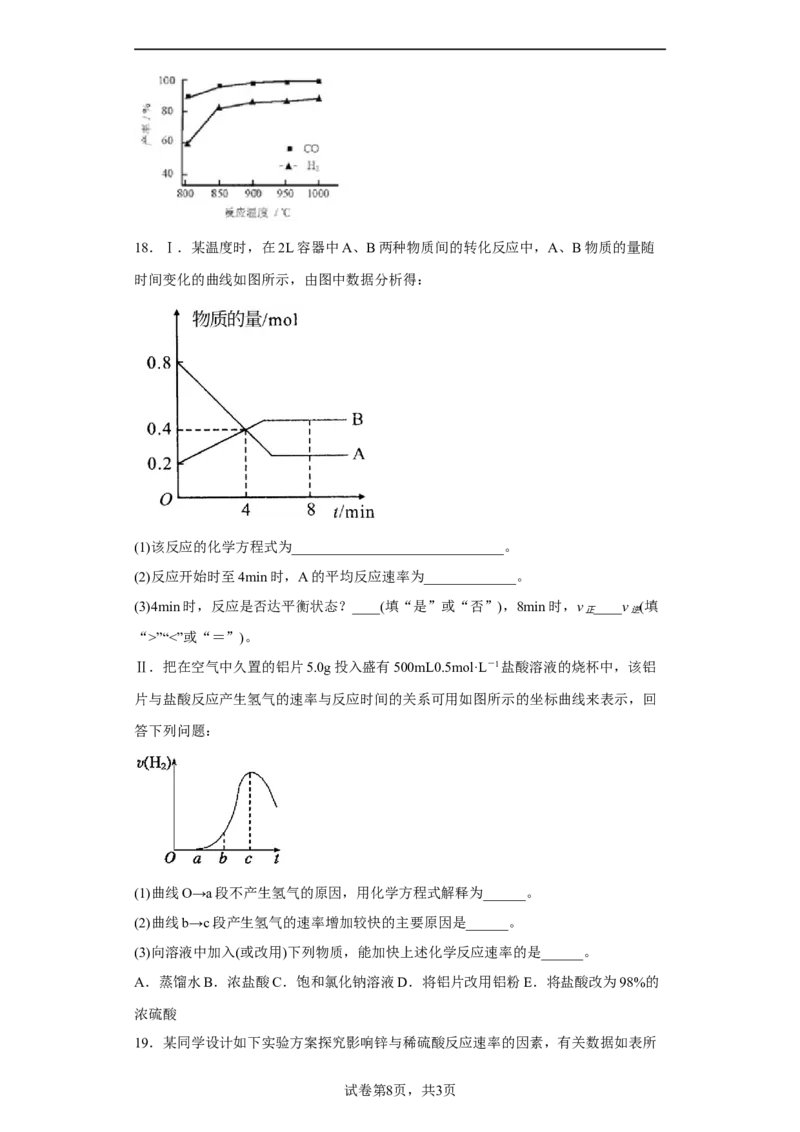
图所示。此反应优选温度为900℃的原因是___。18.Ⅰ.某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随
时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为______________________________。
(2)反应开始时至4min时,A的平均反应速率为_____________。
(3)4min时,反应是否达平衡状态?____(填“是”或“否”),8min时,v ____v (填
正 逆
“>”“<”或“=”)。
Ⅱ.把在空气中久置的铝片5.0g投入盛有500mL0.5mol·L-1盐酸溶液的烧杯中,该铝
片与盐酸反应产生氢气的速率与反应时间的关系可用如图所示的坐标曲线来表示,回
答下列问题:
(1)曲线O→a段不产生氢气的原因,用化学方程式解释为______。
(2)曲线b→c段产生氢气的速率增加较快的主要原因是______。
(3)向溶液中加入(或改用)下列物质,能加快上述化学反应速率的是______。
A.蒸馏水B.浓盐酸C.饱和氯化钠溶液D.将铝片改用铝粉E.将盐酸改为98%的
浓硫酸
19.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如表所
试卷第8页,共3页示:
序 纯锌粉 2.0mol·L-1硫酸溶液 温度 硫酸铜固体 加入蒸馏水
号 (g) (mL) (℃) (g) (mL)
Ⅰ 2.0 50.0 25 0 0
Ⅱ 2.0 40.0 25 0 10.0
Ⅲ 2.0 50.0 25 0.2 0
Ⅳ 2.0 50.0 25 4.0 0
①实验Ⅰ和实验Ⅱ可以探究___对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是___,写出有关反应的离子方程式___,___。
20.反应3Fe(s)+4HO(g) Fe O(s)+4H(g),在一容积可变的密闭容器中进行,试回
2 3 4 2
答:
(1)增加Fe的量,其正反应速率_________(填“增大”“不变”或“减小”,下同),
平衡________移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。
(2)将容器的体积缩小一半,其正反应速率________,平衡________移动。
(3)保持体积不变,充入N 使体系压强增大,其正反应速率________,平衡
2
____________移动。
(4)保持体积不变,充入水蒸气,其正反应速率________,平衡____________移动。
三、实验题
21.已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气
法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次
实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温
度为298K、308K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编 锌规 盐酸浓度/
T/K 实验目的
号 格 mol·L-1
粗颗
① 298 2.00
粒 (I)实验①和②探究盐酸浓度对该反应速率的影
响;
粗颗 (II)实验①和_________探究温度对该反应速率的
② 298 1.00
粒 影响;
(III)实验①和_________探究锌规格(粗、细)对该
粗颗 反应速率的影响。
③ 308 2.00
粒细颗
④ 298 2.00
粒
(2)实验①记录如下(换算成标况):
时间(s) 10 20 30 40 50 60 70 80 90 100
氢气体积(mL) 16.8 39.2 67.2 224 420 492.8 520.8 543.2 554.4 560
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=_________ (忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s)为_________,可能原因是_________;
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先
在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H 气体总量
2
的情况下,你认为他上述做法中可行的是_________(填相应字母);A.NaNO 溶液B.
3
NaCl溶液 C.CuSO 溶液 D.NaCO
4 2 3
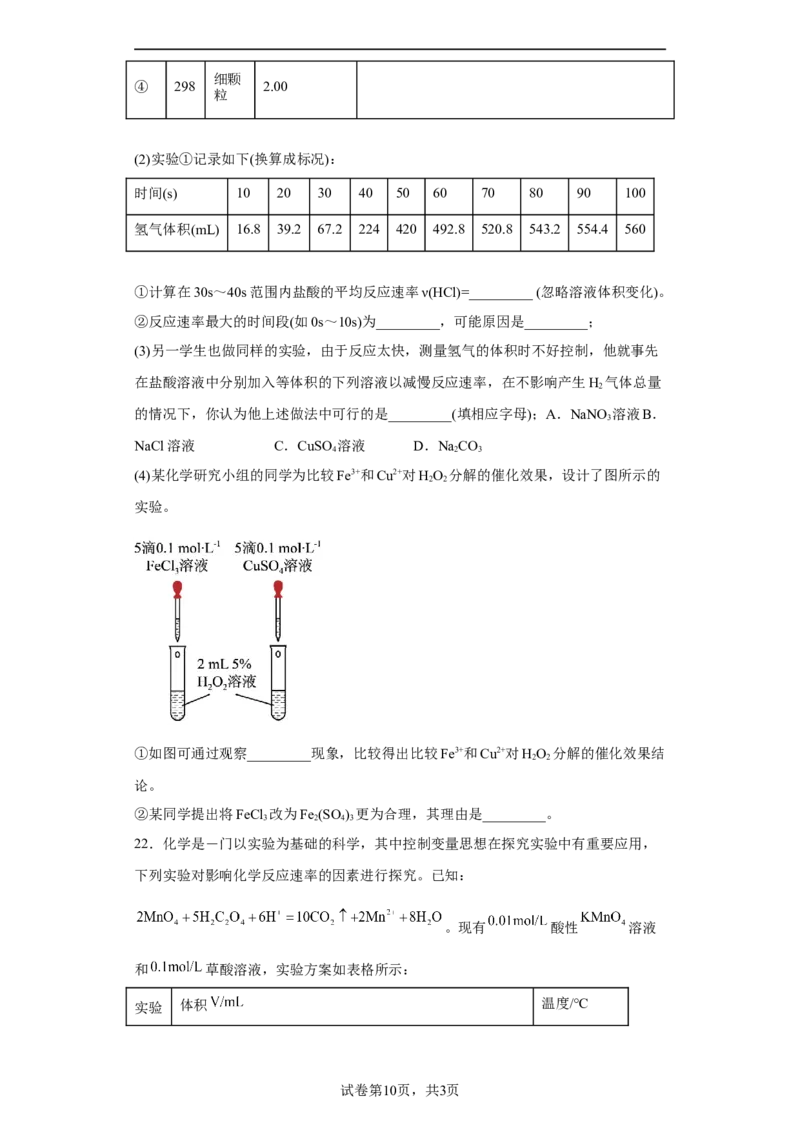
(4)某化学研究小组的同学为比较Fe3+和Cu2+对HO 分解的催化效果,设计了图所示的
2 2
实验。
①如图可通过观察_________现象,比较得出比较Fe3+和Cu2+对HO 分解的催化效果结
2 2
论。
②某同学提出将FeCl 改为Fe (SO ) 更为合理,其理由是_________。
3 2 4 3
22.化学是―门以实验为基础的科学,其中控制变量思想在探究实验中有重要应用,
下列实验对影响化学反应速率的因素进行探究。已知:
。现有 酸性 溶液
和 草酸溶液,实验方案如表格所示:
实验 体积 温度/℃
试卷第10页,共3页序号 溶液 水 溶液
① 4.0 0.0 2.0 25
② 4.0 0.0 2.0 60
③ 4.0 1.0 25
(1) 参与反应,则电子转移_______ 。
(2)通过实验①、③可探究草酸的____(填浓度或温度)对反应速率的影响,表中
V=___mL。
x
(3)描述并对比实验①、②的实验现象_______,由此得出结论_______。
(4)实验①中 时溶液褪色,用草酸表示的反应速率 ___(保留2位有效
数字)。
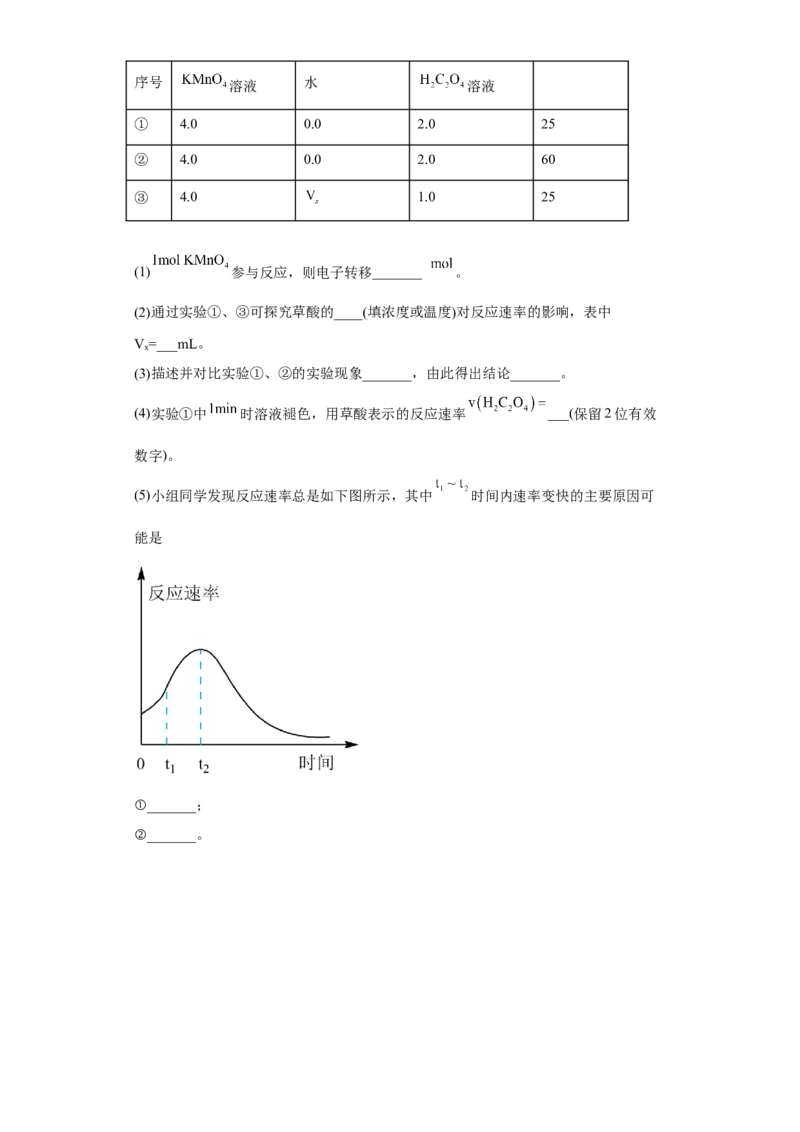
(5)小组同学发现反应速率总是如下图所示,其中 时间内速率变快的主要原因可
能是
①_______;
②_______。参考答案:
1.B
【详解】A.SO 和O 的浓度增大,说明反应向逆反应方向进行建立平衡,若SO 完全反
2 2 3
应,则SO 和O 的浓度的变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于
2 2
该值,所以SO 小于 0.4mol/L,O 小于0.2mol/L,故A不可能;
2 2
B.SO 的浓度增大,说明反应向逆反应方向进行建立平衡,SO 的浓度大于0.2mol/L、小
2 2
于0.4mol/L,该题中为0.25mol/L,在此范围内,故B可能;
C.反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故C不可能;
D.SO 的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,
3
SO 的浓度的变化为0.4mol/L,但是反应为可逆反应,实际变化应小于0.4mol/L,故D不可
3
能;
故答案为B。
2.A
【详解】A.催化剂可以加快化学反应速率,所以使用催化剂可以提高氨气单位时间内的
产量,故A正确;
B.该过程中既有N≡N键和H-H键断裂,又有催化剂中NC间的化学键断裂,故B错误;
C.使用催化剂Y/NC或Sc /NC,能改变化学反应速率,不能改变反应的∆H,∆H只与反
1 1
应物和生成物的能量有关,故C错误;
D.使用Y/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为
1
*N+H→*NNH,故D错误;
2
故答案:A。
3.B
【详解】A.反应速率可以通过观察产生气泡的快慢来判断,故A正确;
B.图甲所示实验中没有控制变量,没有设计实验验证 和 对反应速率的影响,故该
实验不能确定 和 对 分解的催化效果,故B错误;
C.反应速率可以用单位时间内产生气体的体积表示,要测定反应速率,需要记录反应产
生的气体体积及反应时间,故C正确;
D.关闭A处活塞,将注射器活塞拉出一定距离,若气密性不好,气体就能够加入,活塞
不能回到原位,故D正确。故答案选B。
4.A
【详解】由题意可知, 和 反应中消耗 和 的浓度分别为 、
×2min= ,生成Z的浓度为 ,则反应物 、 和生
成物Z的浓度变化量之比为 : : =3∶1∶2,由化学计量系数之
比等于各物质的浓度变化量之比可得反应方程式为 2Z,由反应前后原子个数守
恒可知Z的分子式为 ,反应的化学方程式为 ,故选A。
5.B
【详解】A.分析表格中的数据可知,相同时间内 降低逐渐减小,故题述反应
先快后慢,选项A错误;
B.每消耗 会生成 , 内,
,选项B正确;
C.由于反应速率逐渐减小,故高锰酸钾完全反应,即浓度为 时,反应时间大于
,选项C错误;
D.钾离子不参与反应,故 不变,选项D错误。
答案选B。
6.B
【详解】A.由题图中曲线可知, 内,随着时间的延长, 的氧化率逐渐增大,A
项正确,不符合题意;
B.由曲线②和③可知,当温度相同时,pH越小, 的氧化率越大,相同时间内 的氧
答案第2页,共2页化速率越快,B项错误,符合题意;
C.由曲线①和③可知,温度越高, 的氧化速率越快,C项正确,不符合题意;
D.氧化过程的离子方程式为 ,D项正确,不符合题意。
故选B。
7.D
【分析】根据图中箭头方向,找出反应物和生成物,写出反应原理:①CHOH+H-O-催
3
→CHO-催+H O,②CHO-催+CO →CHCOO-催,③CHOH+CH COO-催
3 2 3 2 3 3 3
→CHOCOOCH +H-O-催;总反应为:2CHOH+CO →CHOCO OCH +H O;据此解答。
3 3 3 2 3 3 2
【详解】A.根据示意图可知①中CHOH生成CHO-催,CHOH中的O-H键断裂;②中
3 3 3
没有O-H键断裂;③中CHOH生成CHOCOOCH ,CHOH中的O-H键断裂,故A错误;
3 3 3 3
B..反应中有水分子生成,生成DMC总反应的原子利用率小于100%,B错误;
C.催化剂的使用不影响化学反应平衡,不能提高反应物的平衡转化率,C错误;
D.DMC的结构中有酯基,能与过量NaOH溶液发生水解反应生成NaCO 和甲醇,D正确;
2 3
答案选D。
8.C
【详解】A.根据表格信息,当反应温度为140℃,反应时间为14h时,生成物的产率最大,
因此最佳反应温度为140℃,A错误;
B.由A的分析可知,最佳反应时间为14h,B错误;
C.根据表格数据,温度超过140℃时,生成物的产率降低,可能是温度过高导致了催化剂
活性降低,C正确;
D.反应产物为 ,属于反式结构,D错误;
答案选C。
9.B
【分析】结合平衡的特征“等、定”及衍生的物理量判定平衡状态,以此来解答。
【详解】①v(NH ) =2v(CO ) 满足正逆反应速率相等,反应达到平衡状态,故选;
3 正 2 逆
②正反应体积增大,当密闭容器中总压强不变时反应达到平衡状态,故选;
③密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但是气体的
质量是变化的,所以当密闭容器中混合气体的密度不变时反应达到平衡状态,故选;④由于体系中只有两种气体,且氨气和二氧化碳的体积之比始终满足2:1,所以密闭容器
中混合气体的平均相对分子质量始终不变,不能说明反应达到平衡状态,故不选;
⑤正反应气体的分子数增大,当密闭容器混合气体的总物质的量不变时反应达到平衡状态,
故选;
⑥由于体系中只有两种气体,且氨气和二氧化碳的体积之比始终满足2:1,所以密闭容器
中CO 的体积分数始终不变,不能说明反应达到平衡状态,故不选;
2
⑦由于反应物是固体,所以混合气体总质量不变时反应达到平衡状态,故选;
故选B。
10.B
【分析】一定条件下的可逆反应达到平衡时,正逆反应速率相等,且体系中各物质的浓度
保持不变;当一个变量不变时,反应达平衡。
【详解】①根据定义, 时,反应达到平衡状态;②该反应为分子数增
大的反应,容器内压强不断增加,当压强不变时,反应达平衡;③由质量守恒定理,该反
应过程中,气体质量增加,根据 ,混合气体的密度为变量,当其不变时,反应达平衡;
④因为反应只有生成物为气体物质,其物质的量之比始终为化学计量数之比,为 ,根据
,混合气体的平均摩尔质量始终不变,混合气体的平均相对分子质量不变不能作为
平衡的标志;⑤该反应为分子数增加的反应,气体混合物的物质的量为变量,混合气体的
总物质的量不变可以作为平衡的标志;⑥因为反应只有生成物为气体物质,其物质的量之
比始终为化学计量数之比,为 ,所以CO 的体积分数始终不变,二氧化碳的体积分数不
2
变不能作为平衡的标志;⑦该反应中,只有气体产物为气体,随着反应的进行,质量在增
加,为变量,当混合气体的总质量不变时,反应达平衡;
综上①②③⑤⑦能判断反应已经达到化学平衡,故选B。
11.A
【详解】①单位时间内生成n mol O ,同进生成2n mol NO ,说明正逆反应速率相等,反
2 2
应达到平衡;
②单位时间内生成n mol O ,同进生成2n mol NO,描述的都是正反应,不能说明反应已达
2
平衡;
答案第4页,共2页③化学反应速率之比=计量数之比,用NO 、NO、O 的物质的量浓度变化表示的反应速率
2 2
之比始终为2∶2∶1,不能说明反应已达平衡;
④容器体积和气体质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平
衡;
⑤混合气体的颜色不再改变,说明NO 浓度不变,反应已达平衡;
2
综上所述,可作为平衡标志的有①⑤,A正确;
选A。
12.A
【详解】若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反
应,则: ,
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
由于为可逆反应,物质不能完全转化,所以平衡时浓度范围为0