文档内容
第一学期学业测试
高二年级化学期中试卷
可能用到的相对原子质量:C 12 H 1 O 16 Na 23 Cl 35.5
第一部分(选择题 共42分)
每小题只有一个选项符合题意(每小题3分)
1. 下列装置或过程能实现电能转化为化学能的是
A B C D
锌锰干电池 燃气燃烧 电池充电 水力发电
.
A A B. B C. C D. D
2. 决定化学反应速率的主要因素是
A. 反应物的浓度 B. 反应体系内的压强
C. 反应物的性质 D. 反应物的状态
3. 下列与化学反应能量变化相关 的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H(g)+Cl (g)=2HCl在光照和点燃条件下的△H不同
2 2
4. 下关于某化学反应的自发性描述中正确的是
A. ∆H<0,∆S<0在任何温度下都能自发进行
B. ∆H<0,∆S>0在任何温度下都能自发进行
C. ∆H>0,∆S<0有可能自发进行
学科网(北京)股份有限公司D. ∆H>0,∆S>0在任何温度下都不能自发进行
5. 将N 和H 通入体积为2 L的恒温恒容密闭容器中,5 min后达到化学平时测得NH 的浓度为0.2 mol/L,
2 2 3
这段时间内用N、H、NH 的浓度变化表示的化学反应速率为
2 2 3
A. υ(N ) = 0.04 mol/(L·min) B. υ(H ) = 0.02mol/(L·min)
2 2
C. υ(NH ) = 0.03mol/(L·min) D. υ(NH ) = 0.04mol/(L·min)
3 3
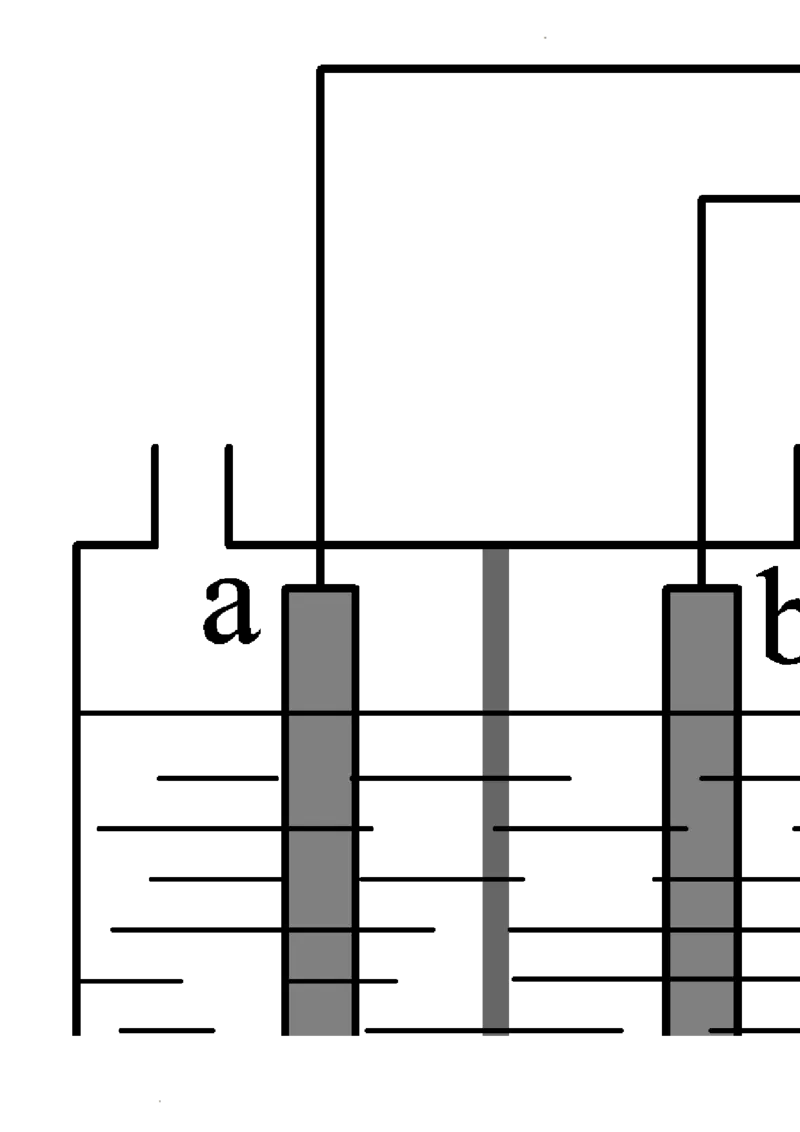
6. 锌铜原电池装置如图,下列说法不正确的是
A. 锌电极上发生氧化反应
B. 电子从锌片经电流计流向铜片
C. 盐桥中K+向负极移动
D. 铜极上发生的反应是:Cu2+ +2e− = Cu
7. 液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。
下列说法不正确的是
已知:①Zn(OH) +2OH− == Zn(OH) 2− 。 ②KOH凝胶中允许离子存在、生成或迁移。
2 4
学科网(北京)股份有限公司学科网(北京)股份有限公司A. 放电过程中,H+由正极向负极迁移
B. 放电过程中,正极的电极反应:MnO +4H++2e−== Mn2++2H O
2 2
C. 充电过程中,阴极的电极反应:Zn(OH) 2−+2e− == Zn+4OH−
4
D. 充电过程中,凝胶中的KOH可再生
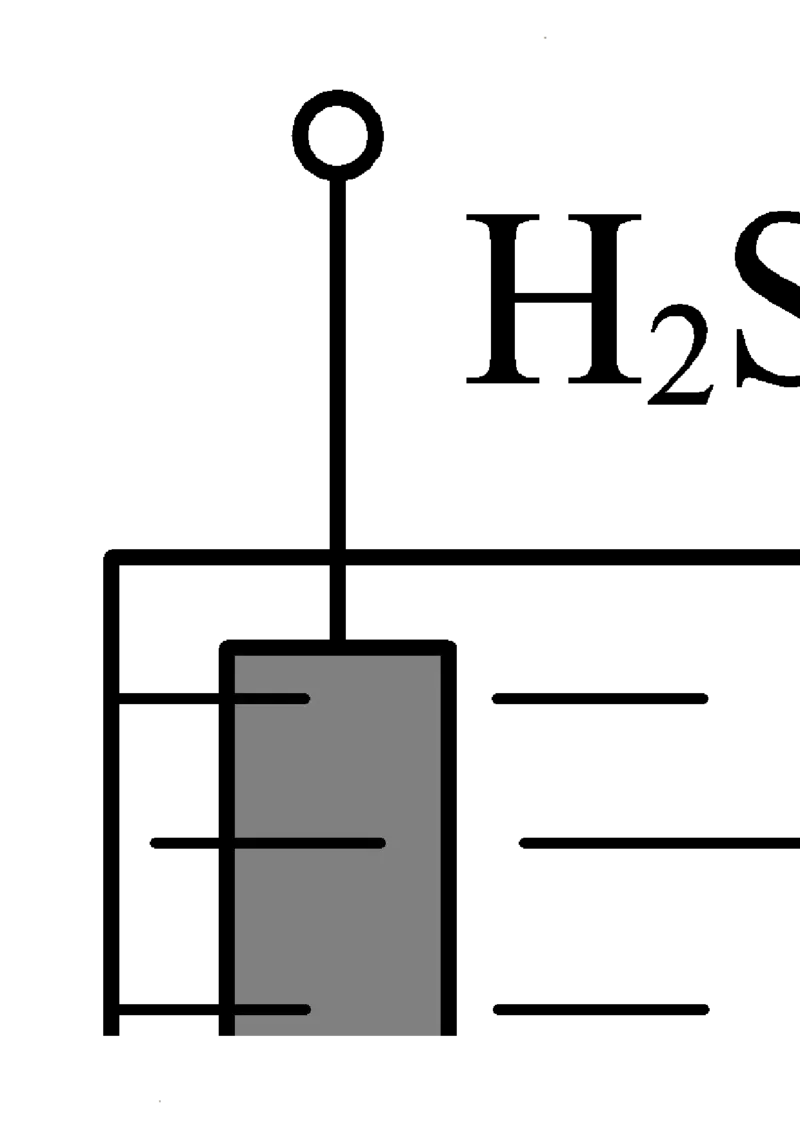
8. 模拟铁制品镀铜的装置如图,下列说法正确的是
学科网(北京)股份有限公司学科网(北京)股份有限公司A. a电极为铁制品
B. 可用CuSO 溶液作电镀液
4
C. b电极上发生氧化反应
D. 电镀过程中,理论上溶液中Cu2+浓度不断减小
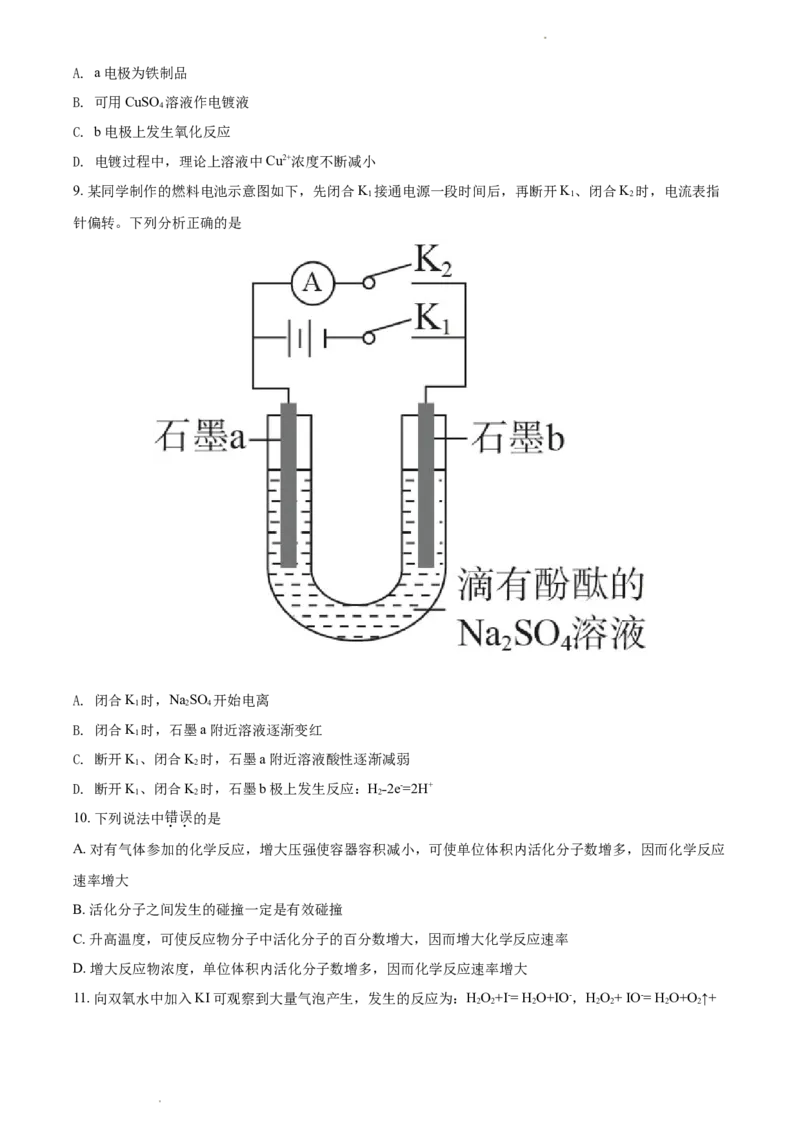
9. 某同学制作的燃料电池示意图如下,先闭合K 接通电源一段时间后,再断开K、闭合K 时,电流表指
1 1 2
针偏转。下列分析正确的是
A. 闭合K 时,NaSO 开始电离
1 2 4
B. 闭合K 时,石墨a 附近溶液逐渐变红
1
C. 断开K、闭合K 时,石墨a 附近溶液酸性逐渐减弱
1 2
D. 断开K、闭合K 时,石墨b极上发生反应:H˗2e-=2H+
1 2 2
10. 下列说法中错误的是
A. 对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增多,因而化学反应
速率增大
B. 活化分子之间发生的碰撞一定是有效碰撞
C. 升高温度,可使反应物分子中活化分子的百分数增大,因而增大化学反应速率
D. 增大反应物浓度,单位体积内活化分子数增多,因而化学反应速率增大
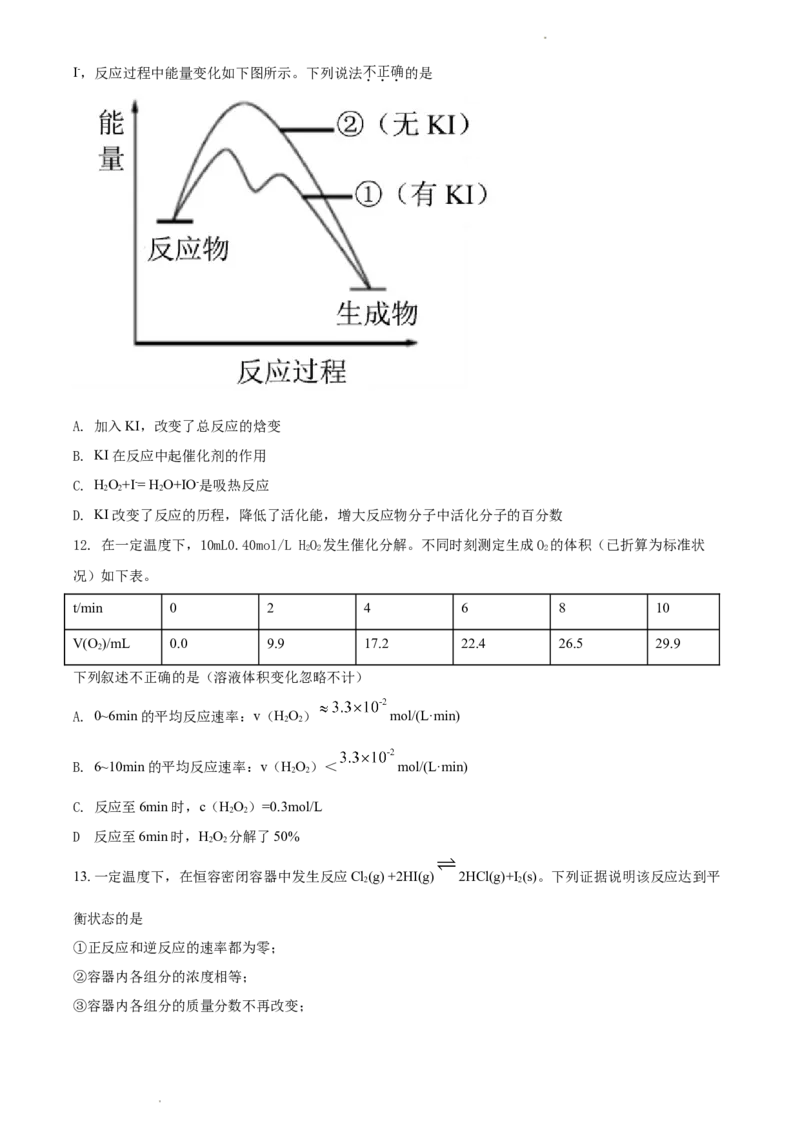
11. 向双氧水中加入KI可观察到大量气泡产生,发生的反应为:HO+I-= H O+IO-,HO+ IO-= H O+O↑+
2 2 2 2 2 2 2
学科网(北京)股份有限公司I-,反应过程中能量变化如下图所示。下列说法不正确的是
A. 加入KI,改变了总反应的焓变
B. KI在反应中起催化剂的作用
C. HO+I-= H O+IO-是吸热反应
2 2 2
D. KI改变了反应的历程,降低了活化能,增大反应物分子中活化分子的百分数
12. 在一定温度下,10mL0.40mol/L HO 发生催化分解。不同时刻测定生成O 的体积(已折算为标准状
2 2 2
况)如下表。
t/min 0 2 4 6 8 10
V(O )/mL 0.0 9.9 17.2 22.4 26.5 29.9
2
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6min的平均反应速率:v(HO) mol/(L·min)
2 2
B. 6~10min的平均反应速率:v(HO)< mol/(L·min)
2 2
C. 反应至6min时,c(HO)=0.3mol/L
2 2
.
D 反应至6min时,HO 分解了50%
2 2
13. 一定温度下,在恒容密闭容器中发生反应Cl(g) +2HI(g) 2HCl(g)+I (s)。下列证据说明该反应达到平
2 2
衡状态的是
①正反应和逆反应的速率都为零;
②容器内各组分的浓度相等;
③容器内各组分的质量分数不再改变;
学科网(北京)股份有限公司④单位时间内生成n mol Cl 的同时生成2n mol HCl
2
⑤单位时间内m mol Cl 断键发生反应,同时2m mol HI也断键发生反应
2
⑥容器内气体分子总数不再改变;
⑦容器内混合气体的平均相对分子质量不再改变;
⑧容器内压强不再改变;
⑨容器内气体的密度不再改变;
⑩混合气体的颜色不再改变。
A. ①②③④⑥⑧⑩ B. ②③④⑤⑦⑧⑨
C. ③④⑤⑥⑧⑨⑩ D. ③④⑥⑦⑧⑨⑩
14. 研究小组将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入醋酸溶
液,容器中的压强随时间的变化曲线如图2。下列说法不正确的是
A. 0-t 时压强增大的原因不一定是铁发生了析氢腐蚀
1
B. 铁粉发生反应:Fe-3e-=Fe3+
C. 碳粉上发生了还原反应
D. t 时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀
2
第二部分(非选择题 共58分)
15. 书写下列化学方程式
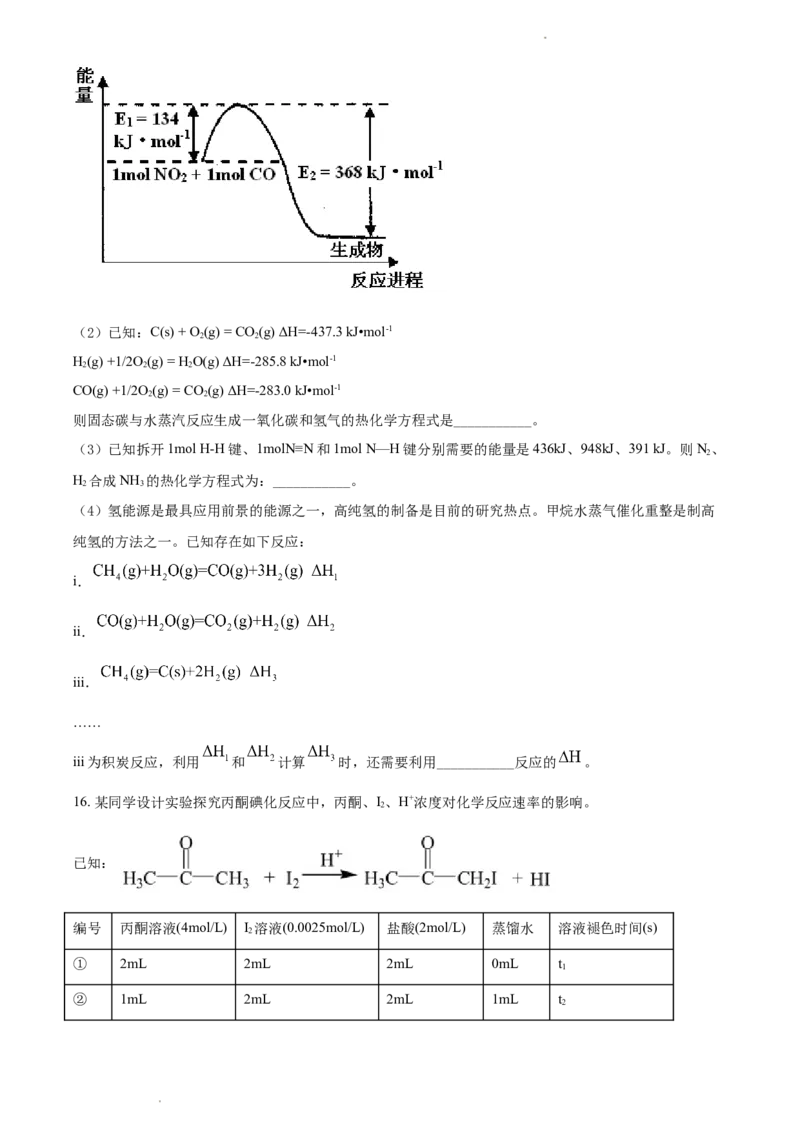
(1)下图是1 mol NO 和1mol CO反应生成CO 和NO过程中能量变化示意图,请写出NO 和CO反应的
2 2 2
热化学方程式___________。
学科网(北京)股份有限公司(2)已知:C(s) + O (g) = CO (g) ΔH=-437.3 kJ•mol-1
2 2
H(g) +1/2O(g) = HO(g) ΔH=-285.8 kJ•mol-1
2 2 2
CO(g) +1/2O (g) = CO (g) ΔH=-283.0 kJ•mol-1
2 2
则固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是___________。
(3)已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、948kJ、391 kJ。则N、
2
H 合成NH 的热化学方程式为:___________。
2 3
(4)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高
纯氢的方法之一。已知存在如下反应:
i.
ii.
iii.
……
iii为积炭反应,利用 和 计算 时,还需要利用___________反应的 。
16. 某同学设计实验探究丙酮碘化反应中,丙酮、I、H+浓度对化学反应速率的影响。
2
已知:
编号 丙酮溶液(4mol/L) I 溶液(0.0025mol/L) 盐酸(2mol/L) 蒸馏水 溶液褪色时间(s)
2
① 2mL 2mL 2mL 0mL t
1
② 1mL 2mL 2mL 1mL t
2
学科网(北京)股份有限公司③ 2mL 1mL 2mL 1mL t
3
④ 2mL 2mL amL 1mL t
3
(1)研究丙酮浓度对反应速率 的影响,应选择的实验为_______和_______。
(2)实验④中,a=_______mL,加1mL蒸馏水的目的是_______。
(3)计算实验③中,以I 表示的反应速率为_______mol/(L∙s) (列出表达式)
2
(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和H+的浓度有关,而与I 的浓度无关,查阅资料发现丙
2
酮碘化反应的历程为:
请依据反应历程,解释丙酮碘化反应速率与I 浓度无关的原因_______。
2
17. 降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H 作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
2
学科网(北京)股份有限公司学科网(北京)股份有限公司①a极为_______(填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为_______。
③下列说法正确的是_______。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:_______。
⑤实际生产中,阳离子交换膜 的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O,产生O
2 2
的电极反应式为_______。下列生产措施有利于提高Cl 产量、降低阳极O 含量的是_______。
2 2
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O,避免水电离的H+直接得电子
2
生成H,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为_______。
2
18. 某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
(1)初步设计的实验装置示意图如图1所示,CuSO 溶液在图1所示装置中的作用是_______(答两点)。
4
实验发现:该装置不能驱动小车。
(2)该小组同学提出假设:
可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在
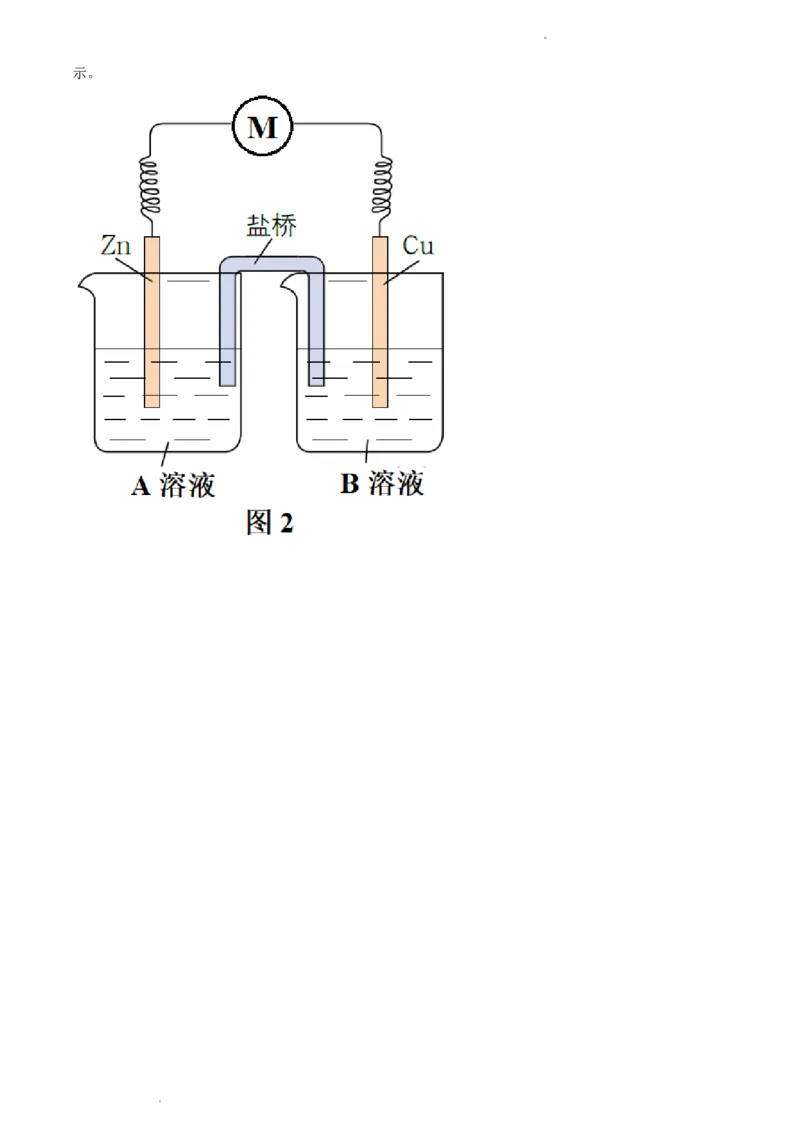
原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和
B溶液分别是_______和_______,盐桥属于_______(填“电子导体”或“离子导体”),盐桥中的Cl-移向
_______溶液(填“A”或“B”)。为降低电池自重,该小组用阳离子交换膜代替盐桥,实验装置示意图如图3所
学科网(北京)股份有限公司示。
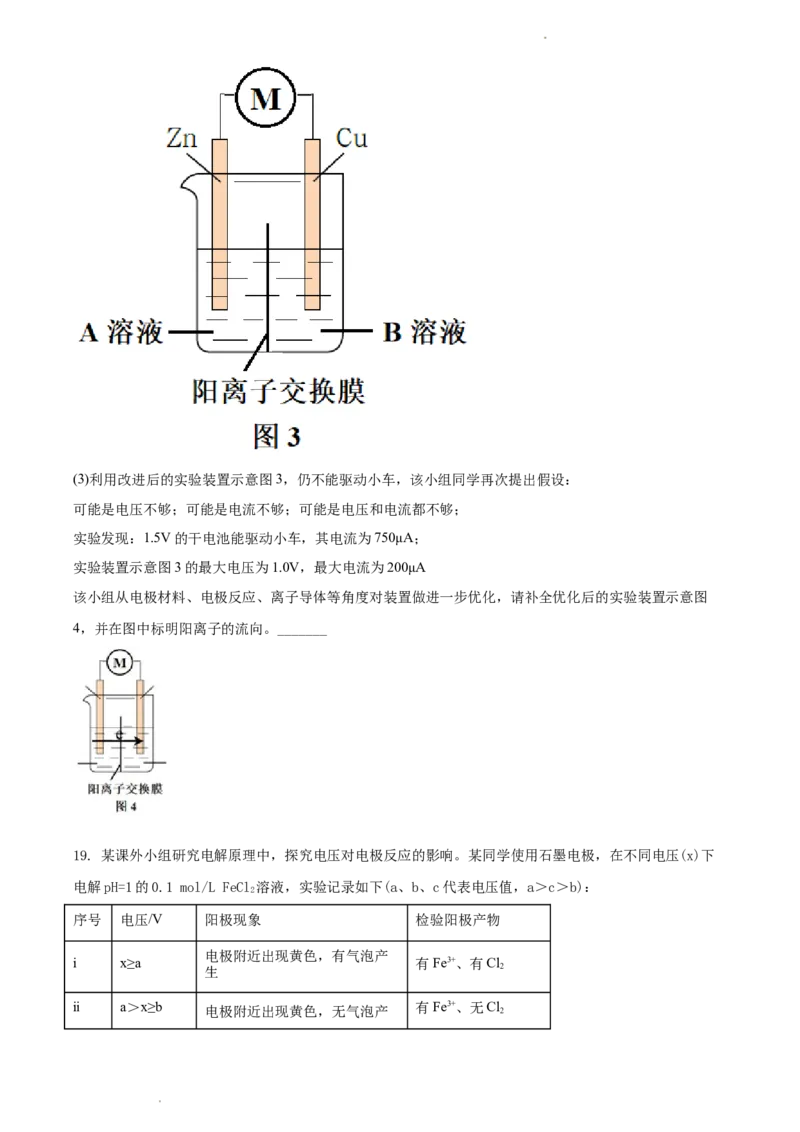
学科网(北京)股份有限公司(3)利用改进后的实验装置示意图3,仍不能驱动小车,该小组同学再次提出假设:
可能是电压不够;可能是电流不够;可能是电压和电流都不够;
实验发现:1.5V的干电池能驱动小车,其电流为750μA;
实验装置示意图3的最大电压为1.0V,最大电流为200μA
该小组从电极材料、电极反应、离子导体等角度对装置做进一步优化,请补全优化后的实验装置示意图
4,并在图中标明阳离子的流向。_______
19. 某课外小组研究电解原理中,探究电压对电极反应的影响。某同学使用石墨电极,在不同电压(x)下
电解pH=1的0.1 mol/L FeCl 溶液,实验记录如下(a、b、c代表电压值,a>c>b):
2
序号 电压/V 阳极现象 检验阳极产物
电极附近出现黄色,有气泡产
ⅰ x≥a 有Fe3+、有Cl
生 2
ⅱ a>x≥b
电极附近出现黄色,无气泡产
有Fe3+、无Cl
2
学科网(北京)股份有限公司生
ⅲ b>x>0 无明显现象 无Fe3+、无Cl
2
(1)ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl 将Fe2+氧化,写出Cl-在阳极放电的电极反应
2
___________。
(2)由ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有___________性(填“氧化”或“还
原”)。
(3)ⅱ中虽未检测出Cl,但Cl-在阳极是否放电仍需进一步验证,电解pH=1的NaCl溶液做对照实验,记
2
录如下:
序号 电压/V 阳极现象 检验阳极产物
ⅳ a>x≥c 无明显现象 有Cl
2
ⅴ c>x≥b 无明显现象 无Cl
2
①NaCl溶液的浓度是___________mol/L。
②ⅳ中检测Cl 的实验方法是:取少量阳极附近的溶液,滴在___________试纸上,试纸___________证明生
2
成氯气,否则无氯气生成。
③与ⅱ相比,可以得出以下结论:
pH=1的0.1 mol/L FeCl 溶液,电压≥cV时,Cl-才能在阳极放电产生Cl;
2 2
pH=1的0.1 mol/L FeCl 溶液,电压c>x≥b V时,阳极的电极反应为___________。
2
学科网(北京)股份有限公司学科网(北京)股份有限公司