文档内容
第一学期期中考试
高二化学试卷(高考)
注意:
1.本试卷共10页,满分100分
2.考试时间75分钟
第Ⅰ卷选择题(共49分)
一、选择题(共10小题,每小题2.5分,共25分。每小题只有一个选项符合题意。)
1. 下列说法正确的是
A. C(石墨,s)=C(金刚石,s) ∆H>0,说明反应物总键能大于生成物总键能
B. H(g)的燃烧热∆H=-285.8kJ/mol,则2HO(g)=2H (g)+O(g) ∆H=+571.6kJ/mol
2 2 2 2
C. 已知稀溶液中,H+(aq)+OH-(aq)=H O(l) ∆H=-57.3kJ/mol,则稀硫酸与氢氧化钡稀溶液反应生成1mol
2
水时放出57.3kJ的热量
D. 增大压强,加快反应速率,是因为提高了活化分子百分比
2. 中国化学家研究出一种新型复合光催化剂(C N/CQDs),能利用太阳光高效分解水,原理如图所示。下
3 4
列说法不正确的是
A. 通过该催化反应,实现了太阳能向化学能 的转化
B. 反应Ⅰ中涉及到O-H键的断裂和H-H、O-O键的形成
C. 反应Ⅱ为2HO 2HO+O↑
2 2 2 2
D. 光催化剂明显降低了2HO 2HO+O↑的反应热
2 2 2 2
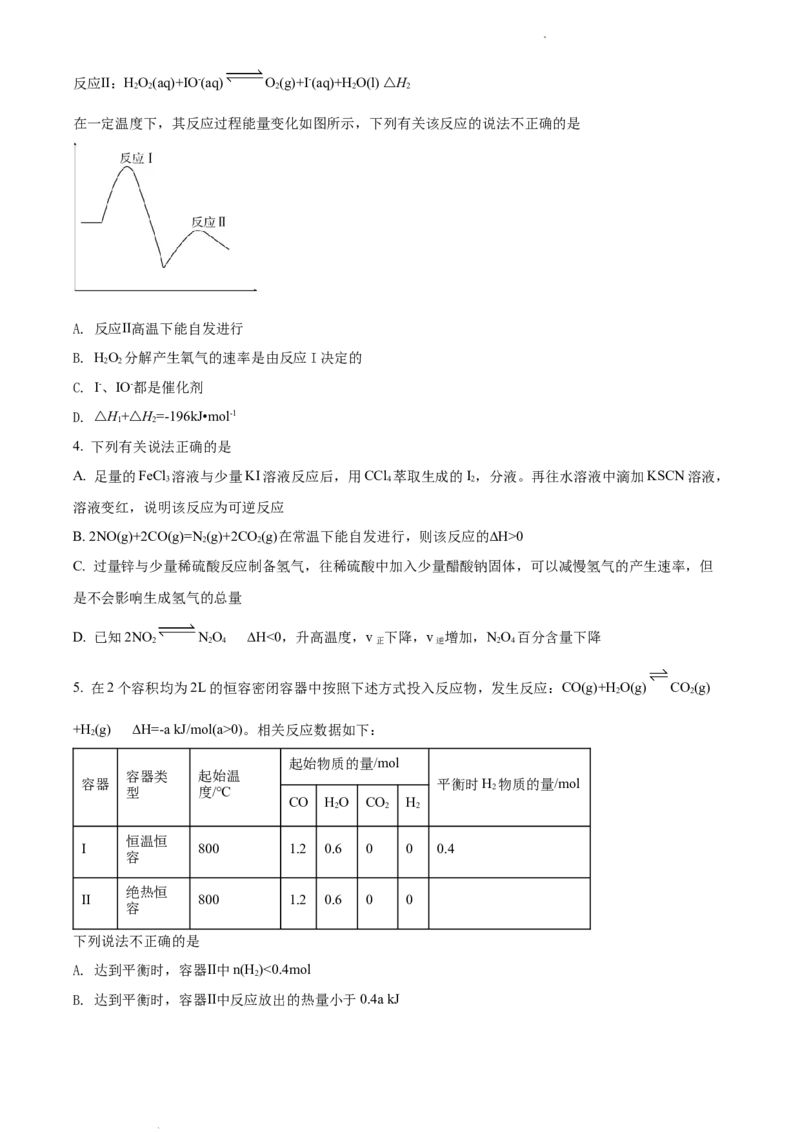
3. 已知完全分解1molH O 放出热量为98kJ,在含有少量I-的溶液中HO 分解的机理为
2 2 2 2
反应Ⅰ:HO(aq)+I-(aq) IO-(aq)+H O(l) △H
2 2 2 1
学科网(北京)股份有限公司反应Ⅱ:HO(aq)+IO-(aq) O(g)+I-(aq)+H O(l) △H
2 2 2 2 2
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
A. 反应Ⅱ高温下能自发进行
B. HO 分解产生氧气的速率是由反应I决定的
2 2
C. I-、IO-都是催化剂
D. △H+△H=-196kJ•mol-1
1 2
4. 下列有关说法正确的是
A. 足量的FeCl 溶液与少量KI溶液反应后,用CCl 萃取生成的I,分液。再往水溶液中滴加KSCN溶液,
3 4 2
溶液变红,说明该反应为可逆反应
B. 2NO(g)+2CO(g)=N (g)+2CO (g)在常温下能自发进行,则该反应的∆H>0
2 2
C. 过量锌与少量稀硫酸反应制备氢气,往稀硫酸中加入少量醋酸钠固体,可以减慢氢气的产生速率,但
是不会影响生成氢气的总量
D. 已知2NO NO ∆H<0,升高温度,v 下降,v 增加,NO 百分含量下降
2 2 4 正 逆 2 4
5. 在2个容积均为2L的恒容密闭容器中按照下述方式投入反应物,发生反应:CO(g)+HO(g) CO(g)
2 2
+H (g) ∆H=-a kJ/mol(a>0)。相关反应数据如下:
2
起始物质的量/mol
容器类 起始温
容器 平衡时H 物质的量/mol
型 度/℃ 2
CO HO CO H
2 2 2
恒温恒
Ⅰ 800 1.2 0.6 0 0 0.4
容
绝热恒
Ⅱ 800 1.2 0.6 0 0
容
下列说法不正确的是
A. 达到平衡时,容器Ⅱ中n(H )<0.4mol
2
B. 达到平衡时,容器Ⅱ中反应放出的热量小于0.4a kJ
学科网(北京)股份有限公司C. 反应Ⅰ在10min刚好到达平衡,则前10min内的平均反应速率v(CO)=0.02mol/(L·min)
D. 平衡常数K=K
Ⅰ Ⅱ
6. 下列事实不能用平衡移动原理解释的是
A. 氯水在光照下颜色变浅,最终变为无色
B. 夏天打开啤酒瓶,有很多气泡冒出
C. 由NO (g)、NO(g)组成的平衡体系通过缩小体积加压后颜色变深
2 2 4
D. 实验室用排饱和食盐水的方法收集Cl
2
7. 在硫酸工业中,通过下列反应使SO 氧化为SO :2SO (g)+O(g) 2SO (g) ∆H=-196.6kJ/mol。下表
2 3 2 2 3
列出了恒容刚性容器中,在不同温度和压强下,反应达到平衡时SO 的转化率。下列说法错误的是
2
平衡时SO 的转化率/%
2
温度/℃
0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
500 85.6 92.9 94.9 97.7 98.3
A. 在到达平衡时充入He增大压强,不能增大SO 转化率
2
B. 为了增大SO 的转化率,可以控制SO 与O 的投料比小于2
2 2 2
C. 在实际生产中,应选择的条件是450℃,10MPa
D. 在实际生产中,选定的温度为400~500℃,主要原因是考虑催化剂的活性最佳
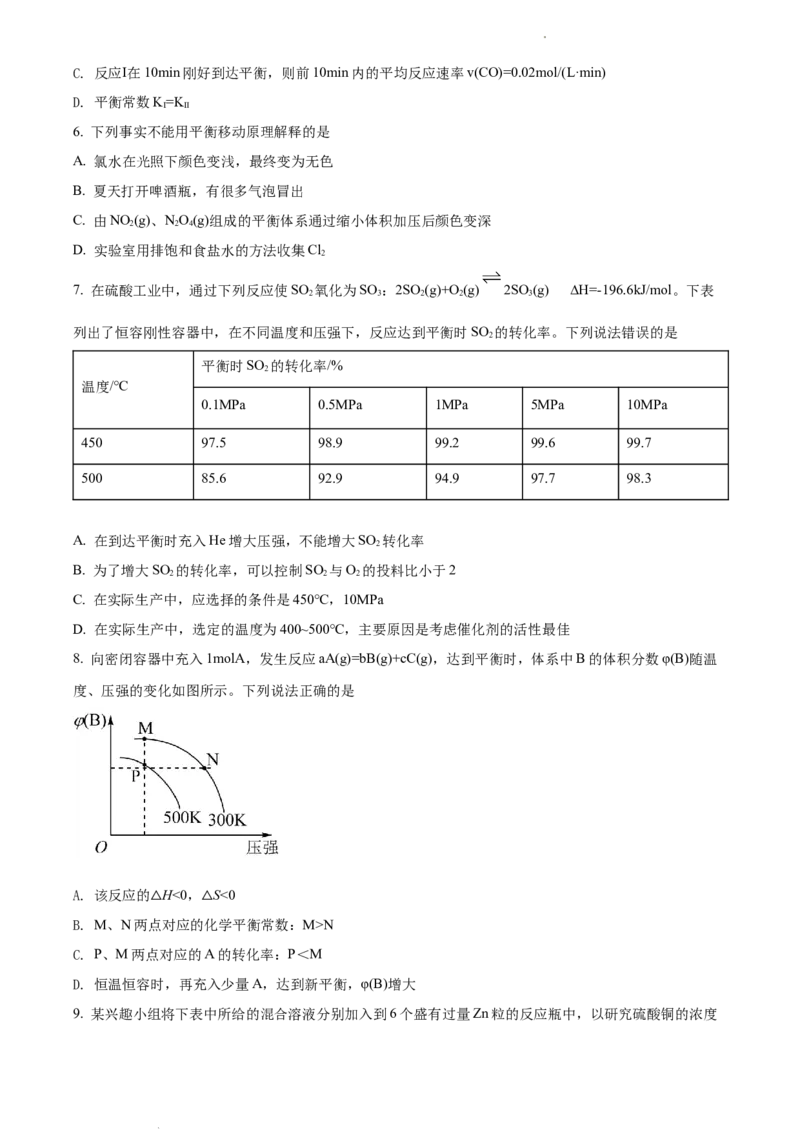
8. 向密闭容器中充入1molA,发生反应aA(g)=bB(g)+cC(g),达到平衡时,体系中B的体积分数φ(B)随温
度、压强的变化如图所示。下列说法正确的是
A. 该反应的 H<0, S<0
B. M、N两点△对应的△化学平衡常数:M>N
C. P、M两点对应的A的转化率:P<M
D. 恒温恒容时,再充入少量A,达到新平衡,φ(B)增大
9. 某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度
学科网(北京)股份有限公司对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是
A B C D E F
4mol·L-1 HSO /mL 30 V V V V V
2 4 1 2 3 4 5
饱和CuSO 溶液/mL 0 0.5 2.5 5 V 20
4 6
HO/mL V V V V 10 0
2 7 8 9 10
A. V=30,V=10,V=20
1 6 7
B. 本实验利用了控制变量思想,变量为Cu2+浓度
C. 反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈现红色
D. 该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用
10. 将4mol A气体和2mol B气体在恒压密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)
2C(g) ∆H<0;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是
A. 此时A的浓度为0.6mol/L
B. 达平衡后若通入一定量氯气,A的转化率降低
C. 4s内用物质B表示的反应速率为0.175mol·L-1·s-1
D. 达平衡后若升高温度,C的浓度将增大
二、选择题(共6小题,每小题4分,共24分。每小题只有一个正确答案。)
11. 已知稀醋酸溶液中存在平衡CHCOOH CHCOO-+H+,为使溶液中 的值增大,可以
3 3
采取的措施是
①加大理石;②加少量浓醋酸;③加少量CHCOONa;④加少量浓盐酸;⑤加水;⑥加热
3
A. ①③⑥ B. ①③⑤⑥ C. ①②③⑥ D. ①②④⑥
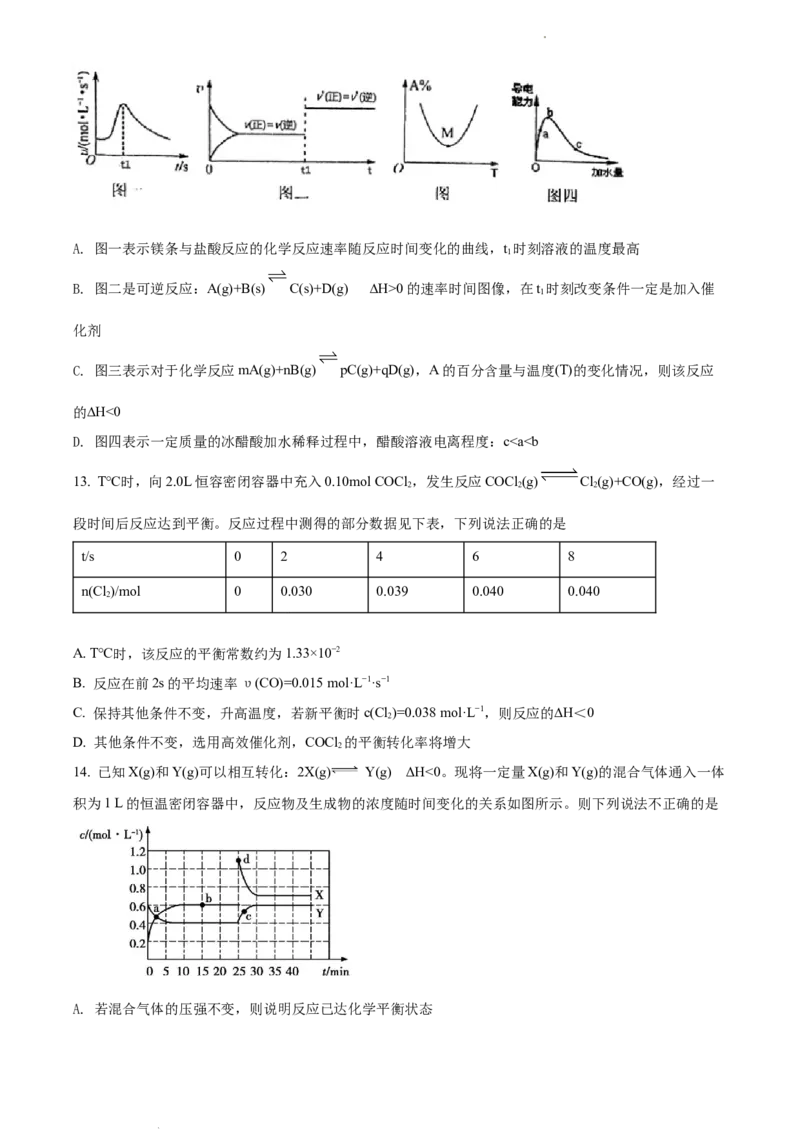
12. 下列图示与对应的叙述相符的是
学科网(北京)股份有限公司A. 图一表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,t 时刻溶液的温度最高
1
B. 图二是可逆反应:A(g)+B(s) C(s)+D(g) ∆H>0的速率时间图像,在t 时刻改变条件一定是加入催
1
化剂
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应
的∆H<0
D. 图四表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c0
C. A、C点的HΔ反应速率V
A
>Vc
D. 30℃时,B点对应状态v >v
正 逆
第Ⅱ卷(非选择题部分,共51分)
17. Ⅰ.NaSO 溶液与稀HSO 的反应方程式为NaSO+H SO =Na SO +S↓+SO ↑+H O,某同学进行了硫代
2 2 3 2 4 2 2 3 2 4 2 4 2 2
硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表,请结合表中信息,回答有关问题:
学科网(北京)股份有限公司参加反应 物的质
实验序号 反应温度/℃ NaSO HSO HO
2 2 3 2 4 2
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
a 20 10 0.1 10 0.1 0
b 20 5 0.1 10 0.1 V
1
.
c 20 10 01 5 0.1 V
2
d 40 5 0.1 10 0.1 5
(1)上述四组实验,能说明温度对该反应速率影响的组合是___________(填实验序号);实验a和b、a和
c的组合比较,所研究的问题是___________。
(2)教材中利用了出现黄色沉淀的快慢来比较该反应的速率,而一般不采用单位时间内收集SO 体积的大
2
小进行比较的原因是___________
(3)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,
键能的大小可用于估算化学反应的反应热∆H。已知部分化学键的键能数据如表所示:
化学键 H-H Cl-Cl H-Cl
键能/kJ·mol-1 436 243 431
则H(g)+Cl (g)=2HCl(g)的反应热∆H为___________
2 2
(4)用HO 和HSO 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
2 2 2 4
Cu(s)+2H+(aq)=Cu2+(aq)+H (g) ∆H
2 1
2HO(l)=2H O(l)+O(g) ∆H
2 2 2 2 2
H2(g)+1/2O(g)=HO(l) ∆H
2 2 3
在HSO 溶液中Cu与HO 反应生成Cu2+和HO的热化学方程式为:___________。(写离子方程式,∆H用
2 4 2 2 2
∆H、∆H、∆H 表示)
1 2 3
Ⅱ.下表是某温度下几种常见弱酸的电离平衡常数:
酸 电离方程式 电离平衡常数K
HA HA A-+H+ 2.0×10-5
HB HB B-+H+ 3.0×10-8
学科网(北京)股份有限公司HC HC-+H+
2 K=4.4×10-7
1
HC
2
K=5.6×10-11
HC- C2-+H+ 2
(5)pH值相同、体积相同的HA与HB与过量Al反应,最终生成氢气的量___________
A.HA多 B.HB多 C.一样多
(6)请依据上表中的数据写出NaB溶液与HC反应的离子方程式___________
2
(7)下列四种离子结合H+能力最强的是___________。
A. HC- B. C2- C. B- D. A-
(8)查阅资料:Cu(HO) (蓝色)+4Cl- [CuCl ]2-+4H O,等量黄色与蓝色混合呈绿色。设计实验证明
2 4 2
CuCl 溶液中存在上述平衡:取少量蓝色CuCl 稀溶液于试管中,___________。(补全实验方案与现象)
2 2
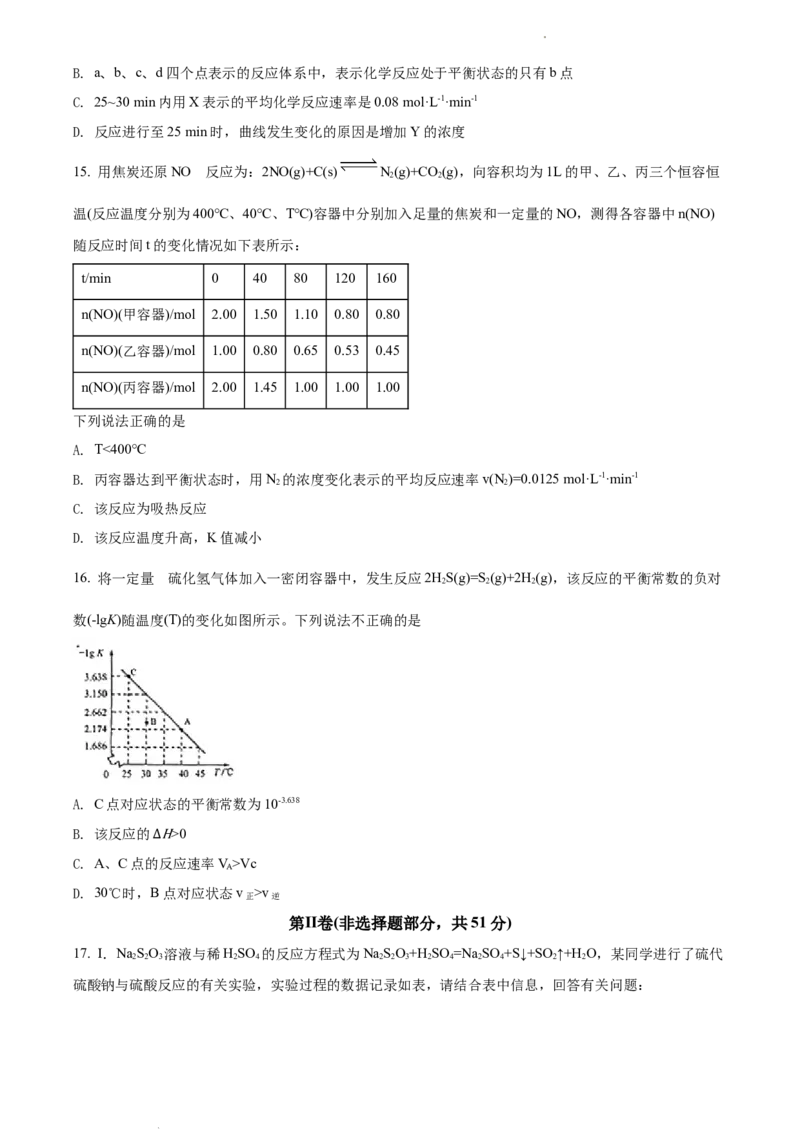
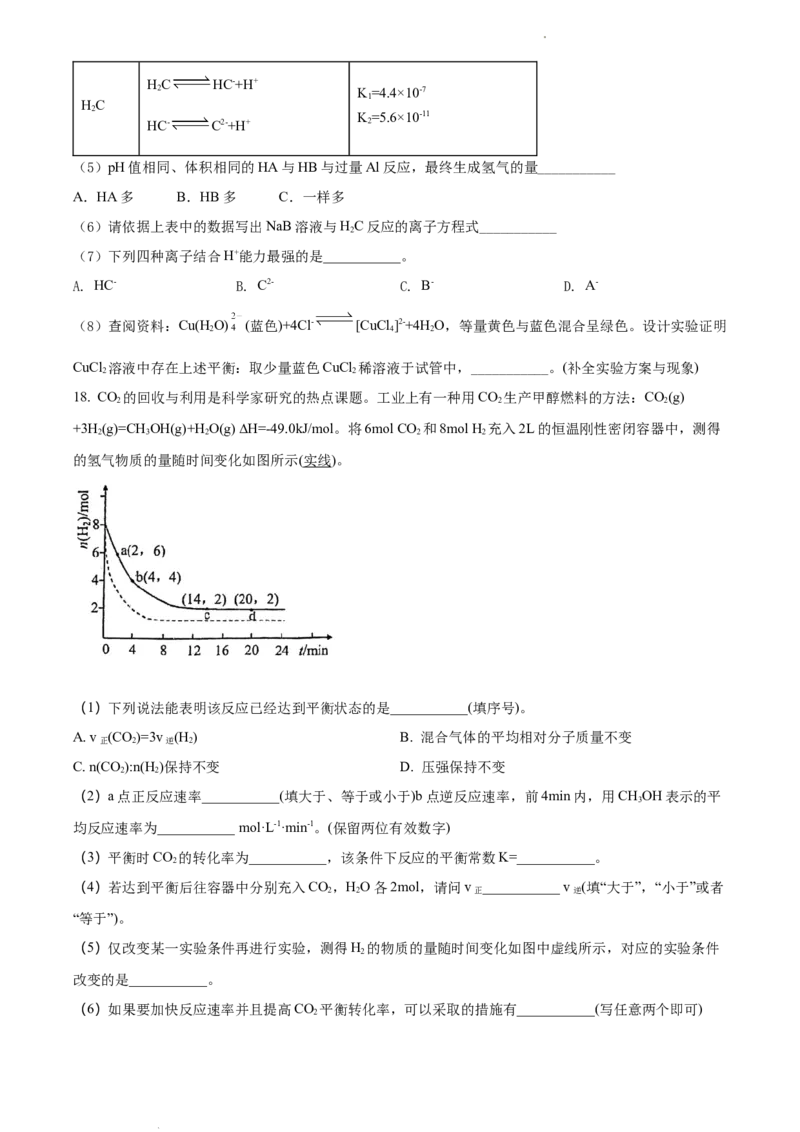
18. CO 的回收与利用是科学家研究的热点课题。工业上有一种用CO 生产甲醇燃料的方法:CO(g)
2 2 2
+3H (g)=CH OH(g)+H O(g) ∆H=-49.0kJ/mol。将6mol CO 和8mol H 充入2L的恒温刚性密闭容器中,测得
2 3 2 2 2
的氢气物质的量随时间变化如图所示(实线)。
(1)下列说法能表明该反应已经达到平衡状态的是___________(填序号)。
A. v (CO)=3v (H ) B. 混合气体的平均相对分子质量不变
正 2 逆 2
C. n(CO):n(H)保持不变 D. 压强保持不变
2 2
(2)a点正反应速率___________(填大于、等于或小于)b点逆反应速率,前4min内,用CHOH表示的平
3
均反应速率为___________ mol·L-1·min-1。(保留两位有效数字)
(3)平衡时CO 的转化率为___________,该条件下反应的平衡常数K=___________。
2
(4)若达到平衡后往容器中分别充入CO,HO各2mol,请问v ___________ v (填“大于”,“小于”或者
2 2 正 逆
“等于”)。
(5)仅改变某一实验条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示,对应的实验条件
2
改变的是___________。
(6)如果要加快反应速率并且提高CO 平衡转化率,可以采取的措施有___________(写任意两个即可)
2
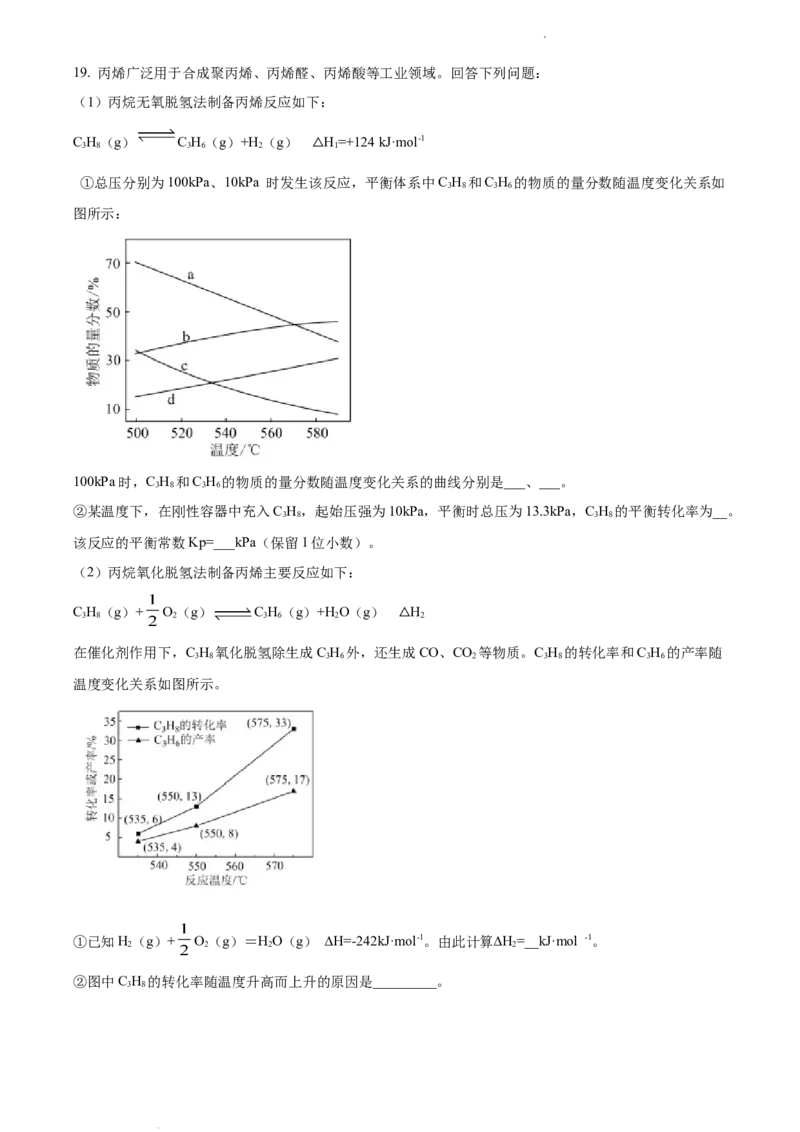
学科网(北京)股份有限公司19. 丙烯广泛用于合成聚丙烯、丙烯醛、丙烯酸等工业领域。回答下列问题:
(1)丙烷无氧脱氢法制备丙烯反应如下:
C H(g) C H(g)+H (g) H=+124 kJ·mol-1
3 8 3 6 2 1
△
①总压分别为100kPa、10kPa 时发生该反应,平衡体系中C H 和C H 的物质的量分数随温度变化关系如
3 8 3 6
图所示:
100kPa时,C H 和C H 的物质的量分数随温度变化关系的曲线分别是___、___。
3 8 3 6
②某温度下,在刚性容器中充入C H,起始压强为10kPa,平衡时总压为13.3kPa,C H 的平衡转化率为__。
3 8 3 8
该反应的平衡常数Kp=___kPa(保留1位小数)。
(2)丙烷氧化脱氢法制备丙烯主要反应如下:
C H(g)+ O(g) C H(g)+H O(g) H
3 8 2 3 6 2 2
△
在催化剂作用下,C H 氧化脱氢除生成C H 外,还生成CO、CO 等物质。C H 的转化率和C H 的产率随
3 8 3 6 2 3 8 3 6
温度变化关系如图所示。
①已知H(g)+ O(g)=HO(g) ∆H=-242kJ·mol-1。由此计算∆H=__kJ·mol -1。
2 2 2 2
②图中C H 的转化率随温度升高而上升的原因是_________。
3 8
学科网(北京)股份有限公司③575℃时,C H 的选择性为___。( ×100%)
3 6
④基于本研究结果,能提高C H 选择性的措施是___________。
3 6
学科网(北京)股份有限公司学科网(北京)股份有限公司