文档内容
第一学期期中检测试卷
高二化学
可能用到的相对原子质量:H 1 N 14 O 16
第一部分 选择题(共42分)
本部分每小题只有一个选项符合题意,每小题3分
1. 下列设备工作时,可将化学能直接转化为热能的是
A B C D
硅太阳能电池 磷酸铁锂电池 燃气灶 风力发电机
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.硅太阳能电池是将光能转化成电能,故A不符合题意;
B.磷酸铁锂电池是将化学能转化成电能,故B不符合题意;
C. 燃气灶主要是将化学能转化为热能,故C符合题意;
D.风力发电机是将电能转化成动能,故D不符合题意;
答案为C。
2. 下列条件改变时,可以改变化学反应速率但一定不能使化学平衡发生移动的是
A. 温度 B. 浓度 C. 压强 D. 催化剂
【答案】D
【解析】
【详解】A.任何反应都伴随着能量变化,升高温度,物质的内能增加,化学反应速率加快,化学平衡向
吸热反应方向移动;降低温度,物质的内能减小,化学反应速率减慢,化学平衡向放热反应方向移动,因此改变反应温度一定会使化学平衡发生移动,A不符合题意;
B.在其它条件不变时,增大反应物浓度,化学反应速率加快,化学平衡向正反应方向移动;减小反应物
浓度,化学反应速率减慢,化学平衡向逆反应方向移动,故改变反应物浓度,化学平衡一定会发生移动,
B不符合题意;
C.对于有气体参加的可逆化学反应,增大体系压强,化学反应速率加快,化学平衡向气体体积减小的方
向移动;减小压强,化学反应速率减小,化学平衡向气体体积扩大的方向移动,对于反应前后气体体积不
变的可逆反应或无气体参加的可逆反应,改变压强化学平衡不移动,故改变压强化学平衡可能会发生移动,
C不符合题意;
D.催化剂能同等倍数的增大或减小正、逆反应速率,因此改变催化剂后正、逆化学反应速率仍然相同,
因此化学平衡不发生移动,故改变催化剂时化学平衡不发生移动,D符合题意;
故合理选项是D。
3. “中和反应反应热的测定”实验中,不需要使用的仪器是
A. 容量瓶 B. 温度计 C. 玻璃搅拌器 D. 量筒
【答案】A
【解析】
【详解】A.容量瓶用于配制一定物质的量浓度溶液,中和反应反应热的测定中用不到,A符合题意;
B.“中和反应反应热的测定”实验中,用温度计测量反应之前酸、碱的温度以及反应过程中的最高温度,B
不符题意;
C.“中和反应反应热的测定”实验中,用玻璃搅拌器搅拌,使酸和碱迅速并完全反应,C不符题意;
D.“中和反应反应热的测定”实验中,用量筒量取酸和碱溶液的体积,D不符题意;
答案选A。
4. 已知:4NH +5O =4NO+6HO(g),若反应速率分别用vNH 、vO、vNO、vHO[mol/(L·min)]表示,
3 2 2 3 2 2
则正确的关系式是
A. vNH =vO B. vO=vHO
3 2 2 2
C. vNH =vHO D. vO=vNO
3 2 2
【答案】D
【解析】
【分析】【详解】A.在化学反应中,用不同物质表示的化学反应速率,速率比等于化学方程式中相应物质的化学
计量数的比,则vNH = vO,A错误;
3 2
B.在化学反应中,用不同物质表示的化学反应速率,速率比等于化学方程式中相应物质的化学计量数的
比,则vO= vHO,B错误;
2 2
C.在化学反应中,用不同物质表示的化学反应速率,速率比等于化学方程式中相应物质的化学计量数的
比,则vNH = vHO,C错误;
3 2
D.在化学反应中,用不同物质表示的化学反应速率,速率比等于化学方程式中相应物质的化学计量数的
比,则 vO=vNO,D正确;
2
故合理选项是D。
5. 已知:25℃、101kPa时,1g H 完全燃烧生成液态水放出142.9kJ的热量,下列热化学方程式中书写正
2
确的是
A. 2H(g) + O(g) = 2HO(l) ΔH = -142.9kJ/mol
2 2 2
B. H(g)+ O(g)= HO(l) ΔH = -285.8kJ/mol
2 2 2
C. 2H(g) + O(g) = 2HO(g) ΔH = -571.6kJ/mol
2 2 2
D. H(g) + O(g) = HO(g) ΔH = +285.8kJ/mol
2 2 2
【答案】B
【解析】
【详解】已知:25℃、101kPa时,1g H 完全燃烧生成液态水放出142.9kJ的热量,因此1mol氢气即2g
2
氢气完全燃烧生成液态水放出 285.8kJ 的热量,所以热化学方程式为 H(g)+ O(g)=HO(l)
2 2 2ΔH=-285.8kJ/mol。
答案选B。
6. 已知:N(g)+3H(g)=2NH (g) ΔH=-92.4 kJ /mol 。若断裂1molH-H键、1molN-H需要吸收的能量分别为
2 2 3
436kJ、391kJ,则断裂1molN≡N需要吸收的能量为
A. 431 kJ B. 945.6 kJ C. 649 kJ D. 869 kJ
【答案】B
【解析】
【 详 解 】 设 键 能 为 , 则 , 解 得
,故断裂1 mol 键需要能量为945.6 kJ;
故选B。
7. 1g水凝结成1g冰的过程中,下列分析不正确的是
A. 该过程是熵减的过程
B. 该过程属于物理变化
C. 1g水与1g冰所具有的内能不同
D. H 与O 反应生成1mol HO(l)与生成1 mol H O(s)放出热量相同
2 2 2 2
【答案】D
【解析】
【详解】A.1g水凝结成1g冰的过程是由无序向有序发展,为熵减的过程,A分析正确;
B.该过程水分子未发生变化,是物理变化,B分析正确;
C.1g水变为1冰放出热量,则1g水与1g冰所具有的内能不同,C分析正确;
D.1mol HO(l)与1mol HO(s)所具有的能量不同,H 与O 初始总能量相同,而生成物的总能量不同,则
2 2 2 2
H 与O 反应生成1mol HO(l)与生成1mol HO(s)放出的热量不相同,D分析错误;
2 2 2 2
答案为D。
8. N(g)+3H(g) 2NH(g) ΔH<0反应达到平衡状态后,改变某一条件,下列图像与条件变化一致
2 2 3
的是
A.升高温度 B.增大N 浓度 C.改变压强 D.加入催化剂
2A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.焓变为负,升高温度平衡逆向移动,则氮气的转化率减小,与图不一致,故A错误;
B.增大N 浓度,正反应速率瞬间增大,逆反应速率逐渐增大,与图一致,故B正确;
2
C.正反应为气体体积减小的反应,增大压强平衡正向移动,则压强大的对应氨气的物质的量分数大,与
图不一致,故C错误;
D.催化剂不影响平衡移动,则气体的总压强不变,与图不一致,故D错误;
故选B。
9. 下列事实能用勒夏特列原理解释的是
A. 铁触媒有利于N 和H 反应合成氨
2 2
B. H(g)+I (g) 2HI(g)的平衡体系,加压后颜色变深
2 2
.
C N(g)+3H(g) 2NH (g) ΔH<0 高温有利于合成氨
2 2 3
D. Fe3++3SCN- Fe(SCN) 的平衡体系,加入少量KSCN固体后溶液颜色加深
3
【答案】D
【解析】
【详解】A.铁触媒能够加快反应速率,缩短达到平衡所需时间,在相同时间内产生更多 NH ,因此有利
3
于N 和H 反应合成氨但不能使化学平衡发生移动,因此不能用勒夏特列原理解释,A不符合题意;
2 2
B.H(g)+I (g) 2HI(g)的平衡体系是反应前后气体体积不变的反应,加压后化学平衡不发生移动,但
2 2
由于物质的浓度增大,因此气体颜色变深,与平衡移动无关,因此不能用勒夏特列原理解释,B不符合题
意;
C.该反应的正反应是放热反应,升高温度化学平衡向吸热的逆反应方向移动,不利于氨的合成,不能用
平衡移动原理解释,C不符合题意;
D.向平衡体系中加入KSCN固体,SCN-的浓度增大,化学平衡正向移动,当反应达到平衡后溶液颜色加
深,可以使用平衡移动原理解释,D符合题意;
故合理选项是D。
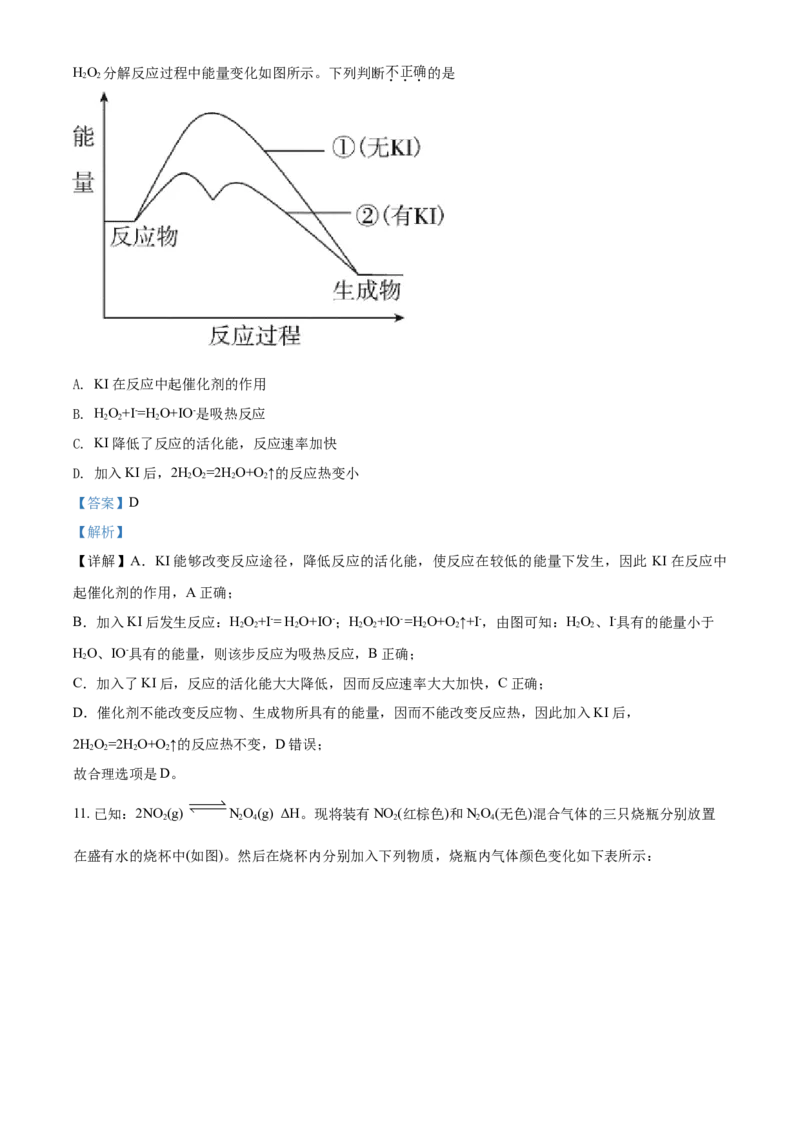
10. HO 是重要的消毒剂,研究其分解反应有重要意义。KI能加快HO 的分解。
2 2 2 2
①2HO=2H O+O↑
2 2 2 2
②HO+I-= H O+IO-;HO+IO- =H O+O↑+I-
2 2 2 2 2 2 2HO 分解反应过程中能量变化如图所示。下列判断不正确的是
2 2
A. KI在反应中起催化剂的作用
B. HO+I-=H O+IO-是吸热反应
2 2 2
C. KI降低了反应的活化能,反应速率加快
D. 加入KI后,2HO=2H O+O↑的反应热变小
2 2 2 2
【答案】D
【解析】
【详解】A.KI能够改变反应途径,降低反应的活化能,使反应在较低的能量下发生,因此 KI在反应中
起催化剂的作用,A正确;
B.加入KI后发生反应:HO+I-= H O+IO-;HO+IO- =H O+O↑+I-,由图可知:HO、I-具有的能量小于
2 2 2 2 2 2 2 2 2
HO、IO-具有的能量,则该步反应为吸热反应,B正确;
2
C.加入了KI后,反应的活化能大大降低,因而反应速率大大加快,C正确;
D.催化剂不能改变反应物、生成物所具有的能量,因而不能改变反应热,因此加入KI后,
2HO=2H O+O↑的反应热不变,D错误;
2 2 2 2
故合理选项是D。
11. 已知:2NO (g) NO(g) ΔH。现将装有NO (红棕色)和NO(无色)混合气体的三只烧瓶分别放置
2 2 4 2 2 4
在盛有水的烧杯中(如图)。然后在烧杯内分别加入下列物质,烧瓶内气体颜色变化如下表所示:序号 I II III
外加物质 CaO固体 无 NH Cl固体
4
气体颜色 加深 不变 变浅
下列叙述正确的是
A. ΔH <0
B. NH Cl固体溶于水时放出热量
4
C. I中烧瓶内混合气体的平均相对分子质量增大
D. III中烧瓶内气体的压强增大
【答案】A
【解析】
【详解】A.氧化钙溶于水放热,Ⅰ中红棕色变深,说明反应2NO (g) NO(g)向左移动,该反应放热,A
2 2 4
正确; ⇌
B.由于Ⅲ 中红棕色变浅,说明反应2NO (g) NO(g)向右移动,温度降低,所以NH Cl溶于水时吸收热
2 2 4 4
量,B错误; ⇌
C.由于Ⅰ中红棕色变深,平衡逆向移动,气体物质的量变大,混合气的相对分子质量减小,C错误;
D.Ⅲ中红棕色变浅,2NO (g) NO(g)平衡右移,气体的总物质的量减少,压强减小,D错误;
2 2 4
故选A。 ⇌
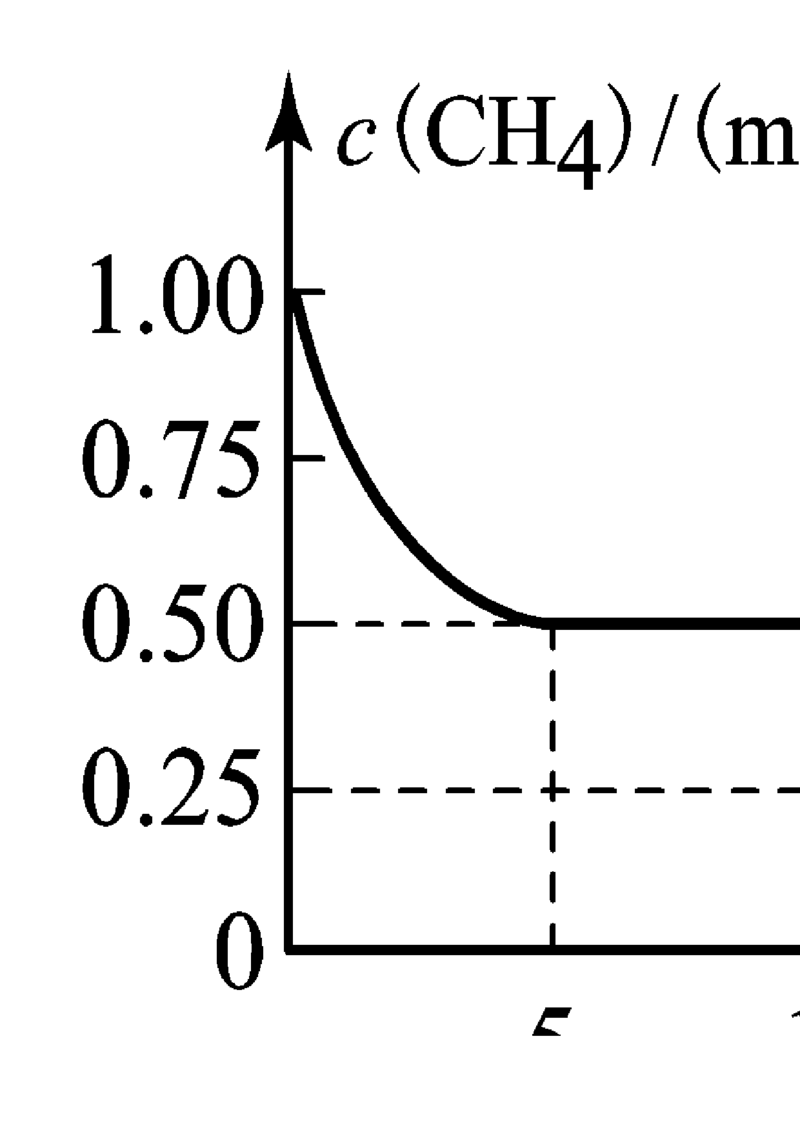
12. 在密闭容器中发生反应CH(g)+ HO(g) CO(g) +3H(g) ΔH>0,测得 随反应时间
4 2 2
的变化如图所示。下列判断不正确的是A. 0~5min内,v(CH)=0.1mol·L-1·min-1
4
B. 10min时,改变的外界条件可能是温度
C. 恒温下,缩小容器体积,达到新平衡时n(H)比原平衡时的小
2
D. 10~12min时间内,反应的平衡常数逐渐减小
【答案】D
【解析】
【详解】A.根据图可知,前 5min 内甲烷的浓度由 1.00mol/L 减小为 0.50mol/L,故 v(CH)=
4
=0.1mol/(L•min),故A正确;
B.由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,该反应正反应是吸热反应,可
能是升高温度,故B正确;
C.恒温下,缩小容器体积,压强增大,平衡向逆反应方向移动,达到新平衡时n(H)比原平衡时的小,故
2
C正确;
D.根据图象可知,10-12 min时甲烷的物质的量减小,改变的条件可能为:减小压强、升高温度或增大
水蒸气浓度,化学平衡常数只与温度变化有关,所以改变的条件不一定为温度,化学平衡常数不一定发生
变化,故D错误;
故选D。
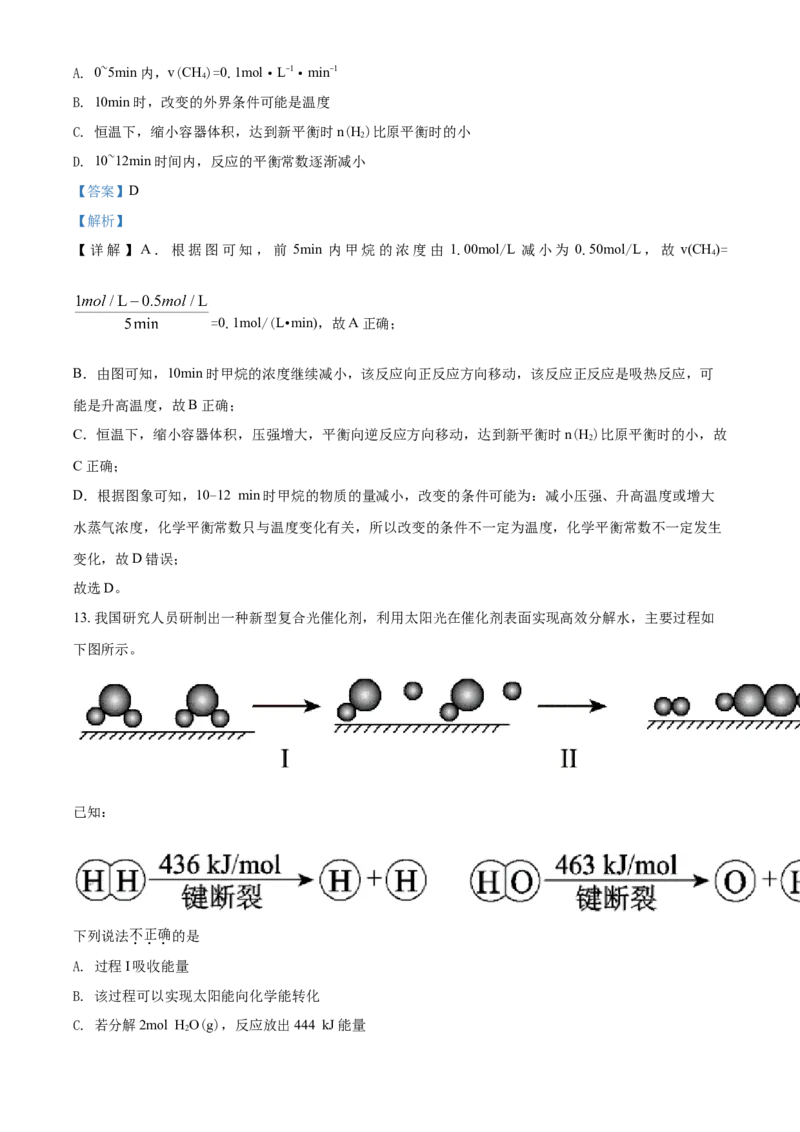
13. 我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如
下图所示。
已知:
下列说法不正确的是
A. 过程I吸收能量
B. 该过程可以实现太阳能向化学能转化
C. 若分解2mol HO(g),反应放出444 kJ能量
2D. 催化剂能降低反应的活化能,增大反应物分子中活化分子的百分数
【答案】C
【解析】
【详解】A.过程I中断裂化学键,则过程I吸收能量,故A正确;
B.该过程利用太阳光 在催化剂表面实现高效分解水,因此该过程可以实现太阳能向化学能转化,故B正
确;
C.分解水的反应为2HO(g)=2H(g)+O(g),焓变△H=反应物的总键能-生成物的总键能=463kJ/mol×4-
2 2 2
(436kJmol×2+498kJ/mol)=+482kJ/mol,即2HO(g)=2H(g)+O(g)△H=+482kJ/mol,所以分解
2 2 2
2molH O(g)吸收482kJ能量,故C错误;
2
D.催化剂能降低反应的活化能,可使反应体系中活化分子数增加,分子总数不变,则反应物分子中活化
分子的百分数增大,故D正确;
故选C。
14. 将0.2mol/L KI溶液和0.05mol/LFe (SO ) 溶液等体积混合,充分反应后,取混合溶液分别完成下列实验,
2 4 3
能说明溶液中存在化学平衡2Fe3+ + 2I- 2Fe2+ + I 的是(已知:Fe2+与K [Fe(CN) ]溶液反应有蓝色沉淀
2 3 6
生成)
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变为红色
② 滴入 溶液 有黄色沉淀生成
③ 滴入K [Fe(CN) ]溶液 有蓝色沉淀生成
3 6
④ 滴入淀粉溶液 溶液变为蓝色
A. ① B. ①和② C. ②和④ D. ③和④
【答案】A
【解析】
【详解】将0.2mol•L-1的KI溶液和0.05mol•L-1 Fe (SO ) 溶液等体积混合后,若此反应不可逆,则Fe3+和I-
2 4 3
完全反应后有I-剩余,故只需要证明含有Fe3+则即能证明此反应为可逆反应,能建立化学平衡。①向溶液
中滴入KSCN溶液,溶液变红,则说明溶液中有Fe3+,即能说明反应存在平衡,故①正确;②向溶液中滴
入AgNO 溶液有黄色沉淀生成,说明溶液中含I-,不能说明反应存在平衡,故②错误;③无论反应存不存
3
在平衡,溶液中均存在Fe2+,滴入K[Fe(CN) ]溶液均有蓝色沉淀生成,故③错误;④无论反应存不存在
3 6平衡,溶液中均有I,滴入淀粉溶液后溶液均变蓝色,故不能证明存在平衡,故④错误;
2
故选A。
第二部分 非选择题(共58分)
15. 按要求回答下列问题:
(1)已知:I.H O(g) = H (g) + O(g) ΔH = +241.8kJ/mol
2 2 2
II.C(s) + O(g) = CO(g) ΔH = -110.5kJ/mol
2
III.C(s) + O (g) = CO (g) ΔH = -393.5kJ/mol
2 2
①上述反应中,属于吸热反应的是___________(填序号)。
②表示C的燃烧热的热化学方程式为___________(填序号)。
③写出CO燃烧的热化学方程式___________。
(2)在密闭容器中,通入a mol N 和b mol H ,在一定条件下反应达到平衡时,容器中剩余c mol N
2 2 2。
①达到平衡时,生成NH 的物质的量为_________,H 的转化率为__________。
3 2
②若把容器的容积缩小一半,则正反应速率___________(填“增大”“减小”或“不变”,下同),逆反应速率
___________,N 的转化率___________。
2
【答案】(1) ①. I ②. III ③. CO(g)+ O (g) = CO (g) △H = -283.0 kJ/mol
2 2
(2) ①. 2(a-c)mol ②. ③. 增大 ④. 增大 ⑤. 增大
【解析】
【小问1详解】
①ΔH>0为吸热反应,ΔH<0为反热反应,所以只有I属于吸热反应,故答案为:I;
②燃烧热:101kPa时,1mol纯物质完全燃烧生成稳定氧化物时所释放的能量为燃烧热,据此分析III为C
的燃烧热的热化学方程式,故答案为:III;
③由加合法可知III-II可得CO燃烧的热化学方程式为CO(g)+ O (g) = CO (g) △H = -283.0 kJ/mol,故答
2 2
案为:CO(g)+ O (g) = CO (g) △H = -283.0 kJ/mol;
2 2【小问2详解】
①由题意可得三段式 所以,平衡时生成NH 的物质的
3
量为 mol;H 的转化率为 ,故答案为:2(a-c)mol;
2
;
②把容器的容积缩小一半,则容器中各物质的浓度增大,化学反应速率加快;由于该反应为气体体积减小
的反应,根据勒夏特列原理可知平衡正向移动,则N 的转化率增大,故答案为为:增大;增大;增大。
2
16. 在密闭容器中发生反应CO(g) + H(g) CO(g) + HO(g),其平衡常数(K)和温度(T)的关系如下
2 2 2
表所示。
T/
700 800 830 1000 1200
℃
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的平衡常数表达式K=___________;由上表可知该反应为___________反应(填“吸热”或
“放热”)。
(2)830℃时,向容器中充入2mol CO、8mol H,保持温度不变,反应达到平衡后,其平衡常数
2 2
___________1.0(填“大于”“小于”或“等于”),此时CO 的物质的量为___________。
2
(3)下列有利于提高平衡时CO 转化率的措施有___________(填字母)。
2
a.使用催化剂 b.升温 c.增大 CO 和 H 的投料比
2 2
(4)若1200℃时,在某时刻反应混合物中CO、H、CO、 HO的浓度分别为2mol/L、2mol/L、
2 2 2
4mol/L、4mol/L,则此时反应的平衡移动方向为___________(填“正反应方向”“逆反应方向”或“不移
动”)。
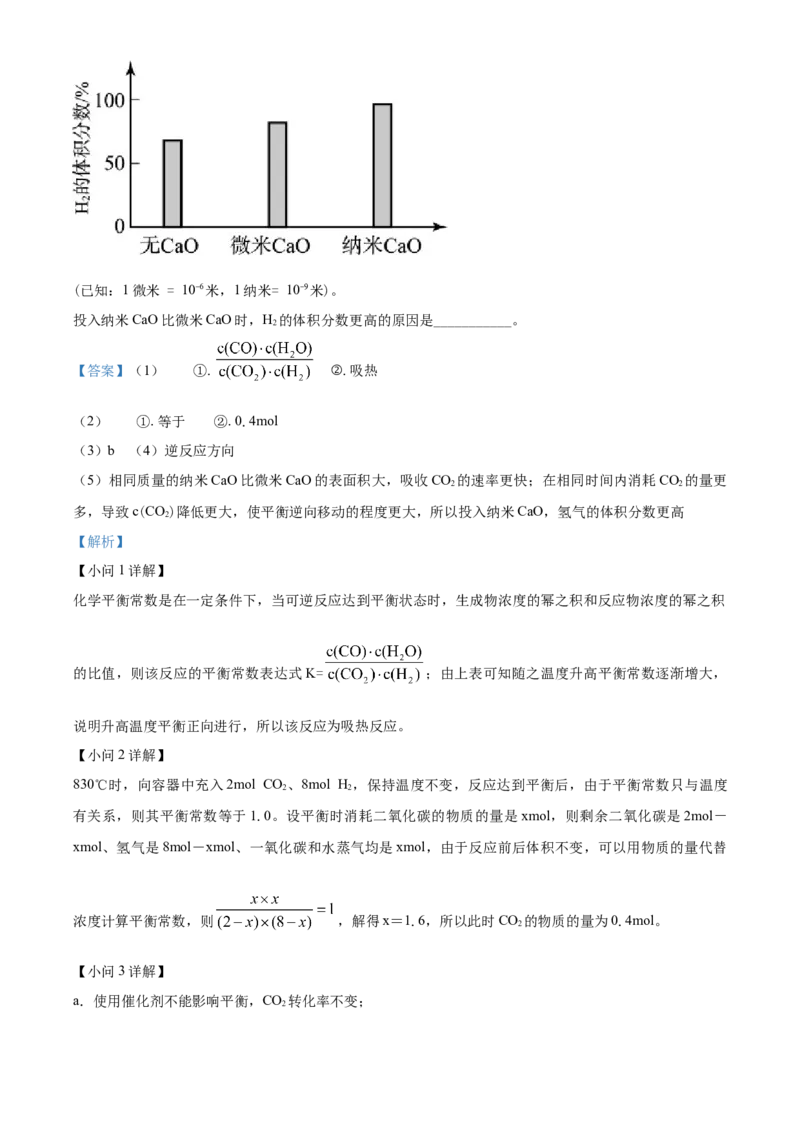
(5)实验发现,其它条件不变,在相同时间内,向上述反应体系中投入一定量的CaO,H 的体积分数增
2
大,实验结果如图所示。(已知:1微米 = 10-6米,1纳米= 10-9米)。
投入纳米CaO比微米CaO时,H 的体积分数更高的原因是___________。
2
【答案】(1) ①. ②. 吸热
(2) ①. 等于 ②. 0.4mol
(3)b (4)逆反应方向
(5)相同质量的纳米CaO比微米CaO的表面积大,吸收CO 的速率更快;在相同时间内消耗CO 的量更
2 2
多,导致c(CO)降低更大,使平衡逆向移动的程度更大,所以投入纳米CaO,氢气的体积分数更高
2
【解析】
【小问1详解】
化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积
的比值,则该反应的平衡常数表达式K= ;由上表可知随之温度升高平衡常数逐渐增大,
说明升高温度平衡正向进行,所以该反应为吸热反应。
【小问2详解】
830℃时,向容器中充入2mol CO 、8mol H ,保持温度不变,反应达到平衡后,由于平衡常数只与温度
2 2
有关系,则其平衡常数等于1.0。设平衡时消耗二氧化碳的物质的量是xmol,则剩余二氧化碳是2mol-
xmol、氢气是8mol-xmol、一氧化碳和水蒸气均是xmol,由于反应前后体积不变,可以用物质的量代替
浓度计算平衡常数,则 ,解得x=1.6,所以此时CO 的物质的量为0.4mol。
2
【小问3详解】
a.使用催化剂不能影响平衡,CO 转化率不变;
2b.正反应吸热,升温平衡正向进行,CO 转化率增大;
2
c.增大CO 和H 的投料比有利于增大氢气的转化率,CO 转化率降低;
2 2 2
答案选b;
【小问4详解】
若1200℃时,在某时刻反应混合物中CO、H、CO、HO的浓度分别为2mol/L、2mol/L、4mol/L、
2 2 2
4mol/L,则此时浓度熵为 >2.6,所以反应的平衡移动方向为逆反应方向。
【小问5详解】
由于相同质量的纳米CaO比微米CaO的表面积大,吸收CO 的速率更快;在相同时间内消耗CO 的量更
2 2
多,导致c(CO)降低更大,使平衡逆向移动的程度更大,所以投入纳米CaO,氢气的体积分数更高。
2
17. 甲醚(CHOCH )是重要的化工原料,可用CO和H 制得,总反应的热化学方程式如为 2CO (g) +4H(g)
3 3 2 2
CHOCH (g) + H O (g) ΔH = -206.0 kJ/mol
3 3 2
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CHOH(g) CHOCH (g)+ H O(g) ΔH = -24.0 kJ/mol
3 3 3 2
(1)起始时向容器中投入2mol CO和4mol H,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO
2
的转化率为___________。
(2)请写出甲醇合成反应的热化学方程式:___________。
(3)在一定条件下,将CO和H 按体积比1:2充入恒容密闭容器中,反应生成CHOCH (g)和HO(g)。
2 3 3 2
下列能说明该反应达到平衡状态的是___________(填字母)。
A. 混合气体的总物质的量保持不变
B. 混合气体的密度保持不变
C. CHOCH (g)和HO(g)的物质的量之比保持不变
3 3 2
D. 每生成1mol CHOCH (g),同时生成2mol CO
3 3
(4)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:CHOH(g) + H O(g) CO(g)
3 2 2
+3H (g) ΔH = +48.8 kJ/mol,将反应物混合气按进料比n(CO)∶n(H ) = 1:2通入反应装置,选择合适的催化
2 2
剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
① 图1中,温度一定,压强增大,甲醚选择性增大的原因___________。
② 图2中,温度高于265℃后,甲醚选择性降低的原因___________。
【答案】(1)25% (2)2CO(g)+4H(g) 2CH OH(g) H = -182.0 kJ/mol(或CO(g)+2H(g)
2 3 2
△
CHOH(g) H = -91.0 kJ/mol) (3)AD
3
△
(4) ①. 增大压强,副反应CHOH(g)+H O(g) CO (g)+3H(g) 逆向移动,被抑制;甲醇脱水反
3 2 2 2
应 2CHOH (g) CH OCH (g)+ HO (g)不受压强影响 ②. 甲醇脱水反应 2CHOH (g)
3 3 3 2 3
CHOCH (g)+ HO (g) H = -24.0 kJ/mol正向为放热反应,升高温度平衡逆移,甲醚选择性降低;副反应
3 3 2
△
CHOH(g)+H O(g) CO (g)+3H(g) H = +48.8 kJ/mol 正向为吸热反应,升高温度平衡正移,副产物
3 2 2 2
△
增加,甲醚选择性降低
【解析】
【小问1详解】
CO的转化率= ×100%=25%;
【小问2详解】
①2CO(g)+4H(g) CHOCH (g)+HO(g),根据盖斯定律,(①-ii)÷2可得CO(g)+2H(g) CHOH (g),则∆H=
2 3 3 2 2 3
⇌ ⇌
=-91 kJ/mol;
【小问3详解】
当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不
发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,
说明可逆反应到达平衡状态;
A.反应是气体物质的量减少的反应,混合气体的总物质的量是变量,当不变时能表明平衡,A符合题意;B.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,B错误;
C.反应生成物CHOCH (g)和HO(g)的物质的量始终是1:1,不能表明平衡,C不符合题意;
3 3 2
D.每生成1mol CHOCH (g),同时也消耗2mol CO,同时生成2mol CO,能表明平衡,D符合题意;
3 3
故选AD;
【小问4详解】
①副反应CHOH(g)+H O(g) CO(g)+3H(g) 为气体增大的反应,温度一定,压强增大,副反应平衡逆向移
3 2 2 2
动,而主反应2CHOH (g) ⇌CHOCH (g)+ HO (g)气体物质的量不变,无影响,则二甲醚选择性增大;
3 3 3 2
②主反应2CH
3
OH (g) CH⇌3 OCH
3
(g)+ H
2
O (g) H = -24.0 kJ/mol为放热反应,升高温度,平衡逆向移动,
二甲醚选择性降低;而⇌副反应CHOH(g)+H O(g△) CO(g)+3H(g) H = +48.8 kJ/mol 为吸热反应,平衡正
3 2 2 2
向移动,副产物增大,二甲醚选择性降低。 ⇌ △
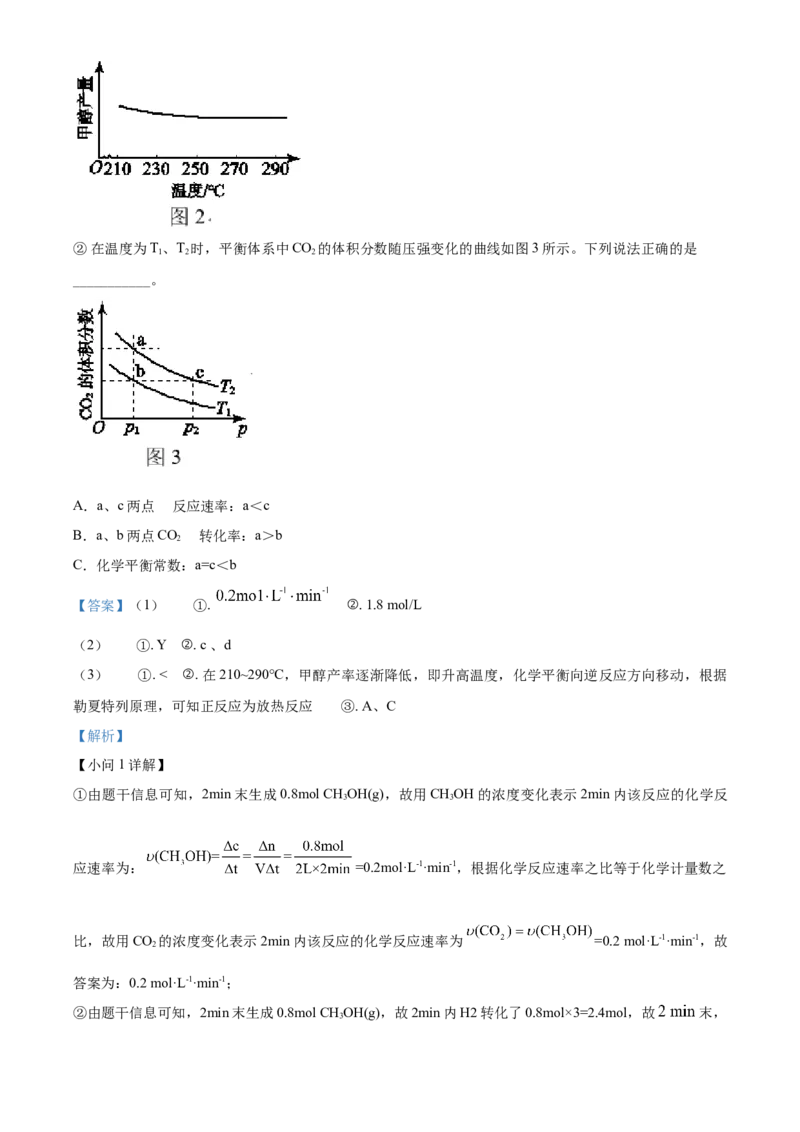
18. 我国力争在2060年前实现“碳中和”,综合利用CO 具有重要的意义。 、 条件下,
2
CO 与H 反应可制得气态甲醇(CHOH),其反应的热化学方程式为:CO(g) + 3H(g)
2 2 3 2 2
CHOH(g) + H O(g) ΔH
3 2
(1)在一定温度下,2mol CO 与6mol H 置于2 L密闭容器中反应制得甲醇,2min末生成0.8mol
2 2
CHOH(g)。
3
① 用 的浓度变化表示2min内该反应的化学反应速率___________。
② 末,容器中H 的物质的量浓度___________。
2
(2)在实际生产中,测得合成塔中H(g)及HO(g)的物质的量随时间变化如图1所示,则图1中代表 的
2 2
曲线是___________ (填“X”或“Y”), (正)与 (逆)相等的点为___________ (填字母)。
(3)研究温度对该反应的影响:
① 研究发现,在210~290℃,保持原料气中CO 和H 的投料比不变,得到平衡时甲醇的产率与温度的关系
2 2
如图2所示,则该反应的ΔH___________0(填“>”“=”或“<”),依据是___________。② 在温度为T、T 时,平衡体系中CO 的体积分数随压强变化的曲线如图3所示。下列说法正确的是
1 2 2
___________。
A.a、c两点 的反应速率:a<c
B.a、b两点CO 的转化率:a>b
2
C.化学平衡常数:a=c<b
【答案】(1) ①. ②. 1.8 mol/L
(2) ①. Y ②. c 、d
(3) ①. < ②. 在210~290℃,甲醇产率逐渐降低,即升高温度,化学平衡向逆反应方向移动,根据
勒夏特列原理,可知正反应为放热反应 ③. A、C
【解析】
【小问1详解】
①由题干信息可知,2min末生成0.8mol CH OH(g),故用CHOH的浓度变化表示2min内该反应的化学反
3 3
应速率为: =0.2mol·L-1·min-1,根据化学反应速率之比等于化学计量数之
比,故用CO 的浓度变化表示2min内该反应的化学反应速率为 =0.2 mol·L-1·min-1,故
2
答案为:0.2 mol·L-1·min-1;
②由题干信息可知,2min末生成0.8mol CH OH(g),故2min内H2转化了0.8mol×3=2.4mol,故 末,
3容器中H 的物质的量浓度为:c= =1.8mol/L,故答案为:1.8mol/L;
2
【小问2详解】
在实际生产中,测得合成塔中H(g)及HO(g)的物质的量随时间变化如图1所示,曲线X随着反应进行不
2 2
断增大至不变,X代表生成物HO(g),Y随着反应的进行不断减小至不变,故代表反应物H 的变化,则图
2 2
1中代表 的曲线是Y,图中可知,ab两点后XY代表物质的物质的量还在变化,说明并未达到平衡,cd
两点后物质的物质的量不变了,说明达到平衡了,即 (正)与 (逆)相等,故答案为:Y;cd;
【小问3详解】
① 研究发现,在210~290℃,保持原料气中CO 和H 的投料比不变,得到平衡时甲醇的产率与温度的关系
2 2
如图2所示,根据图中信息可知,随着温度升高,甲醇的产量逐渐减小,说明升高温度,平衡逆向移动,
说明该反应正反应为放热反应,则该反应的ΔH<0,故答案为:<;在210~290℃,甲醇产率逐渐降低,
即升高温度,化学平衡向逆反应方向移动,根据勒夏特列原理,可知正反应为放热反应;
②
A.由图可知,a点的压强比c的小,则a的浓度比c的小,故a、c两点的反应速率:a<c,A正确;
B.由图可知,a的对应的CO 体积分数大于b点,体积分数越大,转化率越小,故a、b两点CO 的转化
2 2
率:a<b,B错误;
C.由①分析可知,该反应为放热反应,则温度越高,平衡逆向移动,CO 的体积分数越大,平衡常数越
2
小,故可知T<T,温度不变平衡常数不变,故化学平衡常数:a=c<b,C正确;
1 2
故答案为:AC。
19. 兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:(1)利用实验Ⅰ探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。
此方法需要控制的变量有(写出1项即可):___________。
(2)利用实验Ⅱ探究浓度对化学平衡的影响。
已知:Cr O (橙色)+H O 2CrO (黄色)+2H+ 推测B试管中实验现象为___________,用平衡移动原
2 2
理解释原因:___________。
(3)该小组同学继续用酸性KMnO 溶液和草酸(HCO)溶液进行实验,实验操作及现象如下表:
4 2 2 4
编
实验操作 实验现象
号
向一支试管中先加入5mL0.01mol/L酸性KMnO 溶液,再加入 前10min内溶液紫色无明显变化,
4
ⅰ 1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶 后颜色逐渐变浅,30min后几乎变
液 为无色
80s内溶液紫色无明显变化,后颜
向另一支试管中先加入5mL0.01mol/L酸性KMnO 溶液,再加
ⅱ 4 色迅速变浅,约150s后几乎变为无
入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液
色
已知:2MnO + 5H C O +6H+ =2Mn2+ +10CO ↑+8H O
2 2 4 2 2
① 由实验ⅰ、实验ⅱ可得出的结论是___________。
② 关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催
化作用。利用下列提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO 溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO 固体,蒸馏水。
4 4
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO 溶液,___________,最后加入
4
5mL0.1mol/L草酸溶液。
【答案】(1)温度(或者锌粒大小等)
(2) ①. 溶液由橙色变为黄色 ②. 加NaOH溶液使c(H+)减小,平衡右移,c(CrO )增大
(3) ①. 其他条件相同时,H+(或硫酸)浓度越大,反应速率越快 ②. 再加入10滴3mol·L-1硫酸,然
后加入少量MnSO 固体
4
【解析】
【分析】(1) 测定收集一定体积氢气所用的时间,需保证温度、锌粒大小相同;
(2) D中加NaOH,使Cr (橙色)+H O 2Cr (黄色) +2H+正向移动;
2 2
(3) ①实验1、II酸的浓度不同,据此分析解答;
②根据设计的实验1、2可知,猜想为该反应中生成的Mn2+对反应有催化作用,实验2中加入少量MnSO
4固体与实验1进行对比,若猜想成立,加入MnSO 固体溶液紫色应迅速变浅,据此分析。
4
【小问1详解】
测定收集一定体积氢气所用的时间,需保证温度、锌粒大小相同,则此方法需要控制的变量有温度、锌粒
大小;
【小问2详解】
D试管中实验现象为溶液由橙色变为黄色,用平衡移动原理解释原因为加NaOH溶液使c (H+) 减小,平衡
右移,c (Cr )增大;
【小问3详解】
①实验Ⅰ、Ⅱ酸的浓度不同,实验II酸浓度大,反应快,故由实验Ⅰ、Ⅱ可得出的结论是:其他条件相同
时,H+ (或硫酸)浓度越大,反应速率越快;
②为了验证实验II中80s后溶液颜色迅速变浅的是否有锰离子其催化作用,应其他条件相同,只改变锰离
子的量,因此向试管中先加入1mL0.01mol/L酸性KMnO 溶液,再加入10滴3mol/L硫酸,然后加入少量
4
MnSO 固体,最后加入1mL0.1mol/L草酸溶液;
4