文档内容
第一学期期中考试
高二化学试卷(高考)
注意:
1.本试卷共10页,满分100分
2.考试时间75分钟
第Ⅰ卷选择题(共49分)
一、选择题(共10小题,每小题2.5分,共25分。每小题只有一个选项符合题意。)
1. 下列说法正确的是
A. C(石墨,s)=C(金刚石,s) ∆H>0,说明反应物总键能大于生成物总键能
B. H(g)的燃烧热∆H=-285.8kJ/mol,则2HO(g)=2H (g)+O(g) ∆H=+571.6kJ/mol
2 2 2 2
C. 已知稀溶液中,H+(aq)+OH-(aq)=H O(l) ∆H=-57.3kJ/mol,则稀硫酸与氢氧化钡稀溶液反应生成1mol
2
水时放出57.3kJ的热量
D. 增大压强,加快反应速率,是因为提高了活化分子百分比
【答案】A
【解析】
【详解】A.断键需要吸收热量,成键需要释放热量,反应为吸热反应,说明反应物总键能大于生成物总
键能,A正确;
B.燃烧热为1mol可燃物完全燃烧生成指定物质所放出的热量,正反应为放热反应,则逆反应为吸热反应,
则2HO(l)=2H(g)+O(g) ∆H=+571.6kJ/mol,B错误;
2 2 2
C.稀硫酸与氢氧化钡反应生成水和硫酸钡沉淀,反应实质不相符,C错误;
D.增大压强,导致单位体积内活化分子个数增多,活化分子百分比没有增大,D错误;
答案选A。
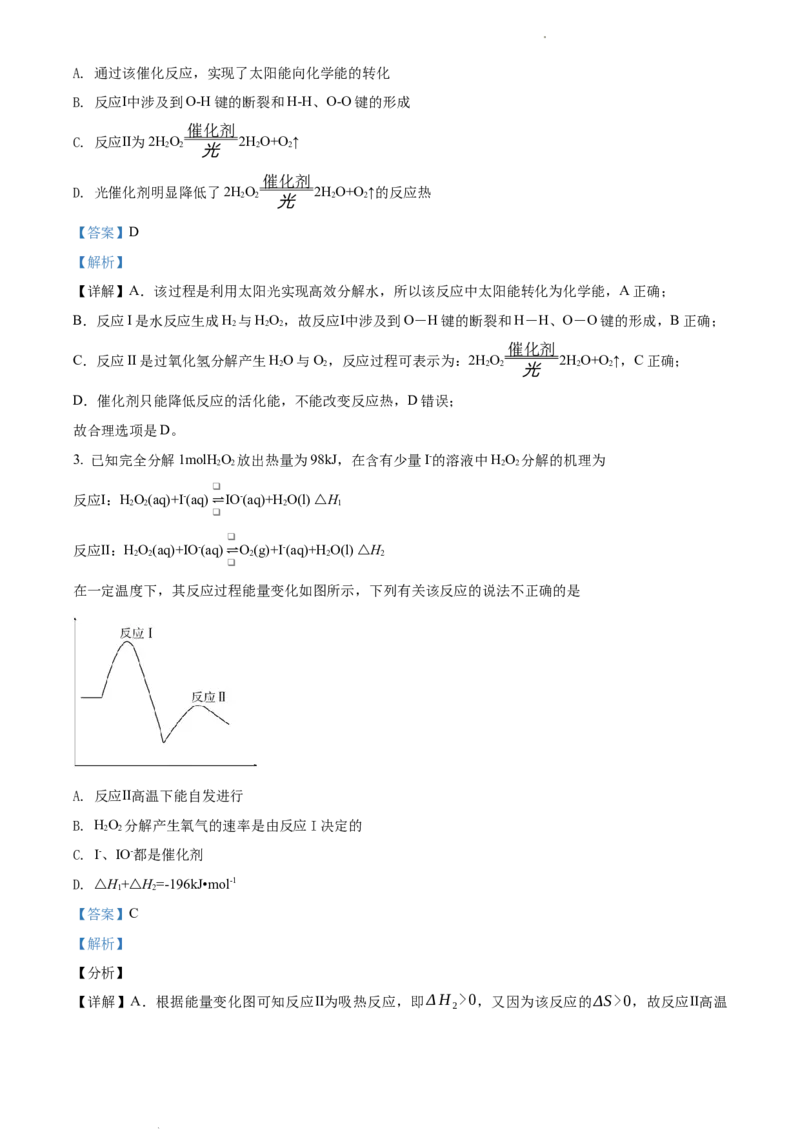
2. 中国化学家研究出一种新型复合光催化剂(C N/CQDs),能利用太阳光高效分解水,原理如图所示。下
3 4
列说法不正确的是
学科网(北京)股份有限公司A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应Ⅰ中涉及到O-H键的断裂和H-H、O-O键的形成
催化剂
C. 反应Ⅱ为2HO 2HO+O↑
2 2 光 2 2
催化剂
D. 光催化剂明显降低了2HO 2HO+O↑的反应热
2 2 光 2 2
【答案】D
【解析】
【详解】A.该过程是利用太阳光实现高效分解水,所以该反应中太阳能转化为化学能,A正确;
B.反应I是水反应生成H 与HO,故反应Ⅰ中涉及到O-H键的断裂和H-H、O-O键的形成,B正确;
2 2 2
催化剂
C.反应II是过氧化氢分解产生HO与O,反应过程可表示为:2HO 2HO+O↑,C正确;
2 2 2 2 光 2 2
D.催化剂只能降低反应的活化能,不能改变反应热,D错误;
故合理选项是D。
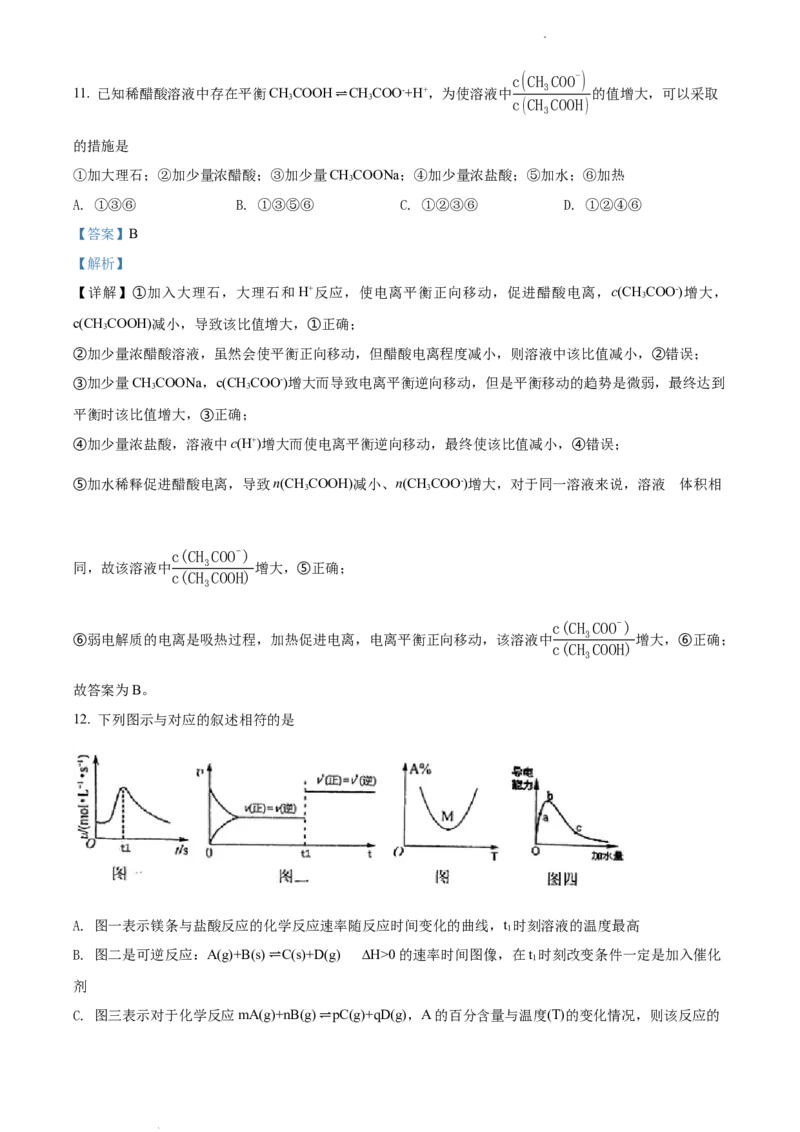
3. 已知完全分解1molH O 放出热量为98kJ,在含有少量I-的溶液中HO 分解的机理为
2 2 2 2
❑
反应Ⅰ:H
2
O
2
(aq)+I-(aq)⇌IO-(aq)+H
2
O(l) △H
1
❑
❑
反应Ⅱ:H
2
O
2
(aq)+IO-(aq)⇌O
2
(g)+I-(aq)+H
2
O(l) △H
2
❑
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
A. 反应Ⅱ高温下能自发进行
B. HO 分解产生氧气的速率是由反应I决定的
2 2
C. I-、IO-都是催化剂
D. △H+△H=-196kJ•mol-1
1 2
【答案】C
【解析】
【分析】
【详解】A.根据能量变化图可知反应Ⅱ为吸热反应,即ΔH >0,又因为该反应的ΔS>0,故反应Ⅱ高温
2
学科网(北京)股份有限公司下能自发进行,A正确;
的
B.反应Ⅰ 活化能高,反应速率慢,故H O 分解产生氧气的速率由反应Ⅰ决定,B正确;
2 2
C.根据反应过程可知,I-是反应的催化剂,而IO-是中间产物,C错误;
D.1molH O 完全分解放出热量98kJ,反应Ⅰ、Ⅱ相加即得ΔH +ΔH =−196kJ⋅mol−1 ,D正确;
2 2 1 2
故选:C。
4. 下列有关说法正确的是
的
A. 足量 FeCl 溶液与少量KI溶液反应后,用CCl 萃取生成的I,分液。再往水溶液中滴加KSCN溶液,
3 4 2
溶液变红,说明该反应为可逆反应
B. 2NO(g)+2CO(g)=N (g)+2CO (g)在常温下能自发进行,则该反应的∆H>0
2 2
C. 过量锌与少量稀硫酸反应制备氢气,往稀硫酸中加入少量醋酸钠固体,可以减慢氢气的产生速率,但
是不会影响生成氢气的总量
❑
D. 已知2NO 2⇌N
2
O
4
∆H<0,升高温度,v
正
下降,v
逆
增加,N
2
O
4
百分含量下降
❑
【答案】C
【解析】
【详解】A.足量的FeCl 溶液与少量KI溶液反应后,用CCl 萃取生成的I ,分液。KI溶液不足,反应后
3 4 2
FeCl 有剩余,再往水溶液中滴加KSCN溶液,溶液变红,不能说明该反应为可逆反应,故A错误;
3
B.2NO(g)+2CO(g)=N (g)+2CO (g)的△S<0,在常温下能自发进行则∆H<0,故B错误;
2 2
C.醋酸钠与稀硫酸反应生成醋酸弱电解质,可以降低氢离子浓度,氢气的产生速率,但氢离子的总物质
的量不变,不影响成氢气的总量,故C正确;
❑
D.2NO 2⇌N
2
O
4
∆H<0,升高温度,v
正
和v
逆
都增加,平衡逆向移动,N
2
O
4
百分含量下降,故D错误;
❑
故答案为C。
5. 在2个容积均为2L的恒容密闭容器中按照下述方式投入反应物,发生反应:CO(g)+H
2
O(g)⇌CO
2
(g)
+H (g) ∆H=-a kJ/mol(a>0)。相关反应数据如下:
2
起始物质的量/mol
容器类 起始温
容器 平衡时H 物质的量/mol
型 度/℃ 2
CO HO CO H
2 2 2
恒温恒
Ⅰ 800 1.2 0.6 0 0 0.4
容
学科网(北京)股份有限公司绝热恒
Ⅱ 800 1.2 0.6 0 0
容
下列说法不正确的是
A. 达到平衡时,容器Ⅱ中n(H )<0.4mol
2
B. 达到平衡时,容器Ⅱ中反应放出的热量小于0.4a kJ
C. 反应Ⅰ在10min刚好到达平衡,则前10min内的平均反应速率v(CO)=0.02mol/(L·min)
D. 平衡常数K=K
Ⅰ Ⅱ
【答案】D
【解析】
【详解】A.达到平衡时,容器Ⅰ中n(H )=0.4mol,反应是放热反应,容器Ⅱ是绝热,相当于加热,平衡左
2
移,平衡时容器Ⅱ中n(H )<0.4mol,故A正确;
2
B.达到平衡时,容器Ⅰ中反应放出的热量等于0.4a kJ,容器Ⅱ中平衡左移反应放出的热量小于0.4a kJ,故
B正确;
C.反应Ⅰ在10min刚好到达平衡,则前10min内的平均反应速率,
0.4mol
v(H )= =0.02mol/(L·min)
,由方程式系数关系得v(CO)=v(H )=0.02mol/(L·min) ,故C正确;
2 2L×10min 2
D.容器Ⅰ和容器Ⅱ的起始温度相同,但随着反应进行容器Ⅱ的温度会发生变化,平衡常数改变,故平衡时平
衡常数K≠K ,故D不正确;
Ⅰ Ⅱ
故答案为:D
6. 下列事实不能用平衡移动原理解释的是
A. 氯水在光照下颜色变浅,最终变为无色
B. 夏天打开啤酒瓶,有很多气泡冒出
C. 由NO (g)、NO(g)组成的平衡体系通过缩小体积加压后颜色变深
2 2 4
D. 实验室用排饱和食盐水的方法收集Cl
2
【答案】C
【解析】
【详解】A.氯水中存在Cl +H O ⇌ H++Cl-+HClO,光照下发生反应2HClO 光照 2HCl+O ↑,随反应进行
2 2 ❑ 2
HClO浓度减小,平衡Cl +H O
⇌
H++Cl-+HClO正向移动,氯气浓度逐渐减小至消失,最终颜色变浅至无
2 2
色,可用平衡移动原理解释,故A不符合题意;
B.夏天打开啤酒瓶,是压强减小,平衡H O(l)+CO (g)
⇌
H CO (l)逆向移动,有很多气泡冒出,可用
2 2 2 3
平衡移动原理解释,故B不符合题意;
学科网(北京)股份有限公司C. 由NO (g)、NO(g)组成的平衡体系2NO (g) ⇌ N O (g),缩小体积增大压强体系物质浓度增大,颜色
2 2 4 2 2 4
变深,而且平衡正向移动,在变深基础上变浅,最终颜色仍然变深,所以颜色变深不能用平衡移动原理解
释,故C符合题意;
D.饱和食盐水中氯离子浓度大,平衡Cl +H O
⇌
H++Cl-+HClO逆向移动,抑制氯气和水反应,所以可用
2 2
排饱和食盐水的方法收集Cl 可用平衡移动原理解释,故D不符合题意;
2
故答案为:C
7. 在硫酸工业中,通过下列反应使SO
2
氧化为SO
3
:2SO
2
(g)+O
2
(g)⇌2SO
3
(g) ∆H=-196.6kJ/mol。下表列
出了恒容刚性容器中,在不同温度和压强下,反应达到平衡时SO 的转化率。下列说法错误的是
2
平衡时SO 的转化率/%
2
温度/℃
0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
500 85.6 92.9 94.9 97.7 98.3
A. 在到达平衡时充入He增大压强,不能增大SO 转化率
2
的
B. 为了增大SO 转化率,可以控制SO 与O 的投料比小于2
2 2 2
C. 在实际生产中,应选择的条件是450℃,10MPa
D. 在实际生产中,选定的温度为400~500℃,主要原因是考虑催化剂的活性最佳
【答案】C
【解析】
【详解】A.容器为恒容刚性容器,充入与反应无关的气体,气体的浓度不变,转化率不变,A正确;
B.增加一种反应物的浓度,可以提高另一种反应物的转化率,故控制二氧化硫和氧气的投料比小于2可
以增大二氧化硫的转化率,B正确;
C.根据表格数据可知,450℃时二氧化硫的转化率比500℃时的高,虽然10MPa时转化率增大,但对设备
要求高,故应选择450℃,5MPa,C错误;
D.为了催化剂的活性最佳,温度选定为400~500℃,D正确;
答案选C。
8. 向密闭容器中充入1molA,发生反应aA(g)=bB(g)+cC(g),达到平衡时,体系中B的体积分数φ(B)随温
度、压强的变化如图所示。下列说法正确的是
学科网(北京)股份有限公司A. 该反应的 H<0, S<0
B. M、N两点△对应的△化学平衡常数:M>N
C. P、M两点对应的A的转化率:P<M
D. 恒温恒容时,再充入少量A,达到新平衡,φ(B)增大
【答案】C
【解析】
【详解】A.由题图可知,压强不变时,升高温度,φ(B)减小,平衡逆向移动,故正反应为放热反应,
ΔH<0,温度不变时,增大压强,φ(B)减小,平衡逆向移动,故a0,A项错误;
B.M、N点的温度相同,化学平衡常数相同,B项错误;
C.P、M点的压强相同,降低温度,φ(B)增大,平衡正向移动,A的转化率增大,转化率:P<M,C项
正确;
D.恒温恒容条件下,向容器中再充入少量A,相当于对体系加压,结合题图可知,达到新平衡时,
φ(B)减小,D项错误。
答案选C。
9. 某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度
对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是
A B C D E F
4mol·L-1 HSO /mL 30 V V V V V
2 4 1 2 3 4 5
饱和CuSO 溶液/mL 0 0.5 2.5 5 V 20
4 6
HO/mL V V V V 10 0
2 7 8 9 10
A. V=30,V=10,V=20
1 6 7
B. 本实验利用了控制变量思想,变量为Cu2+浓度
学科网(北京)股份有限公司C. 反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈现红色
D. 该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用
【答案】D
【解析】
【详解】A.本实验研究硫酸铜的浓度对反应速率的影响,则每组硫酸的量要保持相同,6组实验溶液的
总体积也应该相同,根据实验A和实验F的数据,可知V=30,V=10,V=20,A项正确;
1 6 7
B.本实验利用控制变量思想,通过改变铜离子浓度.来研究硫酸铜的浓度对反应速率的影响,B项正确;
C.反应一段时间后,实验A中的金属为Zn,呈灰白色,实验F中的金属为Cu,呈红色,C项正确;
D.硫酸铜的浓度较小时,锌与置换出的铜形成原电池,化学反应速率加快,硫酸铜的浓度较大时,锌与硫酸
铜反应生成的铜会附着在锌上,阻碍锌与硫酸反应,氢气生成速率下降,故硫酸铜的浓度与生成氢气的速率
不成正比,不能证明硫酸铜对稀硫酸与锌反应生成氢气有催化作用,D项错误;
故答案为D。
10. 将4mol A气体和2mol B气体在恒压密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g)
∆H<0;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是
A. 此时A的浓度为0.6mol/L
B. 达平衡后若通入一定量氯气,A的转化率降低
C. 4s内用物质B表示的反应速率为0.175mol·L-1·s-1
D. 达平衡后若升高温度,C的浓度将增大
【答案】A
【解析】
【详解】A.在恒温恒容容器中投料比为化学计量数之比,达平衡状态质的量浓度之比等于化学计量数之
比,C的浓度为0.6mol/L,则 A的浓度为0.6mol/L,故A正确;
B.在恒温恒容容器中,反应达到平衡时加入氯气,总压增大,各气体分压不变,化学平衡不移动,所以
A的转化率不变,故B错误;
0.6mol/L
C.达到平衡时C的浓度为0.6mol⋅L−1,则C表示的反应速率是 =0.15mol·L-1·s-1在同一化学反
4s
应中的同一时间段内各物质表示的反应速率之比等于其化学计量数之比,所以B表示的反应速率是
0.15mol·L-1·s-1÷2=0.075mol·L-1·s-1,故C错误;
D.该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故D错误;
故答案为A。
二、选择题(共6小题,每小题4分,共24分。每小题只有一个正确答案。)
学科网(北京)股份有限公司c(CH COO-)
11. 已知稀醋酸溶液中存在平衡CH
3
COOH⇌CH
3
COO-+H+,为使溶液中
c(CH
3
COOH)
的值增大,可以采取
3
的措施是
①加大理石;②加少量浓醋酸;③加少量CHCOONa;④加少量浓盐酸;⑤加水;⑥加热
3
A. ①③⑥ B. ①③⑤⑥ C. ①②③⑥ D. ①②④⑥
【答案】B
【解析】
【详解】①加入大理石,大理石和H+反应,使电离平衡正向移动,促进醋酸电离,c(CHCOO-)增大,
3
c(CHCOOH)减小,导致该比值增大,①正确;
3
②加少量浓醋酸溶液,虽然会使平衡正向移动,但醋酸电离程度减小,则溶液中该比值减小,②错误;
③加少量CHCOONa,c(CHCOO-)增大而导致电离平衡逆向移动,但是平衡移动的趋势是微弱,最终达到
3 3
平衡时该比值增大,③正确;
④加少量浓盐酸,溶液中c(H+)增大而使电离平衡逆向移动,最终使该比值减小,④错误;
的
⑤加水稀释促进醋酸电离,导致n(CHCOOH)减小、n(CHCOO-)增大,对于同一溶液来说,溶液 体积相
3 3
c(CH COO-)
同,故该溶液中 3 增大,⑤正确;
c(CH COOH)
3
c(CH COO-)
⑥弱电解质的电离是吸热过程,加热促进电离,电离平衡正向移动,该溶液中 3 增大,⑥正确;
c(CH COOH)
3
故答案为B。
12. 下列图示与对应的叙述相符的是
A. 图一表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,t 时刻溶液的温度最高
1
B. 图二是可逆反应:A(g)+B(s)⇌C(s)+D(g) ∆H>0的速率时间图像,在t
1
时刻改变条件一定是加入催化
剂
C. 图三表示对于化学反应mA(g)+nB(g)⇌pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的
学科网(北京)股份有限公司∆H<0
D. 图四表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c0
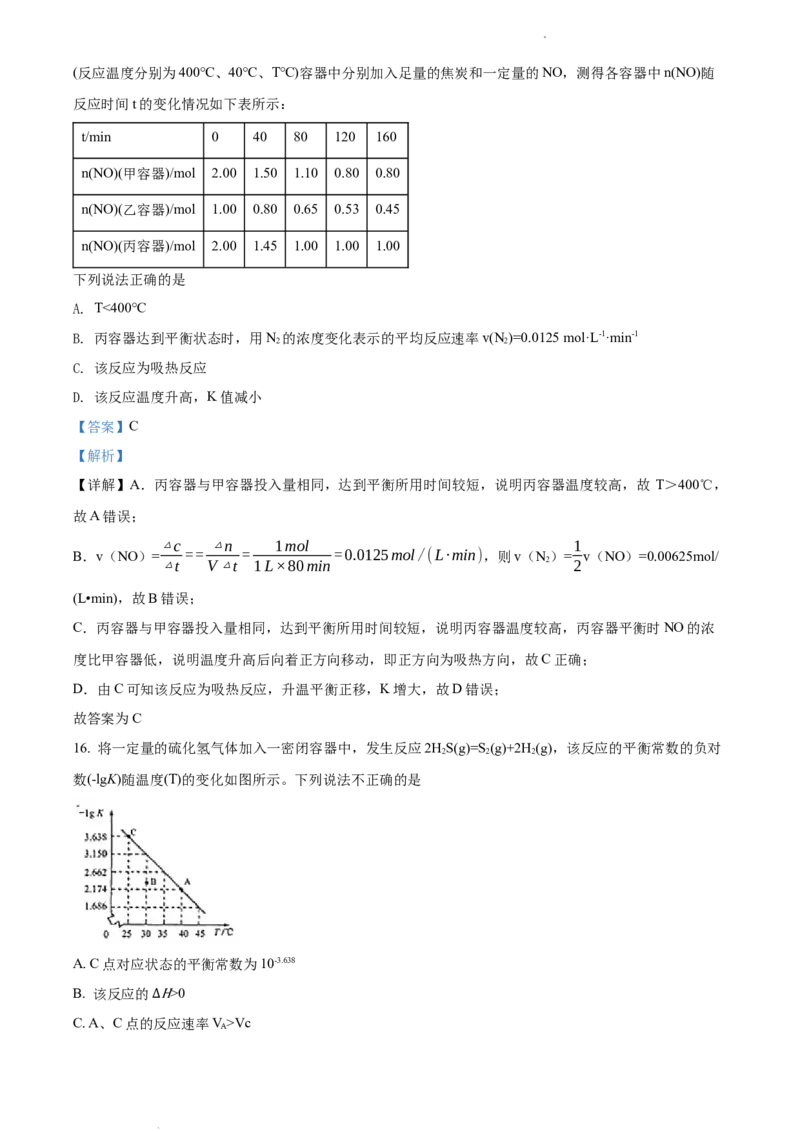
C. A、C点的HΔ反应速率V
A
>Vc
学科网(北京)股份有限公司D. 30℃时,B点对应状态v >v
正 逆
【答案】D
【解析】
【分析】
【详解】A.C点-lgK=3.638,则平衡常数K=10-3.638,A正确;
B.-lgK越大,则平衡常数K越小,由题图可知,随温度升高,平衡常数增大,则升高温度,平衡正向移
动,正反应为吸热反应,故该反应的ΔH>0,B正确;
C.因为A点温度比C点的高,所以A、C点的反应速率:V>V ,C正确;
A C
D.B点位于曲线下方,则浓度商大于相应温度下的平衡常数,反应逆向进行,所以B点对应状态的v K(HB)=3.0×10-8,HB 酸弱,pH值相同、体积相同时HB
的浓度大,与过量Al反应放出氢气多;故答案为B ;
【小问6详解】
根据酸的电离常数可知酸性HC> HB > HC-,NaB溶液与HC反应的离子方程式为:
2 2
B−+H C=HB+HC−
;
2
【小问7详解】
酸越弱对应的阴离子结合H+的能力越强,根据表中的电离平衡常数可知HA >H C> HB > HC-,C2-,结合
2
H+的能力最强,故答案为B
【小问8详解】
❑
查阅资料:Cu(H
2
O)❑ 2
4
+ (蓝色)+4Cl-⇌[CuCl
4
]2-+4H
2
O,等量黄色与蓝色混合呈绿色,取少量蓝色CuCl
2
稀溶
❑
液于试管中,向其中加入少量NaCl固体,振荡,若溶液由蓝色变为黄绿色,则证明CuCl 溶液中存在上述
2
平衡,故答案为:向其中加入少量NaCl固体,振荡,溶液由蓝色变为黄绿色。
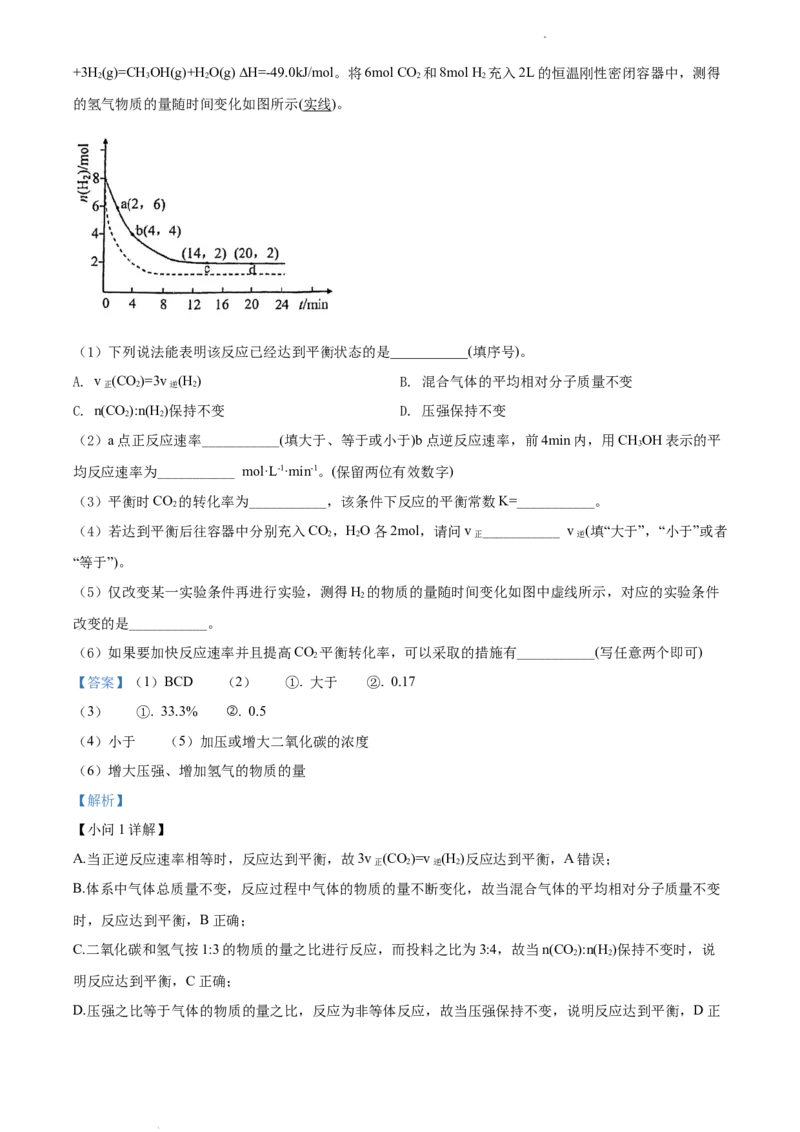
18. CO 的回收与利用是科学家研究的热点课题。工业上有一种用CO 生产甲醇燃料的方法:CO(g)
2 2 2
学科网(北京)股份有限公司+3H (g)=CH OH(g)+H O(g) ∆H=-49.0kJ/mol。将6mol CO 和8mol H 充入2L的恒温刚性密闭容器中,测得
2 3 2 2 2
的氢气物质的量随时间变化如图所示(实线)。
(1)下列说法能表明该反应已经达到平衡状态的是___________(填序号)。
A. v (CO)=3v (H ) B. 混合气体的平均相对分子质量不变
正 2 逆 2
C. n(CO):n(H)保持不变 D. 压强保持不变
2 2
(2)a点正反应速率___________(填大于、等于或小于)b点逆反应速率,前4min内,用CHOH表示的平
3
均反应速率为___________ mol·L-1·min-1。(保留两位有效数字)
(3)平衡时CO 的转化率为___________,该条件下反应的平衡常数K=___________。
2
(4)若达到平衡后往容器中分别充入CO,HO各2mol,请问v ___________ v (填“大于”,“小于”或者
2 2 正 逆
“等于”)。
(5)仅改变某一实验条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示,对应的实验条件
2
改变的是___________。
(6)如果要加快反应速率并且提高CO 平衡转化率,可以采取的措施有___________(写任意两个即可)
2
【答案】(1)BCD (2) ①. 大于 ②. 0.17
(3) ①. 33.3% ②. 0.5
(4)小于 (5)加压或增大二氧化碳的浓度
(6)增大压强、增加氢气的物质的量
【解析】
【小问1详解】
A.当正逆反应速率相等时,反应达到平衡,故3v (CO)=v (H )反应达到平衡,A错误;
正 2 逆 2
B.体系中气体总质量不变,反应过程中气体的物质的量不断变化,故当混合气体的平均相对分子质量不变
时,反应达到平衡,B正确;
C.二氧化碳和氢气按1:3的物质的量之比进行反应,而投料之比为3:4,故当n(CO):n(H)保持不变时,说
2 2
明反应达到平衡,C正确;
D.压强之比等于气体的物质的量之比,反应为非等体反应,故当压强保持不变,说明反应达到平衡,D正
学科网(北京)股份有限公司确;
答案选BCD。
【小问2详解】
根据图像可知,a点之后氢气的物质的量不断减小,说明反应正向移动,故a点正反应速率大于b点逆反应
4
速率,前4min内,反应的氢气的物质的量为4mol,则生成CHOH的物质的量为 mol,其表示的平均反
3 3
4
mol
应速率为 3 mol·L-1·min-1。
≈0.17
2L×4min
【小问3详解】
根据图像可知,14min后反应达到平衡,反应的氢气的物质的量为6mol,则反应的二氧化碳的物质的量为
2mol
2mol,平衡时CO 的转化率为 ×100%=33.3%,平衡时二氧化碳的物质的量为4mol,生成的甲醇和
2 6mol
2mol 2mol
×
c(CH OH)⋅c(H O) 2L 2L
水蒸气的物质的量为2mol,该条件下反应的平衡常数K=
3 2 = =0.5。
c(CO )⋅c3(H ) 4mol 2mol 3
2 2 ×( )
2L 2L
【小问4详解】
若达到平衡后往容器中分别充入CO,HO各2mol,则此时Q=
2 2
2mol 4mol
×
c(CH OH)⋅c(H O) 2L 2L 2
3 2 = =
>0.5,平衡逆向移动,故v 小于 v 。
c(CO )⋅c3(H ) 6mol 2mol 3 3 正 逆
2 2 ×( )
2L 2L
【小问5详解】
虚线的反应速率加快,但平衡时氢气的量减小,说明平衡正向移动,故实验条件改变是加压或增大二氧化
碳的浓度。
【小问6详解】
如果要加快反应速率并且提高CO 平衡转化率,可以采取的措施有增大压强、增加氢气的物质的量。
2
19. 丙烯广泛用于合成聚丙烯、丙烯醛、丙烯酸等工业领域。回答下列问题:
(1)丙烷无氧脱氢法制备丙烯反应如下:
❑
C
3
H
8
(g)⇌C
3
H
6
(g)+H
2
(g) H
1
=+124 kJ·mol-1
❑
△
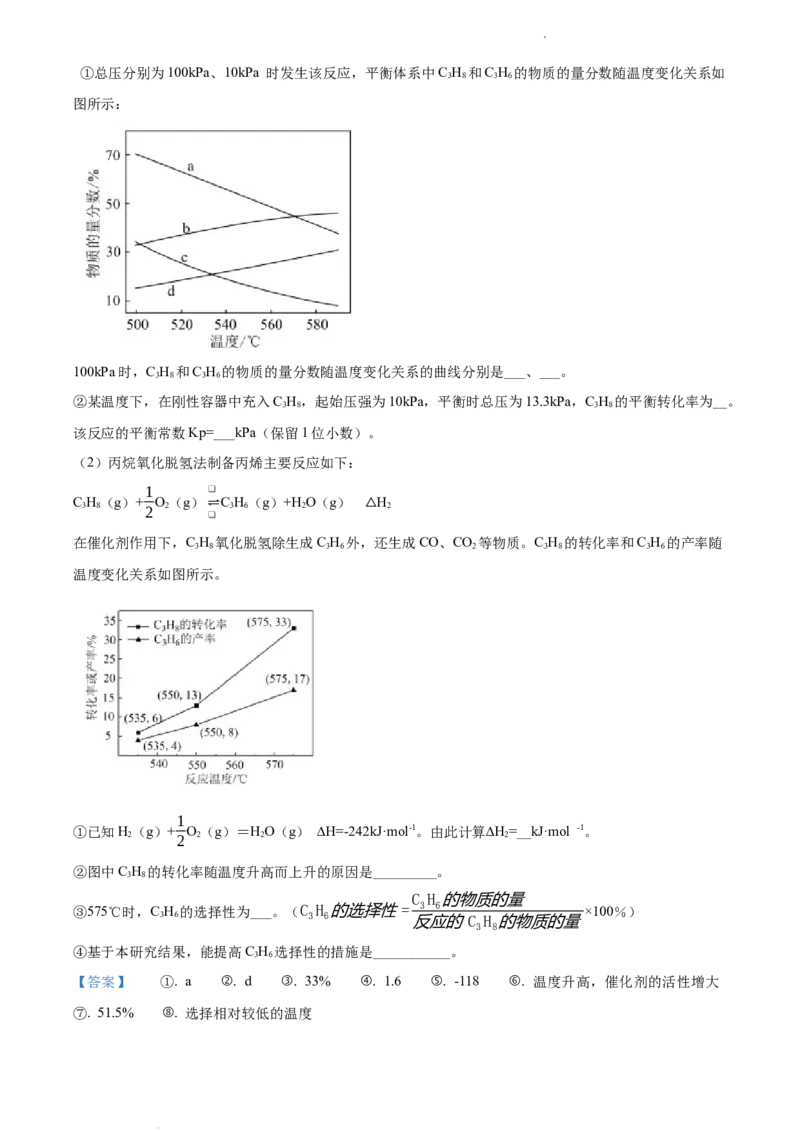
学科网(北京)股份有限公司①总压分别为100kPa、10kPa 时发生该反应,平衡体系中C H 和C H 的物质的量分数随温度变化关系如
3 8 3 6
图所示:
100kPa时,C H 和C H 的物质的量分数随温度变化关系的曲线分别是___、___。
3 8 3 6
②某温度下,在刚性容器中充入C H,起始压强为10kPa,平衡时总压为13.3kPa,C H 的平衡转化率为__。
3 8 3 8
该反应的平衡常数Kp=___kPa(保留1位小数)。
(2)丙烷氧化脱氢法制备丙烯主要反应如下:
1 ❑
C
3
H
8
(g)+
2
O
2
(g)⇌C
3
H
6
(g)+H
2
O(g) H
2
❑
△
在催化剂作用下,C H 氧化脱氢除生成C H 外,还生成CO、CO 等物质。C H 的转化率和C H 的产率随
3 8 3 6 2 3 8 3 6
温度变化关系如图所示。
1
①已知H(g)+ O(g)=HO(g) ∆H=-242kJ·mol-1。由此计算∆H=__kJ·mol -1。
2 2 2 2 2
②图中C H 的转化率随温度升高而上升的原因是_________。
3 8
C H 的物质的量
③575℃时,C H 的选择性为___。(C H 的选择性= 3 6 ×100%)
3 6 3 6 反应的C H 的物质的量
3 8
④基于本研究结果,能提高C H 选择性的措施是___________。
3 6
【答案】 ①. a ②. d ③. 33% ④. 1.6 ⑤. -118 ⑥. 温度升高,催化剂的活性增大
⑦. 51.5% ⑧. 选择相对较低的温度
学科网(北京)股份有限公司【解析】
【分析】(1)①C H(g) C H(g)+H(g) H=+124 kJ·mol-1,正反应吸热,升高温度,平衡正向移动,
3 8 3 6 2 1
C H(g)的物质的量分数减⇌小,C H(g)的物△质的量分数增大;该反应为气体体积增大的反应,增大压强,平
3 8 3 6
衡逆向移动,据此分析判断;②同温同体积条件下,气体的压强之比=气体物质的量之比,设C H 的平衡
3 8
转化率为x,根据三段式列式计算;
1
(2)①i. C H(g) C H(g)+H(g) H=+124 kJ·mol-1,ii. H (g)+ O(g)=HO(g) ∆H=-242kJ·mol-1,根据盖
3 8 3 6 2 1 2 2 2 2
⇌ △
1
斯定律分析计算C H(g)+ O(g) C H(g)+HO(g) H;②结合催化剂的活泼变化分析解答;③根据图
3 8 2 2 3 6 2 2
⇌ △
象,575℃时,C H 的转化率为33%,C H 的产率为17%,据此分析解答;④根据图象,分别计算
3 8 3 6
535℃、550℃、575℃时,C H 的选择性,再分析解答。
3 6
【详解】(1)①C H(g) C H(g)+H(g) H=+124 kJ·mol-1,正反应吸热,升高温度,平衡正向移动,
3 8 3 6 2 1
C H(g)的物质的量分数⇌减小,C H(g)的△物质的量分数增大;根据方程式,该反应为气体体积增大的反应,
3 8 3 6
增大压强,C H 的物质的量分数大于10kPa 时C H 的物质的量分数,因此表示100kPa时,C H 的物质的
3 8 3 8 3 8
量分数随温度变化关系的曲线是a;增大压强,平衡逆向移动,C H 的物质的量分数减小,表示100kPa时,
3 6
C H 的物质的量分数随温度变化关系的曲线是d,故答案为:a;d;
3 6
②同温同体积条件下,气体的压强之比=气体物质的量之比,设C H 的平衡转化率为x,
3 8
C H (g)⇌C H (g)+H (g)
¿起始(kPa) 3 8 3 6 2
10 0 0
反应(kPa)
10x 10x 10x
平衡(kPa)
10(1-x) 10x 10x
3.3kPa×3.3kPa
则10(1-x)+10x+10x=13.3,解得:x=0.33,K= =1.6kPa,故答案为:33%;1.6;
p (10-3.3)kPa
1
(2)①i. C H(g) C H(g)+H(g) H=+124 kJ·mol-1,ii. H (g)+ O(g)=HO(g) ∆H=-242kJ·mol-1,根据盖斯
3 8 3 6 2 1 2 2 2 2
⇌ △
1
定律,将i+ii得:C H(g)+ O(g) C H(g)+HO(g) H=(+124 kJ·mol-1)+(-242kJ·mol-1)=-118kJ·mol-1,
3 8 2 2 3 6 2 2
⇌ △
故答案为:-118;
②该反应为放热反应,升高温度,平衡逆向移动,C H 的转化率应该降低,但实际上C H 的转化率随温度
3 8 3 8
升高而上升,可能是升高温度,催化剂的活性增大导致的,故答案为:温度升高,催化剂的活性增大;
③根据图象,575℃时,C H 的转化率为33%,C H 的产率为17%,假设参加反应的C H 为100mol,生成
3 8 3 6 3 8
17
的C H 为17mol,C H 的选择性= ×100%=51.5%,故答案为:51.5%;
3 6 3 6 33
学科网(北京)股份有限公司4 8
④根据图象,535℃时,C H 的选择性= ×100%=66.7%,550℃时,C H 的选择性= ×100%=61.5%,
3 6 6 3 6 13
17
575℃时,C H 的选择性= ×100%=51.5%,选择相对较低的温度能够提高C H 选择性,故答案为:选择
3 6 33 3 6
相对较低的温度。
学科网(北京)股份有限公司学科网(北京)股份有限公司