文档内容
第一学期学业测试
高二年级化学期中试卷
可能用到的相对原子质量:C 12 H 1 O 16 Na 23 Cl 35.5
第一部分(选择题 共42分)
每小题只有一个选项符合题意(每小题3分)
1. 下列装置或过程能实现电能转化为化学能的是
A B C D
锌锰干电池 燃气燃烧 电池充电 水力发电
A. A B. B C. C D. D
【答案】C
【解析】
【分析】
【详解】A.锌锰干电池是将化学能转化为电能,A不符合题意;
B.燃气燃烧是将化学能转化为热能,B不符合题意;
C.电池充电是将电能转化为化学能,C符合题意;
D.水力发电是将机械能转化为电能,D不符合题意;
故合理选项是C。
2. 决定化学反应速率的主要因素是
A. 反应物的浓度 B. 反应体系内的压强
C. 反应物的性质 D. 反应物的状态
【答案】C
学科网(北京)股份有限公司【解析】
【详解】决定化学反应速率的是反应物的性质,温度、浓度、压强、催化剂是外界的影响因素,故C正确。
3. 下列与化学反应能量变化相关的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H(g)+Cl (g)=2HCl在光照和点燃条件下的△H不同
2 2
【答案】C
【解析】
【详解】A、化学反应过程中一定伴随能量变化,反应可以是放热反应或吸热反应,反应物总能量高于生
成物总能量则反应放热,反应物总能量低于生成物总能量,反应吸热,错误;
B、反应速率的大小与反应热无关,如氢氧化钡晶体和氯化铵的反应为吸热反应,在常温下能迅速反应,
金属的腐蚀为放热反应,但反应速率较慢,错误;
C、反应热与反应的途径无关,取决于反应物和生成物的始末状态,可根据盖斯定律,计算某些难以直接
测量的反应焓变,正确;
D、反应热与反应的条件无关,同温同压下,H(g)+Cl(g)═2HCl(g)在光照和点燃条件下的△H相同,
2 2
错误;
答案选C。
4. 下关于某化学反应的自发性描述中正确的是
A. ∆H<0,∆S<0在任何温度下都能自发进行
B. ∆H<0,∆S>0在任何温度下都能自发进行
C. ∆H>0,∆S<0有可能自发进行
D. ∆H>0,∆S>0在任何温度下都不能自发进行
【答案】B
【解析】
【分析】反应自发进行的判断依据是∆H-T∆<0,反应自发进行,∆H-T∆S>0,反应非自发进行,据此解答。
【详解】A.若∆H<0,∆S<0,依据∆H-T∆S分析判断,低温时可自发进行,故A错误;
B.若∆H<0,∆S>0,∆H-T∆S<0,任何温度下都能自发进行,故B正确;
C.若∆H>0,∆S<0,∆H-T∆S>0,任何温度下都不能自发进行,故C错误;
D.若∆H>0,∆S>0,高温时可自发进行,故D错误;
故选B。
5. 将N 和H 通入体积为2 L的恒温恒容密闭容器中,5 min后达到化学平时测得NH 的浓度为0.2 mol/L,
2 2 3
这段时间内用N、H、NH 的浓度变化表示的化学反应速率为
2 2 3
学科网(北京)股份有限公司A. υ(N ) = 0.04 mol/(L·min) B. υ(H ) = 0.02mol/(L·min)
2 2
C. υ(NH ) = 0.03mol/(L·min) D. υ(NH ) = 0.04mol/(L·min)
3 3
【答案】D
【解析】
【详解】N 和H 合成NH 的化学方程式为:N+3H 2NH ,5min后达到化学平衡时测得NH 的浓度为
2 2 3 2 2 3 3
⇌
0.2mol/L,则这段时间内,υ(NH )= =0.04mol/(L•min),根据反应速率之比等于化学计量数
3
之比,υ(N )= υ(NH )= ×0.04mol/(L•min)=0.02mol/(L•min),υ(H )=3υ(N)=3×0.02mol/(L•min)=0.06mol/
2 3 2 2
(L•min),故选:D。
6. 锌铜原电池装置如图,下列说法不正确的是
A. 锌电极上发生氧化反应
B. 电子从锌片经电流计流向铜片
C. 盐桥中K+向负极移动
D. 铜极上发生的反应是:Cu2+ +2e− = Cu
【答案】C
【解析】
【分析】锌铜原电池中,锌为负极,发生失去电子的氧化反应,电极反应式为 Zn-2e-=Zn2+,铜为正极,
发生得到电子的还原反应,电极反应式为Cu2++2e-=Cu,原电池工作时,电子从负极锌沿导线流向正极铜,
内电路中阳离子移向正极Cu,阴离子移向负极Zn,据此判断。
【详解】A.该原电池中,锌为负极,发生失去电子的氧化反应,故A正确;
B.该原电池中,Zn为负极、Cu为正极,工作时电子从锌片流向铜片,故B正确;
C.电路中阳离子移向正极Cu,阴离子移向负极Zn,K+向正极移动,故C错误;
D.铜为正极,发生得到电子的还原反应,电极反应式为Cu2++2e-=Cu,故D正确;
学科网(北京)股份有限公司故选C。
7. 液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。
下列说法不正确的是
已知:①Zn(OH) +2OH− == Zn(OH) 2− 。 ②KOH凝胶中允许离子存在、生成或迁移。
2 4
学科网(北京)股份有限公司学科网(北京)股份有限公司A. 放电过程中,H+由正极向负极迁移
B. 放电过程中,正极的电极反应:MnO +4H++2e−== Mn2++2H O
2 2
C. 充电过程中,阴极的电极反应:Zn(OH) 2−+2e− == Zn+4OH−
4
D. 充电过程中,凝胶中的KOH可再生
【答案】A
【解析】
【分析】放电过程中,Zn为负极,电极反应式为: Zn -2e−+4OH− == Zn(OH) 2−,MnO 为正极,电极反应
4 2
式为:MnO +4H++2e−== Mn2++2H O,充电时的阴极反应式为:Zn(OH) 2−+2e− == Zn +4OH−,阳极反应式为:
2 2 4
Mn2++2H O-2e−== MnO+4H+。
2 2
【详解】A、放电时正极反应式为:MnO +4H++2e−== Mn2++2H O,消耗氢离子,应该是硫酸根离子向锌电
2 2
极迁移,故A错误;
B、MnO 为正极,电极反应式为:MnO +4H++2e−== Mn2++2H O,故B正确;
2 2 2
C、充电时,由负极反应式写阴极反应式为:Zn(OH) 2−+2e− == Zn+4OH−,故C正确;
4
D、充电过程中,阴极反应式为:Zn(OH) 2−+2e− == Zn +4OH−,氢氧根与钾离子组成氢氧化钾,故D正确。
4
答案选A。
【点睛】该题考查可充电电池,一般先分析放电过程的负极反应式、正极反应式;再分析充电过程的阴极
反应式和阳极反应式。
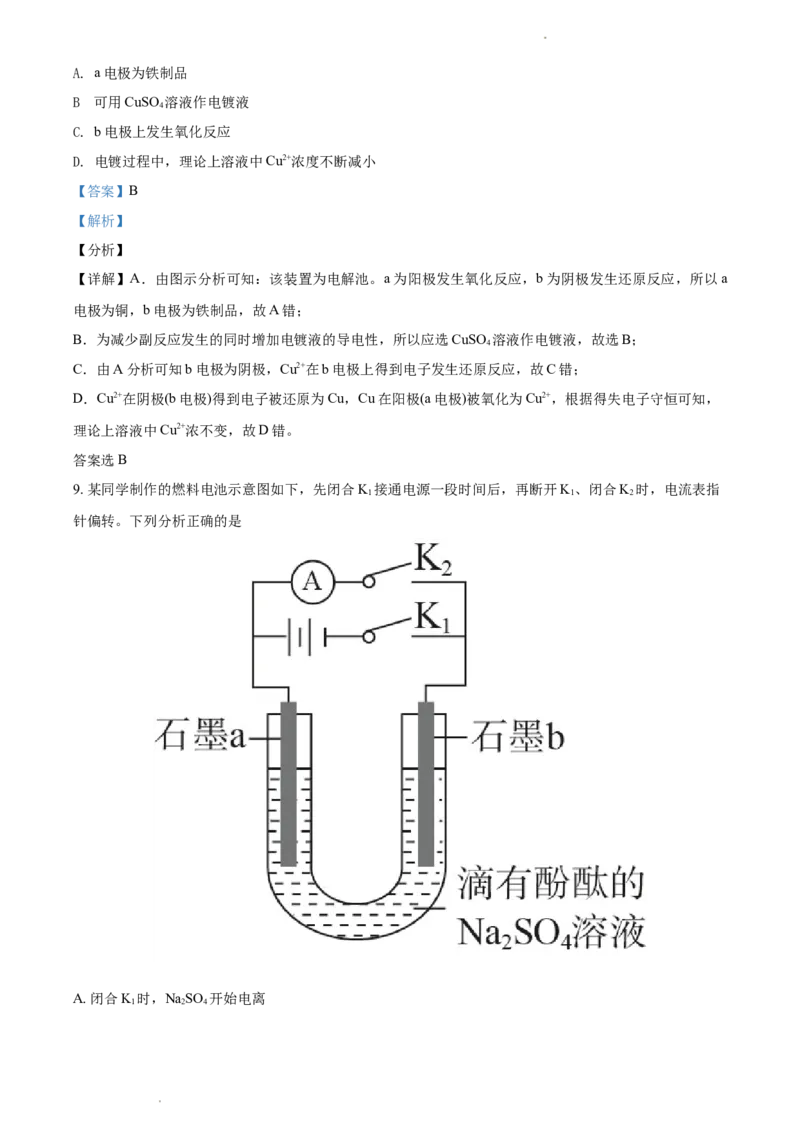
8. 模拟铁制品镀铜的装置如图,下列说法正确的是
学科网(北京)股份有限公司学科网(北京)股份有限公司A. a电极为铁制品
.
B 可用CuSO 溶液作电镀液
4
C. b电极上发生氧化反应
D. 电镀过程中,理论上溶液中Cu2+浓度不断减小
【答案】B
【解析】
【分析】
【详解】A.由图示分析可知:该装置为电解池。a为阳极发生氧化反应,b为阴极发生还原反应,所以a
电极为铜,b电极为铁制品,故A错;
B.为减少副反应发生的同时增加电镀液的导电性,所以应选CuSO 溶液作电镀液,故选B;
4
C.由A分析可知b电极为阴极,Cu2+在b电极上得到电子发生还原反应,故C错;
D.Cu2+在阴极(b电极)得到电子被还原为Cu,Cu在阳极(a电极)被氧化为Cu2+,根据得失电子守恒可知,
理论上溶液中Cu2+浓不变,故D错。
答案选B
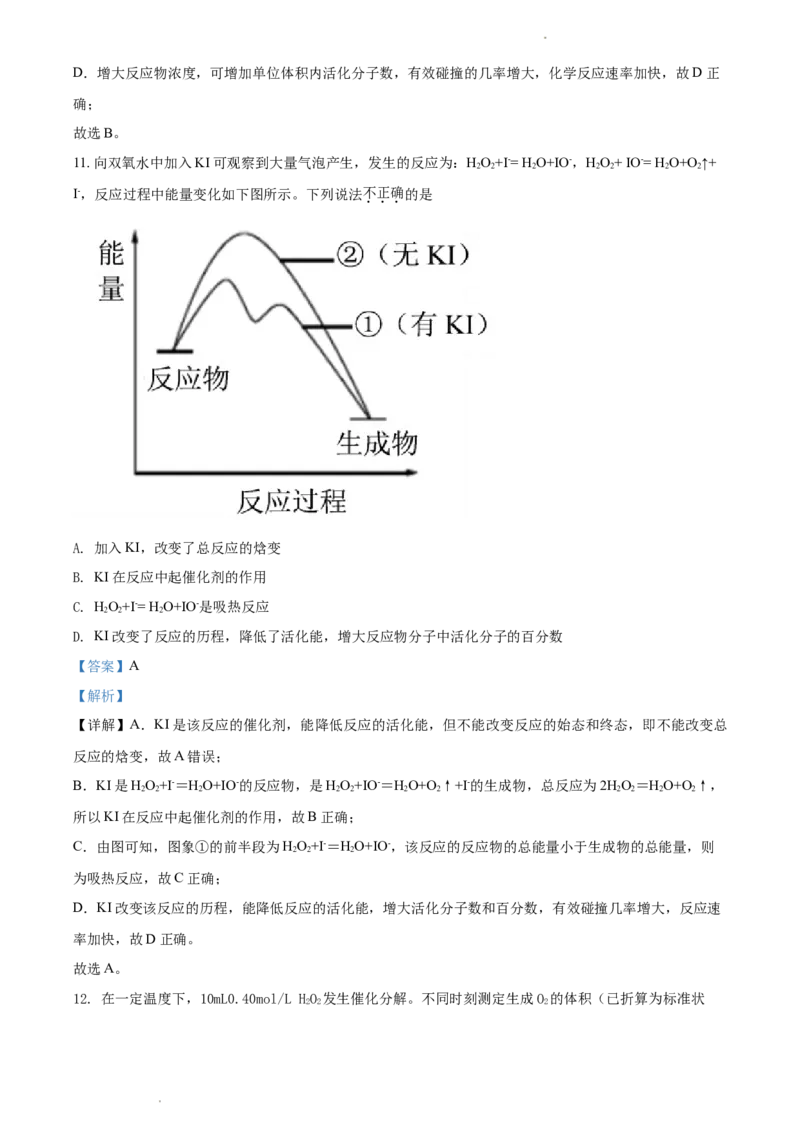
9. 某同学制作的燃料电池示意图如下,先闭合K 接通电源一段时间后,再断开K、闭合K 时,电流表指
1 1 2
针偏转。下列分析正确的是
A. 闭合K 时,NaSO 开始电离
1 2 4
学科网(北京)股份有限公司B. 闭合K 时,石墨a 附近溶液逐渐变红
1
C. 断开K、闭合K 时,石墨a 附近溶液酸性逐渐减弱
1 2
D. 断开K、闭合K 时,石墨b极上发生反应:H˗2e-=2H+
1 2 2
【答案】C
【解析】
【分析】闭合K 时,装置为电解池,电解质溶液为NaSO 溶液,则该装置电解水,石墨a(阳极)的电极
1 2 4
反应为:4OH--4e-=O ↑+2H O,石墨b(阴极)的电极反应为:4H++4e-=2H ↑;断开K 、闭合K 时,电流
2 2 2 1 2
表发生偏转说明该装置内有电流产生,则该装置转变为了原电池,反应是电解池产生的O 和H (题中也
2 2
说明了是燃料电池),原本O 在石墨a电极上产生,H 在石墨b电极上产生,故石墨a作正极,电极反应
2 2
为O+2H O+4e-=4OH-,石墨b作负极,电极反应为2H-4e-=4H+。
2 2 2
【详解】A、NaSO 遇水形成溶液就开始电离,不需要等到通电才发生电离,A错误;
2 4
B、闭合K 时,装置为电解池,石墨a为阳极,其电极反应为4OH--4e-=O ↑+2H O,由于该电极消耗OH-,
1 2 2
故该电极附近溶液不会变红,B错误;
C、断开K、闭合K 时,该装置转变 为了原电池,石墨a作正极,电极反应为O+2H O+4e-=4OH-,由此
1 2 2 2
可见石墨a 附近溶液酸性逐渐减弱,C正确;
D、断开K、闭合K 时,石墨b极作负极,电极反应为2H-4e-=4H+,D错误;
1 2 2
故选C。
10. 下列说法中错误的是
A. 对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增多,因而化学反
应速率增大
B. 活化分子之间发生的碰撞一定是有效碰撞
C. 升高温度,可使反应物分子中活化分子的百分数增大,因而增大化学反应速率
D. 增大反应物浓度,单位体积内活化分子数增多,因而化学反应速率增大
【答案】B
【解析】
【详解】A.对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增多,有
效碰撞的几率增大,化学反应速率增大,故A正确;
B.当活化分子有合适取向时的碰撞才是有效碰撞,所以活化分子之间发生的碰撞不一定是有效碰撞,故
B错误;
C.升高温度,反应物分子获得能量,可使反应物分子中活化分子的百分数增大,有效碰撞的几率增大,
因而化学反应速率增大,故C正确;
学科网(北京)股份有限公司D.增大反应物浓度,可增加单位体积内活化分子数,有效碰撞的几率增大,化学反应速率加快,故D正
确;
故选B。
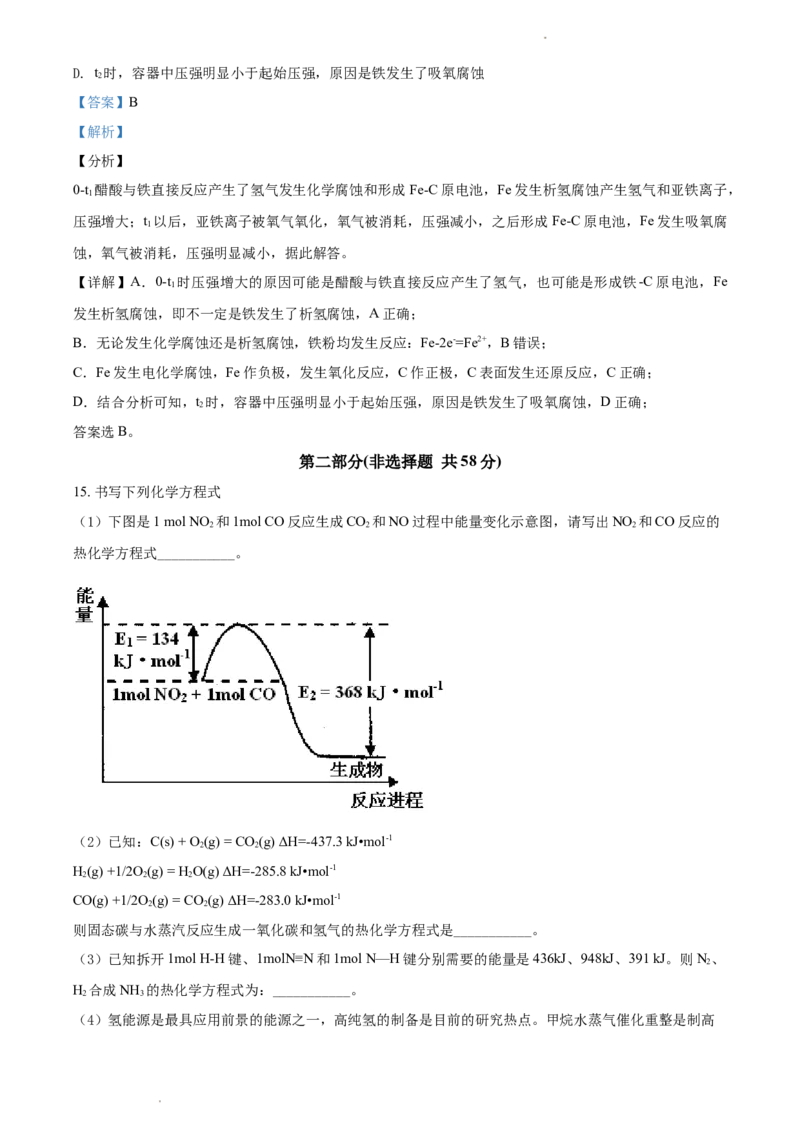
11. 向双氧水中加入KI可观察到大量气泡产生,发生的反应为:HO+I-= H O+IO-,HO+ IO-= H O+O↑+
2 2 2 2 2 2 2
I-,反应过程中能量变化如下图所示。下列说法不正确的是
A. 加入KI,改变了总反应的焓变
B. KI在反应中起催化剂的作用
C. HO+I-= H O+IO-是吸热反应
2 2 2
D. KI改变了反应的历程,降低了活化能,增大反应物分子中活化分子的百分数
【答案】A
【解析】
【详解】A.KI是该反应的催化剂,能降低反应的活化能,但不能改变反应的始态和终态,即不能改变总
反应的焓变,故A错误;
B.KI是HO+I-=HO+IO-的反应物,是HO+IO-=HO+O↑+I-的生成物,总反应为2HO=HO+O↑,
2 2 2 2 2 2 2 2 2 2 2
所以KI在反应中起催化剂的作用,故B正确;
C.由图可知,图象①的前半段为HO+I-=HO+IO-,该反应的反应物的总能量小于生成物的总能量,则
2 2 2
为吸热反应,故C正确;
D.KI改变该反应的历程,能降低反应的活化能,增大活化分子数和百分数,有效碰撞几率增大,反应速
率加快,故D正确。
故选A。
12. 在一定温度下,10mL0.40mol/L HO 发生催化分解。不同时刻测定生成O 的体积(已折算为标准状
2 2 2
学科网(北京)股份有限公司况)如下表。
t/min 0 2 4 6 8 10
V(O )/mL 0.0 9.9 17.2 22.4 26.5 29.9
2
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6min的平均反应速率:v(HO) mol/(L·min)
2 2
B. 6~10min的平均反应速率:v(HO)< mol/(L·min)
2 2
C. 反应至6min时,c(HO)=0.3mol/L
2 2
D. 反应至6min时,HO 分解了50%
2 2
【答案】C
【解析】
【详解】A.0~6min时间内,△c(HO )=0.002mol÷0.01L=0.2mol/L,所以v(HO )=0.2mol/L÷6min
2 2 2 2
mol/(L·min), A正确;
B.随着反应的进行,HO 的浓度逐渐减小,反应速率减慢,B正确;
2 2
C.6min时,c(HO)=0.002mol÷0.01L=0.2mol/L, C错误;
2 2
D.6min时,HO 分解率为: =50%, D正确。
2 2
答案选C。
13. 一定温度下,在恒容密闭容器中发生反应Cl(g) +2HI(g) 2HCl(g)+I (s)。下列证据说明该反应达到平
2 2
衡状态的是
①正反应和逆反应的速率都为零;
②容器内各组分的浓度相等;
③容器内各组分的质量分数不再改变;
④单位时间内生成n mol Cl 的同时生成2n mol HCl
2
⑤单位时间内m mol Cl 断键发生反应,同时2m mol HI也断键发生反应
2
⑥容器内气体分子总数不再改变;
⑦容器内混合气体的平均相对分子质量不再改变;
⑧容器内压强不再改变;
⑨容器内气体的密度不再改变;
⑩混合气体的颜色不再改变。
学科网(北京)股份有限公司A. ①②③④⑥⑧⑩ B. ②③④⑤⑦⑧⑨
C. ③④⑤⑥⑧⑨⑩ D. ③④⑥⑦⑧⑨⑩
【答案】D
【解析】
【详解】①化学平衡的特征是正反应和逆反应的速率相等,但都不为零,不合题意;②化学平衡的特征是
容器内各组分的浓度保持不变而不是相等,不合题意;③化学平衡的特征是容器内各组分的质量分数不再
改变,符合题意;④单位时间内生成n mol Cl 表示逆反应速率,同时生成2n mol HCl表示正反应速率,根
2
据反应速率之比等于化学计量系数比可知,正、逆反应速率相等,说明反应达到化学平衡,符合题意;⑤
单位时间内m mol Cl 断键发生反应表示正反应速率,同时2m mol HI也断键发生反应表示正反应速率,故
2
不能说明达到化学平衡,不合题意;⑥由于I 为固体,故反应前后气体的分子数发生改变,则容器内气体
2
分子总数不再改变,说明反应达到化学平衡,符合题意;⑦根据反应方程式可知,该反应为气体平均摩尔
质量减小的反应,所以容器内气体平均摩尔质量不再改变时,反应即处于平衡状态,符合题意;⑧由于 I
2
为固体,故反应前后气体的分子数发生改变,即容器的压强一直在改变,故容器内压强不再改变说明反应
达到化学平衡了,符合题意;⑨由于I 为固体,故反应前后气体的质量改变,即容器内的气体的密度一直
2
在改变,故容器内气体的密度不再改变说明反应达到化学平衡了,符合题意;⑩容器内气体颜色不再改变,
说明氯气的浓度不变,则反应处于平衡状态,符合题意;综上分析可知,③④⑥⑦⑧⑨⑩符合题意,故答
案为:D。
14. 研究小组将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入醋酸溶
液,容器中的压强随时间的变化曲线如图2。下列说法不正确的是
A. 0-t 时压强增大的原因不一定是铁发生了析氢腐蚀
1
B. 铁粉发生反应:Fe-3e-=Fe3+
C. 碳粉上发生了还原反应
学科网(北京)股份有限公司D. t 时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀
2
【答案】B
【解析】
【分析】
0-t 醋酸与铁直接反应产生了氢气发生化学腐蚀和形成Fe-C原电池,Fe发生析氢腐蚀产生氢气和亚铁离子,
1
压强增大;t 以后,亚铁离子被氧气氧化,氧气被消耗,压强减小,之后形成Fe-C原电池,Fe发生吸氧腐
1
蚀,氧气被消耗,压强明显减小,据此解答。
【详解】A.0-t 时压强增大的原因可能是醋酸与铁直接反应产生了氢气,也可能是形成铁-C原电池,Fe
1
发生析氢腐蚀,即不一定是铁发生了析氢腐蚀,A正确;
B.无论发生化学腐蚀还是析氢腐蚀,铁粉均发生反应:Fe-2e-=Fe2+,B错误;
C.Fe发生电化学腐蚀,Fe作负极,发生氧化反应,C作正极,C表面发生还原反应,C正确;
D.结合分析可知,t 时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀,D正确;
2
答案选B。
第二部分(非选择题 共58分)
15. 书写下列化学方程式
(1)下图是1 mol NO 和1mol CO反应生成CO 和NO过程中能量变化示意图,请写出NO 和CO反应的
2 2 2
热化学方程式___________。
(2)已知:C(s) + O (g) = CO (g) ΔH=-437.3 kJ•mol-1
2 2
H(g) +1/2O(g) = HO(g) ΔH=-285.8 kJ•mol-1
2 2 2
CO(g) +1/2O (g) = CO (g) ΔH=-283.0 kJ•mol-1
2 2
则固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是___________。
(3)已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、948kJ、391 kJ。则N、
2
H 合成NH 的热化学方程式为:___________。
2 3
(4)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高
学科网(北京)股份有限公司纯氢的方法之一。已知存在如下反应:
i.
ii.
iii.
……
iii为积炭反应,利用 和 计算 时,还需要利用___________反应的 。
【答案】(1)NO (g)+CO(g)=CO (g)+NO(g) ∆H=-234kJ/mol
2 2
(2)C(s)+HO(g)=H (g)+CO(g) ∆H=+131.5kJ•mol-1
2 2
(3)N(g)+3H(g)=2NH (g) ∆H=-90.0kJ•mol-1
2 2 3
(4)C(s)+HO(g)=CO(g)+H (g)或C(s)+CO(g)=2CO(g)
2 2 2
【解析】
【小问1详解】
根 据 图 像 可 知 1 mol NO 和 1mol CO 反 应 生 成 CO 和 NO 的 焓 变 ΔH= ( E-
2 2 1
E )kJ/mol=134kJ/mol-368kJ/mol=-234kJ/mol,故1molNO 和1molCO反应生成CO 和NO的热化学方程式
2 2 2
为 : NO (g)+CO(g)=CO (g)+NO(g) ∆H=-234kJ/mol , 故 答 案 为 : NO (g)+CO(g)=CO (g)+NO(g)
2 2 2 2
∆H=-234kJ/mol;
【小问2详解】
已知:
①C(s) + O (g)=CO(g) ΔH=-437.3 kJ•mol-1
2 2
②H(g) +1/2O(g)=HO(g) ΔH=-285.8 kJ•mol-1
2 2 2
③CO(g) +1/2O (g)=CO(g) ΔH=-283.0 kJ•mol-1
2 2
根据盖斯定律可知①-②-③即得到碳单质与水蒸气反应生成一氧化碳和氢气的热化学方程式为C(s)
+H O(g)=H (g)+CO(g) ∆H=+131.5kJ•mol-1,故答案为:C(s)+HO(g)=H (g)+CO(g) ∆H=+131.5kJ•mol-1;
2 2 2 2
【小问3详解】
氮气、氢气合成氨的反应为N(g)+3H(g)=2NH (g),焓变等于反应物的总键能减去生成物的总键能,故∆H
2 2 3
=436×3kJ/mol+948kJ/mol-391×6kJ/mol=-90.0kJ/mol,故氮气与氢气合成氨气的热化学方程式为:N(g)
2
+3H (g)=2NH (g) ∆H=-90.0kJ•mol-1,故答案为:N(g)+3H(g)=2NH (g) ∆H=-90.0kJ•mol-1;
2 3 2 2 3
【小问4详解】
比较反应i、ii和iii的化学方程式,可发现反应i和反应ii中没有出现碳单质,故应缺少单质参加的反应,
碳单质可以与水蒸气或二氧化碳反应,故还需要利用反应C(s)+HO(g)=CO(g)+H (g)或C(s)+CO(g)=2CO(g)
2 2 2
学科网(北京)股份有限公司的焓变,故答案为:C(s)+HO(g)=CO(g)+H (g)或C(s)+CO(g)=2CO(g)。
2 2 2
16. 某同学设计实验探究丙酮碘化反应中,丙酮、I、H+浓度对化学反应速率的影响。
2
已知:
编号 丙酮溶液(4mol/L) I 溶液(0.0025mol/L) 盐酸(2mol/L) 蒸馏水 溶液褪色时间(s)
2
① 2mL 2mL 2mL 0mL t
1
② 1mL 2mL 2mL 1mL t
2
③ 2mL 1mL 2mL 1mL t
3
④ 2mL 2mL amL 1mL t
3
(1)研究丙酮浓度对反应速率的影响,应选择的实验为_______和_______。
(2)实验④中,a=_______mL,加1mL蒸馏水的目的是_______。
(3)计算实验③中,以I 表示的反应速率为_______mol/(L∙s) (列出表达式)
2
(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和H+的浓度有关,而与I 的浓度无关,查阅资料发现丙
2
酮碘化反应的历程为:
请依据反应历程,解释丙酮碘化反应速率与I 浓度无关的原因_______。
2
【答案】 ①. ① ②. ② ③. 1 ④. 保证丙酮溶液和碘溶液的起始浓度不变 ⑤. v(I)=
2
=0.0025mol/L÷t s= mol/(L∙s) ⑥. 根据反应历程,丙酮与氢离子反应慢,则反应速率由H+的浓度决
3
定,与碘的浓度无关
【解析】
学科网(北京)股份有限公司【分析】研究影响反应速率的因素时,只改变一种反应条件,而其它条件则完全相同。
【详解】(1)研究丙酮浓度对反应速率的影响,则只有丙酮的浓度不同,而其它条件需完全相同,对比表中
数据,①和②符合要求;
(2)根据①、②、③中的数据,溶液的总体积为6mL,则实验④中,a=1mL;加1mL蒸馏水可保证丙酮溶
液和碘溶液的起始浓度不变;
(3)根据反应的方程式,③中丙酮过量,碘完全反应,v(I)= =0.0025mol/L÷t s= mol/(L∙s);
2 3
(4)反应速率由反应中进行程度慢的反应决定,根据反应历程,反应速率由H+的浓度决定,故丙酮碘化反应
速率与I 浓度无关。
2
17. 降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H 作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
2
学科网(北京)股份有限公司学科网(北京)股份有限公司①a极为_______(填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为_______。
③下列说法正确的是_______。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:_______。
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O,产生O 的
2 2
电极反应式为_______。下列生产措施有利于提高Cl 产量、降低阳极O 含量的是_______。
2 2
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O,避免水电离的H+直接得电子
2
生成H,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为_______。
2
【答案】 ①. 负 ②. 2NaCl+2H O 2NaOH+H ↑+Cl↑ ③. AC ④. d极发生反应:2HO+2e-
2 2 2 2
=H ↑+2OH-生成OH-,且Na+从阳极区透过阳离子交换膜进入d极区,生成NaOH ⑤. 4OH--4e-=O ↑+2H O
2 2 2
⑥. ABC ⑦. O+4e-+2H O=4OH-
2 2
【解析】
【分析】图示中甲池为原电池,其中通入H 的a电极为负极,通入空气的b电极为正极;乙池为电解池,
2
与正极b连接的c电极为阳极,与负极a连接的d电极为阴极。原电池的负极和电解池的阳极发生氧化反
应;原电池的正极和电解池的阴极上发生还原反应。阳离子交换膜只允许阳离子通过,结合溶液中离子放
电顺序分析解答。
【详解】(1)①装置甲为原电池,其中通入燃料H 的a极为负极;
2
②乙装置中电解饱和NaCl溶液,反应产生H、Cl、NaOH,反应的化学方程式为:2NaCl+2H O
2 2 2
2NaOH+H ↑+Cl↑;
2 2
③A.甲装置为原电池,可以实现化学能向电能的转化,A正确;
B.甲装置中Na+透过阳离子交换膜向负电荷较多的正极b极移动,B错误;
C.乙装置中c极为阳极,Cl-不断放电产生Cl 逸出,导致附近溶液中Cl-的浓度减小,因此c极一侧流出的
2
是淡盐水,C正确;
学科网(北京)股份有限公司故合理选项是AC;
④d电极为阴极,在d极上水电离产生的H+不断得到电子变为H 逸出,破坏了附近的水的电离平衡,促进
2
水电离,最终使附近c(OH-)>c(H+),且Na+从阳极区透过阳离子交换膜进入d极区,与OH-结合生成
NaOH;
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O,在阳极上
2
OH-失去电子,发生氧化反应产生O,则阳极的电极反应式为4OH--4e-=O ↑+2H O;
2 2 2
A.定期检查并更换阳离子交换膜,就可以使阳极上只有Cl-放电产生Cl,避免OH-放电产生O,因此有
2 2
利于提高Cl 产量、降低阳极O 含量,A正确;
2 2
B.向阳极区加入适量盐酸,可增大c(Cl-),提高其还原性,可以产生更多Cl,避免副反应的反应,B正确;
2
C.使用Cl-浓度高的精制饱和食盐水为原料,增大了Cl-的浓度,提高了Cl-的还原性,可以产生更多Cl,
2
减少OH-放电产生O 的机会,因而就降低了O 的含量,C正确;
2 2
故合理选项是ABC;
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O,避免水电离的H+直接得电子
2
生成H,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极上O 得到电子反应产生OH-,该电极的电
2 2
极反应式为:O+4e-+2H O=4OH-。
2 2
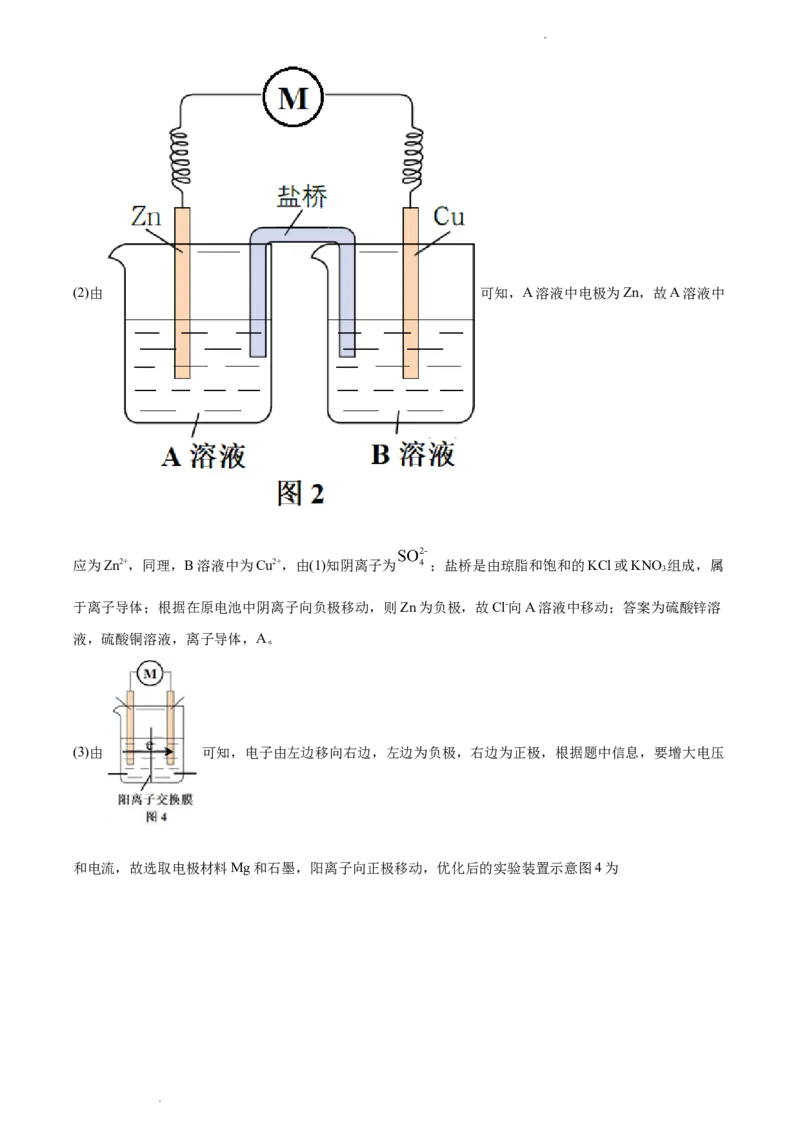
18. 某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
(1)初步设计的实验装置示意图如图1所示,CuSO 溶液在图1所示装置中的作用是_______(答两点)。
4
实验发现:该装置不能驱动小车。
(2)该小组同学提出假设:
可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在
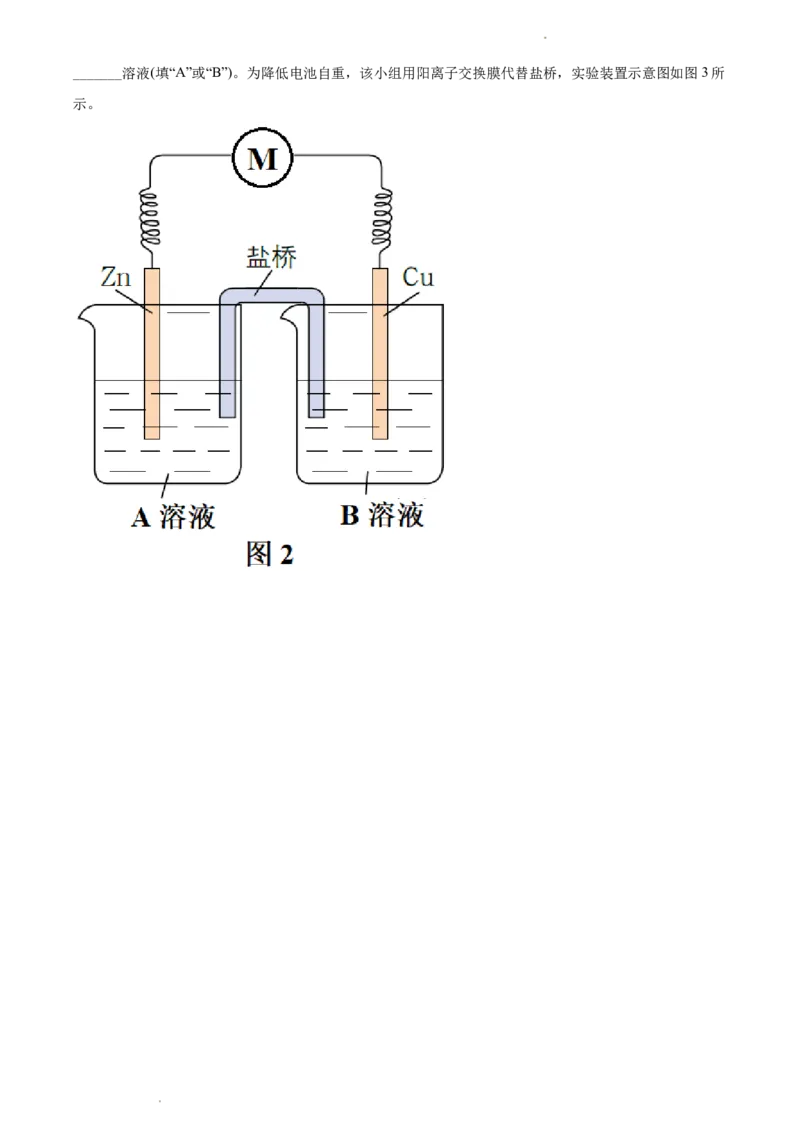
原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和
B溶液分别是_______和_______,盐桥属于_______(填“电子导体”或“离子导体”),盐桥中的Cl-移向
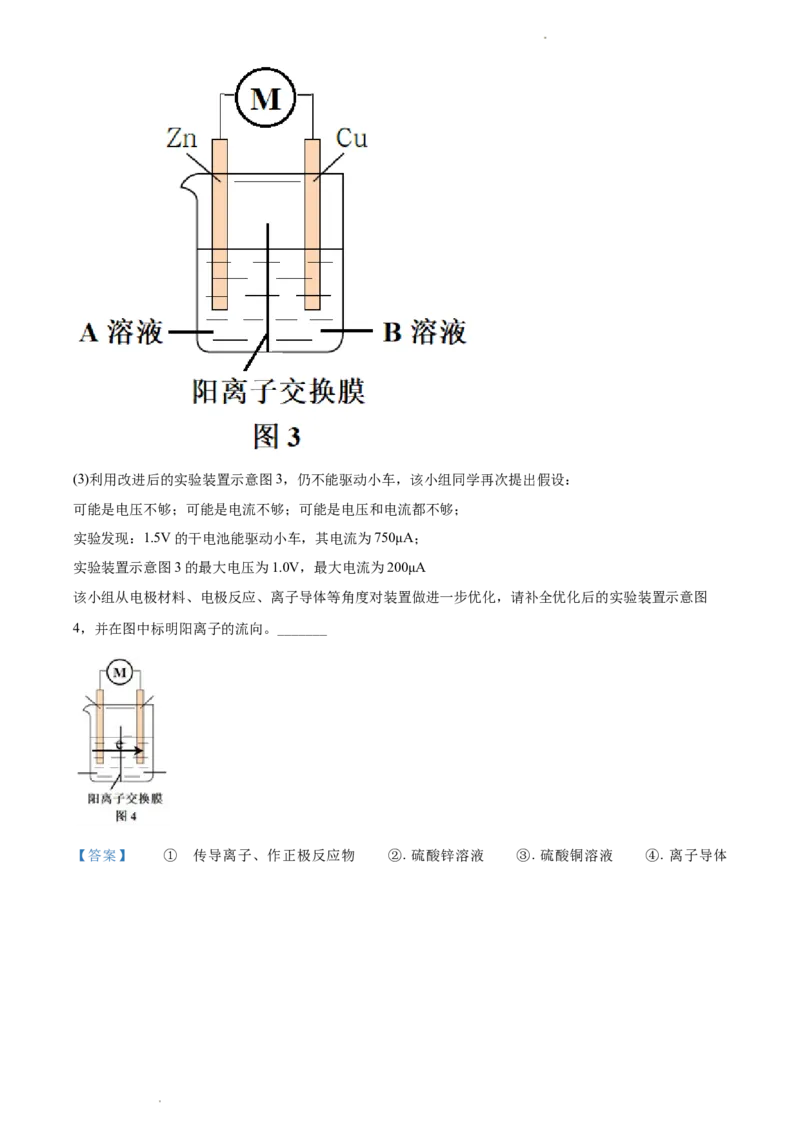
学科网(北京)股份有限公司_______溶液(填“A”或“B”)。为降低电池自重,该小组用阳离子交换膜代替盐桥,实验装置示意图如图3所
示。
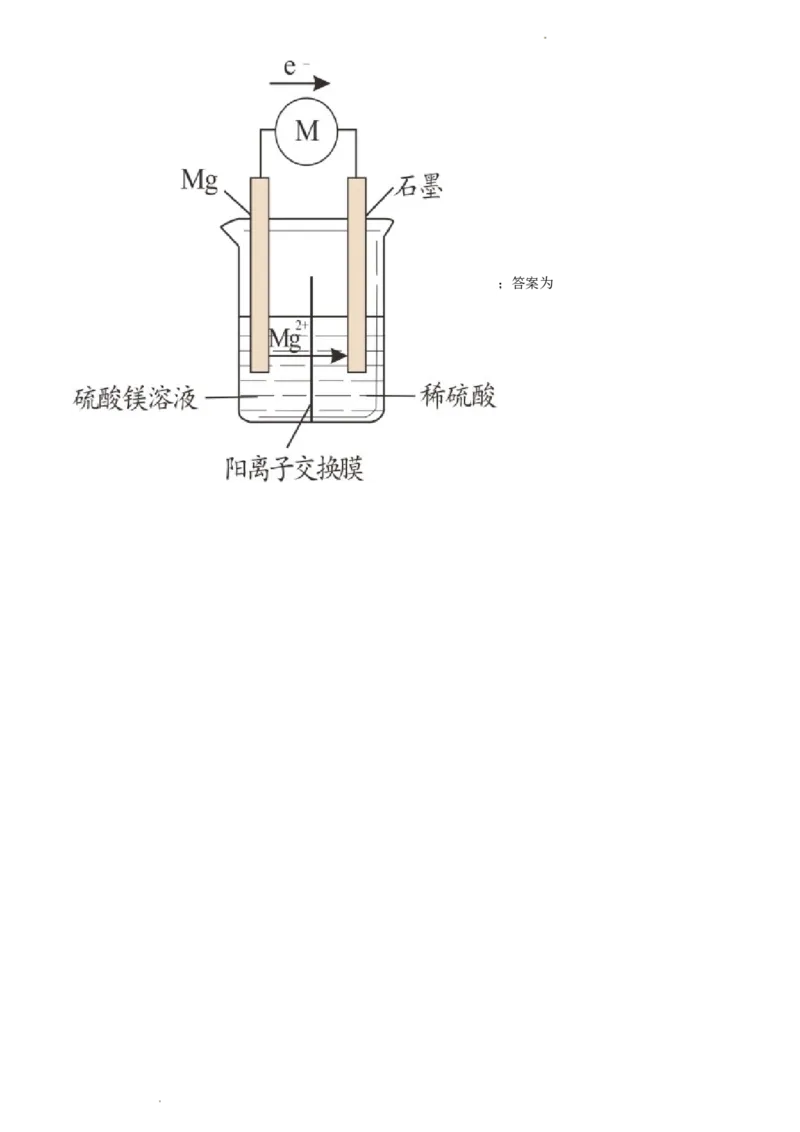
学科网(北京)股份有限公司(3)利用改进后的实验装置示意图3,仍不能驱动小车,该小组同学再次提出假设:
可能是电压不够;可能是电流不够;可能是电压和电流都不够;
实验发现:1.5V的干电池能驱动小车,其电流为750μA;
实验装置示意图3的最大电压为1.0V,最大电流为200μA
该小组从电极材料、电极反应、离子导体等角度对装置做进一步优化,请补全优化后的实验装置示意图
4,并在图中标明阳离子的流向。_______
.
【答案】 ① 传导离子、作正极反应物 ②. 硫酸锌溶液 ③. 硫酸铜溶液 ④. 离子导体
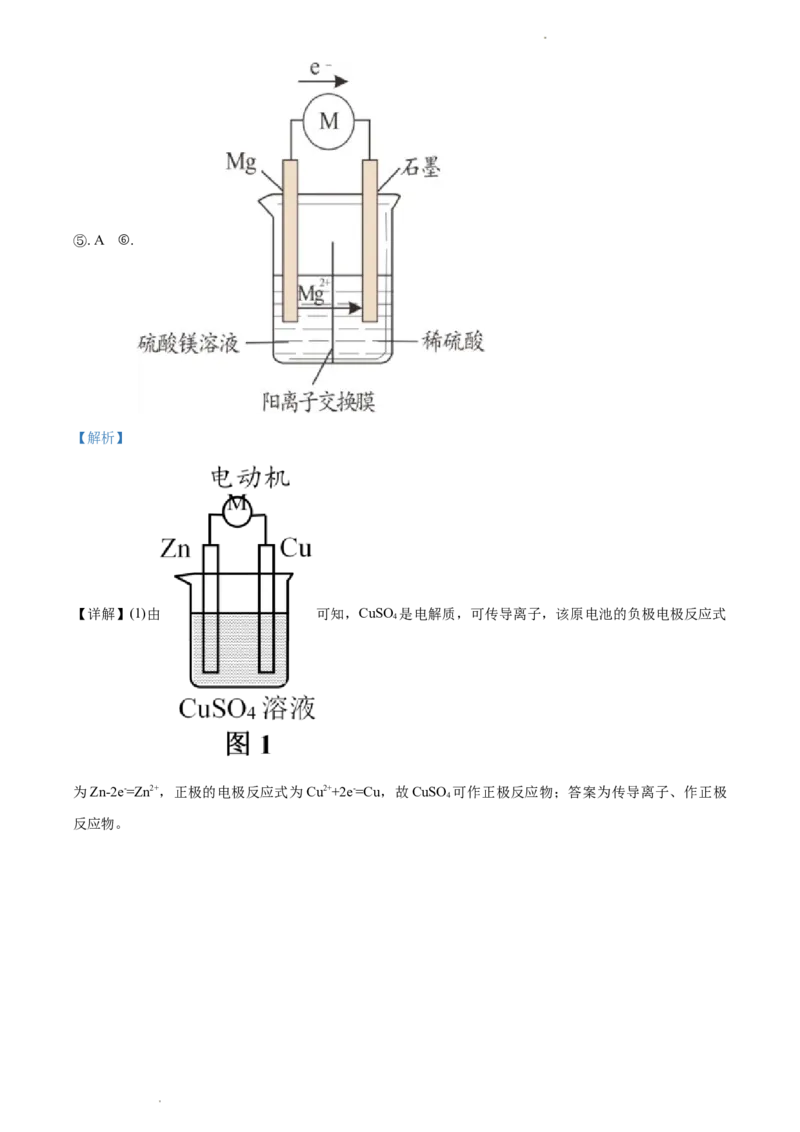
学科网(北京)股份有限公司⑤. A ⑥.
【解析】
【详解】(1)由 可知,CuSO 是电解质,可传导离子,该原电池的负极电极反应式
4
为Zn-2e-=Zn2+,正极的电极反应式为Cu2++2e-=Cu,故CuSO 可作正极反应物;答案为传导离子、作正极
4
反应物。
学科网(北京)股份有限公司(2)由 可知,A溶液中电极为Zn,故A溶液中
应为Zn2+,同理,B溶液中为Cu2+,由(1)知阴离子为 ;盐桥是由琼脂和饱和的KCl或KNO 组成,属
3
于离子导体;根据在原电池中阴离子向负极移动,则Zn为负极,故Cl-向A溶液中移动;答案为硫酸锌溶
液,硫酸铜溶液,离子导体,A。
(3)由 可知,电子由左边移向右边,左边为负极,右边为正极,根据题中信息,要增大电压
和电流,故选取电极材料Mg和石墨,阳离子向正极移动,优化后的实验装置示意图4为
学科网(北京)股份有限公司;答案为
学科网(北京)股份有限公司。
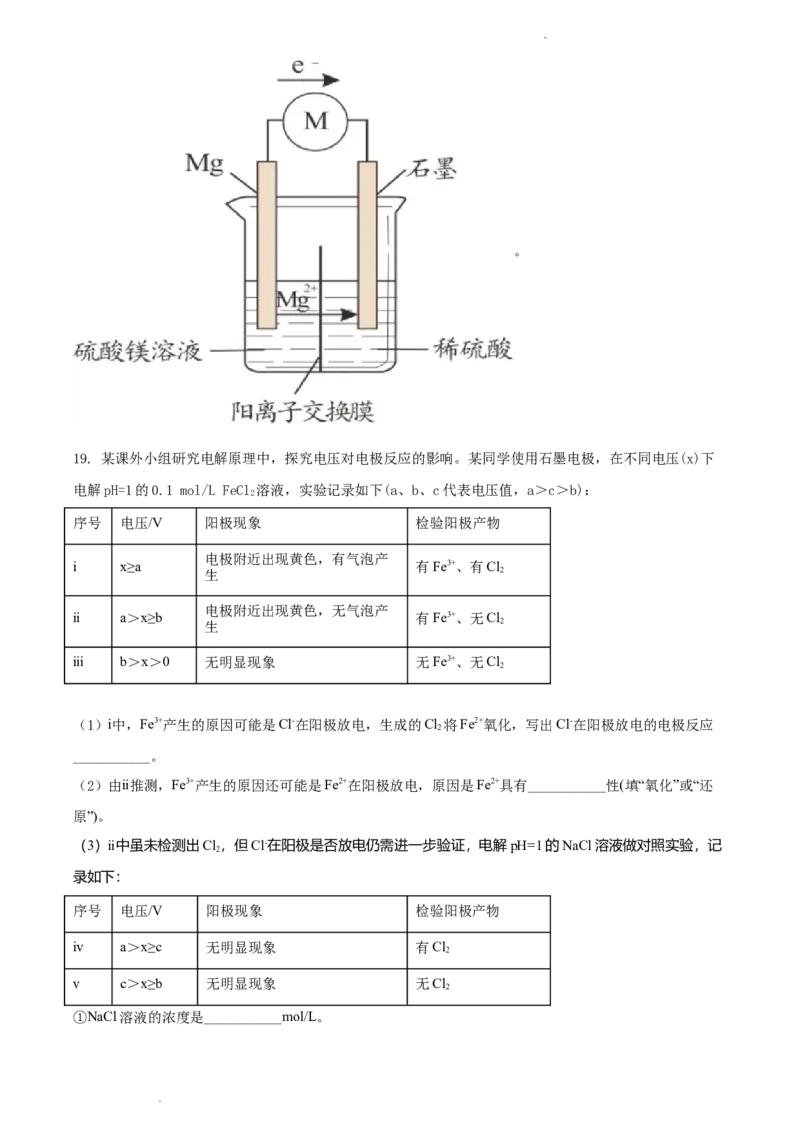
19. 某课外小组研究电解原理中,探究电压对电极反应的影响。某同学使用石墨电极,在不同电压(x)下
电解pH=1的0.1 mol/L FeCl 溶液,实验记录如下(a、b、c代表电压值,a>c>b):
2
序号 电压/V 阳极现象 检验阳极产物
电极附近出现黄色,有气泡产
ⅰ x≥a 有Fe3+、有Cl
生 2
电极附近出现黄色,无气泡产
ⅱ a>x≥b 有Fe3+、无Cl
生 2
ⅲ b>x>0 无明显现象 无Fe3+、无Cl
2
(1)ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl 将Fe2+氧化,写出Cl-在阳极放电的电极反应
2
___________。
(2)由ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有___________性(填“氧化”或“还
原”)。
(3)ⅱ中虽未检测出Cl,但Cl-在阳极是否放电仍需进一步验证,电解pH=1的NaCl溶液做对照实验,记
2
录如下:
序号 电压/V 阳极现象 检验阳极产物
ⅳ a>x≥c 无明显现象 有Cl
2
ⅴ c>x≥b 无明显现象 无Cl
2
①NaCl溶液的浓度是___________mol/L。
学科网(北京)股份有限公司②ⅳ中检测Cl 的实验方法是:取少量阳极附近的溶液,滴在___________试纸上,试纸___________证明生
2
成氯气,否则无氯气生成。
③与ⅱ相比,可以得出以下结论:
pH=1的0.1 mol/L FeCl 溶液,电压≥cV时,Cl-才能在阳极放电产生Cl;
2 2
pH=1的0.1 mol/L FeCl 溶液,电压c>x≥b V时,阳极的电极反应为___________。
2
【答案】(1)2Cl--2e-= Cl ↑
2
(2)还原 (3) ①. 0.2 ②. 淀粉碘化钾 ③. 变蓝 ④. Fe2+-e-=Fe3+
【解析】
【小问1详解】
依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl↑,氯气具有氧化性氧化亚铁离子
2
生成铁离子溶液变黄色,反应的离子方程式为:Cl+2Fe2+=2Fe3++2Cl-,故答案为:2Cl--2e-=Cl↑;
2 2
【小问2详解】
由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析 Fe2+具有还
原性,反应式为Fe2+-e-=Fe3+,故答案为:还原;
【小问3详解】
①电解pH=1的0.1mol/L FeCl 溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难
2
度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②ⅳ中检测Cl 的实验方法是:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝证明生成氯气,
2
否则无氯气生成,故答案为:淀粉碘化钾;变蓝;
③pH=1的0.1mol/LFeCl 溶液,电压≥cV时,Cl-才能在阳极放电产生Cl ;pH=1的0.1mol/LFeCl 溶液,电
2 2 2
压c>x≥b V时,阳极生成铁离子,电极反应为Fe2+-e-═Fe3+,故答案为:Fe2+-e-═Fe3+。
学科网(北京)股份有限公司学科网(北京)股份有限公司