文档内容
高二化学高频考题期末测试卷 01
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教选择性必修一 难度:★★★☆☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32
一、选择题:本题包括16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小
题4分。在每小题给出的四个选项中,只有一项符合题目要求。
1.中国生产的首艘国产航母“山东”号已经下水。为保护航母、延长服役寿命可采用两种电化
学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确
的是( )
A.方法1中金属块可能是锌、锡和铜
B.方法2中舰体连接电源的负极
C.方法1叫外加电流的阴极保护法
D.方法2叫牺牲阳极的阴极保护法
2.化学与人类生产、生活密切相关。下列描述中不涉及盐类水解原理的是
A.明矾净水 B.氯化铵溶液除铁锈
C.用食盐腌制肉制品 D.用草木灰去除油污
3.在25℃某稀溶液中,由水电离产生的c(H+)=10-13mol·L-1。下列有关该溶液的叙述正确的是
( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH一定为1 D.该溶液的pH可能为13
4.有关溶液中3KSCN+FeCl Fe(SCN) +3KCl的反应,下列说法不正确的是
3 3
学科网(北京)股份有限公司A.向平衡体系中加入少量KCl固体,溶液红色变浅
B.加入少量KCl固体,溶液红色加深
C.给体系加压,溶液红色没有明显变化
D.Fe(SCN) 属于盐类,难电离
3
5.通过以下反应均可获取H。下列有关说法正确的是( )
2
①太阳光催化分解水制氢:2HO(l)==2H(g)+O(g) ΔH=+571.6 kJ·mol-1
2 2 2 1
②焦炭与水反应制氢:C(s)+HO(g)==CO(g)+H(g) ΔH=+131.3 kJ·mol-1
2 2 2
③甲烷与水反应制氢:CH(g)+HO(g)==CO(g)+3H(g) ΔH=+206.1 kJ·mol-1
4 2 2 3
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH 减小
3
D.反应CH(g)==C(s)+2H(g)的ΔH=+74.8 kJ·mol-1
4 2
6.关于如图所示的原电池,下列说法正确的是
A.电流从铜电极通过导线流向锌电极
B.盐桥中的阴离子向CuSO 溶液中迁移
4
C.锌电极发生还原反应,铜电极发生氧化反应
学科网(北京)股份有限公司D.铜电极上发生的电极反应是2H++2e-=H ↑
2
7.下列离子方程式书写正确的是
A.小苏打溶液中溶质的电离:NaHCO Na+ + H+ + CO
3
B.钢铁发生吸氧腐蚀时的正极反应:O + 2H O + 4e-= 4OH-
2 2
C.稀硫酸与氢氧化钡溶液反应的中和热:H+(aq) + OH-(aq)= HO(l) ΔH=-57.3 kJ·mol-1
2
D.用铁电极电解MgCl 溶液:Mg2+ + 2Cl-+ 2H O Mg(OH) ↓+ H ↑+ Cl ↑
2 2 2 2 2
8.常温下,下列各组离子在指定溶液中能大量共存的是
A.甲基橙呈红色的溶液中:Na+、K+ 、HCO 、NO
B. 的溶液中:NH 、Ca2+、ClO-、I-
C.pH = 7的溶液中:Fe3+、Na+、Cl-、Br-
D.溶有大量CO 气体的溶液中:Na+、 、Cl-、NO
2
9.能够使CHCOONa溶液pH增大且水解程度也增大的条件是( )
3
A.加水 B.升温
C.加压 D.加CHCOONa固体
3
10.下列关于沉淀溶解平衡的判断正确的是
A.某离子被沉淀完全是指该离子在溶液中的浓度为0
学科网(北京)股份有限公司B.向饱和 水溶液中加入 固体, 值变大
C.向 悬浊液中滴加 溶液,生成红褐色沉淀
D.含有 和 固体的悬浊液:
11.锂-空气电池是一种可充放电池,电池反应为2Li+O=LiO,某锂-空气电池的构造原理
2 2 2
图如图。下列说法正确的是
A.可选用有机电解液或水性电解液
B.含催化剂的多孔电极为电池的负极
C.放电时负极的电极反应式为Li-e-=Li+
D.充电时锂电极应连接外接电源的正极
12.金属镍有广泛的用途。粗镍中含有少量 、 、 、 等杂质,可用电解法制备高纯
度的镍,下列叙述正确的是(已知:氧化性 )
A.电解后,电解槽底部的阳极泥中含有 和
B.电解过程中,阳极质量的减少与阴极质量的增加相等
学科网(北京)股份有限公司C.阳极发生还原反应,其电极反应式:
D.电解后,溶液中存在的金属阳离子只有 和
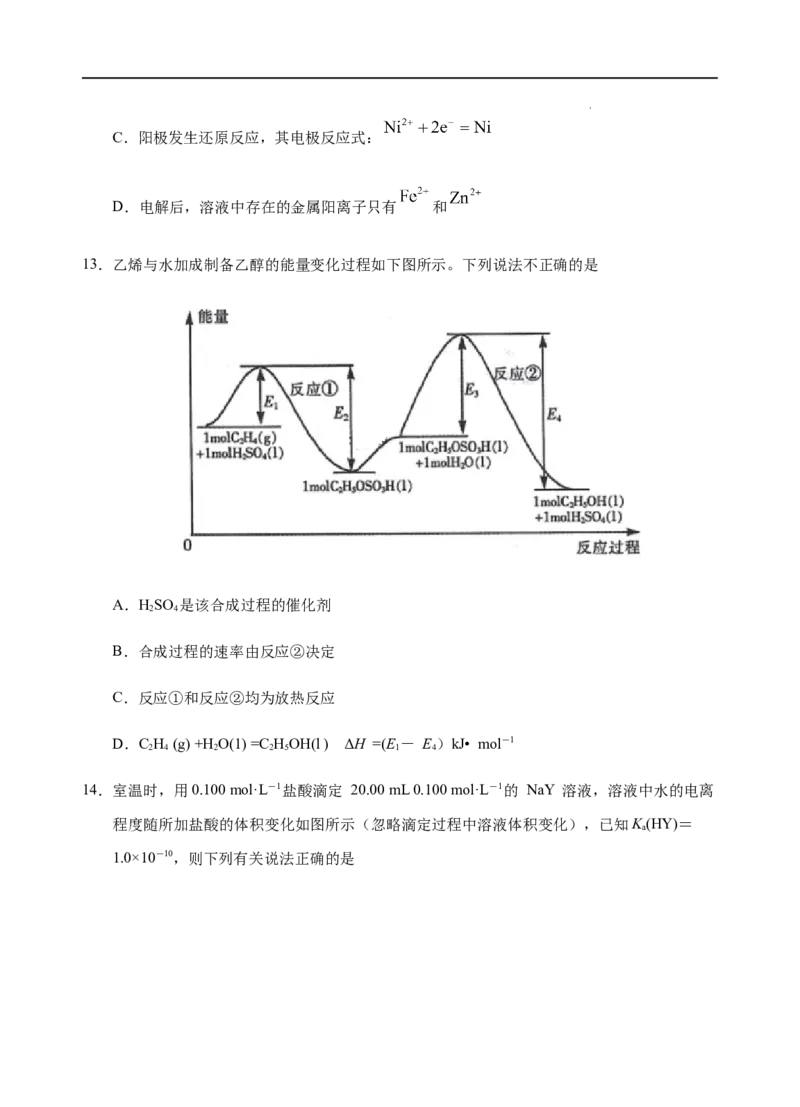
13.乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是
A.HSO 是该合成过程的催化剂
2 4
B.合成过程的速率由反应②决定
C.反应①和反应②均为放热反应
D.C H (g) +H O(1) =C HOH(l ) ΔH =(E- E)kJ• mol-1
2 4 2 2 5 1 4
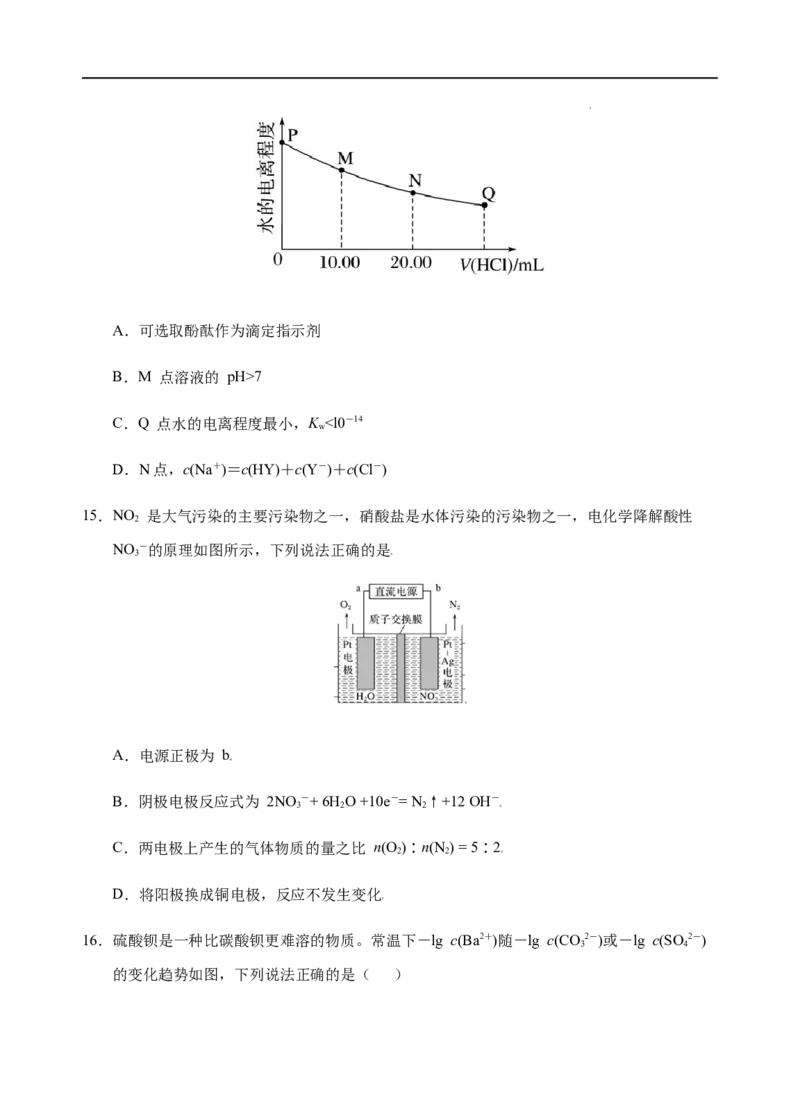
14.室温时,用0.100 mol·L-1盐酸滴定 20.00 mL 0.100 mol·L-1的 NaY 溶液,溶液中水的电离
程度随所加盐酸的体积变化如图所示(忽略滴定过程中溶液体积变化),已知K(HY)=
a
1.0×10-10,则下列有关说法正确的是
学科网(北京)股份有限公司A.可选取酚酞作为滴定指示剂
B.M 点溶液的 pH>7
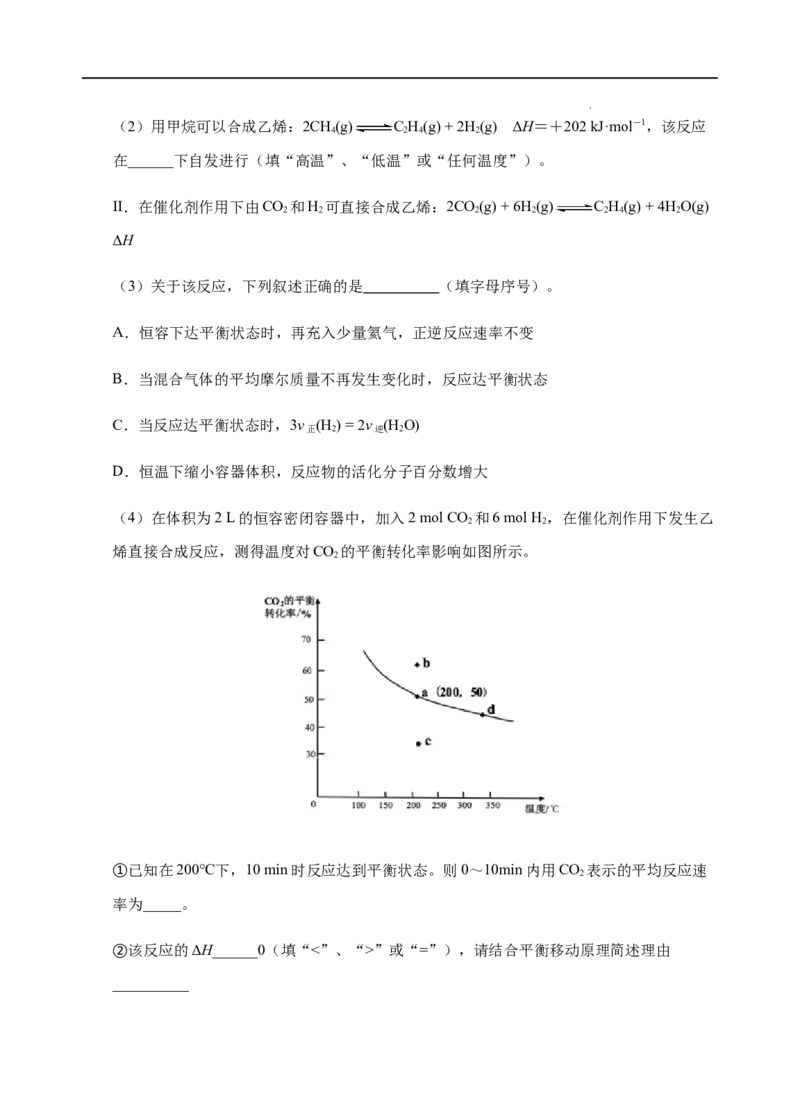
C.Q 点水的电离程度最小,K ”或“=”),请结合平衡移动原理简述理由
__________
学科网(北京)股份有限公司______ _。
③若不使用催化剂,则200℃ 时CO 的平衡转化率位于图中的_____点(填
2
“a”、“b”、“c”或“d”)。
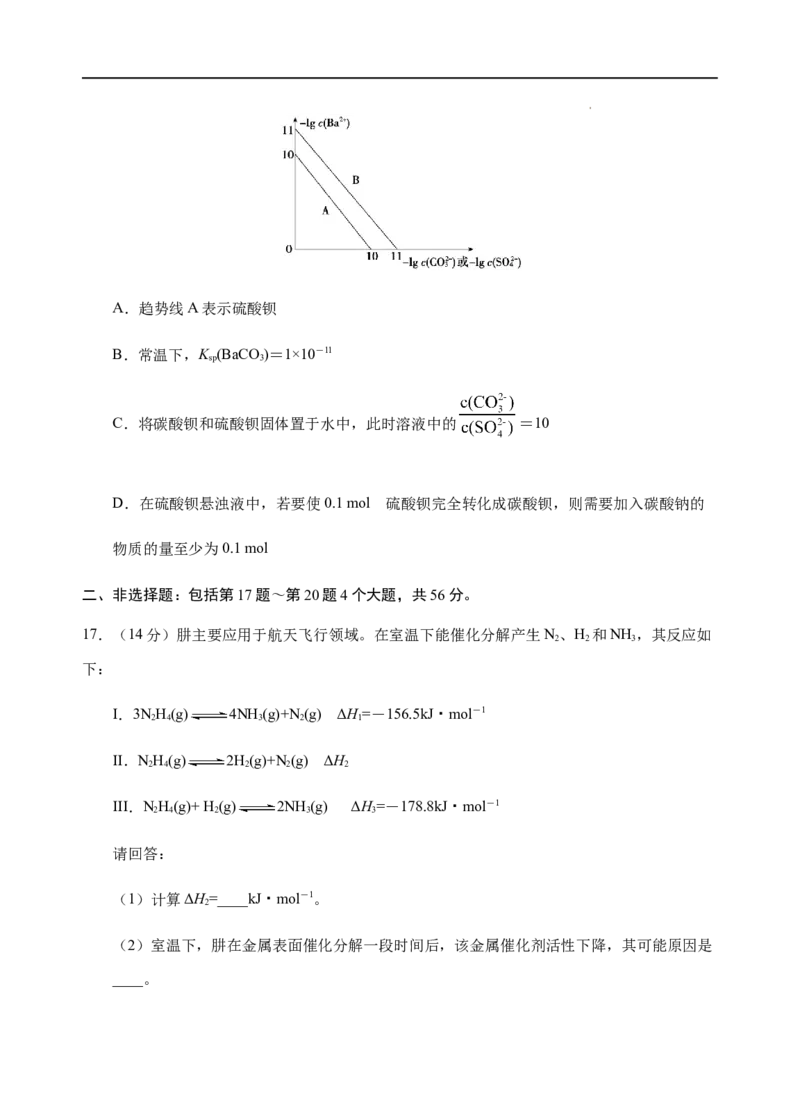
20.(13分)溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多NaCO、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产
2 3
生碱性的原因:_______;农业上用石膏(CaSO·2HO)降低其碱性的反应原理:
4 2
_______。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相
等,则m_______(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CHCOOH与CHCOONa的混合溶液中水电离出来的c(OH
3 3
-)=_______。
(4)25℃时,将a mol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH
)=c(Cl-),则溶液显_______(填“酸”“碱”或“中”)性。用含a的代数式表示NH ·HO
3 2
的电离常数K =_______。
b
(5)已知25 ℃时,K [Fe(OH) ]=2.79×10-39,该温度下反应Fe(OH) +3H+ Fe3++
sp 3 3
3HO的平衡常数K=_______。
2
学科网(北京)股份有限公司学科网(北京)股份有限公司