文档内容
高二化学高频考题期末测试卷 01
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教选择性必修一 难度:★★★☆☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32
一、选择题:本题包括16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小
题4分。在每小题给出的四个选项中,只有一项符合题目要求。
1.中国生产的首艘国产航母“山东”号已经下水。为保护航母、延长服役寿命可采用两种电化
学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确
的是( )
A.方法1中金属块可能是锌、锡和铜
B.方法2中舰体连接电源的负极
C.方法1叫外加电流的阴极保护法
D.方法2叫牺牲阳极的阴极保护法
【答案】B
【解析】方法1舰体上镶嵌活泼性比Fe强的金属块,如锌,发生腐蚀时舰体作正极、活泼
的金属作负极,可防止舰体,延长舰船服役寿命,该方法为牺牲阳极的阴极保护法;方法2
舰体与直流电源的负极相连,舰体作电解池的阴极,可以起到防腐效果,该方法为外加电
流的阴极保护法,据此进行解答。方法1舰体上镶嵌活泼性比Fe强的金属块,如锌,而锡
和铜比铁不活泼,则不行,A错误;方法2舰体与直流电源的负极相连,B正确;方法1舰
体上镶嵌活泼性比Fe强的金属块,如锌,发生腐蚀时舰体做正极、活泼的金属作负极,可
防止舰体,延长舰船服役寿命,该方法为牺牲阳极的阴极保护法,C错误;方法2舰体与直
流电源的负极相连,舰体作电解池的阴极,可以起到防腐效果,该方法为外加电流的阴极
1
学科网(北京)股份有限公司保护法,D错误。
2.化学与人类生产、生活密切相关。下列描述中不涉及盐类水解原理的是
A.明矾净水 B.氯化铵溶液除铁锈
C.用食盐腌制肉制品 D.用草木灰去除油污
【答案】C
【解析】明矾中得氯离子水解为氢氧化铝胶体,从而吸附水中的杂质,A正确;氯化铵是
强酸弱碱盐,水解成酸性,铁锈易溶于酸性溶液,B正确;食盐主要成分为氯化钠,不发
生水解,C错误;草木灰的主要成分为碳酸钾为强碱弱酸盐,水解呈碱性,油污在碱性条
件下水解,D正确。
3.在25℃某稀溶液中,由水电离产生的c(H+)=10-13mol·L-1。下列有关该溶液的叙述正确的是
( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH一定为1 D.该溶液的pH可能为13
【答案】D
【解析】根据水的离子积常数,可知由水电离出的c(H+)=c(OH-)=10-13 mol·L-1,这是
由于在水中加酸或碱,抑制了水的电离。若水中加酸,溶液呈酸性,若水中加减,溶液呈
碱性,A错误;若水中加酸,溶液呈酸性,若水中加减,溶液呈碱性,B错误;若水中加
酸,溶液显酸性则溶液中 OH-只来自水的电离,c(H+) =c(OH-) =c(OH-) =10-13
水 水 总
mol·L-1,由K =c(H+) ·c(OH-) 得:c(H+) = mol·L-1=10-1 mol·L-1,pH=1;若
w 总 总 总
水中加碱,溶液呈碱性,则溶液中H+只来自水的电离,c(H+) =c(H+) =10-13 mol·L-1,
总 水
pH=13,C错误;由分析知,该溶液的pH可能是1可能为13,D正确。
2
学科网(北京)股份有限公司4.有关溶液中3KSCN+FeCl Fe(SCN) +3KCl的反应,下列说法不正确的是
3 3
A.向平衡体系中加入少量KCl固体,溶液红色变浅
B.加入少量KCl固体,溶液红色加深
C.给体系加压,溶液红色没有明显变化
D.Fe(SCN) 属于盐类,难电离
3
【答案】A
【解析】反应实质为Fe3++3SCN- Fe(SCN) (红色),KCl没有参与反应,向平衡体系中
3
加入少量KCl固体,平衡不移动,溶液红色不变浅,A错误;加入少量KCl固体,铁离子
浓度提高,平衡正向移动,溶液红色加深,B正确;没有气体参加反应或生成,给体系加
压,平衡不移动,溶液红色没有明显变化,C正确;Fe(SCN) 可以看成由铁离子和酸根组
3
成,属于盐类,形成络合物,难电离,D正确。
5.通过以下反应均可获取H。下列有关说法正确的是( )
2
①太阳光催化分解水制氢:2HO(l)==2H(g)+O(g) ΔH=+571.6 kJ·mol-1
2 2 2 1
②焦炭与水反应制氢:C(s)+HO(g)==CO(g)+H(g) ΔH=+131.3 kJ·mol-1
2 2 2
③甲烷与水反应制氢:CH(g)+HO(g)==CO(g)+3H(g) ΔH=+206.1 kJ·mol-1
4 2 2 3
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH 减小
3
D.反应CH(g)==C(s)+2H(g)的ΔH=+74.8 kJ·mol-1
4 2
【答案】D
3
学科网(北京)股份有限公司【解析】反应①中,太阳光催化分解水制氢,由光能转化为化学能,A不正确;反应②
中,ΔH>0,为吸热反应,B不正确;反应③中,使用催化剂,对ΔH 不产生影响,C不正
2 3
确;应用盖斯定律,将反应③-反应②得,反应CH (g)=C(s)+2H(g)的ΔH=+74.8 kJ·mol-
4 2
1,D正确。
6.关于如图所示的原电池,下列说法正确的是
A.电流从铜电极通过导线流向锌电极
B.盐桥中的阴离子向CuSO 溶液中迁移
4
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e-=H ↑
2
【答案】A
【解析】锌铜原电池中金属锌做电池负极,发生氧化反应,铜做电池正极,电解质溶液中
铜离子在正极放电,发生还原反应。电流从电源正极流向电源负极,所以电流从铜电极通
过导线流向锌电极,A正确;阴离子向负极即硫酸锌溶液中迁移,B错误;负极发生氧化反
应,正极发生还原反应,C错误;铜电极上是铜离子放电,电极反应式为 ,
D错误。
7.下列离子方程式书写正确的是
4
学科网(北京)股份有限公司A.小苏打溶液中溶质的电离:NaHCO Na+ + H+ + CO
3
B.钢铁发生吸氧腐蚀时的正极反应:O + 2H O + 4e-= 4OH-
2 2
C.稀硫酸与氢氧化钡溶液反应的中和热:H+(aq) + OH-(aq)= HO(l) ΔH=-57.3 kJ·mol-1
2
D.用铁电极电解MgCl 溶液:Mg2+ + 2Cl-+ 2H O Mg(OH) ↓+ H ↑+ Cl ↑
2 2 2 2 2
【答案】B
【解析】小苏打为NaHCO ,其电离方程式为NaHCO =Na+ + 、
3 3
,A错误;钢铁发生吸氧腐蚀时的正极反应为O + 2H O + 4e-=
2 2
4OH-,B正确;稀硫酸与氢氧化钡溶液反应生成水和硫酸钡难溶盐,故其中和热不等于
57.3 kJ·mol-1,C错误;用铁电极电解MgCl 溶液,阳极是Fe失电子变为Fe2+,总反应的
2
离子方程式为Fe+ Mg2+ Fe2++ Mg,D错误。
8.常温下,下列各组离子在指定溶液中能大量共存的是
A.甲基橙呈红色的溶液中:Na+、K+ 、HCO 、NO
B. 的溶液中:NH 、Ca2+、ClO-、I-
C.pH = 7的溶液中:Fe3+、Na+、Cl-、Br-
D.溶有大量CO 气体的溶液中:Na+、 、Cl-、NO
2
5
学科网(北京)股份有限公司【答案】D
【解析】甲基橙的变色范围是pH3.1到4.4,氢离子与HCO 反应生成二氧化碳,A错误;
,溶液显碱性,铵根与氢氧根反应生成水,B错误;Fe3+在中
性溶液中会发生水解,C错误;溶有大量CO 气体的溶液中溶液呈酸性,Na+、 、Cl
2
-、NO 均可大量共存,D正确。
9.能够使CHCOONa溶液pH增大且水解程度也增大的条件是( )
3
A.加水 B.升温
C.加压 D.加CHCOONa固体
3
【答案】B
【解析】CH COONa溶液加水,升温,pH减小,A错误;升温促进CH COONa水解,
3 3
pH增大,B正确;加压水解平衡不移动,C错误;加CH COONa固体,CH COONa水解
3 3
程度减小,D错误。
10.下列关于沉淀溶解平衡的判断正确的是
A.某离子被沉淀完全是指该离子在溶液中的浓度为0
B.向饱和 水溶液中加入 固体, 值变大
C.向 悬浊液中滴加 溶液,生成红褐色沉淀
6
学科网(北京)股份有限公司D.含有 和 固体的悬浊液:
【答案】C
【解析】某离子被沉淀完全,则该体系内有沉淀,存在沉淀溶解平衡,该离子在溶液中的
浓度⩽1×10−5mol/L,不为0,A错误;向饱和 水溶液中加入 固体,则沉淀溶解
平衡发生移动,但K 只与温度有关,与浓度多少无关,B错误;向 悬浊液中滴
sp
加 溶液,则离子反应: 朝右移动,故生
成红褐色沉淀,C正确;含有 和 固体的悬浊液中氯化银溶解度大于碘化银:
,D错误。
11.锂-空气电池是一种可充放电池,电池反应为2Li+O=LiO,某锂-空气电池的构造原理
2 2 2
图如图。下列说法正确的是
A.可选用有机电解液或水性电解液
B.含催化剂的多孔电极为电池的负极
C.放电时负极的电极反应式为Li-e-=Li+
7
学科网(北京)股份有限公司D.充电时锂电极应连接外接电源的正极
【答案】C
【解析】在锂-空气电池中,锂失电子作负极,负极反应式为:Li-e-=Li+,以空气中的氧
气作为正极反应物,氧气得电子生成LiO,正极反应为:O+2Li++2e-=Li O,总反应为:
2 2 2 2 2
2Li+O =Li O,据此解答。应选用有机电解液,水性电解液会与Li直接反应,A错误;含
2 2 2
催化剂的多孔电极为电池的正极,B错误;放电时负极的电极反应式为Li-e-=Li+,C正
确;充电时锂电极应连接外接电源的负极,发生电极反应:Li++e-=Li,D错误。
12.金属镍有广泛的用途。粗镍中含有少量 、 、 、 等杂质,可用电解法制备高纯
度的镍,下列叙述正确的是(已知:氧化性 )
A.电解后,电解槽底部的阳极泥中含有 和
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.阳极发生还原反应,其电极反应式:
D.电解后,溶液中存在的金属阳离子只有 和
【答案】A
【解析】已知:氧化性 ,则金属性 ,电解时,粗镍中镍
及比它活泼的金属都溶解了,电解槽底部的阳极泥中含有 和 ,A正确;电解过程
中,在阳极,粗镍中镍及比它活泼的金属都溶解了,阴极上只有金属镍析出,得失电子数
8
学科网(北京)股份有限公司相等,则阳极质量的减少与阴极质量的增加不相等,B错误;阴极发生还原反应,其电极
反应式: ,C错误;电解后,溶液中存在的金属阳离子只有 、
和 ,D错误。
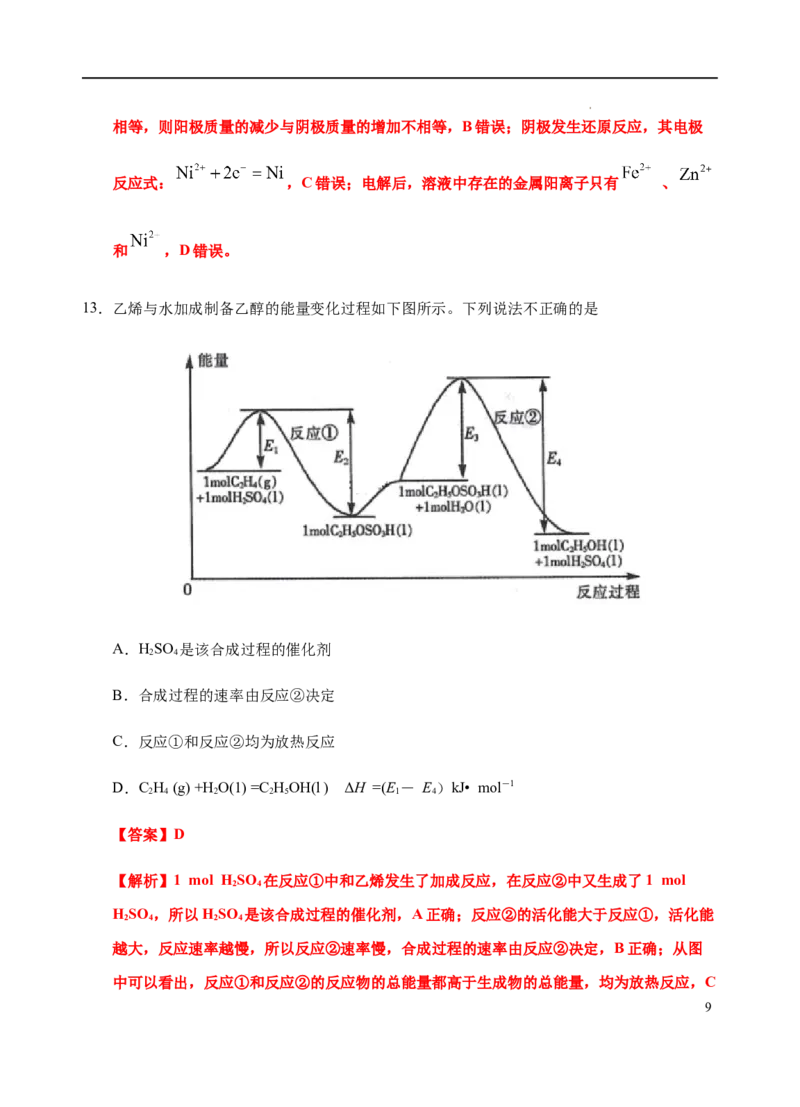
13.乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是
A.HSO 是该合成过程的催化剂
2 4
B.合成过程的速率由反应②决定
C.反应①和反应②均为放热反应
D.C H (g) +H O(1) =C HOH(l ) ΔH =(E- E)kJ• mol-1
2 4 2 2 5 1 4
【答案】D
【解析】1 mol HSO 在反应①中和乙烯发生了加成反应,在反应②中又生成了1 mol
2 4
HSO ,所以HSO 是该合成过程的催化剂,A正确;反应②的活化能大于反应①,活化能
2 4 2 4
越大,反应速率越慢,所以反应②速率慢,合成过程的速率由反应②决定,B正确;从图
中可以看出,反应①和反应②的反应物的总能量都高于生成物的总能量,均为放热反应,C
9
学科网(北京)股份有限公司正确;从图中可以看出,总反应CH (g) +H O(1) =C HOH(l )的ΔH =( E - E +E -
2 4 2 2 5 1 2 3
E )kJ• mol-1,D错误。
4
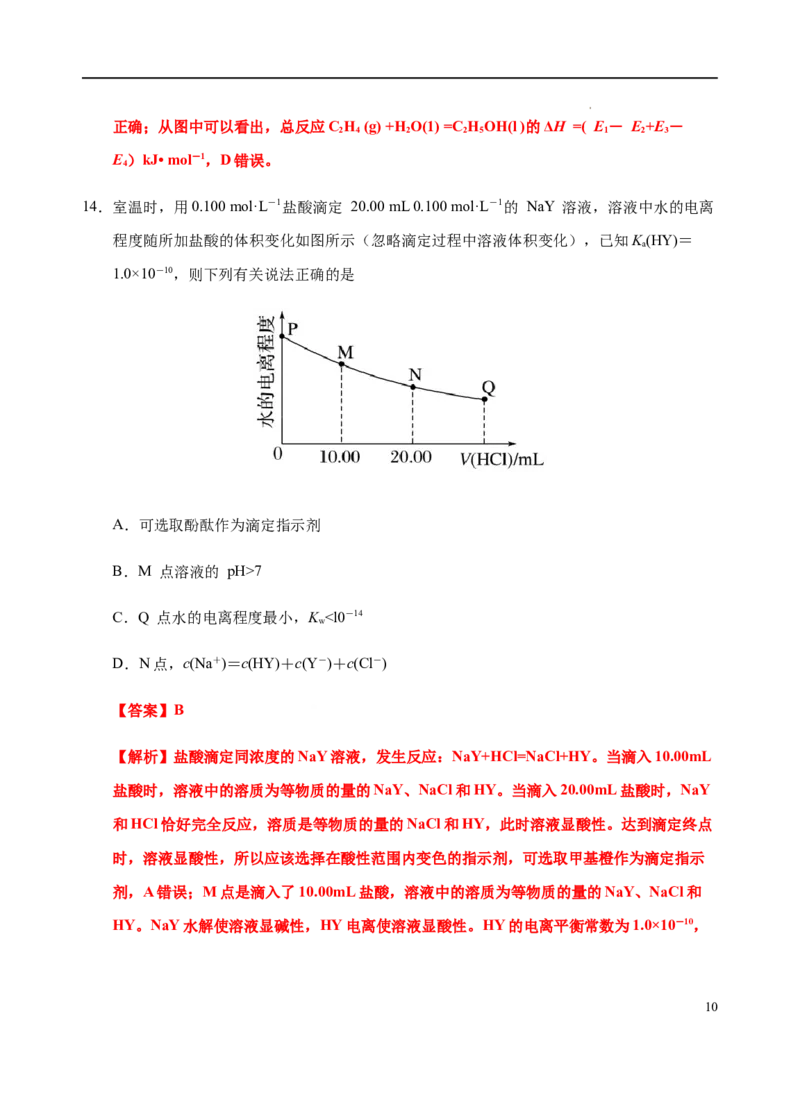
14.室温时,用0.100 mol·L-1盐酸滴定 20.00 mL 0.100 mol·L-1的 NaY 溶液,溶液中水的电离
程度随所加盐酸的体积变化如图所示(忽略滴定过程中溶液体积变化),已知K(HY)=
a
1.0×10-10,则下列有关说法正确的是
A.可选取酚酞作为滴定指示剂
B.M 点溶液的 pH>7
C.Q 点水的电离程度最小,K ”或“=”),请结合平衡移动原理简述理由
__________
______ _。
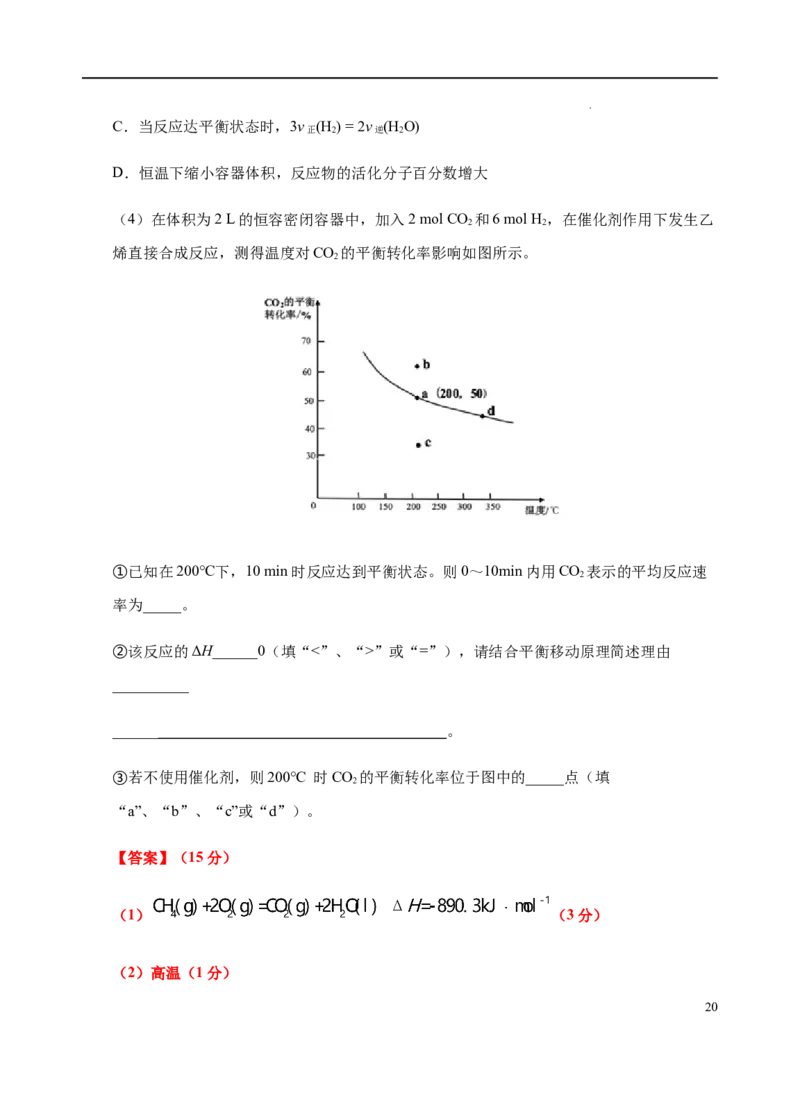
③若不使用催化剂,则200℃ 时CO 的平衡转化率位于图中的_____点(填
2
“a”、“b”、“c”或“d”)。
【答案】(15分)
(1) (3分)
(2)高温(1分)
20
学科网(北京)股份有限公司(3)AB(4分)
(4)①0.05 mol·L-1·min-1(2分) ②<(1分)
温度升高,CO 的平衡转化率减小,说明温度升高平衡逆向移动,所以该反应的 ΔH<0(2
2
分)
③a(2分)
【解析】(1)25℃,101kPa时,甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧热的
热化学方程式为 ;
(2)该反应的ΔH=+202 kJ·mol-1>0,且反应的ΔS>0,自发进行的条件:ΔG=ΔH-
TΔS<0,故该反应高温时自发进行;
(3)恒容下达平衡状态时,再充入少量氦气,不改变生成物和反应为浓度,则正、逆反应
速率不变,A正确;当混合气体的平均摩尔质量不再发生变化时,说明各物质的物质的量
不变,反应达到平衡状态,B正确;反应速率之比等于化学计量数之比,当反应达平衡状
态时,2v (H ) =3v (H O),C错误;恒温下缩小容器体积,单位体积内的活化分子数增
正 2 逆 2
多,但反应物的活化分子百分数不变,D错误;
(4)①由图可知,200℃时,CO 的平衡转化率为50%,在体积为2 L的恒容密闭容器
2
中,加入2 mol CO ,则消耗CO 的物质的量为1mol,剩余1mol CO ,则0~10min内用
2 2 2
CO 表示的平均反应速率为 ;
2
②由图可知,温度升高,CO 的平衡转化率减小,说明温度升高平衡逆向移动,所以该反
2
应的ΔH<0;
③使用催化剂,能加快反应速率,但不影响平衡转化率,故不使用催化剂,200℃ 时CO
2
21
学科网(北京)股份有限公司的平衡转化率位于图中的a点。
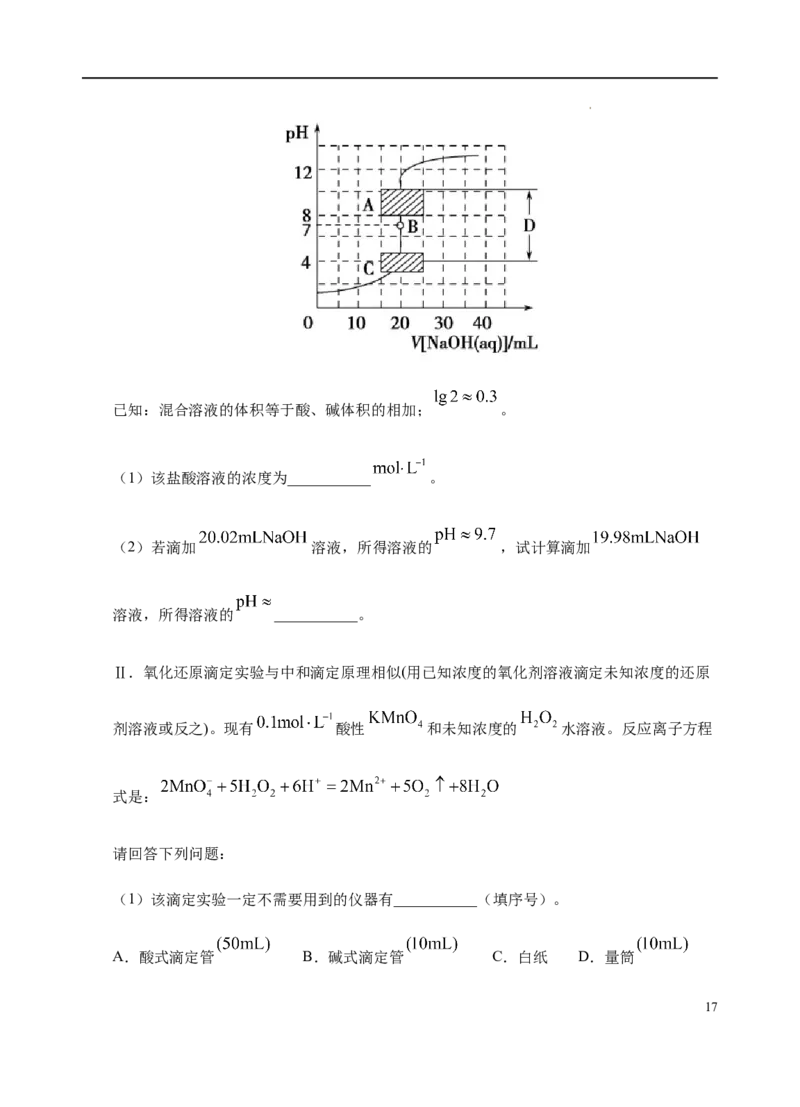
20.(13分)溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多NaCO、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产
2 3
生碱性的原因:_______;农业上用石膏(CaSO·2HO)降低其碱性的反应原理:
4 2
_______。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相
等,则m_______(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CHCOOH与CHCOONa的混合溶液中水电离出来的c(OH
3 3
-)=_______。
(4)25℃时,将a mol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH
)=c(Cl-),则溶液显_______(填“酸”“碱”或“中”)性。用含a的代数式表示NH ·HO
3 2
的电离常数K =_______。
b
(5)已知25 ℃时,K [Fe(OH) ]=2.79×10-39,该温度下反应Fe(OH) +3H+ Fe3++
sp 3 3
3HO的平衡常数K=_______。
2
【答案】(13分)
(1)Na CO +HO NaHCO +NaOH(2分)
2 3 2 3
Na CO +CaSO =CaCO +Na SO (2分)
2 3 4 3 2 4
(2)<(1分)
(3)1.0×10-8 mol·L-1(2分)
22
学科网(北京)股份有限公司(4)中(1分) (3分)
(5)2.79×103(2分)
【解析】(1) 水解使土壤显碱性,对应方程式为Na CO +HO NaHCO +
2 3 2 3
NaOH;CaSO 结合 生成CaCO 沉淀,降低了 浓度,其水解程度减弱,故碱性
4 3
减弱,对应反应原理为:Na CO +CaSO =CaCO +Na SO ;
2 3 4 3 2 4
(2)由于稀释时NH ·HO继续电离,所以稀释相同倍数时,NaOH中c(OH-)变化幅度大
3 2
于氨水中c(OH-)变化幅度,即稀释相同倍数时,溶液pH:NaOH<NH ·HO,故当氨水稀
3 2
释倍数大于NaOH溶液稀释倍数时,两者稀释后pH才可能相等,即m<n;
(3)CH COOH与CH COONa混合溶液pH=6,说明此时CH COOH电离大于CH COO
3 3 3 3
-水解,水的电离受到抑制,H+主要来源于CH COOH电离,故此时溶液中OH-代表水的
3
电离情况,c(OH-)= ,即由水电离出的OH-浓度为
1.0×10-8 mol·L-1;
(4)由电荷守恒: ,结合 ,知此时
,故溶液显中性;由于溶液此时显中性,故氨水未完全反应,
= ,c(OH-)=10-7 mol/L,c(NH·HO)=
3 2
23
学科网(北京)股份有限公司,由 ,得NH ·HO电离常
3 2
数K = ;
b
(5)由题意得K=
。
24
学科网(北京)股份有限公司25
学科网(北京)股份有限公司