文档内容
下学期期末原创卷02
高二化学 选择性必修2·全解全析
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
C D C D A A B D B A A B D A C B
1.C
【详解】
A.电子层越多,半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,K+、S2-核外电子有
3层,O2-核外有2层,钾原子序数大于硫原子序数,所以离子半径:S2->K+>O2-,故A错误;
B.氧元素没有最高正价,硫元素最高化合价为+6价,碳元素最高化合价为+4价,故B错误;
C.同一周期,从左到右,第一电离能呈增大的趋势,IIA、VA族依次为ns的全充满、np的半充满结构,
其第一电离能比相邻元素偏高,所以第一电离能:N>O>C>K,故C正确;
D.同周期从左到右元素的电负性增大,同主族从上到下元素的电负性减小,所以电负性:O>N、O>S,
故D错误;
故选C。
2.D
【详解】
A.冰晶体中存在分子间氢键和范德华力,碘晶体中只有范德华力,A错误;
B.稀有气体的原子结构是稳定结构,同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低,
故在所有的元素中,氦元素的第一电离能最大,B错误;
C.共价键的成键原子也可以是金属原子,如AlCl 中Al原子和Cl原子之间形成共价键,C错误;
3
D.1860年通过原子光谱发现铯元素,1861年通过原子光谱发现铷元素,1868年分析太阳光谱发现氦元素,
D正确;
综上所述答案为D。
3.C
【详解】
A.晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等。结晶速度太大,可能导致晶体质量
下降,A错误;
B.晶体有固定的熔点,B错误;
C.晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X射线衍射可以看到微观结
构,所以可用X射线衍射实验来鉴别晶体硅和玻璃,C正确;
D.晶体硅的形成与晶体的自范性有关,形成的晶体有各向异性,D错误;
答案选C。
4.D
【详解】
A.第一周期元素的最外层电子排布由1s1过渡到1s2,A错误;
B.元素周期表共分成5个区,s区(ⅠA、ⅡA)、p区(ⅢA~ⅦA、0族)、d区(ⅢB~ⅦB、Ⅷ族)、ds区(ⅠB、ⅡB)、f区(镧系、锕系),B错误;
C.最外层电子数为8的粒子可能是稀有气体原子,也可能是离子,比如Na+、F-等,C错误;
D.周期表ⅢB~ⅡB称过渡元素,又这10列均为金属元素,所以又叫过渡金属元素,D正确;
故答案选D。
5.A
【详解】
A.副族都是金属元素,非金属元素是主族或零族元素,A正确;
B.+3价离子的电子排布式为1s22s22p63s23p63d5,则基态原子核外有26个电子,为26号元素,位于第四周
期第Ⅷ族位置,属于d区,B错误;
C.p 和p 能量相同,1s22s22 →1s22s22 过程中不释放能量,C错误;
x y
D.最外层电子数为ns2的元素可能为He、ⅡA族元素或一些过渡元素,D错误;
综上所述答案为A。
6.A
【详解】
A. 硒元素位于元素周期表中第16列,故A错误;
B. 基态硒元素原子核外电子所占据的最高能级4p的电子云轮廓图为哑铃形,故B正确;
C. 硒的最高价为+6价,硒的最高价氧化物对应的水化物的化学式为HSeO,故C正确;
2 4
D. O和Se基态原子的电子最后排入的轨道均为p轨道,均为p区非金属元素,故D正确;
故选A。
7.B
【详解】
A.Mg的原子序数为12,核外电子排布为2、8、2,由此可知Mg元素位于元素周期表中第三周期IIA族,
故A错误;
B.同周期元素原子的第一电离能从左至右逐渐增大,而Mg原子价电子排布式为2s2,2s轨道中电子全充
满,相较于Al难以失去第一个电子,因此第一电离能:I(Na)<I(Al)<I(Mg),故B正确;
1 1 1
C.同周期主族元素从左至右原子半径逐渐减小,因此r(Al)<r(Mg)<r(Na),故C错误;
D.同周期主族元素从左至右元素金属性逐渐减弱,其元素对应最高价氧化物的水化物的碱性逐渐减弱,
因此碱性:Al(OH) <Mg(OH) <NaOH,故D错误;
3 2
综上所述,说法正确的是B项,故答案为B。
8.D
【详解】
A.利用价层电子对互斥理论计算可知, 、 、 中心原子的价层电子对数都是4对, 无
孤电子对, 有一个孤电子对, 有2个孤电子对,由于斥力关系:孤电子对-孤电子对>孤电子对-
成键电子对>成键电子对-成键电子对,所以键角关系为: ,故A错误;
B.共价键的键长决定于两个原子半径和的大小,F-F、Cl-Cl、Br-Br、I-I的键长逐渐增大,键能逐
渐减小,而化学反应除了分子解离过程,还有分子结合过程,F 在冷暗处就可以和氢气反应,最不稳定,
2故B错误;
C.键能为气态基态原子形成 化学键释放的最低能量,18gHO未指明状态,不能利用键能计算消耗
2
能量,故C错误;
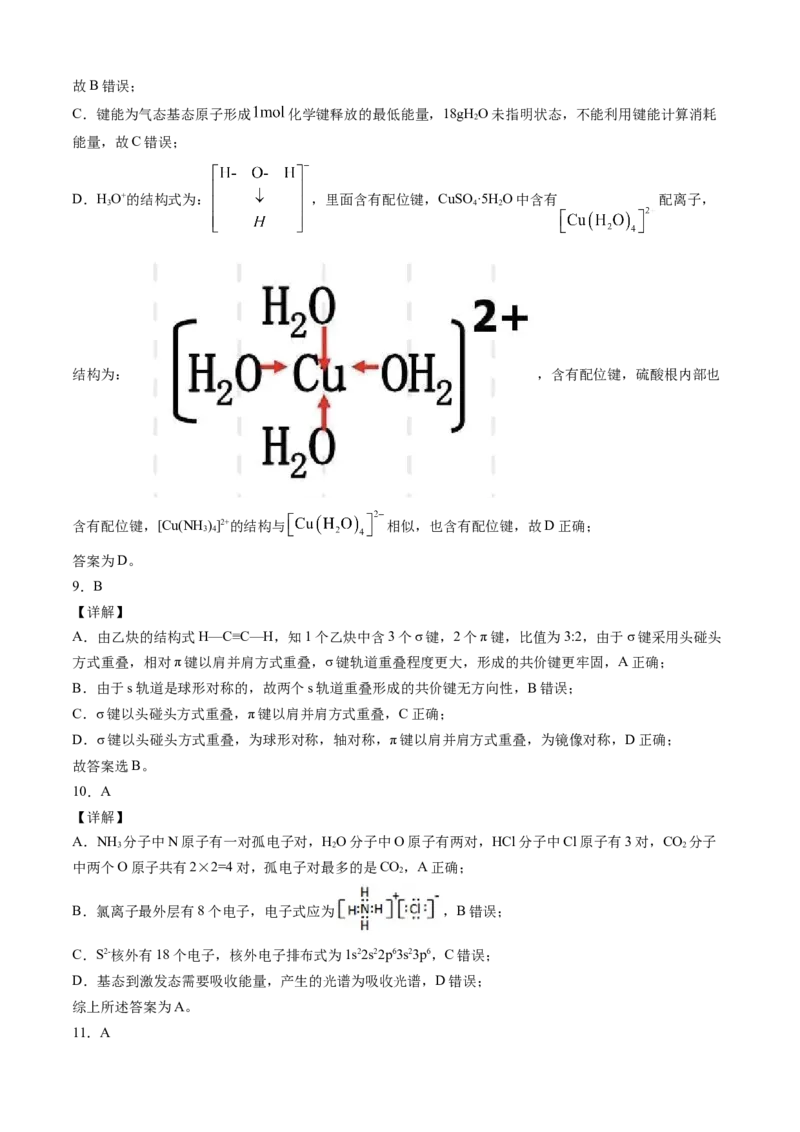
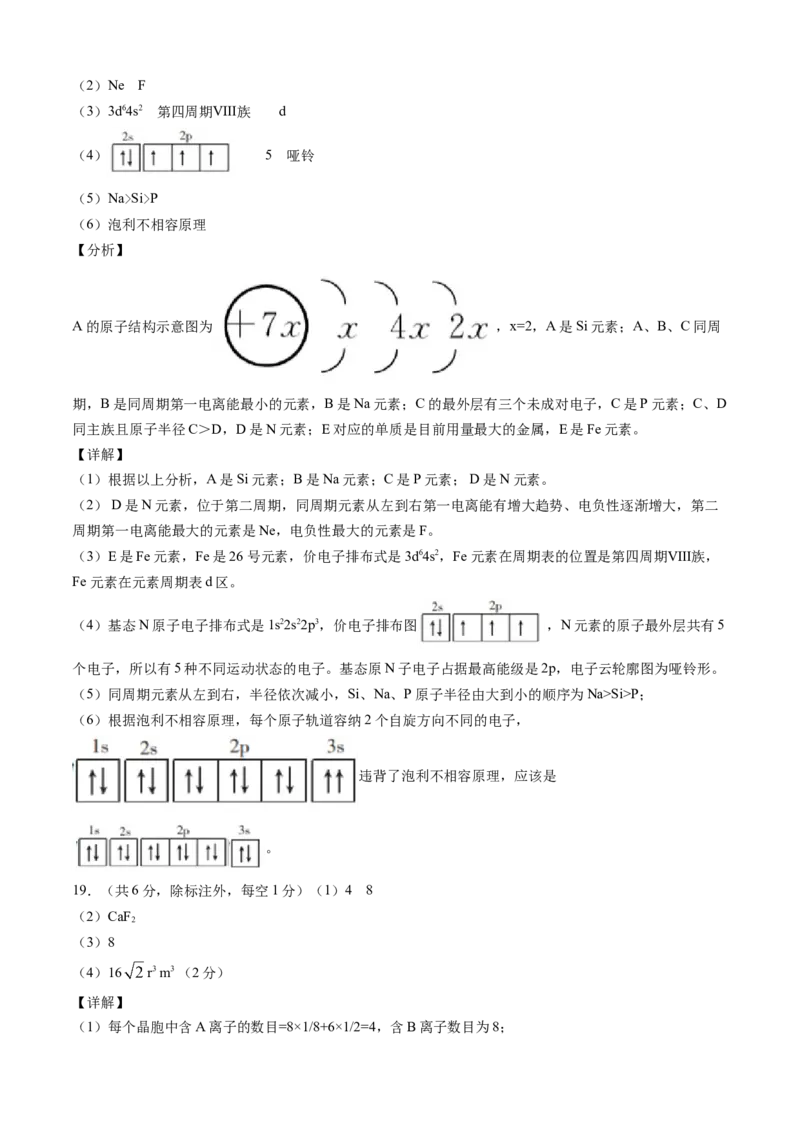
D.HO+的结构式为: ,里面含有配位键,CuSO ·5H O中含有 配离子,
3 4 2
结构为: ,含有配位键,硫酸根内部也
含有配位键,[Cu(NH )]2+的结构与 相似,也含有配位键,故D正确;
3 4
答案为D。
9.B
【详解】
A.由乙炔的结构式H—C≡C—H,知1个乙炔中含3个σ键,2个π键,比值为3:2,由于σ键采用头碰头
方式重叠,相对π键以肩并肩方式重叠,σ键轨道重叠程度更大,形成的共价键更牢固,A正确;
B.由于s轨道是球形对称的,故两个s轨道重叠形成的共价键无方向性,B错误;
C.σ键以头碰头方式重叠,π键以肩并肩方式重叠,C正确;
D.σ键以头碰头方式重叠,为球形对称,轴对称,π键以肩并肩方式重叠,为镜像对称,D正确;
故答案选B。
10.A
【详解】
A.NH 分子中N原子有一对孤电子对,HO分子中O原子有两对,HCl分子中Cl原子有3对,CO 分子
3 2 2
中两个O原子共有2×2=4对,孤电子对最多的是CO,A正确;
2
B.氯离子最外层有8个电子,电子式应为 ,B错误;
C.S2-核外有18个电子,核外电子排布式为1s22s22p63s23p6,C错误;
D.基态到激发态需要吸收能量,产生的光谱为吸收光谱,D错误;
综上所述答案为A。
11.A【详解】
根据价层电子对互斥理论判断C原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,如果价层电子
对个数是4,则C原子采用sp3杂化,如果价层电子对个数是3,则C原子采用sp2杂化,如果价层电子对
个数是2,则C原子采用sp杂化,
甲基上C原子含有4个σ键,则C原子采用sp3杂化,碳碳双键两端的C原子含有3个σ键,则C原子采用
sp2杂化,碳碳三键两端的C原子含有2个σ键,则C原子采用sp杂化,
答案选A。
12.B
【分析】
正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子,结合分子空间构型判断,对于AB 型
n
分子,中心原子A的最外层电子全部成键,为非极性分子,中心原子A的最外层电子部分成键,为极性分
子。
【详解】
①SO 分子中S元素的最外层电子数为6,化合价为+4,最外层电子未全部成键,是极性分子;②BeCl 分
2 2
子中Be元素的最外层电子数为2,化合价为+2,最外层电子全部成键,是非极性分子;③BBr 分子中B
3
元素的最外层电子数为3,化合价为+3,最外层电子全部成键,是非极性分子④COCl 中心C原子成2个
2
C-Cl键、1个C=O,不含孤电子对,为平面三角形,分子不对称,为极性分子;综上分析②③符合,故选
B。
13.D
【详解】
A.乙醇存在氢键,沸点较高,前者高于后者,故A不符合题意;
B .C F 与C H 都是分子晶体,结构相似,相对分子质量越大,沸点越高,前者高于后者,故B不符合题
3 8 3 8
意;
C.对羟基苯甲醛含有分子间氢键,邻羟基苯甲醛含有分子内氢键,分子间作用力较强,沸点较高,前者
高于后者,故C不符合题意;
D.邻羟基苯甲酸存在分子内氢键,对羟基苯甲酸存在分子间氢键,分子间作用力较强,沸点较高,前者
低于后者,故D符合题意;
故答案为D。
14.A
【详解】
A.同周期元素的第一电离能从左到右有增大的趋势,但ⅡA族和ⅤA族的元素达到全满或半满状态,所
以N、O、F的第一电离能由大到小的顺序为F>N>O,A正确;
B.分子中C-H键的键能与C-F键的键能比较,可以根据键长的大小来判断,具体来说就是根据相结合的
两个原子的半径来比较,半径越小键能越大,两个化学键都含有C原子,F原子的半径大于H原子的,所
以C-H键的键能大于C-F键的键能,B正确;
C.该分子中 键与 键数目之比为15:4,C错误;
D.手性碳原子一定是饱和碳原子,所连接的四个基团要是不同的,该有机物中没有饱和的碳原子,故D
错误;故选A。
15.C
【详解】
A.组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔沸点越高,则晶体熔点由低到高:
CF<CCl <CBr <CI ,故A正确;
4 4 4 4
B.原子晶体中,原子半径越小,键长越短,键能越大,共价键越牢固,硬度越大,键长C−C<C−Si<
Si−Si,则硬度由大到小:金刚石>碳化硅>晶体硅,故B正确;
C.金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由移动的电子之间的静电作用
越强,金属键越强,熔沸点越高,则熔点由高到低:Al>Mg>Na,故C错误;
D.离子半径越小、离子键越强,晶格能越大,熔沸点越高,离子半径:r(F-)<r(Cl-)<r(Br-)<r(I-),则熔
点由高到低:NaF>NaCl>NaBr>NaI,故D正确;
故选C。
16.B
【详解】
A.六方氮化硼为层状结构,层间的分子间作用力比共价键弱得多,故立方氮化硼大于六方氮化硼的硬度,
正确,A不符合题意;
B.六方氮化硼为层状结构,层内原子之间形成共价键,层间通过分子间作用力维系,因此虚线不比表示
共价键,错误,B符合题意;
C.根据立方氮化硼的晶胞结构示意图,左边面心的B原子与2个N相连;右边面心的B原子与2个N相
连,可知左边面心的B原子还会与另一个晶胞的2个N原子相连,因此B的配位数为4,正确,C不符合
题意;
D.在一定条件下,可以使B、N原子之间形成配位键,六方氮化硼可转化为立方氮化硼,正确,D不符合
题意;
答案选B。
17.(共9分,除标注外,每空2分)(1)4
(2)随着气态离子所带正电荷数的增多,核外电子距离原子核的距离减小,原子核对核外电子的引力增
大
(3)sp2、sp3 4(1分) N>H>C>Sc
【详解】
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有4种,分别为K、Cu、Ga、Br。
(2)上述三种气态离子的电离势依次增大的原因为随着气态离子所带正电荷数的增多,核外电子距离原
子核的距离减小,原子核对核外电子的引力增大。
(3)①该配合物分子中碳原子的杂化方式含有双键为sp2 其余为sp3;根据结构式可知与Sc原子形成配位
,
键的N原子个数为4。
②总体上金属元素第一电离能较小非金属元素第一电离能较大,N为半充满状态,故第一电离能较大,该
配合物中各元素第一电离能从大到小的顺序为:N>H>C>Sc。
18.(共14分,每空1分)(1)Si Na P N(2)Ne F
(3)3d64s2 第四周期Ⅷ族 d
(4) 5 哑铃
(5)Na>Si>P
(6)泡利不相容原理
【分析】
A的原子结构示意图为 ,x=2,A是Si元素;A、B、C同周
期,B是同周期第一电离能最小的元素,B是Na元素;C的最外层有三个未成对电子,C是P元素;C、D
同主族且原子半径C>D,D是N元素;E对应的单质是目前用量最大的金属,E是Fe元素。
【详解】
(1)根据以上分析,A是Si元素;B是Na元素;C是P元素; D是N元素。
(2) D是N元素,位于第二周期,同周期元素从左到右第一电离能有增大趋势、电负性逐渐增大,第二
周期第一电离能最大的元素是Ne,电负性最大的元素是F。
(3)E是Fe元素,Fe是26号元素,价电子排布式是3d64s2,Fe元素在周期表的位置是第四周期Ⅷ族,
Fe元素在元素周期表d区。
(4)基态N原子电子排布式是1s22s22p3,价电子排布图 ,N元素的原子最外层共有5
个电子,所以有5种不同运动状态的电子。基态原N子电子占据最高能级是2p,电子云轮廓图为哑铃形。
(5)同周期元素从左到右,半径依次减小,Si、Na、P原子半径由大到小的顺序为Na>Si>P;
(6)根据泡利不相容原理,每个原子轨道容纳2个自旋方向不同的电子,
违背了泡利不相容原理,应该是
。
19.(共6分,除标注外,每空1分)(1)4 8
(2)CaF
2
(3)8
(4)16 r3 m3 (2分)
【详解】
(1)每个晶胞中含A离子的数目=8×1/8+6×1/2=4,含B离子数目为8;(2)通过(1)知,该物质的化学式为:AB ,A是金属阳离子,则A的化合价是+2价,若A的核外电子
2
排布与Ar相同,则A是Ca元素,B的化合价是-1价,且B的电子排布与Ne相同,则B是F元素,则该
离子化合物的化学式是CaF ;
2
(3)阳离子周围距离最近的阴离子数为8;
(4)该晶胞中正方形对角线的长度=4rm,则该晶胞的边长=2 r m,则该晶胞的体积=(2 r m)3=16
r3 m3。
20.(共7分,每空1分)(1)第一周期IA族 Cl
(2)氧
(3)黄
(4) NaO 平面三角形
2 2
【分析】
A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;D+与C2-具
有相同的电子数,则D处于IA族,C处于ⅥA族,则D为Na、C为O元素;B在C中充分燃烧生成
BC ,B的成对电子与未成对电子所占据的原子轨道数相等,故B为碳元素;A在E中燃烧,产物溶于水
2
得到种强酸,则E为Cl;据此推断作答。
【详解】
(1)A为H元素,位于元素周期表中第一周期IA族;E的元素符号为Cl;
(2)由于O的非金属性比C强,吸引电子对的能力强,故共用电子对偏向O,该元素名称为氧;
(3)Na原子由激发态跃迁到基态时会释放黄色的光;
(4) a由Na和H组成的离子化合物NaH,电子式为 ;Na与O两元素组成的含有
非极性键的离子化合物的化学式为NaO;化学组成为BCE 的化学式为COCl ,其中碳原子为sp2杂化,C
2 2 2 2
原子的 键电子对数为3,孤电子对数为0,则其空间构型为平面三角形。
21.(共16分,除标注外,每空1分)(1) 乙二胺的两个N提供孤对电子给Cu2+形成配位键
(2) P-Pσ键
(3) (2分) 离子键、共价键、配位键 2
(4) V形 硫原子上孤电子对存在对共价键的排斥作用使键角变小 小于
(5) (2分)
(6)Ag+对 中氧离子的吸引,在加热条件下使碳氧键断裂,释放出CO 气体(2分)
2
【详解】
(1)已知基态铜原子的价层电子排布式为: ,元素周期表中,铜、银、金位于同一副族相邻周期,
故基态银原子的价层电子排布式为 ,由于乙二胺( )中两个-NH 的N原子上均有
2孤电子,均能与Cu2+等金属离子形成配位键,故能与 等金属离子形成稳定环状离子,故答案为:
;乙二胺的两个N提供孤对电子给Cu2+形成配位键;
(2)等电子体是指原子总数相等,价电子总数相等的分子,因S和O的价电子数相等,故 等电子
体为 ,其结构中σ键是S原子的3p轨道和O原子的2p轨道重叠形成的,故σ键的类型为P-Pσ键,
故答案为: ;P-Pσ键;
(3)由题干信息可知,硫代硫酸钠( )溶解未曝光的溴化银(AgBr),生成含 ,
AgBr溶于 溶液反应的方程式为:AgBr+2 = +NaBr,故离子方程式为:
,
中存在的作用力有Na+与 之间的离子键、 内部中有S原子
和O原子间的共价键和Ag+与 之间的配位键, 中银离子的配位数是2,故答案为:
;离子键、共价键、配位键;2;
(4)在空气中灼烧 生成Ag和 分子中心原子S原子周围形成2个σ键,含有的孤电子对
数为: =1,故中心原子的价层电子对数为3,故杂化类型为sp2,分子的空间构型为V形,CO
2
中C原子没有孤电子对,导致C=O之间的排斥力减小,故键角增大,故SO 与CO 构型不同的原因是硫原
2 2
子上孤电子对存在对共价键的排斥作用使键角变小,由于HO中O原子存在2对孤电子对, 中O原
2
子存在1对孤电子对,由此判断 的键角小于 的键角,故答案为:sp2;V形;硫原子上孤电子
对存在对共价键的排斥作用使键角变小;小于;
(5)设阿伏加德罗常数N ,已知金的晶胞属于面心立方晶胞,故一个晶胞中含有 个金原
A
子,设晶胞的边长为xcm,若金原子的半径为rcm,可知:4r= ,即x=2 rcm,又金的密度为
,摩尔质量为 ,列出为:4M=N (2 r)3 ,故计算阿伏加德罗常数的算式为:
A
,故答案为: ;
(6)由于S2-的半径大于O2-的半径,Ag+对 中氧离子的吸引,在加热条件下使碳氧键断裂,释放出
CO 气体,导致Ag CO 比Ag S的分解温度低,故答案为:Ag+对 中氧离子的吸引,在加热条件下使
2 2 3 2
碳氧键断裂,释放出CO 气体。
2