文档内容
2023-2024 学年上学期期末模拟考试 01
高二化学
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证
号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用
橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:人教版2019选择性必修1全册+选择性必修2第一章。
5.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Na-23 Fe-56 Cu-64
第Ⅰ卷(选择题 共 45 分)
一、选择题:本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要
求的。
1.化学知识广泛应用于生产、生活中。下列叙述不正确的是
A.明矾和 均可用作净水剂,但净水原理不同
B.泡沫灭火器中常使用的原料是碳酸钠溶液和硫酸铝溶液
C.纯碱可以用作锅炉除垢时 的转化剂
D.用饱和氯化铵溶液可以清洗钢铁表面的锈迹
2.如图所示是298 K时,A 与B 反应过程中能量变化的曲线图,下列叙述正确的是
2 2
A.该反应为吸热反应 B.加入催化剂,反应热发生改变
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司C.断裂1 mol A-A和1 mol B-B键,放出a kJ能量 D.该反应的 ∆H= + (b-a) kJ/mol
3.下列实验事实能用平衡移动原理解释的是
A.工业上用SO 和O 制备SO 时,选择常压而不用高压
2 2 3
B.使用铁触媒能加快合成氨的反应速率
C.平衡4CO(g)+2NO (g) N (g)+4CO (g),加压气体颜色变深
2 2 2
D.将氯化铝溶液低温蒸干,最终得到氢氧化铝固体
4.下列有关化学用语的表示正确的是
A.甲基的电子式 B.S2-的结构示意图:
C.Cl的最外层电子排布式:3s23p5 D.N的轨道表示式:
5.合成氨工业中可采用水煤气法作为氢气的来源,其中一步的反应为 ;
,欲提高 的转化率,所采取的下列方法比较适宜的组合是
①降低温度 ②增大压强 ③使用催化剂 ④增大 的浓度 ⑤增大
的浓度
A.①② B.②④⑤ C.①⑤ D.①③⑤
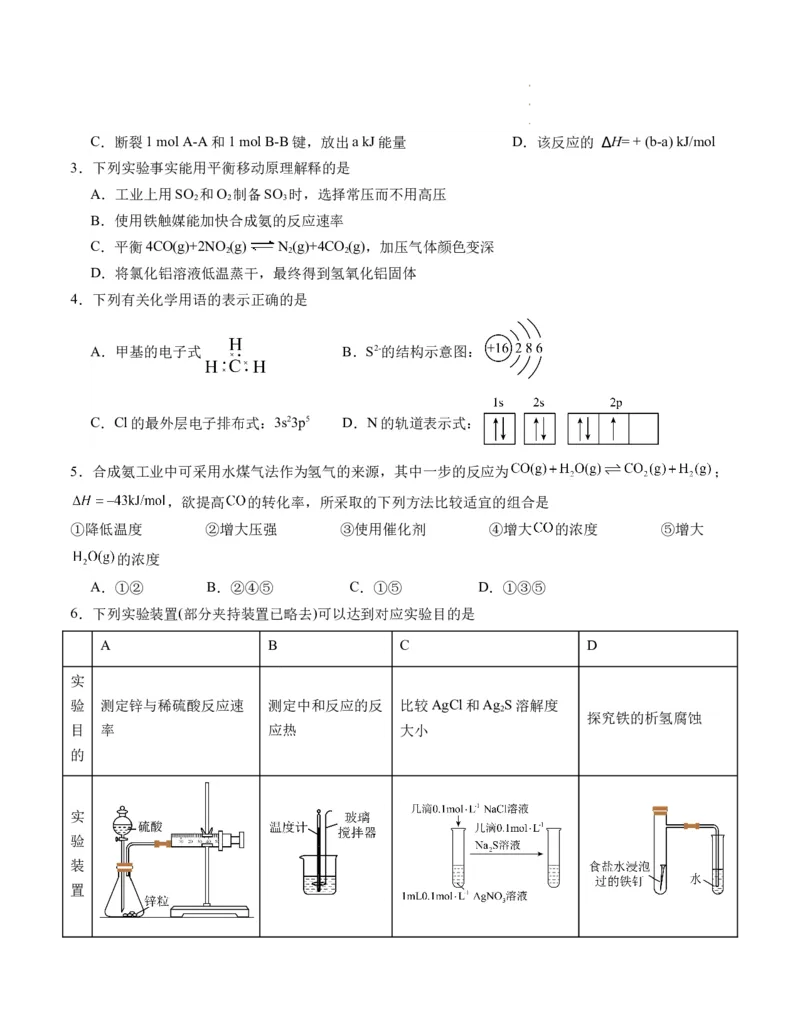
6.下列实验装置(部分夹持装置已略去)可以达到对应实验目的是
A B C D
实
验 测定锌与稀硫酸反应速 测定中和反应的反 比较AgCl和Ag S溶解度
2
探究铁的析氢腐蚀
目 率 应热 大小
的
实
验
装
置
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司7.下列说法正确的是
A.常温下,反应4Fe(OH) (s)+2H O(l)+O (g)=4Fe(OH) (s)能自发进行,则△H<0
2 2 2 3
B.铁片镀锌时,铁片与外电源的正极相连
C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动
D.t℃时,恒容密闭容器中反应:NO (g)+SO (g) NO(g)+SO (g),通入少量O ,
2 2 3 2
的值及SO 转化率不变
2
8.下列各组离子在指定溶液中一定能大量共存的是
A. 的溶液中: 、 、 、
B.常温下,水电离的 的溶液: 、 、 、
C.使酚酞变红色的溶液中: 、 、 、
D.常温下,在 的溶液中: 、 、 、
9.四种短周期元素X、Y、Z、W的原子序数依次增大,其结构信息如表所示。
元素 结构信息
基态原子核外s能级的电子数等于p能级的电子
X
数
Y 基态原子的M能层只有1种自旋电子
Z 在元素周期表中,族序数等于周期数
W 基态原子核外p能级只有1个未成对电子
下列说法中正确的是
A.电负性:X>Y>W>Z B.离子半径:W>Y>Z>X
C. 中含有的离子总数为4mol D.Y、Z、W的最高价氧化物对应的水化物之间能相互反
应
10.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.常温下1LpH=3的FeCl 溶液中Cl—数目为3N
3 A
B.常温下,1L0.1mol•L-1的NH NO 溶液中氮原子数为0.2N
4 3 A
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司C.0.1mol•L-1碳酸钠溶液含有的CO 数目一定小于0.1N
A
D.粗铜精炼中阳极质量减小64g时,转移电子数目为2N
A
11.将1molCO和2molH 充入一容积为1L密闭容器中,分别在250℃、T℃发生反应:
2
,根据图示判断,下列正确的是
A. ,
B.250℃时,0~10min内
C.CO的平衡转化率在250℃时比T℃时大
D.250℃时,起始时改为向容器中充入2molCO和4molH ,恒温达平衡后, 的物质的量大于
2
0.30mol
12.下列是教材中常规电化学示意图,其标注完全正确的是
A. B.
C. D.
13.若某元素原子处于能量最低状态时,原子的最外层电子数为2,价层电子数为5,下列关于该元素的
叙述正确的是
A.该元素原子的M层有11个电子 B.该元素处于元素周期表中第VA族
C.该元素位于元素周期表的d区或p区 D.该元素基态原子的价电子排布式为
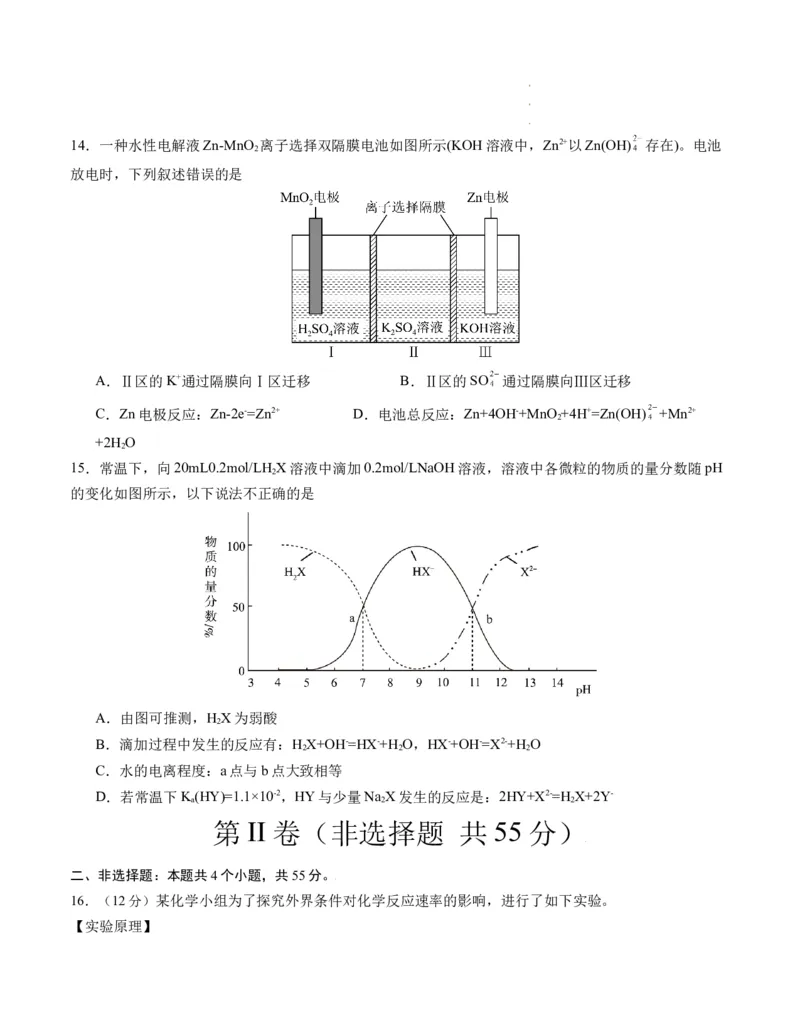
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司14.一种水性电解液Zn-MnO 离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH) 存在)。电池
2
放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅰ区迁移 B.Ⅱ区的SO 通过隔膜向Ⅲ区迁移
C.Zn电极反应:Zn-2e-=Zn2+ D.电池总反应:Zn+4OH-+MnO +4H+=Zn(OH) +Mn2+
2
+2H O
2
15.常温下,向20mL0.2mol/LH X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH
2
的变化如图所示,以下说法不正确的是
A.由图可推测,H X为弱酸
2
B.滴加过程中发生的反应有:H X+OH-=HX-+H O,HX-+OH-=X2-+H O
2 2 2
C.水的电离程度:a点与b点大致相等
D.若常温下K(HY)=1.1×10-2,HY与少量Na X发生的反应是:2HY+X2-=H X+2Y-
a 2 2
第 II 卷(非选择题 共 55 分)
二、非选择题:本题共4个小题,共55分。
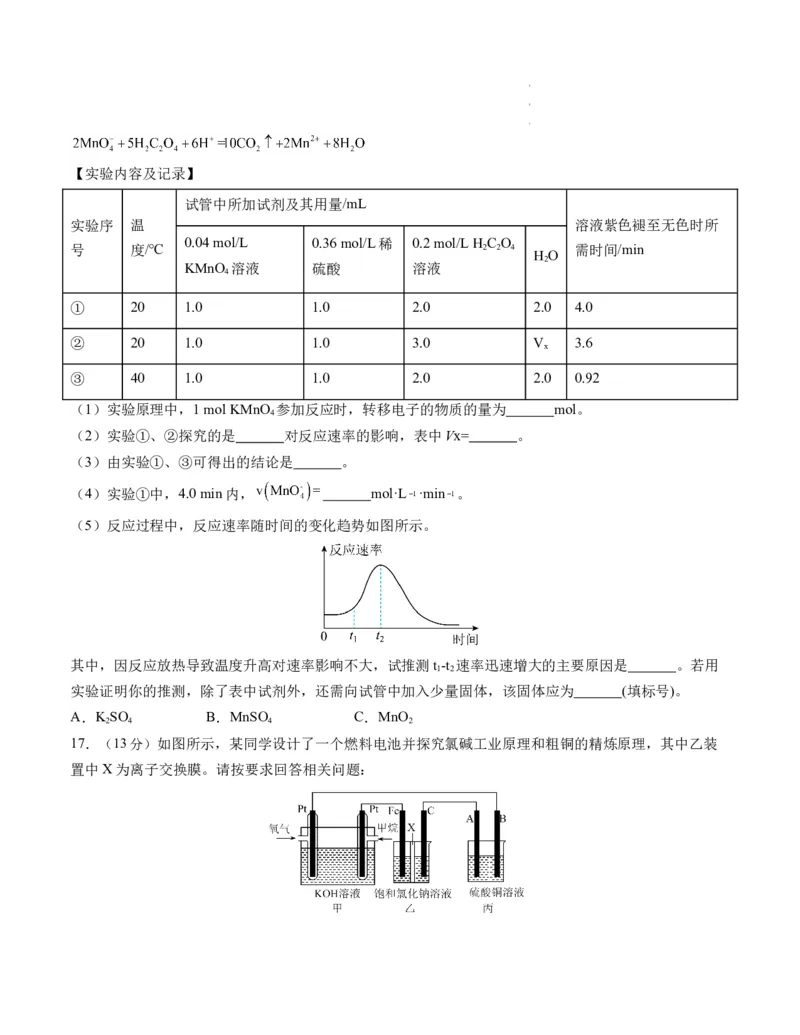
16.(12分)某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验。
【实验原理】
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司【实验内容及记录】
试管中所加试剂及其用量/mL
实验序 温 溶液紫色褪至无色时所
0.04 mol/L 0.36 mol/L稀 0.2 mol/L H C O
号 度/℃ 2 2 4 需时间/min
H O
2
KMnO 溶液 硫酸 溶液
4
① 20 1.0 1.0 2.0 2.0 4.0
② 20 1.0 1.0 3.0 V 3.6
x
③ 40 1.0 1.0 2.0 2.0 0.92
(1)实验原理中,1 mol KMnO 参加反应时,转移电子的物质的量为 mol。
4
(2)实验①、②探究的是 对反应速率的影响,表中Vx= 。
(3)由实验①、③可得出的结论是 。
(4)实验①中,4.0 min内, mol·L ·min 。
(5)反应过程中,反应速率随时间的变化趋势如图所示。
其中,因反应放热导致温度升高对速率影响不大,试推测t -t 速率迅速增大的主要原因是 。若用
1 2
实验证明你的推测,除了表中试剂外,还需向试管中加入少量固体,该固体应为 (填标号)。
A.K SO B.MnSO C.MnO
2 4 4 2
17.(13分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装
置中X为离子交换膜。请按要求回答相关问题:
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司(1)甲烷燃料电池负极反应式是 。
(2)Fe电极的电极反应式为 。
(3)X选择 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在 (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度
(填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为 L。
(6)写出图中电解饱和食盐水的总的化学反应方程式 。
18.(15分)回答下列问题:
Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ 25
水的离子积
a
(1)若 ,在 下,其溶液的 ,则该溶液 (填字母)。
a.呈中性 b.呈酸性 c.呈碱性
(2)若 ,则a (填“>”“<”或“=”) 。
(3)在25℃,a. 盐酸 b. 溶液 c. 的 溶液三份溶液中水的电
离程度由大到小排序为 (用a、b、c填空)
Ⅱ.实验室欲测定某 溶液的物质的量浓度,用 标准溶液进行中和滴定(用酚酞作
指示剂)。请回答下列问题:
(4)向 的碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为 ,将滴定管中的液体放
出至滴定管的读数为 ,则滴定管中剩余的氢氧化钠溶液的体积为 (填“大
于”“小于”或“等于”)
(5)该实验滴定至终点的现象是 。
(6)某同学记录滴定前滴定管内液面读数 ,滴定后液面如图所示,则此时消耗标准
溶液的体积为 。
Ⅲ.已知:常温下, ,(在溶液中某离子完全沉淀时,认为该离子浓度小于
)
(7) 的溶度积常数表达式 。
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司(8) 完全沉淀的 为 。
19.(15分)氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到
氢气:方法一:氨热分解法制氢气。
相关化学键的键能数据
化学键
键能
946 436 391
E/(KJ/mol)
(1)反应 kJ/mol
(2)已知反应的 J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(3)298 K时,1 g H 燃烧生成 放热121 kJ,1 mol 蒸发吸热44
2
kJ,表示 燃烧热的热化学方程式为 。
方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:
(4)电解过程中 的移动方向为 (填“从左往右”或“从右往左)
(5)阳极的电极反应式为 。
Ⅱ. 可用于高效制取氢气,发生的反应为 。
若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如
图。
(6)图中曲线Z表示的物质是 (填化学式)。
(7)C点时 的转化率为 %(保留一位小数)。
(8)A点时,设容器内的总压为p Pa,则平衡常数 Pa(用平衡分压
代替平衡浓度计算,分压=总压×物质的量分数)。
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司