文档内容
绝密★启用前(新高考卷)
化学参考答案
1.【答案】D
【解析】光伏发电是太阳能直接转化成电能,A项错误;石墨烯是无机非金属材料,B项错误;碲是VⅠA族元
素,镉属于过渡元素,C项错误;人工合成淀粉属于有机高分子化合物,D项正确。
2.【答案】D
【解析】将盐卤溶液蒸干得到的是Mg(OH) 、CaSO 等,D项错误。
2 4
3.【答案】A
1
【解析】SO
2
的价层电子对=键电子对+孤电子对=2+ (622)=2+1=3,则SO
2
的价层电子对互斥模型为
2
,A项正确;顺-2-丁烯的2个甲基应该位于同侧,图中的球棍模型是反-2-丁烯,B项错误;Na O 是
2 2
离子化合物,电子式为 ,C项错误;MgCl 的形成过程的箭头方向画反了,D项错误。
2
4.【答案】C
【解析】钠和钾容易与水剧烈反应,白磷容易自燃,实验室没有用完的钠、钾和白磷物质需要放回原试剂瓶,A
项错误;量筒的精确度不能到0.01mL,应该用碱式滴定管或移液管量取,B项错误;蒸馏实验操作中,若使用
球形冷凝管可能导致部分馏分滞留在冷凝管中,D项错误。
5.【答案】B
【解析】1mol苯甲酸含有的双键数目为N ,A项错误;1molSiO 晶体含有4molSi-O键,6.0gSiO (0.1mol)含
A 2 2
有的Si-O键数目为0.4N ,B项正确;1LpH=1的H SO 溶液中n(H+)=1L×0.1mol/L=0.1mol,则H+的数目为0.
A 2 4
1N ,C项错误;标准状况下,SO 是非气态,不能用V =22.4L/mol计算,D项错误。
A 3 m
6.【答案】B
【解析】1molX 分子中含有 2mol 碳氧π键,A 项错误;分子 Y 不含手性碳原子,B 项正确;1molX与H 发
2
生加成反应,最多消耗5molH ,酯基不与H 加成,C项错误;X中含有醛基,Y中不含醛基,可以用新制的
2 2
Cu(OH) 悬浊液检验Y中是否含有X,D项错误。
2
7.【答案】C
【解析】A项中H S不能拆写;B项中HClO会氧化SO 2-;D项中不会生成Cu(OH) ,生成的是[Cu(NH₃)₄]²⁺;
2 3 2
C项,加入MgO,消耗FeCl 水解生成的盐酸,促使水解程度增大,生成Fe(OH) 沉淀,C项离子方程式正确。
3 3
8.【答案】C
【解析】Cu+的核外电子排布为1s22s22p63s23p63d10,M层有18个电子,A项正确;晶胞中的4个Cu+,组成是
3
正四面体,B项正确;半径该晶胞的边长为apm,其体对角线为 3apm,Cu+、Br-离子其核之间最短距离 apm,
4
化学参考答案(新高考卷) 第 1 页 (共 7 页)C项错误;根据晶胞结构特点,可以得出该晶胞中含有4个Cu+、4个Br-离子,其所占体积为
4 4 16
πr34 πr34 π(r3 r3)pm3,该晶胞的体积为a3pm3,所以该晶胞中Cu+、Br-离子的空间占有率为
3 1 3 2 3 1 2
16π(r3 r3)
1 2 ×100%,D项正确。
3a3
9.【答案】D
【解析】苯酚与溴水反应生成的三溴苯酚易溶于苯,看不到白色沉淀,A项错误;在铁制镀件上镀铜,铜片做阳
极,铁制镀件做阴极,B项错误;方案丙只能验证非金属性C>Si,不能验证Cl>C,C项错误;由难溶的
ZnS生成了更难溶的CuS,D项正确。
10.【答案】D
【解析】H原子不满足8电子稳定结构,A项错误;键角1的中心C是sp2杂化(键角约为120°),键角2的
中心C是sp3杂化(键角约为109°28′),图中的键角1大于键角2,B项错误;该配合物中的配体只有一种,
是EDTA,Mg2+的配位数是6,C项错误,D项正确。
11.【答案】B
【解析】根据图示结构判断M、N、W、X、Y、Z分别为B、O、F、Al、Si、Cl。硅原子的最外层是3s23p2排布,
3p上有2个未成对的电子,A项正确;Al O 的熔点高于AlCl 的熔点,前者一般看做共价晶体,后者为分子晶
2 3 3
体,B项错误;核外电子排布相同的简单离子,核电荷数越大,半径越小,X(Al3+)<W(F-)<N(O2-),
C项正确;W的简单氢化物为HF,Z的简单氢化物为HCl,HF分子间存在氢键,沸点:HF>HCl,D项正确。
12.【答案】B
【解析】医用酒精中含有水,水也可与钠反应生成H ,A项错误;比较HCOOH和H S的酸性,应选择同浓度
2 2
HCOO−和HS−的盐溶液进行比较,B项正确;向0.1molFeI 的溶液中通入0.1molCl ,无论是Fe2+先反应,还是
2 2
I-先反应,都会生成I ,溶液都会变蓝,不能说明还原性:I->Fe2+,C项错误;过量的KOH也能与AgNO 反
2 3
应产生白色沉淀AgOH,然后迅速变成黑色沉淀AgO,溶液变浑浊,会干扰氯离子的检验,不能说明氯乙烷含
有氯元素,D项错误。
13.【答案】D
【解析】该反应的催化剂是Pd(0)L ,Ⅰ、Ⅱ、Ⅲ为中间产物,A项正确;催化剂Pd(0)L 中的Pd元素是0价,Ⅰ、
2 2
Ⅱ、Ⅲ中Pd元素是+2价,B项正确;Br-C键能小于Cl-C,溴代烃比氯代烃更容易发生偶联反应,C项正确;
B(OH)
2
X 2
R
总反应为 + 2OH- + R 2 + X- + B(OH) -,D项错误。
1 4
1 R
R
14.【答案】D
【解析】电池分析:该装置为电解池,电极N附近产生了H+和Ca2+,电极M附近得到是高纯度的磷酸钙产品,
化学参考答案(新高考卷) 第 2 页 (共 7 页)说明电极N附近的Ca2+通过了“网兜”移动到了电极M附近。电极N是阳极,跟电源的正极连接,A项正确;
电极M、N都没有参与电极反应,都可以是惰性电极,B项正确;从示意图可知,阳极电极反应为2H O-4e-
2
=4H++O ↑,C项正确;钙离子通过了网兜,迁移至电极M处生成Ca (PO ) 产品,说明“网兜”的实际作用
2 3 4 2
并不是阴离子交换膜,D项错误。
15.【答案】D
c(B) c(HA) c(HA)
【解析】根据平衡常数K不变可知,当1g 增大时[即c(H+)减小],1g 增大,1g 减小,所
c(HB) c(H A) c(A2 )
2
c(HA) c(HA) c(B) c(B)
以L 和L 分别表示1g 和1g 随1g 变化的图像。根据图象,当1g =0时[即
1 2 c(H A) c(A2 ) c(HB) c(HB)
2
c(HA) c(HA) c(HA)c(H) c(H A)
c(B-)=c(HB)],1g =1.2,即 =101.2,由K (H A)= 得c(H+)=K (H A) 2 =
c(H A) c(H A) a1 2 c(H A) a1 2 c(HA)
2 2 2
c(B)c(H) c(B) c(HA)
1.0×10-3×10-1.2=10-4.2,则K (HB)= =c(H+)=10-4.2,A项错误。当1g =0时,1g =3.4,
a c(HB) c(HB) c(A2 )
c(A2 )c(H) K
c(H+)=10-4.2,则K (H A)= =10-3.4×10-4.2=10-7.6,HA-的水解平衡常数K = w =10-14×103=10-11,
a2 2 c(HA) h2 K
a1
c(HA)
K <K (H A),则NaHA溶液中HA-的电离程度大于水解,溶液呈酸性,B项错误。P点溶液,1g =
h2 a2 2
c(H A)
2
c(HA)
1g ,即c(H A)=c(A2-),根据电荷守恒得①:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(B-)+c(OH-),根据Na A的物
2 2
c(A2 )
料守恒得②:c(Na+)=2×[c(A2-)+c(HA-)+c(H A)],将②代入①得③:c(HA-)+2c(H A)+c(H+)=c(B-)+c(OH-),再将
2 2
c(H A)=c(A2-)代入③得:c(HA-)+2c(A2-)+c(H+)=c(B-)+c(OH-),C项错误。根据前面的相关数据可以得出:
2
K (H A)>K (HB)>K (H A),即酸性强弱关系:H A>HB>HA-,故Na A溶液中滴入足量HB溶液的离子方程
a1 2 a a2 2 2 2
式为A2-+HB=HA-+B-,D项正确。
16.(14分)
【答案】
(1)第四周期第ⅡA族(1分)
(2)CaO+H O+2NH +=Ca2++2NH ·H O(2分) a(2分)
2 4 3 2
(3)MgO(2分)
(4)7.0(2分,填“7”也给分) pH约为7.0时,碳酸钙产率最高,pH低于7时(继续通入CO ),
2
发生CaCO +CO +H O=Ca2++2HCO -,CaCO 产率降低(2分)
3 2 2 3 3
(5)CO 、NH Cl、NH ·H O(3分,漏写1个扣1分,写错不得分)
2 4 3 2
化学参考答案(新高考卷) 第 3 页 (共 7 页)【解析】
(1)钙是20号元素,在元素周期表的第四周期第ⅡA族。
(2)常温下,NH Cl溶液浸取CaO发生反应CaO+H O=Ca(OH) 和Ca(OH) +2NH Cl=CaCl +2NH ·H O,其总反
4 2 2 2 4 2 3 2
应的离子方程式为CaO+H O+2NH +=Ca2++2NH ·H O。“氨浸1”过程,需要溶解Ca(OH) ,“氨浸2”过程,
2 4 3 2 2
需要溶解Mg(OH) ,再结合两者的K 大小和表达式可判断,“氨浸1”过程碱性更强,pH更大。
2 sp
(3)根据流程可判断,“滤渣1”主要成分是MgO,还有少量杂质。
(4)根据图判断,CaCO 产率最高(即“碳化”效果最好)时,对应的pH约为7.0;pH低于7时(继续通入CO ),
3 2
发生CaCO +CO +H O=Ca2++2HCO -,整体来看,CaCO 产率在降低。
3 2 2 3 3
(5)白云石煅烧会生成CO ,“沉镁”过程会生成NH Cl,氨浸1和氨浸2生成NH ·H O,再结合流程图可知,
2 4 3 2
可循环利用的物质是CO 、NH Cl和NH ·H O。
2 4 3 2
17.(13分)
【答案】
(1)5H C O +6H++2MnO -=10CO ↑+2Mn2++8H O(2分)
2 2 4 4 2 2
(2)H SO (2分)
2 4
(3)d(2分)
(4)酸式(1分) 偏小(2分)
FeSO 标准溶液放置时间长,部分亚铁离子被溶液中的O 氧化了(2分)
4 2
(5)97.6(2分)
【解析】
(1)反应为酸性高锰酸钾氧化草酸根且有 CO 气体产生,离子方程式为 5H C O +6H++2MnO -=10CO ↑
2 2 2 4 4 2
+2Mn2++8H O。
2
(2)实验室使用的酸性KMnO 溶液一般是用硫酸来酸化。
4
(3)溶液冷却需要用到烧杯,定容需要用到容量瓶和胶头滴管,步骤Ⅱ中不会用到滴定管。
(4)FeSO 标准溶液呈酸性,应该装在酸式滴定管中;开始时滴定管读数正确,结束时仰视,则FeSO 标准溶
4 4
液体积读数会偏大,滴定实验消耗的KMnO 的量偏大,实验中KMnO 的总量一定,则实验I中消耗的KMnO
4 4 4
的量偏小,则测得草酸钴晶体样品的纯度会偏小。若某次所测草酸钴晶体样品的纯度的误差也是偏小,实验操
作和读数也均无误,可能是FeSO 标准溶液没有现配,放置时间长,部分亚铁离子被溶液中的O 氧化了。
4 2
18.03mL17.97mL
(5)消耗FeSO 溶液体积的第一组数据误差较大,计算要舍去,V(FeSO )= =18.00mL,
4 4
2
1
根据离子方程式:5Fe2++8H++MnO -=5Fe3++Mn2++4H O可知滴定过程消耗MnO -的物质的量为 ×18×10-3L×
4 2 4
5
0.1000mol/L=3.6×10-4mol,则实验步骤I中消耗的MnO -的物质的量为0.01mol-10×3.6×10-4mol=0.0064mol,根
4
化学参考答案(新高考卷) 第 4 页 (共 7 页)据步骤I中离子方程式5H C O +6H++2MnO -=10CO ↑+2Mn2++8H O可知,晶体样品中CoC O ·2H O的物质
2 2 4 4 2 2 2 4 2
5 0.016mol183g/mol
的量为 ×0.0064mol=0.016mol,则草酸钴晶体样品的纯度= ×100%=97.6%。
2 3.0000g
18.(14分)
【答案】
(1)+128.1(2分)
(2) ①A(2分) 随着投料比增大,平衡正向移动,甲醇的平衡转化率升高(2分)
②66.7(2分) 3200(2分)
(3)无(2分) *CH O+*H=*CH O+*2H(2分,或*CH O=*CH O+*H)
3 2 3 2
【解析】
(1)根据盖斯定律可知ΔH=ΔH-ΔH -2ΔH =-726.5kJ/mol-(-283kJ/mol)-2×(-285.8kJ/mol)=+128.1kJ/mol。
1 2 3
(2)①随着投料比增大(可以看做甲醇的量不变,Ar的量在增大),由于总压强不变,所以相当于体积在增大,
导致甲醇的分压在减小,平衡正向移动,甲醇的转化率在升高,故曲线A表示CH OH(g)的平衡转化率,曲线
3
B表示H 的分压p(H )。
2 2
②当x=1时,可看做n(Ar)=1mol,n(CH OH)=1mol,看图可知此时H 的分压p(H )=40kPa。设生成的CO的物
3 2 2
质的量为a mol,
CH OH(g) CO(g)+2H (g)
3 2
起始(mol) 1 0 0
转化(mol) a a 2a
平衡(mol) 1-a a 2a
平衡时,气体总物质的量=n(Ar)+n(CH OH)+n(CO)+n(H )=1mol+(1-a)mol+a mol+2a mol=2(1+a)mol,
3 2
2a 2
根据H 的分压p(H )=40kPa=100kPa× ,a= ,CH OH(g)的平衡转化率=66.7%。CO的分压p(CO)=10
2 2 3
2(1a) 3
2 4 1
3 3 3
0kPa× =20kPa,H 的分压p(H )=100kPa× =40kPa,CH OH的分压p(CH OH)=100kPa×
2 2 3 3
2 2 2
2(1 ) 2(1 ) 2(1 )
3 3 3
p2(H ) p(CO) (40kPa)2( 20kPa)
=10kPa,该反应的压强平衡常数K = 2 = =3200(kPa)2。
p
p(CH OH) 10kPa
3
(3)从历程图或化学方程式均可判断,历程中无C-O键的断裂;活化能最大的一步需要的能量最大,决定了反
应的速率,该步为*CH O+*H=*CH O+*2H。
3 2
19.(14分)
化学参考答案(新高考卷) 第 5 页 (共 7 页)【答案】
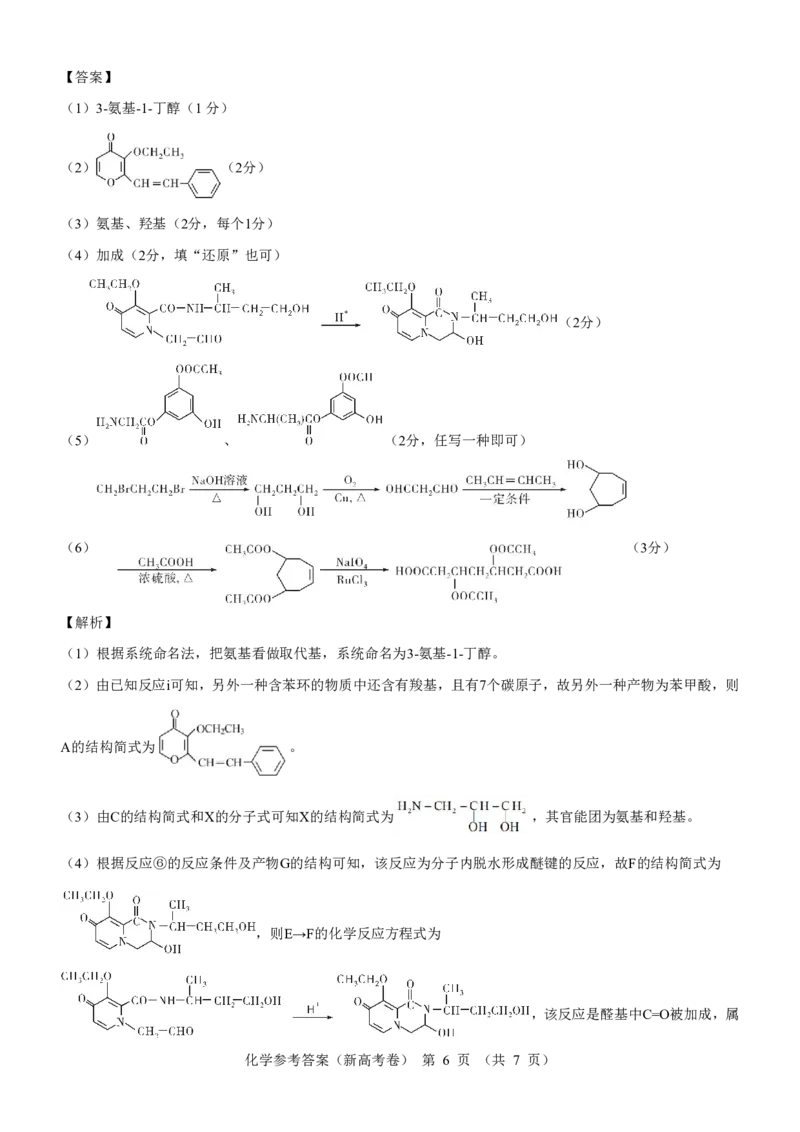
(1)3-氨基-1-丁醇(1分)
(2) (2分)
(3)氨基、羟基(2分,每个1分)
(4)加成(2分,填“还原”也可)
(2分)
(5) 、 (2分,任写一种即可)
(6) (3分)
【解析】
(1)根据系统命名法,把氨基看做取代基,系统命名为3-氨基-1-丁醇。
(2)由已知反应ⅰ可知,另外一种含苯环的物质中还含有羧基,且有7个碳原子,故另外一种产物为苯甲酸,则
A的结构简式为 。
(3)由C的结构简式和X的分子式可知X的结构简式为 ,其官能团为氨基和羟基。
(4)根据反应⑥的反应条件及产物G的结构可知,该反应为分子内脱水形成醚键的反应,故F的结构简式为
,则E→F的化学反应方程式为
,该反应是醛基中C=O被加成,属
化学参考答案(新高考卷) 第 6 页 (共 7 页)于加成反应,也属于还原反应。
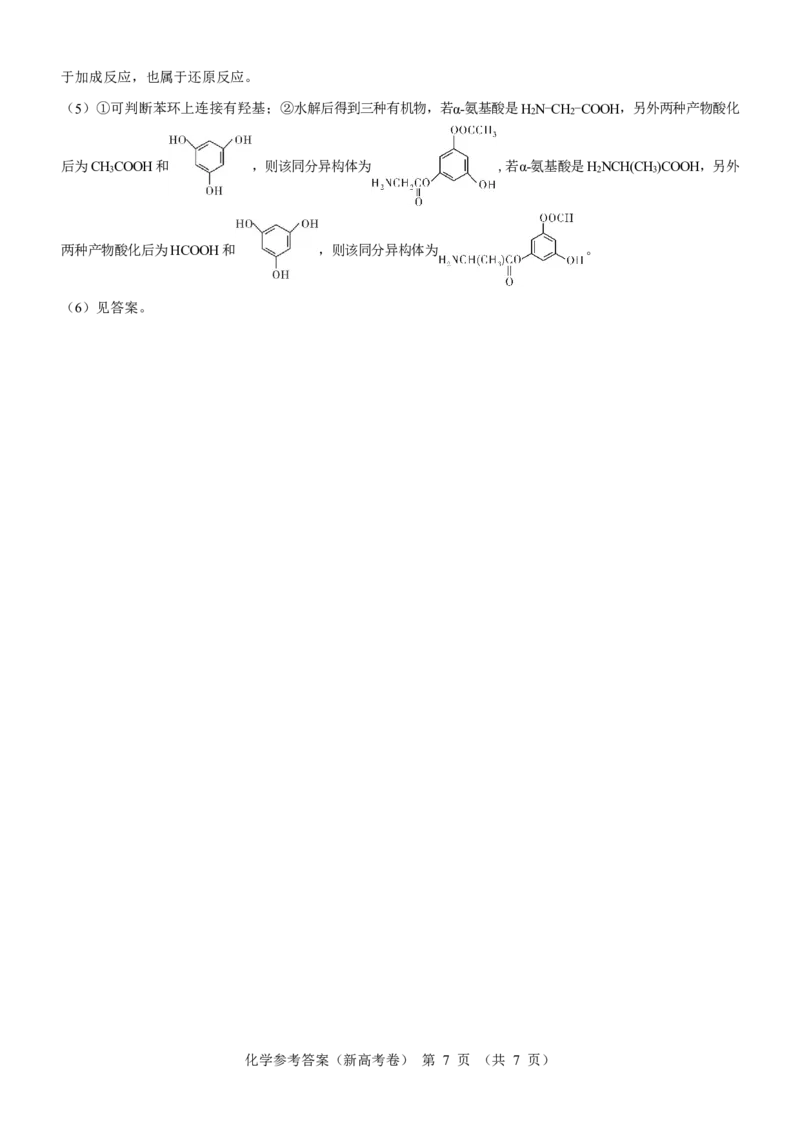
(5)①可判断苯环上连接有羟基;②水解后得到三种有机物,若α-氨基酸是HN-CH-COOH,另外两种产物酸化
2 2
后为CHCOOH和 ,则该同分异构体为 ,若α-氨基酸是HNCH(CH)COOH,另外
3 2 3
两种产物酸化后为HCOOH和 ,则该同分异构体为 。
(6)见答案。
化学参考答案(新高考卷) 第 7 页 (共 7 页)