文档内容
2024届高三第二学期期初学业质量监测
化学
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1. 本试卷共6页,满分100分,考试时间为75分钟。考试结束后,请将答题卷交回。
2. 答题前,请您务必将自己的姓名、准考证号、座位号用0.5毫米黑色字迹签字笔填写在答题卷上。
3. 请认真核对监考员在答题卡上所粘贴的条形码上的姓名、考试证号与你本人的是否相符。
4. 作答选择题必须用2B铅笔把答题卡对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后,再选涂其
它答案。作答非选择题必须用书写黑色字迹的0.5毫米的签字笔写在答题卷上的指定位置,在其它位置作答
一律无效。
可能用到的相对原子质量:H1C12O16
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.耐高温材料广泛应用于工业生产。下列物质中属于耐高温酸性氧化物的是
A.CO B.SiO C.MgO D.
2 2
Al O
2 3
2.侯氏制碱法主要反应之一为 NH +NaCl+H O+CO =NaHCO ↓+NH Cl。下列说法正确的是
3 2 2 3 4
NH
3
A. 电子式:
B.NaHCO 在水溶液中的电离:NaHCO =Na++H++CO2−
3 3 3
C.Na+与 Cl−具有相同的电子层结构
D.NH 与 H O的 VSEPR模型均为四面体
3 2
3.A、B、C、D四种短周期元素,A元素原子的价层电子排布式为 2s22p2,B元素与 A元素位于同一周
期,其原子的核外有三个未成对电子,C元素位于第2周期,电负性仅小于氟,D元素在短周期元素中第一电
离能最小。下列说法正确的是
A.第一电离能:C>B>A
B.原子半径:D>A>B
C.C、D两种元素组成的化合物一定不含共价键
D.简单气态氢化物的热稳定性:B>C
4.下列制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是
A. B. C.
D.
阅读下列材料,完成 5∼7题:
第 1 页
学科网(北京)股份有限公司甲醇是易燃液体,能与水、乙醇、丙酮等混溶。甲醇燃烧热为 726.51KJ⋅mol−1。工业使用原料气
CO、H 气相法合成甲醇的主反应:CO(g)+2H (g)=CH OH(g)ΔH=−90.8KJ⋅mol−1 。有少量 CO
2 2 3 2
存在时,会发生副反应 :CO (g)+H (g)=CO(g)+H O(g)ΔH=+41.3KJ⋅mol−1 。甲醇是一种重要的工
2 2 2
业原料,可用于制备甲醚 CH OCH 甲醛、甲酸等有机物。
3 3
5.下列说法正确的是
A.CO、H 、CO 都属于非极性分子 B.用分液法分离甲醇和丙酮的二元混合物
2 2
C.甲醇和二甲醚互为同分异构体 D.甲醇和二氧化碳分子中碳原子杂化方式不同
6.下列化学反应或转化过程表示正确的是
A.CH OH燃烧热的热化学方程式;
3
CH OH(l)+❑ 3O (g)=CO (g)+2H O(g)ΔH=−726.51KJ⋅mol−1
3 2 2 2 2
B.气相法合成甲醇的副反应:CO (g)+H (g)=CO(g)+H O(g)ΔS=0
2 2 2
浓硫酸
C.实验室由甲醇制备二甲醚:2CH OH → CH OCH +H O
3 3 3 2
Δ
氧气
新制氢氧化铜 →
D.甲醇转化为甲酸 CH OH → HCHO催化剂,△HCOOH
3
△
7.下列物质结构与性质或物质性质与用途具有对应关系的是
A.甲醇分子间能形成氢键,可与水任意比例互溶
B.CO具有氧化性,可用于冶金工业
C.干冰能溶于水,可用作制冷剂
D.二甲醚具有可燃性,可用作燃料
8.微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法正确的是
A.电极 a极为该电池的正极
B.放电过程中 a极附近溶液 pH增大
C.电极 b极的电极反应式为 [Fe(CN) ] 4− −e−=[Fe(CN) ] 3−
6 6
D.每消耗 23gCH CH OH,,理论上会有 6molH+通过质子交换膜移向 b极
3 2
9.金属硫化物 (M S )催化反应 CH (g)+2H S(g)⇌CS (g)+4H (g)ΔH,T∘C,平衡常数为 K。该
X Y 4 2 2 2
反应既可以除去天然气中的 H S,又可以获得 H 。下列说法正确的是
2 2
第 2 页
学科网(北京)股份有限公司c(CS )⋅c4 (H )
A.T∘C时,若 2 2 v
c(CH )⋅c2 (H S) 正 逆
4 2
B.选择金属硫化物 (M S )作催化剂可以提高活化分子百分数,ΔH减少
X Y
C.题图所示的反应机理中,升高温度,步骤I中催化剂吸附 H S的能力一定增强
2
D.该反应中每消耗 1molH S,转移电子的数目约为 2×6.02×1023
2
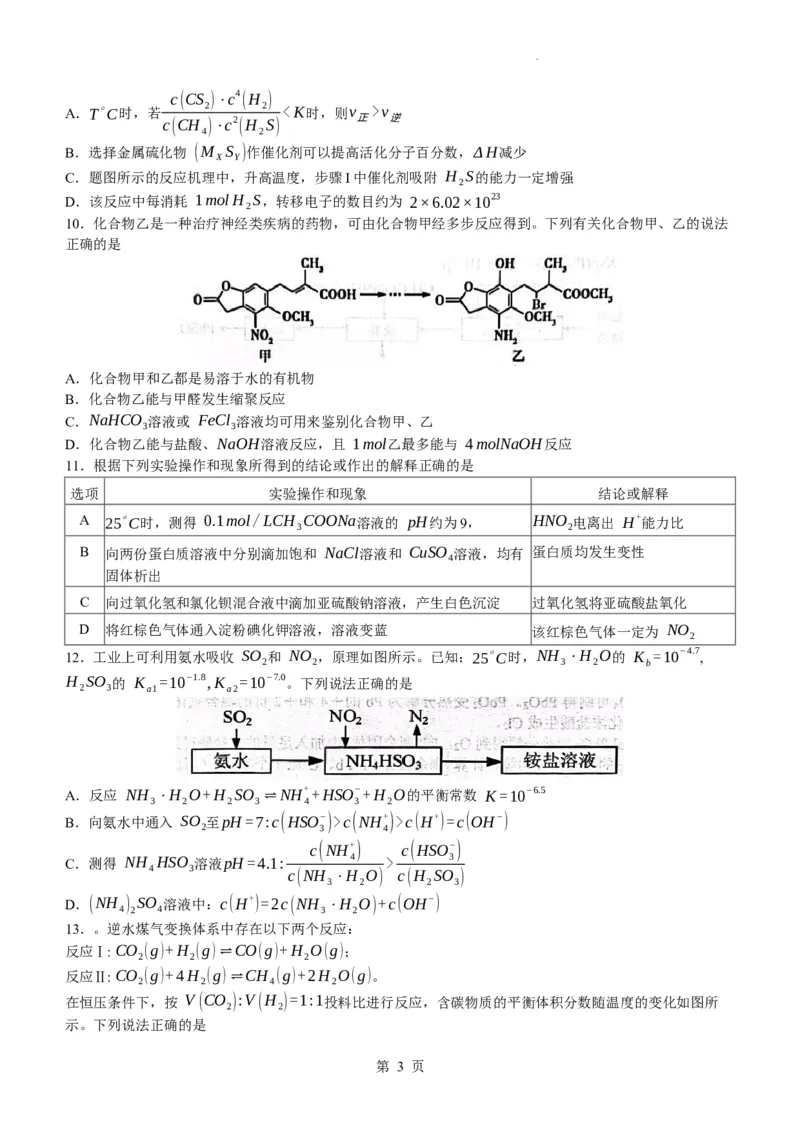
10.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法
正确的是
A.化合物甲和乙都是易溶于水的有机物
B.化合物乙能与甲醛发生缩聚反应
C.NaHCO 溶液或 FeCl 溶液均可用来鉴别化合物甲、乙
3 3
D.化合物乙能与盐酸、NaOH溶液反应,且 1mol乙最多能与 4molNaOH反应
11.根据下列实验操作和现象所得到的结论或作出的解释正确的是
选项 实验操作和现象 结论或解释
A 25∘C时,测得 0.1mol/LCH COONa溶液的 pH约为9, HNO 电离出 H+能力比
3 2
B 向两份蛋白质溶液中分别滴加饱和 NaCl溶液和 CuSO 溶液,均有 蛋白质均发生变性
4
固体析出
C 向过氧化氢和氯化钡混合液中滴加亚硫酸钠溶液,产生白色沉淀 过氧化氢将亚硫酸盐氧化
D 将红棕色气体通入淀粉碘化钾溶液,溶液变蓝 该红棕色气体一定为 NO
2
12.工业上可利用氨水吸收 SO 和 NO ,原理如图所示。已知:25∘C时,NH ⋅H O的 K =10−4.7 ,
2 2 3 2 b
H SO 的 K =10−1.8,K =10−7.0 。下列说法正确的是
2 3 a1 a2
A.反应 NH ⋅H O+H SO ⇌NH++HSO−+H O的平衡常数 K=10−6.5
3 2 2 3 4 3 2
B.向氨水中通入 SO 至pH=7:c(HSO−)>c(NH+)>c(H+)=c(OH−)
2 3 4
c(NH+) c(HSO−)
C.测得 NH HSO 溶液pH=4.1: 4 > 3
4 3
c(NH ⋅H O) c(H SO )
3 2 2 3
D.(NH ) SO 溶液中:c(H+)=2c(NH ⋅H O)+c(OH−)
4 2 4 3 2
13.。逆水煤气变换体系中存在以下两个反应:
反应Ⅰ: CO (g)+H (g)⇌CO(g)+H O(g);
2 2 2
反应Ⅱ: CO (g)+4H (g)⇌CH (g)+2H O(g)。
2 2 4 2
在恒压条件下,按 V(CO ):V(H )=1:1投料比进行反应,含碳物质的平衡体积分数随温度的变化如图所
2 2
示。下列说法正确的是
第 3 页
学科网(北京)股份有限公司A.反应CO(g)+3H (g)⇌CH (g)+H O(g)ΔH>0
2 4 2
B.M点反应Ⅰ的平衡常数 K约为1
C.加入合适的催化剂可由 N点到 P点
D.500∘C后,温度升高,反应Ⅰ的改变程度大于反应Ⅱ导致 CO 转化率明显减小
2
二、非选择题:共4题,共61分。
14.(14分)电解锰渣主要含 MnO 、PbSO 、Fe (SO ) 、SiO 。利用电解锰渣回收铅的工艺如下图
2 4 2 4 3 2
所示[已知:Ksp(PbSO )=2.6×10−3 ]:
4
(1)关于电解锰渣回收铅的工艺
①“还原酸浸”时,Fe (SO ) 氧化 PbS生成 S的离子方程式为 。
2 4 3
②“浸出液”含有的盐类主要有 FeSO 和 (填化学式)。
4
③从平衡移动的角度分析“浸铅”反应发生的原因: 。
(2)利用 PbSO 可制备 PbCrO 。以 PbSO 、Na Cr O 和 NaOH为原料,通过混合后进行沉淀转化
4 4 4 2 2 7
可制得 PbCrO 。已知:PbCrO 的产率随 pH的变化如图1所示。
4 4
①制备 PbCrO 时,控制 pH约为8的原因是 。
4
②设计如图装置(均为惰性电极)电解 Na Cr O 溶液制取 Na CrO 。图中右侧电极产生的气体为
2 2 7 2 4
。
(3)利用 PbSO 可制得 PbO 。PbO 受热分解为 Pb的 +4和 +2价的混合氧化物, +4价的Pb能氧化
4 2 2
浓盐酸生成 Cl 。
2
现将 1molPbO 加热分解得到 O ,向“剩余固体”中加入足量的浓盐酸得到 Cl 。生成的O 和 Cl 的物
2 2 2 2 2
质的量相等。计算“剩余固体”中 Pb、O原子个数比。(写出计算过程)
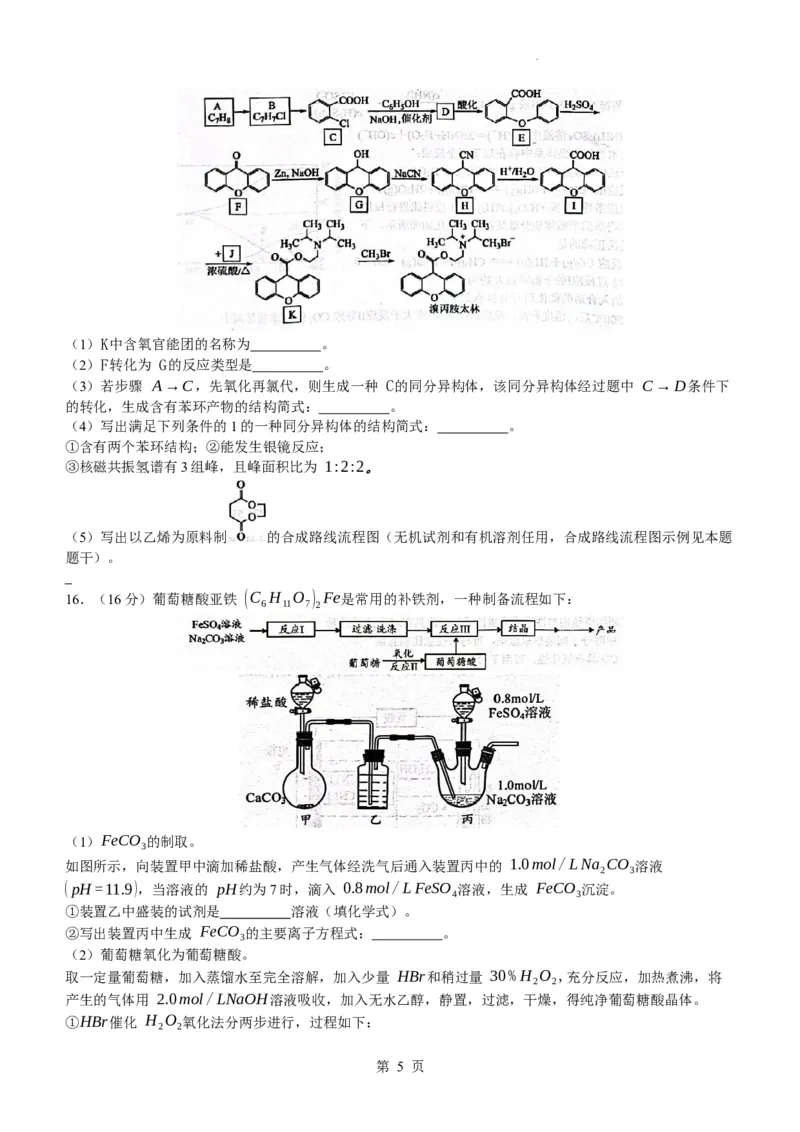
15.(15分)溴丙胺太林是辅助治疗十二指肠溃疡的药物,其合成路线如图所示:
第 4 页
学科网(北京)股份有限公司(1)K中含氧官能团的名称为 。
(2)F转化为 G的反应类型是 。
(3)若步骤 A→C,先氧化再氯代,则生成一种 C的同分异构体,该同分异构体经过题中 C→D条件下
的转化,生成含有苯环产物的结构简式: 。
(4)写出满足下列条件的1的一种同分异构体的结构简式: 。
①含有两个苯环结构;②能发生银镜反应;
③核磁共振氢谱有3组峰,且峰面积比为 1:2:2。
(5)写出以乙烯为原料制 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题
题干)。
16.(16分)葡萄糖酸亚铁 (C H O ) Fe是常用的补铁剂,一种制备流程如下:
6 11 7 2
(1)FeCO 的制取。
3
如图所示,向装置甲中滴加稀盐酸,产生气体经洗气后通入装置丙中的 1.0mol/LNa CO 溶液
2 3
(pH=11.9),当溶液的 pH约为7时,滴入 0.8mol/LFeSO 溶液,生成 FeCO 沉淀。
4 3
①装置乙中盛装的试剂是 溶液(填化学式)。
②写出装置丙中生成 FeCO 的主要离子方程式: 。
3
(2)葡萄糖氧化为葡萄糖酸。
取一定量葡萄糖,加入蒸馏水至完全溶解,加入少量 HBr和稍过量 30%H O ,充分反应,加热煮沸,将
2 2
产生的气体用 2.0mol/LNaOH溶液吸收,加入无水乙醇,静置,过滤,干燥,得纯净葡萄糖酸晶体。
①HBr催化 H O 氧化法分两步进行,过程如下:
2 2
第 5 页
学科网(北京)股份有限公司第一步:
第二步:C H O +HBrO=C H O +HBr
6 12 6 6 12 7
写出第一步反应的化学方程式: 。
②加热煮沸的作用是 。
(3)用酸性 KMnO 溶液测定葡萄糖酸亚铁晶体中 Fe2+含量,进而计算出晶体的纯度。
4
①请补充完整测定葡萄糖酸亚铁晶体中 Fe2+含量的实验方案;准确称取一定质量的葡萄糖酸亚铁晶体样
品,用稀硫酸溶解,配制成 100mL溶液, 。
【须使用的仪器和药品:酸式滴定管(规格 25mL),锥形瓶,0.0100mol/L的 KMnO 标准溶液】
4
②发现纯度总是大于 100%。若实验操作和计算均正确,其可能原因是 。
17.(16分) NO是环境污染物。
(1)消除 NO转化为游离态的氮。
氮元素的单质有 N 、N 、N 、N 分子有多种结构,一种 N 分子中4个氮原子在同一平面上,N 的结
2 4 8 4 4 4
构式为 。
(2)以氨气为原料脱硝除去 NO。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:2H (g)+O (g)=2H O(g)ΔH =−484kJ⋅mol−1
2 2 2 1
4NH (g)+3O (g)=2N (g)+6H O(g) ΔH =−1266kJ⋅mol−1
3 2 2 2 2
则 N (g)+3H (g)⇌2NH (g)的 ΔH= kJ⋅mol−1。
2 2 3
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 Fe−TiO xH 双催化剂,通过光
2 y
辐射产生温差(如体系温度为 495∘C时,Fe的温度为 547∘C,而TiO −xH 的温度为 415∘C)。结合图
2 y
1示解释该双催化剂的工作原理是 。
(3)以丙烯为原料脱硝除去 NO。
研究表明催化剂添加助剂后催化活性提高的原因是形成活性 O2与反应,图2为丙烯脱硝机理。
①图2中,甲为 。(用化学式表示)
②若参加反应的丙烯与 NO物质的量之比为 1:2,则反应的化学方程式为 。
(4)以 H O 为原料脱硝除去 NO。
2 2
烟气中的 NO与 O 反应缓慢。雾化后的 H O 在催化剂中 Fe元素作用下可以产生具有极强氧化活性的
2 2 2
⋅OH(羟基自由基),⋅OH能将 NO快速氧化为 NO 、HNO 等物质。 H O 在一种固体催化剂表面转
2 3 2 2
化的过程如图3所示:
①图3所示,过程 (1)可描述为 。
②化学式为 LaFeO 的催化剂中,Fe3+和 Fe2+的物质的量之比为 。
2.7
第 6 页
学科网(北京)股份有限公司