文档内容
江苏省扬州中学2024届高三第二学期阶段练习
化学试题
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Na-23 K-39 Cr-52 Ba-137
一、 单项选择题:共13题,每题3分,共39分。每小题只有一个选项最符合题意。
1.化学和生活、科技、社会发展息息相关,下列说法正确的是
A.火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为FeO
B.三星堆黄金面具出土时光亮且薄如纸,说明金不活泼和有良好的延展性
C.“酒曲”的酿酒工艺,是利用了催化剂使平衡正向移动的原理
D.医用外科口罩使用的材料聚丙烯,能使酸性高锰酸钾溶液褪色
2.亚硝酰氟(FNO)是一种工业稳定剂,可通过反应NO +CsF=FNO+CsNO 制得。下列说
2 4 3
法正确的是
A.氧原子基态价电子轨道表达式为
B.CsF的电子式为
C.FNO的空间构型为直线形 D.CsNO 中含有离子键与共价键
3
3. 下列由废催化剂(主要含FeBr 及少量溴、苯)制取无水FeCl 的实验装置与原理能达到
3 3
实验目的的是
A. 用装置甲制取氯气 B. 用装置乙氧化FeBr 溶液中的溴离子
3
C. 用装置丙分离出FeCl 溶液 D. 用装置丁蒸干溶液可得无水FeCl
3 3
4.某含锰着色剂的化学式为 ,Y、X、Q、Z为原子序
数依次增大的短周期元素,其中 具有正四面体空间结构,结构如图所示。下列说法正确的是
A.第一电离能: B.键角:
C.简单氢化物沸点: D.最高价氧化物对应的水化物酸性:
阅读下列材料,回答5~7题:
ⅤA族氮、磷、砷(As)、锑(Sb)元素及其化合物应用广泛。氨是重要的化工原料,广泛用
于生产铵盐、硝酸、纯碱、医药等;肼( )的燃烧热为 ,是常用的火箭燃
料。白磷( )晶胞如图所示,P元素可形成多种含氧酸,其中次
磷酸( )为一元弱酸, 为三元中强酸。雌黄
(As S)和SnCl 在盐酸中反应转化为雄黄(As S)和SnCl (沸点114 ℃)并放出HS
2 3 2 4 4 4 2
气体。锑是带有银色光泽的灰色金属,铅锑合金一般用作铅蓄电池的负极材料。
5.下列说法正确的是
A.PCl 是由极性键形成的非极性分子
3
B. 易液化是由于 与 分子间形成氢键
C.ⅤA族元素单质的晶体类型相同
D.白磷晶体中1个 分子周围有12个紧邻的 分子
6.下列化学反应表示正确的是
A.NO 制HNO 的离子方程式:3NO +HO===2HNO +NO
2 3 2 2 3
B.次磷酸与足量NaOH溶液反应:C.肼燃烧的热化学方程式: ;
D.雌黄制备雄黄的化学方程式:2As S+2SnCl +4HCl===AsS+2SnCl +2HS↑
2 3 2 4 4 4 2
7.下列物质的性质与用途具有对应关系的是
A. 易分解,可用作氮肥
B.氨气易液化,可用于工业制硝酸
C. 具有脱水性,可用于实验室乙醇制取乙烯
D.铅锑合金导热性好,可用作铅蓄电池的电极材料
8.如图为一种酶生物电池,可将葡萄糖(C H O)转化为葡萄糖内酯(C H O),两个碳纳
6 12 6 6 10 6
米管电极材料由石墨烯片层卷曲而成。下列说法不正确的是
A.图中的离子交换膜为阳离子交换膜
B.负极区发生的电极反应主要为
C.碳纳米管有良好导电性能,且能高效吸附气体
D.理论上消耗标况下2.24LO ,可生成葡萄糖内酯0.2mol
2
9. 异甘草素具有抗肿瘤、抗病毒等药物功效。合成中间体Z的部分路线如图:
下列有关化合物X、Y和Z的说法正确的是A. 1molZ中含有6mol碳氧σ键
B. X分子中的所有原子一定共平面
C. Y能发生加成、氧化和消去反应
D. Z与足量的氢气加成后的产物分子中含有3个手性碳原子
10. 利用如下流程可从废光盘中回收金属层中的银(金属层中其他金属含量过低,对实验
影响可忽略):
已知:NaClO溶液在加热时易分解生成NaCl和 。下列说法正确的是
的
A. 若省略第一次过滤,会使氨水 用量增加
B. “氧化”时,发生的化学方程式:
C. 若“还原”工序利用原电池来实现,则 是正极产物
D. “还原”时,每生成1molAg,理论上消耗
11.室温下,下列实验方案能达到探究目的的是( )
选
探究方案 探究目的
项
该反应是否为可逆反
A 向 溶液中滴加 溶
应
液,充分反应后,滴加KSCN溶液,观察现象
B
用pH计分别测定的 溶液和 溶液 探究键的极性对羧酸
酸性的影响
的pH
向 溶 液 中 滴 加 2 滴
比较 与
C
,观察现象。振荡试管,再滴加2滴
的大小
溶液,观察现象
向CO还原FeO 所得到的产物中加入稀盐酸,滴加KSCN
D 2 3 FeO 全部被还原
溶液,观察颜色变化 2 312. 已知室温下, ,
用氨水吸收 并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可
忽略。下列说法正确的是
序号 实验操作和现象
实验1 向10 mL 0.1 mol·L 氨水中通入0.0005 mol ,测得反应后溶液
实验2 向“实验1”所得溶液中继续通入0.0005 mol ,测得反应后溶液
实验3 取“实验2”所得溶液,向其中加入过量 溶液,产生白色沉淀
实验4 取“实验2”所得溶液,向其中加入 至溶液
A. “实验1”得到的溶液中:
B. 实验2”得到的溶液中:
C. “实验3”发生反应的离子方程式:
D. “实验4”得到的溶液中:
13.用草酸二甲酯 (H COOCCOOCH )和氢气为原料制备乙二醇的反应原理如下:
3 3在 条件下,将氢气和草酸二甲酯体积比(氢酯比)
为 的混合气体以一定流速通过装有催化剂的反应
管,草酸二甲酯的转化率、产物的选择性与温度的关系
如下图所示。产物的选择性
。下列说法不正确的是
A.曲线I表示草酸二甲酯的转化率随温度的变化
B.其他条件不变,在 温度范围,随着温度升高,出口处乙醇酸甲酯的量不
断增大
C.其他条件不变,增大压强或升高温度,草酸二甲酯的平衡转化率均增大
D.其他条件不变,在 温度范围,随着温度升高,出口处甲醇和乙二醇的
物质的量之比 逐渐减小且大于2
二、 非选择题:共4题,共61分。
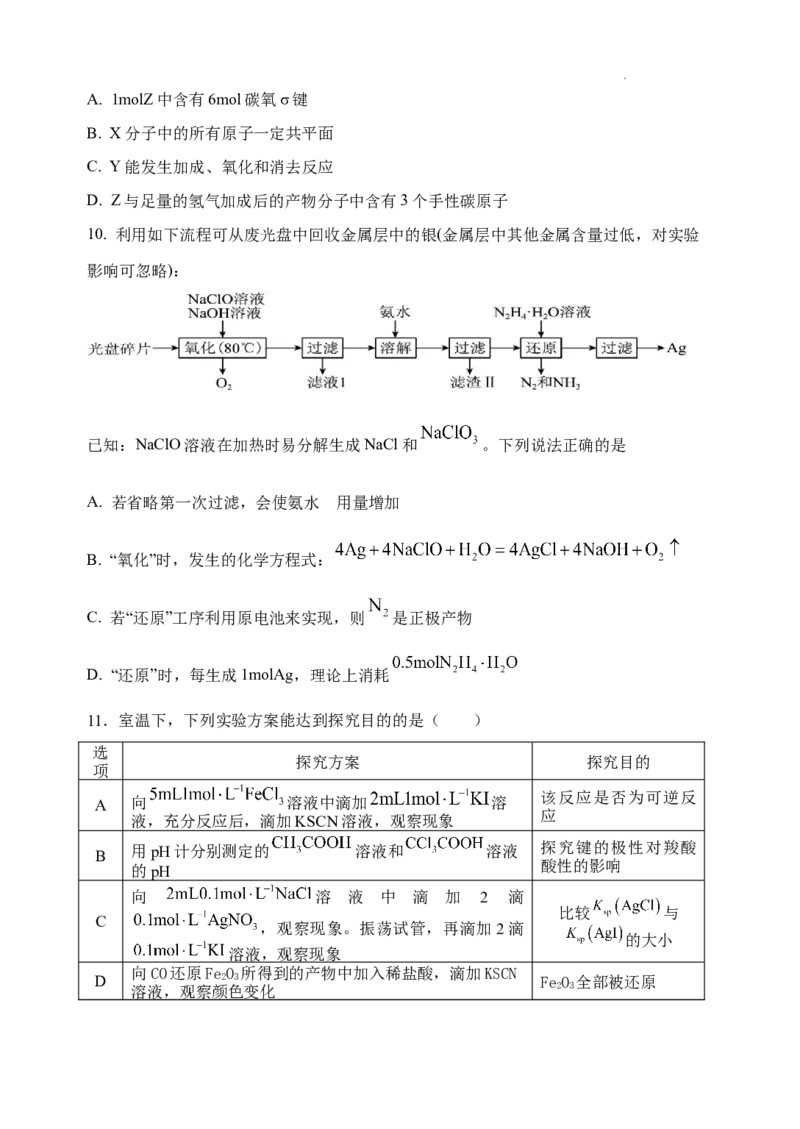
14. 金属铼(Re)广泛应用于国防、石油化工以及电子制造等领域,铼可通过还原高铼酸铵
(NH ReO)制备。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流
4 4
程如下图所示。
(1)为了提高“焙烧”过程的效率,可以采取的措施为_____(回答任意两点)。“焙烧”
过程加入生石灰,有效解决了SO 的危害,则ReS 转化为Ca(ReO ) 的方程式为_____。
2 2 4 2
(2)“萃取”机理为:R N+H++ReO =R N·HReO ,则“反萃取”所用试剂X为_____。
3 3 4
(3)如图表示萃取液流速与铼吸附率关系,萃取剂流
速宜选用的范围是6~8BV/h,选择此范围的原因是_____。
(4)已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是_____。
(5)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,
利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因_____。
物质 熔点(℃) 沸点(℃)
Re 3180 5900
C 3652 4827
Fe 1535 2750
(6)三氧化铼晶胞如下图所示(小黑点代表铼或氧原子),铼原子填在
了氧原子围成的_____(填“四面体”“立方体”或“八面体”)空隙中。
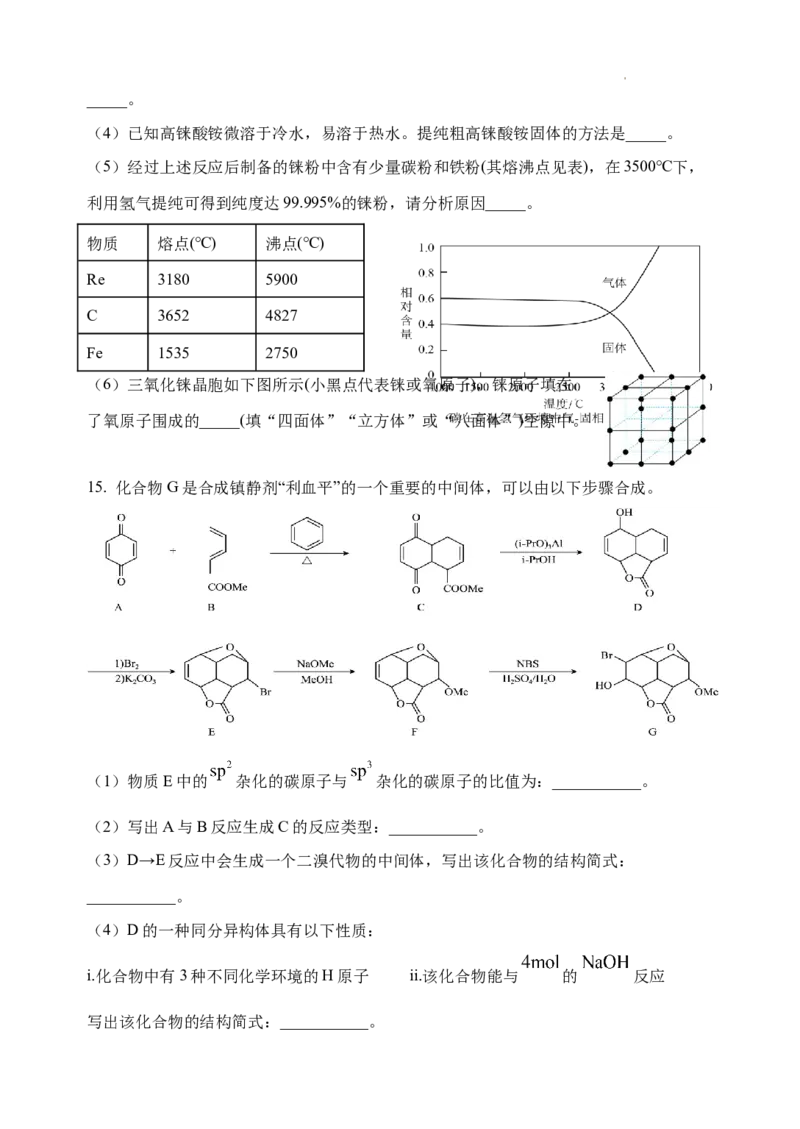
15. 化合物G是合成镇静剂“利血平”的一个重要的中间体,可以由以下步骤合成。
(1)物质E中的 杂化的碳原子与 杂化的碳原子的比值为:___________。
(2)写出A与B反应生成C的反应类型:___________。
(3)D→E反应中会生成一个二溴代物的中间体,写出该化合物的结构简式:
___________。
(4)D的一种同分异构体具有以下性质:
i.化合物中有3种不同化学环境的H原子 ii.该化合物能与 的 反应
写出该化合物的结构简式:___________。(5)结合题干信息,写出以乙烯和环戊二烯( )为原料制备产率较高的
的合成路线图___________(无机试剂和流程中的有机试剂任用,合成路线
流程图示例见本题题干)。
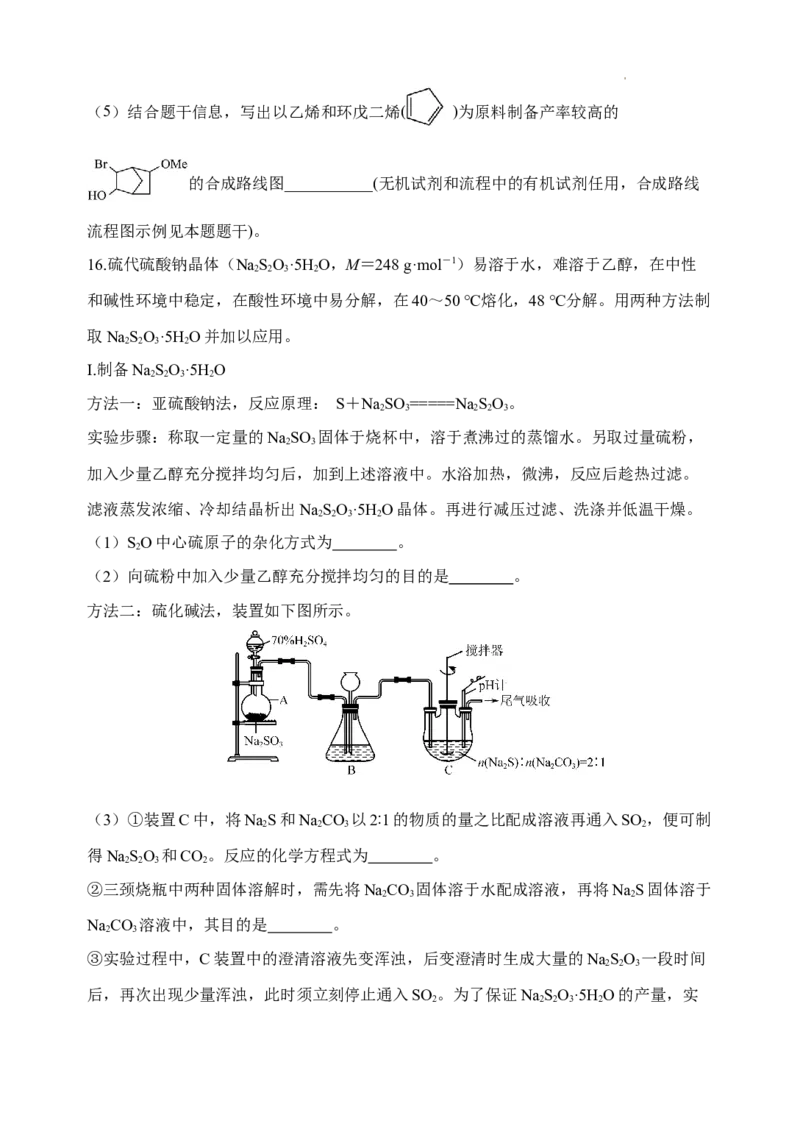
16.硫代硫酸钠晶体(NaSO·5H O,M=248 g·mol-1)易溶于水,难溶于乙醇,在中性
2 2 3 2
和碱性环境中稳定,在酸性环境中易分解,在40~50 ℃熔化,48 ℃分解。用两种方法制
取NaSO·5H O并加以应用。
2 2 3 2
Ⅰ.制备NaSO·5H O
2 2 3 2
方法一:亚硫酸钠法,反应原理: S+NaSO =====NaSO。
2 3 2 2 3
实验步骤:称取一定量的NaSO 固体于烧杯中,溶于煮沸过的蒸馏水。另取过量硫粉,
2 3
加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。
滤液蒸发浓缩、冷却结晶析出NaSO·5H O晶体。再进行减压过滤、洗涤并低温干燥。
2 2 3 2
(1)SO中心硫原子的杂化方式为 。
2
(2)向硫粉中加入少量乙醇充分搅拌均匀的目的是 。
方法二:硫化碱法,装置如下图所示。
(3)①装置C中,将NaS和NaCO 以2∶1的物质的量之比配成溶液再通入SO ,便可制
2 2 3 2
得NaSO 和CO。反应的化学方程式为 。
2 2 3 2
②三颈烧瓶中两种固体溶解时,需先将NaCO 固体溶于水配成溶液,再将NaS固体溶于
2 3 2
NaCO 溶液中,其目的是 。
2 3
③实验过程中,C装置中的澄清溶液先变浑浊,后变澄清时生成大量的NaSO 一段时间
2 2 3
后,再次出现少量浑浊,此时须立刻停止通入SO 。为了保证NaSO·5H O的产量,实
2 2 2 3 2验中通入的SO 不能过量,原因是 。
2
Ⅱ. Na SO 的应用
2 2 3
(4)某消毒液中含有ClO 和Cl 两种主要成分。请补充完整用NaSO 标准溶液测定该消
2 2 2 2 3
毒液中ClO 含量的实验方案:量取5.00 mL消毒液于锥形瓶中,加蒸馏水稀释到25.00
2
mL,____________________________________
,重复实验2~3次,取实验平均值计算ClO 含量。
2
已知:① 2ClO +2KI===2KClO +I;
2 2 2
② KClO +4KI+2HSO ===KCl+2KSO +2I+2HO,该反应在pH=3时进行;
2 2 4 2 4 2 2
③ 2Na SO+I===Na SO+2NaI。
2 2 3 2 2 4 6
(须使用的试剂: 0.100 0 mol·L-1 Na SO 标准溶液、淀粉溶液、KI溶液、稀硫
2 2 3
酸)
(5) 设计以下实验测定粗产品中NaSO·5H O的含量:
2 2 3 2
步骤1:准确称取8.000 0 g样品溶于水,配成100 mL溶液。
步骤2:准确称取0.294 0 g KCr O 固体于碘量瓶中,加入20 mL蒸馏水溶解,再加入10
2 2 7
mL 2 mol·L-1 HSO 和20 mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100
2 4
mL。
步骤3:向碘量瓶中加入1 mL 1%淀粉,用待测NaSO 溶液滴定碘量瓶中溶液至滴定终
2 2 3
点,消耗NaSO 溶液20.00 mL。(已知:I+2SO===2I-+SO)
2 2 3 2 2 4
试计算NaSO·5H O的纯度。(写出计算过程)
2 2 3 2
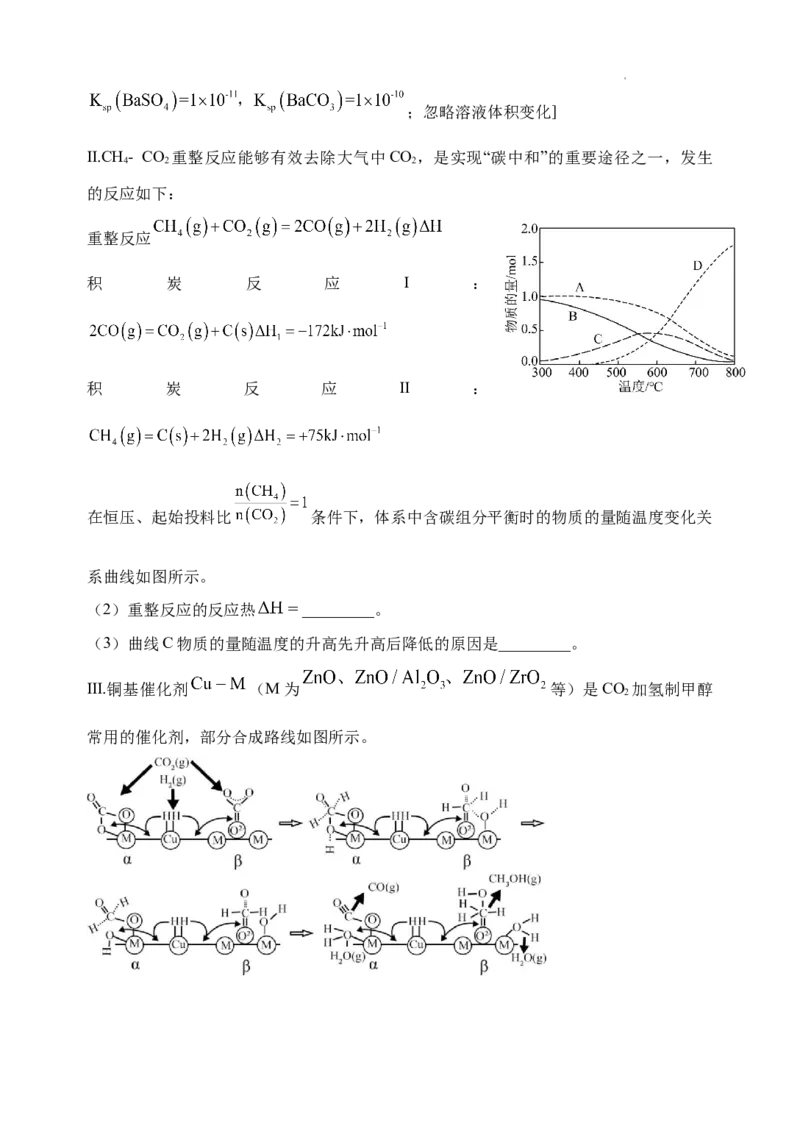
17. 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO 的
2
碳捕捉和碳利用技术则是关键。
Ⅰ.常温下,以NaOH溶液作CO 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
2
NaCO。
2 3
的
(1)用1L Na CO 溶液将2.33gBaSO 固体全都转化为BaCO ,再过滤,所用 NaCO 溶
2 3 4 3 2 3
液的物质的量浓度至少为_________mol/L。[已知:常温下;忽略溶液体积变化]
Ⅱ.CH- CO 重整反应能够有效去除大气中CO ,是实现“碳中和”的重要途径之一,发生
4 2 2
的反应如下:
重整反应
积 炭 反 应 Ⅰ :
积 炭 反 应 Ⅱ :
在恒压、起始投料比 条件下,体系中含碳组分平衡时的物质的量随温度变化关
系曲线如图所示。
(2)重整反应的反应热 _________。
(3)曲线C物质的量随温度的升高先升高后降低的原因是_________。
Ⅲ.铜基催化剂 (M为 等)是CO 加氢制甲醇
2
常用的催化剂,部分合成路线如图所示。其中催化剂上有两个活动点位( 位点、氧化物载体位点),CO 分别在中碱位 、
2
强碱位 吸附发生反应。
(4)请写出中碱位 上发生反应的总化学方程式_________。
Ⅳ.利用电化学可以将CO 有限转化为有机物。
2
(5)多晶 是目前唯一被实验证实能高效催化CO 还原为烃类(如 )的金属。
2
如图所示,电解装置中分别以多晶 和 为电极材
料,用阴离子交换膜分隔开阴、阳极室,反应前后
浓度基本保持不变,温度控制在 左右。
阴极生成 的电极反应式为_________。
(6)装置工作时,阴极主要生成 ,还可能生成副产物降低电解效率。标准状况下,
当阳极生成 的体积为 时,测得阴极区生成 ,则电解效率_____。
(忽略电解前后溶液体积的变化)已知:电解效率
。
扬州中学2024届高三第二学期化学阶段练习答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 B D C A D D C D A A C B C
14(15分)(1) ①. 适当升高温度,将钼精矿粉碎,增大空气通入量 (2分)②. 4ReS +10CaO+19O 2Ca(ReO )+8CaSO (3分)
2 2 4 2 4
(2)氨水 (2分) (3)萃取液流速小于6BV/h,萃取时间太长,会降低生产效率;
萃取液流速大于8BV/h,铼吸附率下降太多 (2分)
(4)重结晶或用热水溶解再降温结晶,过滤,再洗涤干燥 (2分)
(5)3500℃时,Fe已气化去除;固态碳与H 完全反应,形成了气态物质 (2分)
2
(6)八面体(2分)
15. (14分)(1)3:8 (2分)
(2). 加成反应 (2分) (3). (2分)
(4). (3分)
(5).
(5分)
16(17分)(1) sp3 (2分)
(2) 硫粉微溶于乙醇,在乙醇中有一定的溶解度,从而增大反应物的接触面积,加快
反应速率(2分)
(3) ① 4SO +2NaS+NaCO===3Na SO+CO (2分)
2 2 2 3 2 2 3 2
② Na CO 溶液呈碱性,可以抑制NaS水解,防止产生HS气体(2分)
2 3 2 2
③ 若SO 过量,溶液显酸性,产物分解(2分)
2
(4) 向其中加入过量KI溶液,充分振荡,以淀粉溶液为指示剂,用0.10 mol·L-1NaSO 标准溶液滴定至终点,加入稀硫酸调节溶液pH=3,再以淀粉溶液为指示剂,用
2 2 3
0.10 mol·L-1 Na SO 标准溶液滴定至终点,记录第二次滴定消耗NaSO 溶液的体积(4
2 2 3 2 2 3
分)
(5) 93.00%(计算过程见解析) (3分)
17(15分)(1)0.11 (2分)
(2)+247kJ/mol (2分)
(3)低于 时,随着温度升高反应以重整反应为主,所以 物质的量增大;高于
时,增多的 使积炭反应Ⅰ的平衡正向移动导致 物质的量减小 (2分)
(4) (3分)
(5) (3分)
(6)75% (3分)