文档内容
湖北省部分高中协作体 2024--2025 学年下学期五月联考
高二化学试题
本试卷共 8 页,19 题,全卷满分 100 分,考试用时 75 分钟。
★祝考试顺利★
注意事项:
1、答题前,请将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并
将准考证号条形码粘贴在答题卡上的制定位置。
2、选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,
写在试卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题作答:用黑色签字笔直接答在答题卡对应的答题区域内,写在试卷、草稿
纸和答题卡上的非答题区域均无效。
4、考试结束后,请将答题卡上交。
一、选择题:本题共 15 小题,每题 3 分,共 45 分,每小题仅有一项是符合题意。
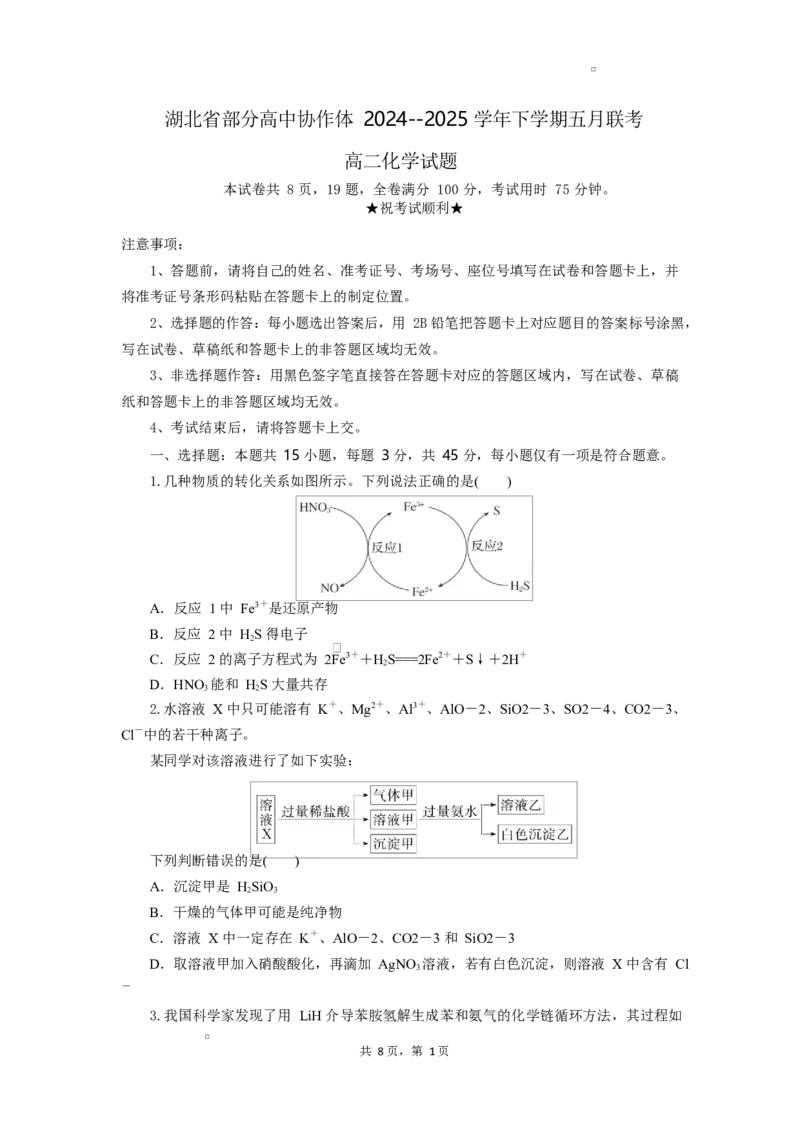
1.几种物质的转化关系如图所示。下列说法正确的是( )
A.反应 1 中 Fe3+是还原产物
B.反应 2 中 HS 得电子
2
C.反应 2 的离子方程式为 2Fe3++HS===2Fe2++S↓+2H+
2
D.HNO 能和 HS 大量共存
3 2
2.水溶液 X 中只可能溶有 K+、Mg2+、Al3+、AlO-2、SiO2-3、SO2-4、CO2-3、
Cl-中的若干种离子。
某同学对该溶液进行了如下实验:
下列判断错误的是( )
A.沉淀甲是 HSiO
2 3
B.干燥的气体甲可能是纯净物
C.溶液 X 中一定存在 K+、AlO-2、CO2-3 和 SiO2-3
D.取溶液甲加入硝酸酸化,再滴加 AgNO 溶液,若有白色沉淀,则溶液 X 中含有 Cl
3
-
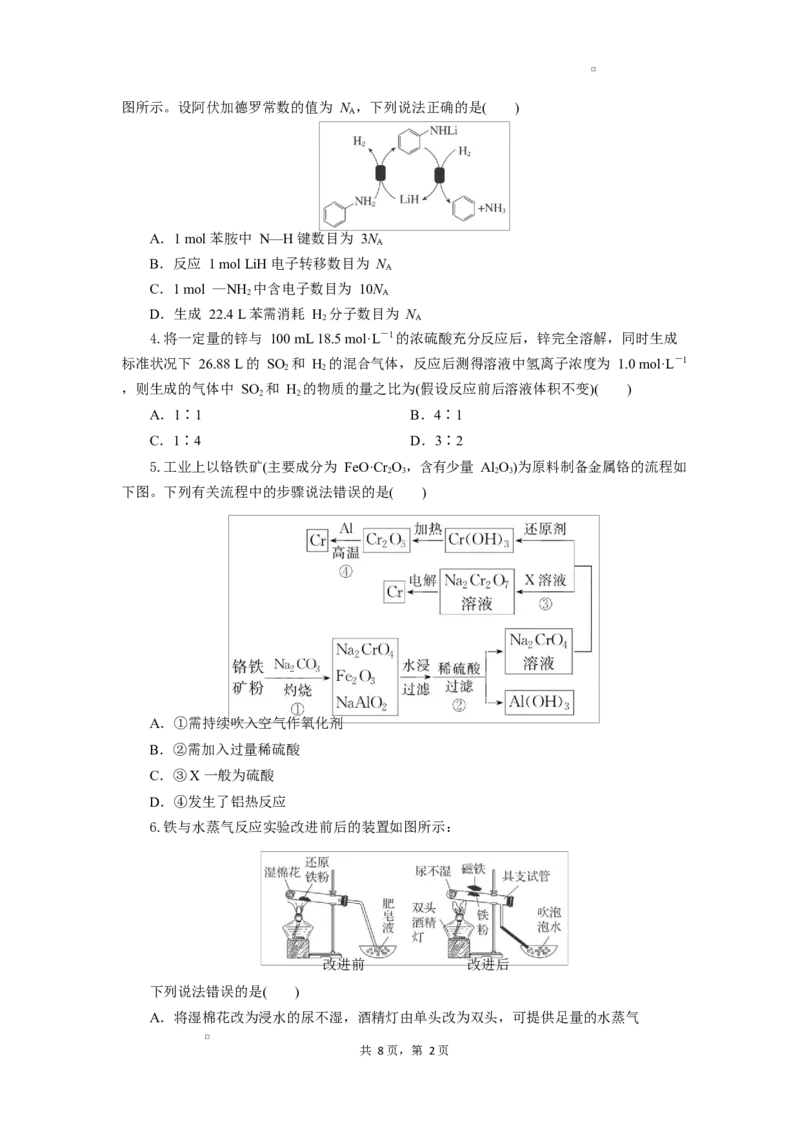
3.我国科学家发现了用 LiH 介导苯胺氢解生成苯和氨气的化学链循环方法,其过程如
共 8 页,第 1页图所示。设阿伏加德罗常数的值为 N ,下列说法正确的是( )
A
A.1 mol 苯胺中 N—H 键数目为 3N
A
B.反应 1 mol LiH 电子转移数目为 N
A
C.1 mol —NH 中含电子数目为 10N
2 A
D.生成 22.4 L 苯需消耗 H 分子数目为 N
2 A
4.将一定量的锌与 100 mL 18.5 mol·L-1 的浓硫酸充分反应后,锌完全溶解,同时生成
标准状况下 26.88 L 的 SO 和 H 的混合气体,反应后测得溶液中氢离子浓度为 1.0 mol·L-1
2 2
,则生成的气体中 SO 和 H 的物质的量之比为(假设反应前后溶液体积不变)( )
2 2
A.1∶1 B.4∶1
C.1∶4 D.3∶2
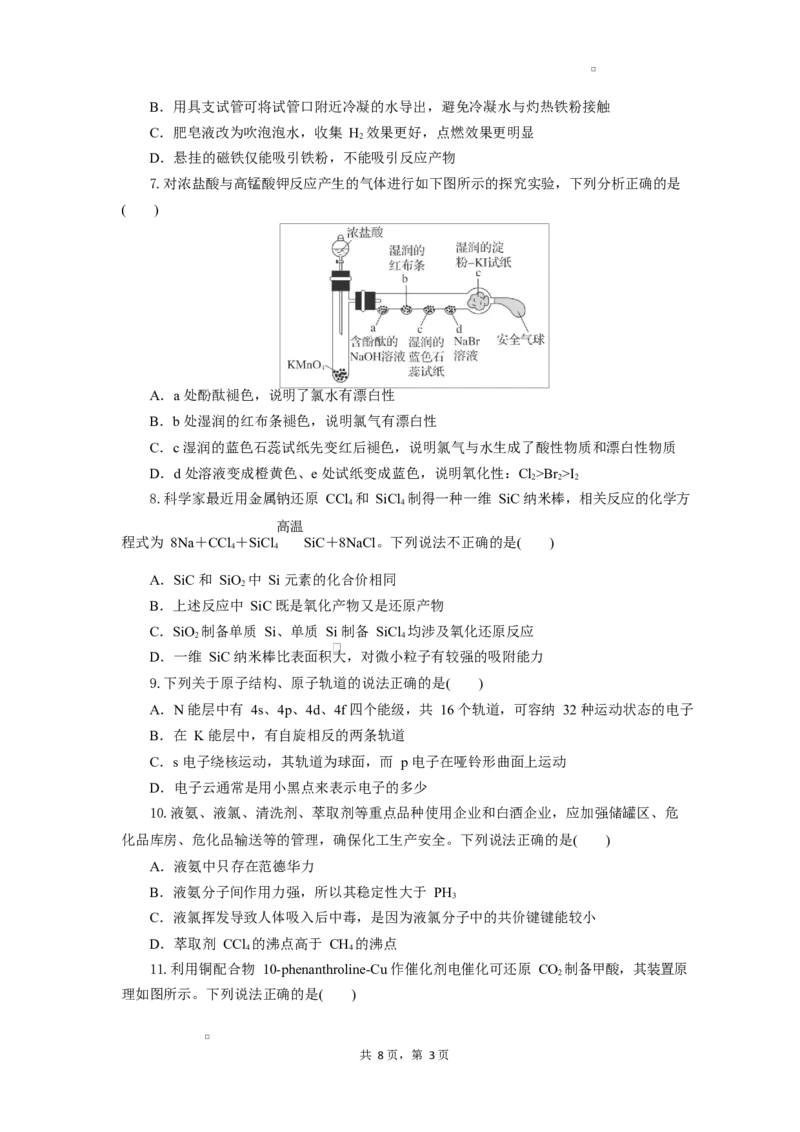
5.工业上以铬铁矿(主要成分为 FeO·Cr O,含有少量 Al O)为原料制备金属铬的流程如
2 3 2 3
下图。下列有关流程中的步骤说法错误的是( )
A.①需持续吹入空气作氧化剂
B.②需加入过量稀硫酸
C.③X 一般为硫酸
D.④发生了铝热反应
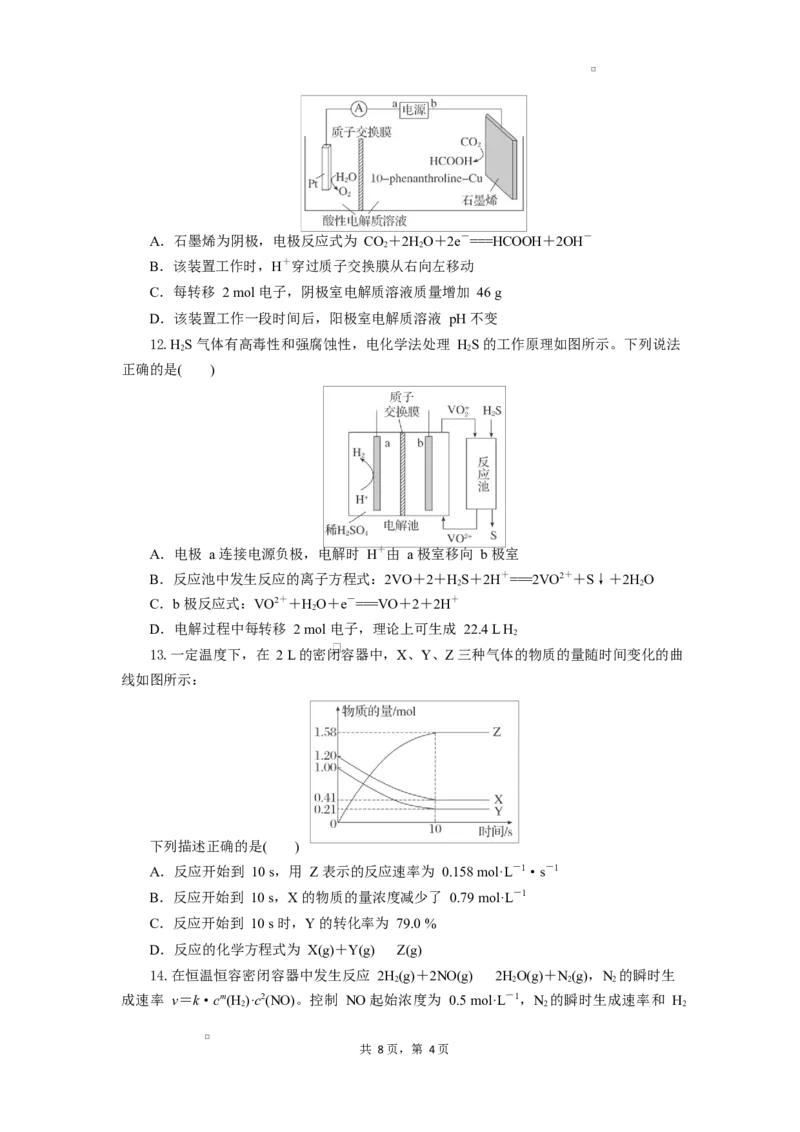
6.铁与水蒸气反应实验改进前后的装置如图所示:
改进前 改进后
下列说法错误的是( )
A.将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气
共 8 页,第 2页B.用具支试管可将试管口附近冷凝的水导出,避免冷凝水与灼热铁粉接触
C.肥皂液改为吹泡泡水,收集 H 效果更好,点燃效果更明显
2
D.悬挂的磁铁仅能吸引铁粉,不能吸引反应产物
7.对浓盐酸与高锰酸钾反应产生的气体进行如下图所示的探究实验,下列分析正确的是
( )
A.a 处酚酞褪色,说明了氯水有漂白性
B.b 处湿润的红布条褪色,说明氯气有漂白性
C.c 湿润的蓝色石蕊试纸先变红后褪色,说明氯气与水生成了酸性物质和漂白性物质
D.d 处溶液变成橙黄色、e 处试纸变成蓝色,说明氧化性:Cl>Br >I
2 2 2
8.科学家最近用金属钠还原 CCl 和 SiCl 制得一种一维 SiC 纳米棒,相关反应的化学方
4 4
高温
程式为 8Na+CCl +SiCl SiC+8NaCl。下列说法不正确的是( )
4 4
A.SiC 和 SiO 中 Si 元素的化合价相同
2
B.上述反应中 SiC 既是氧化产物又是还原产物
C.SiO 制备单质 Si、单质 Si 制备 SiCl 均涉及氧化还原反应
2 4
D.一维 SiC 纳米棒比表面积大,对微小粒子有较强的吸附能力
9.下列关于原子结构、原子轨道的说法正确的是( )
A.N 能层中有 4s、4p、4d、4f 四个能级,共 16 个轨道,可容纳 32 种运动状态的电子
B.在 K 能层中,有自旋相反的两条轨道
C.s 电子绕核运动,其轨道为球面,而 p 电子在哑铃形曲面上运动
D.电子云通常是用小黑点来表示电子的多少
10.液氨、液氯、清洗剂、萃取剂等重点品种使用企业和白酒企业,应加强储罐区、危
化品库房、危化品输送等的管理,确保化工生产安全。下列说法正确的是( )
A.液氨中只存在范德华力
B.液氨分子间作用力强,所以其稳定性大于 PH
3
C.液氯挥发导致人体吸入后中毒,是因为液氯分子中的共价键键能较小
D.萃取剂 CCl 的沸点高于 CH 的沸点
4 4
11.利用铜配合物 10-phenanthroline-Cu 作催化剂电催化可还原 CO 制备甲酸,其装置原
2
理如图所示。下列说法正确的是( )
共 8 页,第 3页A.石墨烯为阴极,电极反应式为 CO+2HO+2e-===HCOOH+2OH-
2 2
B.该装置工作时,H+穿过质子交换膜从右向左移动
C.每转移 2 mol 电子,阴极室电解质溶液质量增加 46 g
D.该装置工作一段时间后,阳极室电解质溶液 pH 不变
12.HS 气体有高毒性和强腐蚀性,电化学法处理 HS 的工作原理如图所示。下列说法
2 2
正确的是( )
A.电极 a 连接电源负极,电解时 H+由 a 极室移向 b 极室
B.反应池中发生反应的离子方程式:2VO+2+HS+2H+===2VO2++S↓+2HO
2 2
C.b 极反应式:VO2++HO+e-===VO+2+2H+
2
D.电解过程中每转移 2 mol 电子,理论上可生成 22.4 L H
2
13.一定温度下,在 2 L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲
线如图所示:
下列描述正确的是( )
A.反应开始到 10 s,用 Z 表示的反应速率为 0.158 mol·L-1·s-1
B.反应开始到 10 s,X 的物质的量浓度减少了 0.79 mol·L-1
C.反应开始到 10 s 时,Y 的转化率为 79.0 %
D.反应的化学方程式为 X(g)+Y(g)Z(g)
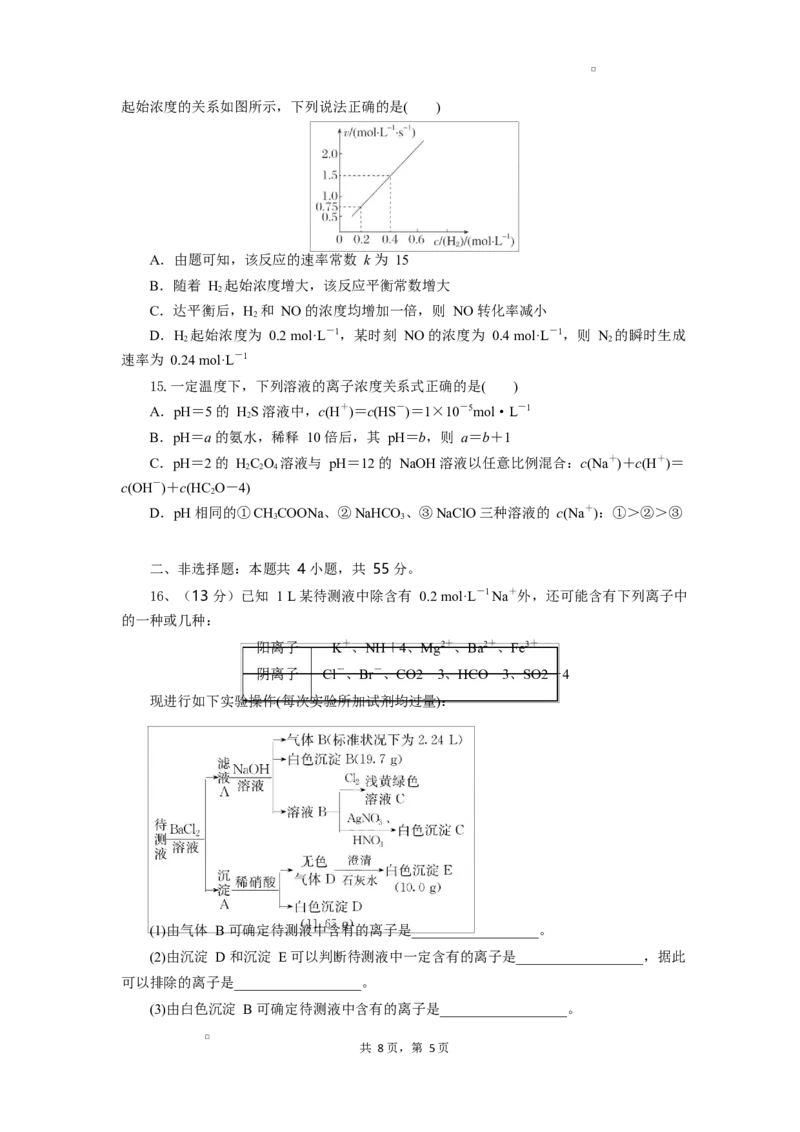
14.在恒温恒容密闭容器中发生反应 2H(g)+2NO(g)2HO(g)+N(g),N 的瞬时生
2 2 2 2
成速率 v=k·cm(H )·c2(NO)。控制 NO 起始浓度为 0.5 mol·L-1,N 的瞬时生成速率和 H
2 2 2
共 8 页,第 4页起始浓度的关系如图所示,下列说法正确的是( )
A.由题可知,该反应的速率常数 k 为 15
B.随着 H 起始浓度增大,该反应平衡常数增大
2
C.达平衡后,H 和 NO 的浓度均增加一倍,则 NO 转化率减小
2
D.H 起始浓度为 0.2 mol·L-1,某时刻 NO 的浓度为 0.4 mol·L-1,则 N 的瞬时生成
2 2
速率为 0.24 mol·L-1
15.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5 的 HS 溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
2
B.pH=a 的氨水,稀释 10 倍后,其 pH=b,则 a=b+1
C.pH=2 的 HC O 溶液与 pH=12 的 NaOH 溶液以任意比例混合:c(Na+)+c(H+)=
2 2 4
c(OH-)+c(HC O-4)
2
D.pH 相同的①CHCOONa、②NaHCO 、③NaClO 三种溶液的 c(Na+):①>②>③
3 3
二、非选择题:本题共 4 小题,共 55 分。
16、(13 分)已知 1 L 某待测液中除含有 0.2 mol·L-1 Na+外,还可能含有下列离子中
的一种或几种:
阳离子 K+、NH+4、Mg2+、Ba2+、Fe3+
阴离子 Cl-、Br-、CO2-3、HCO-3、SO2-4
现进行如下实验操作(每次实验所加试剂均过量):
(1)由气体 B 可确定待测液中含有的离子是__________________。
(2)由沉淀 D 和沉淀 E 可以判断待测液中一定含有的离子是__________________,据此
可以排除的离子是__________________。
(3)由白色沉淀 B 可确定待测液中含有的离子是__________________。
共 8 页,第 5页(4)某 同 学 读 图 后 , 认 为 待 测 液 中 一 定 不 含 溴 离 子 , 他 判 断 的 依 据 是
_______________________________________________________________________________
_________________________________________________________________。
(5)综合分析,待测液中 K+的最小浓度为__________________。
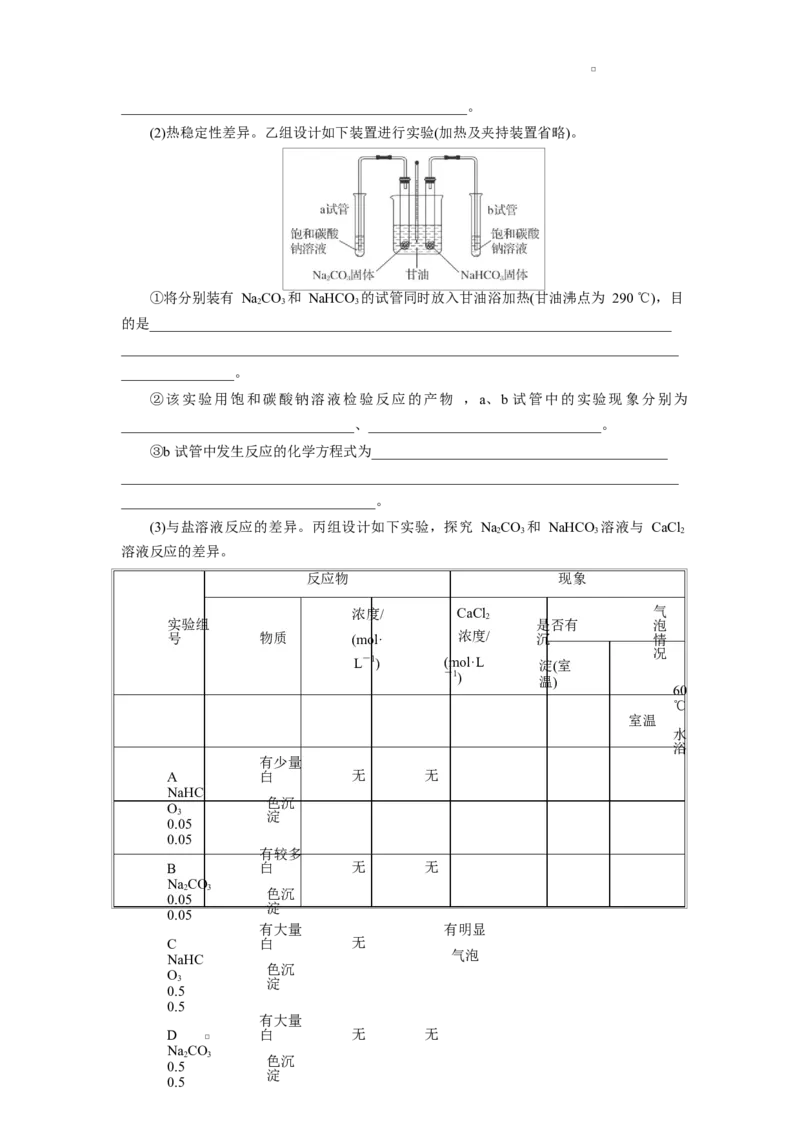
17.(14 分)氮是一种典型的非金属元素,其单质及化合物在生活和生产中具有广泛的
用途。回答下列问题:
(1)磷元素与氮元素同主族,基态磷原子有________个未成对电子,白磷的分子式为 P,
4
其结构如图所示。科学家目前合成了 N 分子,N 分子中氮原子的杂化轨道类型是
4 4
______________,N—N—N 键角为________;N 分解后能产生 N 并释放出大量能量,推
4 2
测其用途:_______________________。
(2)NH 与 Zn2+可形成[Zn(NH )]2+,其部分结构如图所示。
3 3 6
①NH 的空间结构为____________。
3
②[Zn(NH )]2+中存在的化学键类型有________;NH 分子中 H—N—H 键角为 107°,
3 6 3
判断[Zn(NH )]2+中 H—N—H 键角________(填“>”“<”或“=”)107°。
3 6
点燃
③肼(N H)可用作火箭燃料,燃烧时发生的反应是 NO+2NH 3N+4HO,若该
2 4 2 4 2 4 2 2
反应中有 2 mol N—H 键断裂,则形成的π键有________N 。
A
18.(14 分)NaCO 和 NaHCO 是厨房中常见的两种盐,可用化学性质的差异进行鉴
2 3 3
别。回答下列问题:
(1)与酸反应的差异。甲组进行了如下 4 组实验。
其中实验____________和____________(填实验序号)可以鉴别 NaCO 和 NaHCO ,实
2 3 3
验现象分别是__________________________________________________________________
_______________________________________________________________________________
共 8 页,第 6页_________________________________________________。
(2)热稳定性差异。乙组设计如下装置进行实验(加热及夹持装置省略)。
①将分别装有 NaCO 和 NaHCO 的试管同时放入甘油浴加热(甘油沸点为 290 ℃),目
2 3 3
的是__________________________________________________________________________
_______________________________________________________________________________
________________。
②该实验用饱和碳酸钠溶液检验反应的产物 ,a、b 试管中的实验现象分别为
_________________________________、_________________________________。
③b 试管中发生反应的化学方程式为__________________________________________
_______________________________________________________________________________
____________________________________。
(3)与盐溶液反应的差异。丙组设计如下实验,探究 NaCO 和 NaHCO 溶液与 CaCl
2 3 3 2
溶液反应的差异。
反应物 现象
浓度/ CaCl 气
2
实验组 是否有 泡
号 物质 (mol· 浓度/ 沉 情
况
L-1) (mol·L 淀(室
-1)
温)
60
℃
室温
水
浴
有少量
A 白 无 无
NaHC
色沉
O
3 淀
0.05
0.05
有较多
B 白 无 无
NaCO
2 3 色沉
0.05
淀
0.05
有大量 有明显
C 白 无
气泡
NaHC
色沉
O
3 淀
0.5
0.5
有大量
D 白 无 无
NaCO
2 3 色沉
0.5
淀
0.5①丙组由此得出“能用 CaCl 鉴别同浓度的 NaCO 和 NaHCO 溶液”的结论,理由
2 2 3 3
是__________________________________________________________________________
____________________________________________________________________________
________________________________________________________________。
共 8 页,第 7页②请写出 C 组中 60 ℃时,NaHCO 与 CaCl 溶液反应的离子方程式:
3 2
__________________________________________________________________。
19.(14 分)甲醛在医药方面有重要用途。工业上可利用反应Ⅰ:CHOH(g)HCHO(g)
3
+H(g)来合成甲醛。
2
(1)反应Ⅱ 2CHOH(g)+O(g)2HCHO(g)+2HO(g) ΔH=-313.2 kJ·mol-1
3 2 2 2
反应Ⅲ 2H(g)+O(g)2HO(g) ΔH=-483.6 kJ·mol-1
2 2 2 3
反应Ⅰ的ΔH=________kJ·mol-1。
1
(2)利用反应Ⅰ合成甲醛时,为增大化学反应速率,同时提高 CHOH 的平衡转化率,可
3
采取的措施为________。
(3)T ℃时,向体积恒为 2 L 的密闭容器中充入 8 mol CH OH(g)发生反应Ⅰ,5 min 后反
3
应达到平衡,测得混合体系中 HCHO(g)的体积分数为 20%。
①下列事实不能说明该反应已达到化学平衡状态的是________(填序号)。
A.v (HCHO)=v (H )
正 逆 2
B.c(CHOH)∶c(HCHO)∶c(H )=1∶1∶1
3 2
C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
②5 min 内,v(CHOH)=____________mol·L-1·min-1。
3
③其他条件不变时,向已达平衡的反应体系中充入 1 mol CHOH(g)和 1 mol H(g),此
3 2
时 v ________(填“大于”“小于”或“等于”)v 。
正 逆
共 8 页,第 8页