文档内容
{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}人大附中 2025届高三10月检测练习
化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A B C D D C A D B C B D B D
未注明的每空2分
15.(10分)
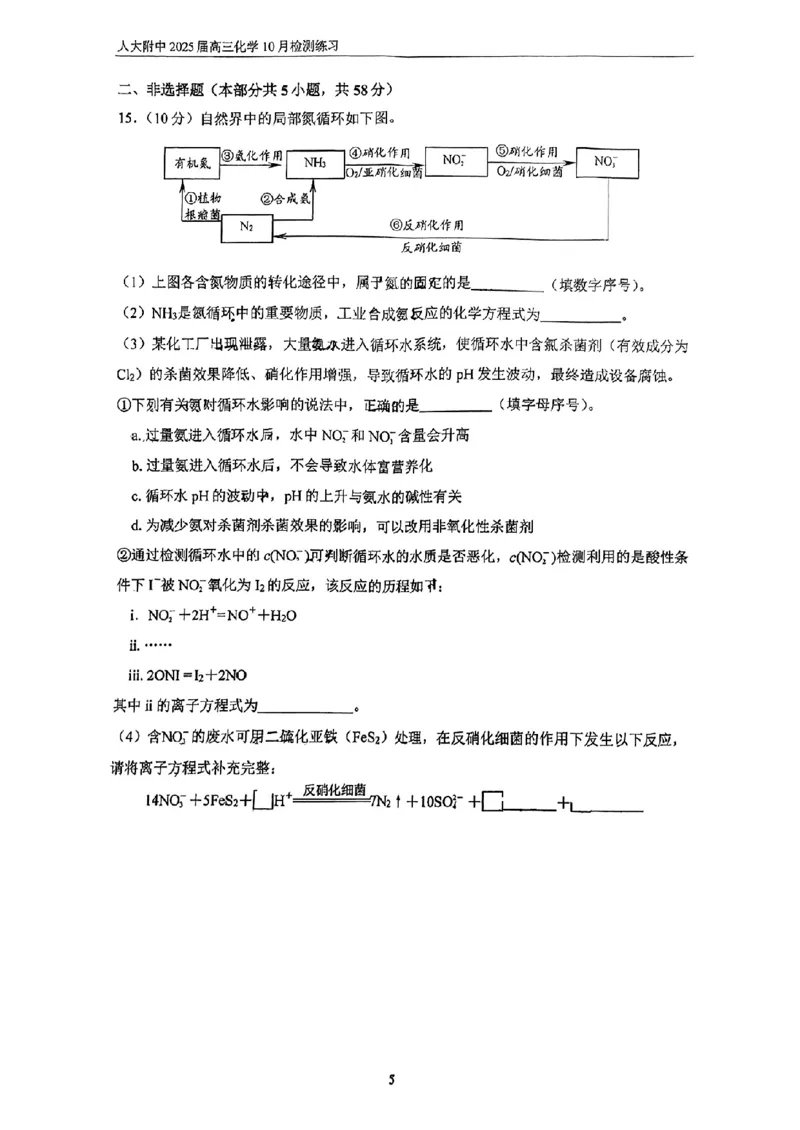
(1)①②
高温高压
(2)N + 3H 2NH
2 2 3
催化剂
(3)①acd ②NO++I- = ONI
反硝化细菌
(4)14NO- +5FeS +4H+===========7N ↑+10SO2- +5Fe2++ 2H O
3 2 2 4 2
16.(10分)
(1)① 非极性(1分) ② sp3(1分) ③ >(1分)
(2)① 5(1分)
② ⅰ.H‒O‒C≡N(1分)
ⅱ.N原子的电负性大,‒CN具有吸电子效应,使HCN中H—C的极性更大,更
易断裂
(3)① 离子键、(极性)共价键 ② 1(1分)
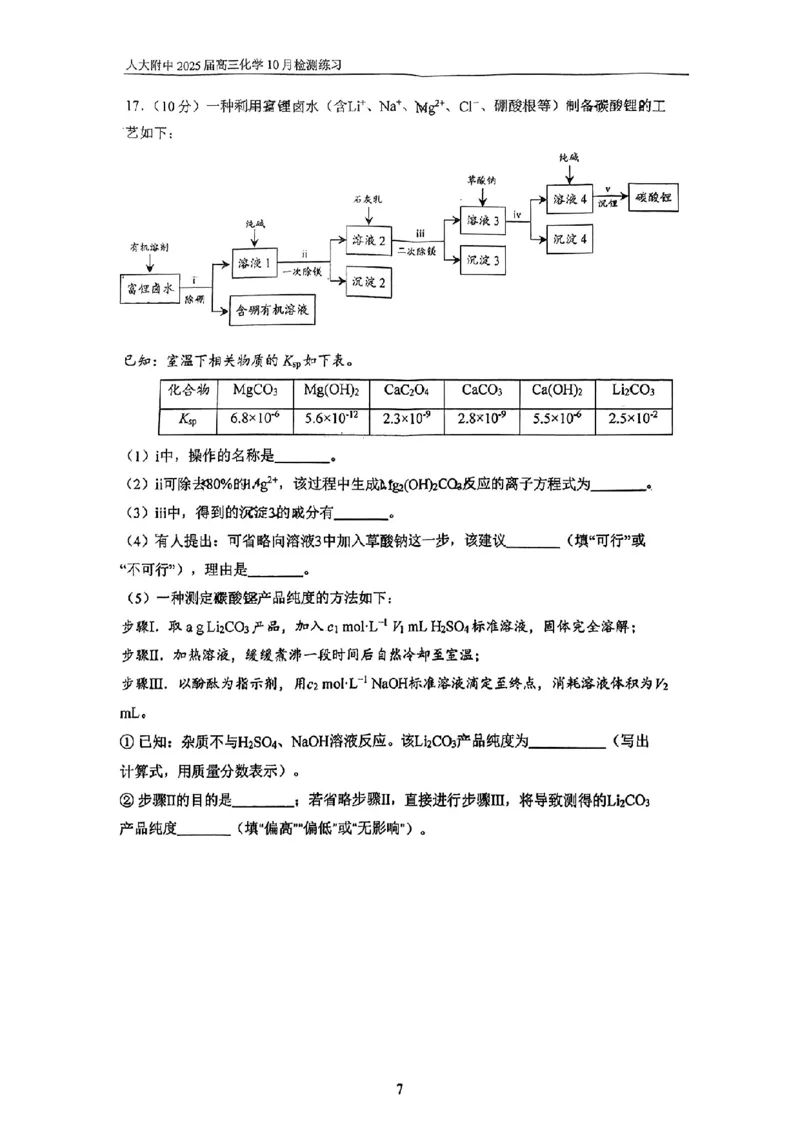
17.(10分)
(1)萃取、分液(1分)
(2)2Mg2+ + 3CO2- + 2H O = Mg (OH) CO ↓+ 2HCO-
3 2 2 2 3 3
(3)Mg(OH) 、CaCO 、Ca(OH) (1分)
2 3 2
(4)不可行(1分),由于 Ksp(CaCO )远小于 Ksp(Li CO ),若省略向溶液 3中加入草酸钠
3 2 3
这一步,会在沉锂的同时生成CaCO 沉淀,造成产品纯度降低(1分)
3
(5)①
74(𝑐1𝑉1− 1
2
𝑐2𝑉2)×10−3
×100%
𝑎
② 除去溶液中的CO (1分),偏低(1分)
2
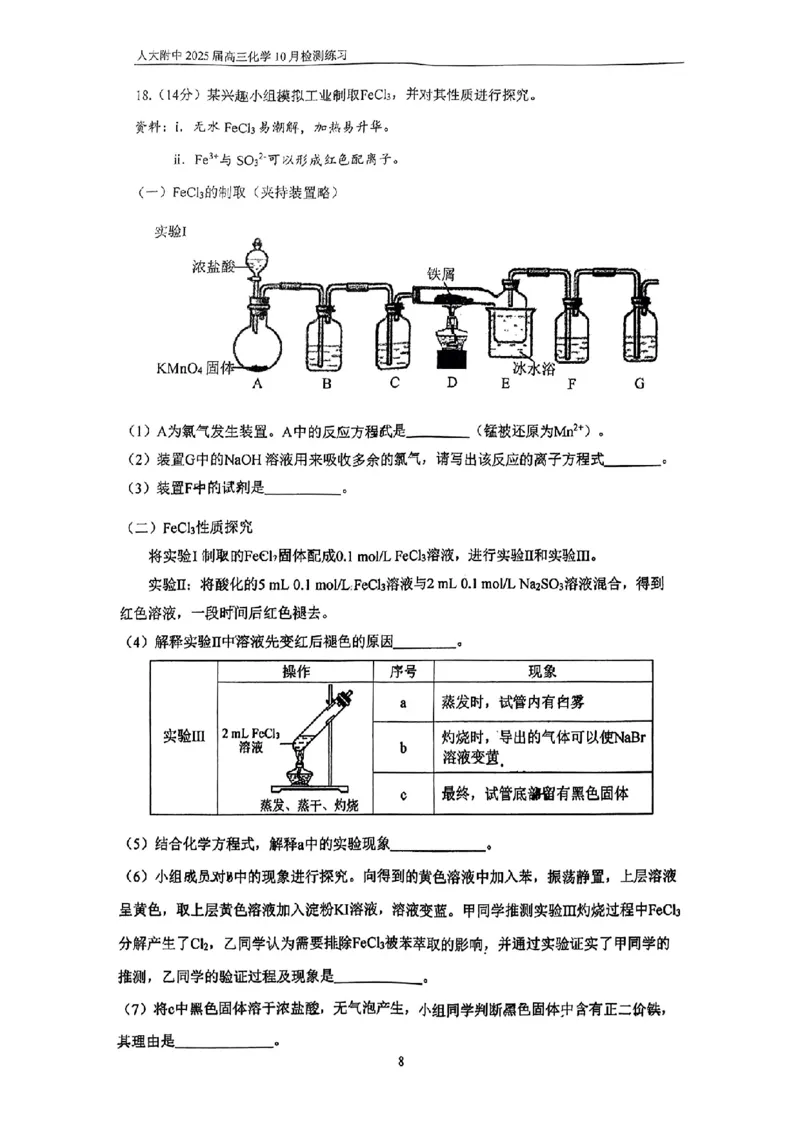
18.(14分)
(1)2KMnO + 16HCl = 2MnCl + 5Cl ↑+ 8H O + 2KCl
4 2 2 2
(2)Cl + 2OH- = Cl- + ClO- + H O
2 2
(3)浓H SO
2 4
(4)Fe3+与SO 2-既可以形成配离子也可以发生氧化还原反应;开始时形成配离子的反应速
3
率大,但氧化还原反应限度大,最终红色褪去
1
{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}(5)加热促进FeCl +3H O Fe(OH) +3HCl平衡正移,挥发的HCl形成白雾
3 2 3
(6)向FeCl 溶液中加入苯,振荡静置,未见变黄
3
(或:向FeCl 溶液中加入苯,振荡静置,取上层溶液加入淀粉KI溶液,溶液未变蓝)
3
(7)实验确认有Cl 生成,Cl元素化合价升高,黑色固体与盐酸反应没有H 生成,说明没
2 2
有0价Fe,判断+3价铁降低到+2价
19.(14分)
△
(1)2KNO === 2KNO + O ↑
3 2 2
(2)① 2CrO2− + 2H+ === Cr O2− + H O(1分)
4 2 7 2
② NO、CO
2
③ 加入稀硫酸,调至pH=3,溶液由黄色变为橙色(1分)
(3)① 黄色固体中含有Cr O ,溶于稀硫酸生成Cr3+(1分)
2 3
② CrO2− + 3NO- + 8H+ = 2Cr3+ + 3NO- + 4HO
2 7 2 3 2
Cr3+ + 6NO- = [Cr(NO)]3−(1分)
2 26
[Cr(NO ) ]3− Cr3+ + 6NO- ,加入H SO 溶液,NO- + H+ = HNO ,且HNO 易
2 6 2 2 4 2 2 2
分解,c(NO- )减小,平衡正向移动,[Cr(NO ) ]3−转化为Cr3+,溶液由玫瑰红色变为绿色
2 2 6
(4)实验Ⅲ中,过滤除去了Cr O ,溶液中的c(H+)比实验Ⅰ中的小,Cr O2− 的氧化性减弱的
2 3 2 7
程度大于HNO 的还原性增强的程度,使Cr O2− 与HNO 不能反应生成Cr3+,溶液仍为橙色
2 2 7 2
2
{{##{{QQQQAABBCBQQSSsEwgggACYoAkIIbJAACAYQ4hrCEE0wXaHC6gCqgQCkQJkAAhELAWCgSMgQGVgAEAAOAAMxAKAyABCFAAFFAKBAC=}A#=}}#}