文档内容
成都七中 2024-2025 学年度上期高 2026 届 12 月月考
化学试卷
考试时间:75 分钟 总分:100 分
可能用到的相对原子质量 O-16N-14Cl-35.5 Fe-56
第Ⅰ卷 选择题(共 45 分)
一、选择题(每小题只有一个选项符合题意,每题3分,共45分)
1.下列说法正确的是( )
A.向反应体系中加入相同浓度的反应物,使活化分子百分数增大
B.冰在室温下自动融化成水,这是熵增的过程
C.强电解质溶液的导电能力一定比弱电解质溶液的强
D.生铁中含有碳,抗腐蚀能力比纯铁强
2.下列有关化学用语表示正确的是( )
A.S2-的结构示意图:
B.N 的电子式:
2
C.镁原子最外层电子的电子云轮廓图:
D.基态硫原子的价层电子轨道表示式:
3.现有4种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;
④1s22s22p5。则下列比较中,正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
4.主族元素W、X、Y、Z原子序数依次增大,X、Y的价电子数相等,Z的价电子所在能层有16个轨道,
4种元素形成的化合物如图。下列说法正确的是( )
A.电负性:W>Y
B.酸性:W YX >W YX
2 3 2 4
C.基态原子的未成对电子数:W>X
D.氧化物溶于水所得溶液的pH:Z>Y
1
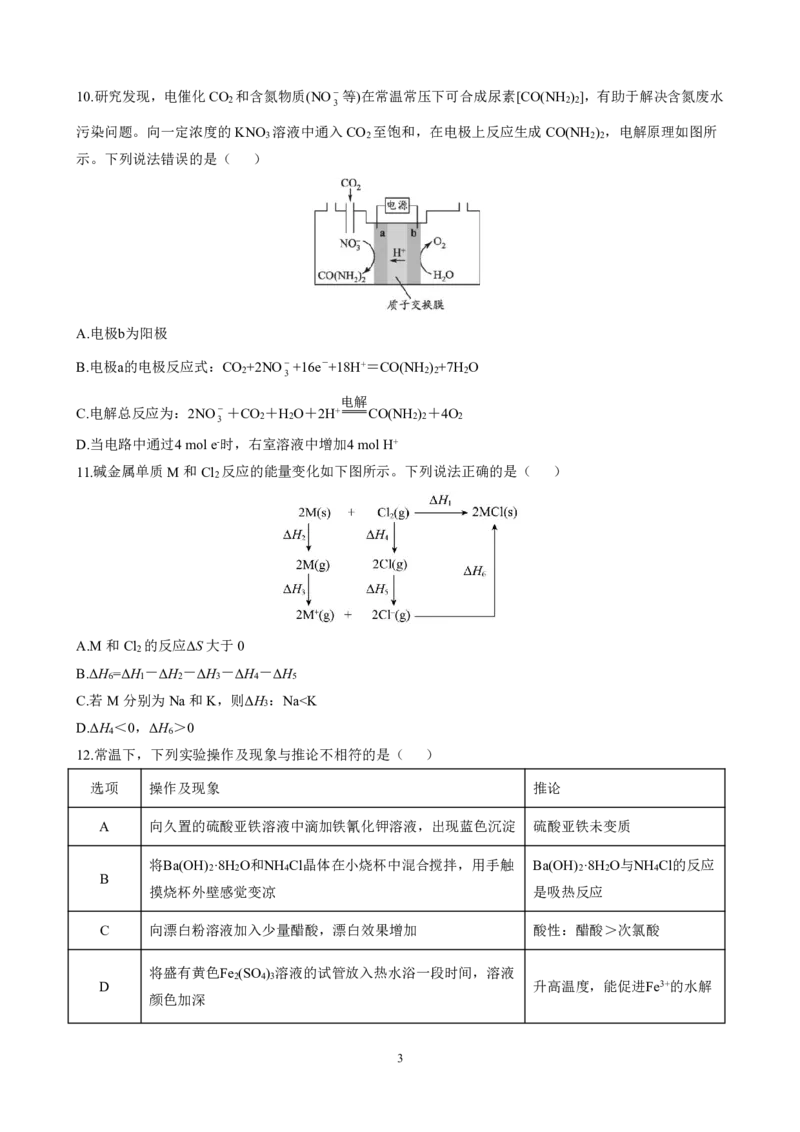
{#{QQABRQAEggiAAhBAABhCQwVQCgCQkhGCCSgGxFAEoAABiANABAA=}#}{#{QQABRQAEggiAAhBAABhCQwVQCgCQkhGCCSgGxFAEoAABiANABAA=}#}10.研究发现,电催化CO 和含氮物质(NO 等)在常温常压下可合成尿素[CO(NH ) ],有助于解决含氮废水
2 3 2 2
污染问题。向一定浓度的KNO 溶液中通入CO 至饱和,在电极上反应生成CO(NH ) ,电解原理如图所
3 2 2 2
示。下列说法错误的是( )
A.电极b为阳极
B.电极a的电极反应式:CO +2NO+16e-+18H+=CO(NH ) +7H O
2 3 2 2 2
电解
C.电解总反应为:2NO+CO +H O+2H+ CO(NH ) +4O
3 2 2 2 2 2
D.当电路中通过4mole-时,右室溶液中增加4molH+
11.碱金属单质M和Cl 反应的能量变化如下图所示。下列说法正确的是( )
2
A.M和Cl 的反应ΔS大于0
2
B.ΔH =ΔH -ΔH -ΔH -ΔH -ΔH
6 1 2 3 4 5
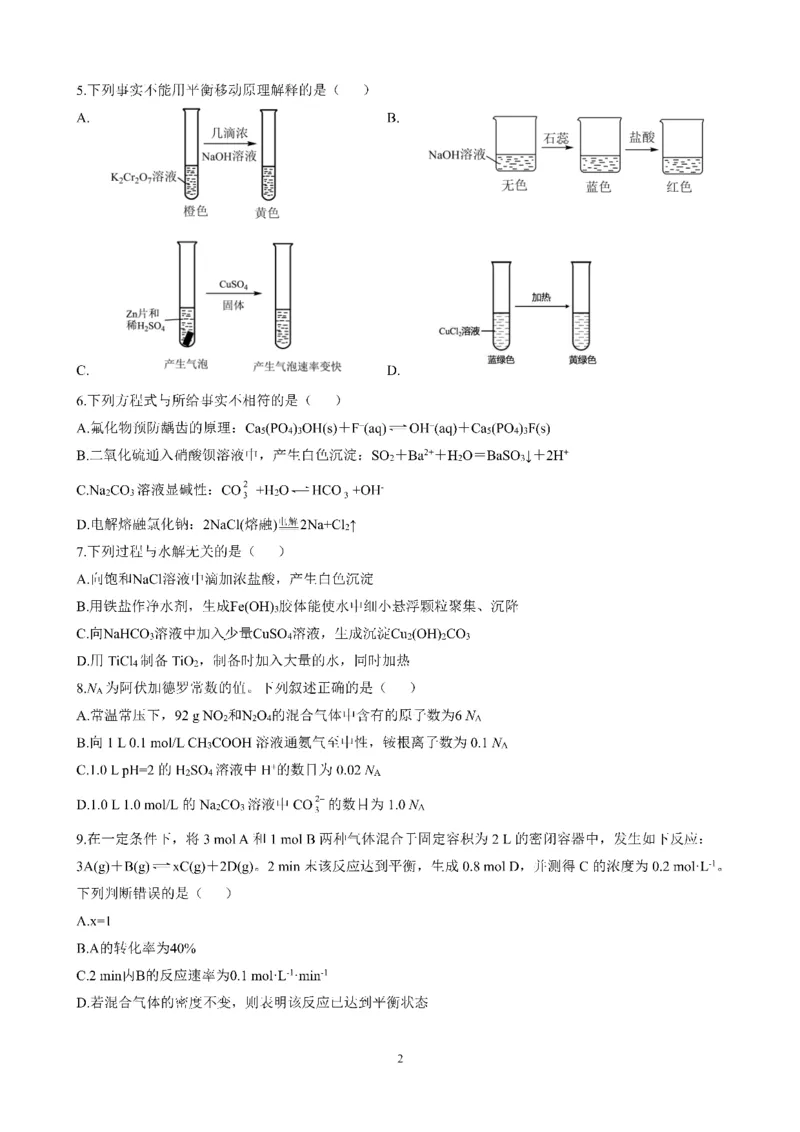
C.若M分别为Na和K,则ΔH :Nab点
cHAc OH
D.从b点到c点,溶液中 逐渐增大(其中HA、A-分别代表酸和酸根离子)
c
A
14.一定条件下,酸性KMnO 溶液与H C O 发生反应,Mn(Ⅱ)起催化作用,过程中不同价态含Mn粒子的
4 2 2 4
浓度随时间变化如下图所示。下列说法正确的是( )
A.Mn(Ⅲ)不能氧化H C O
2 2 4
B.随着反应物浓度的减小,反应速率逐渐减小
C.酸性条件下,上图Mn(Ⅱ)和Mn(Ⅶ)不能大量共存
D.总反应为:2MnO5C O216H 2Mn210CO 8H O
4 2 4 2 2
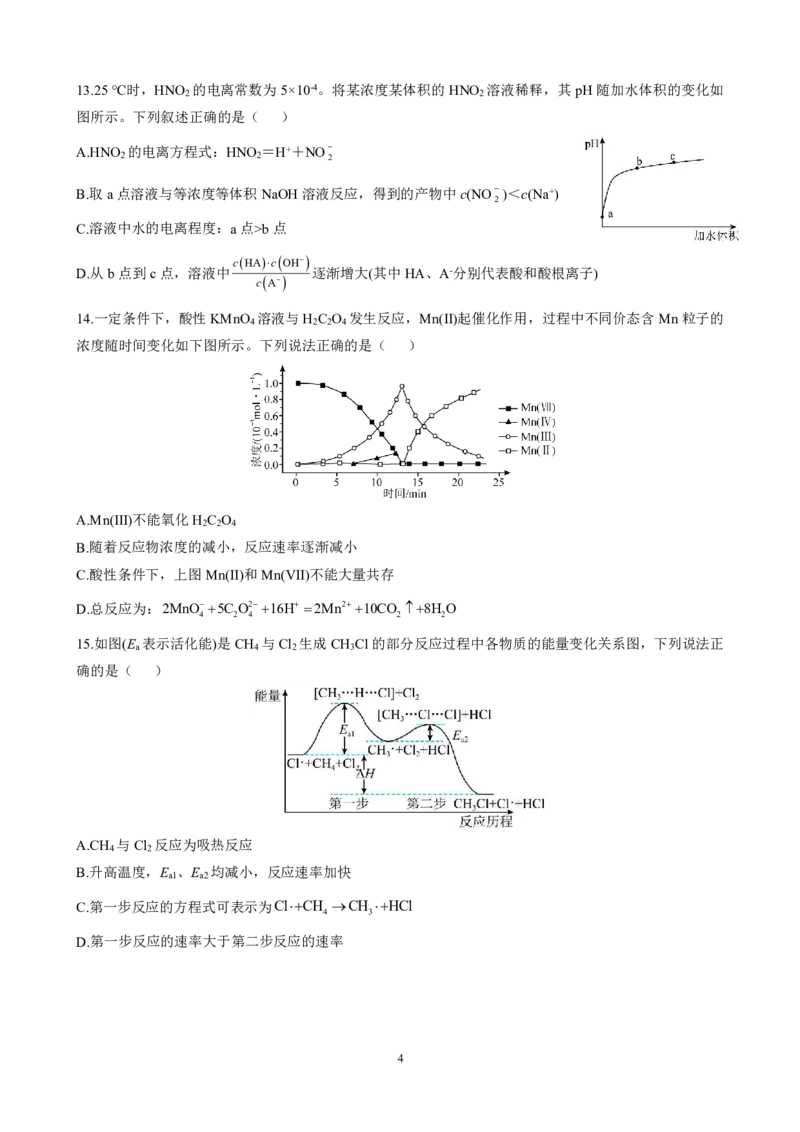
15.如图(E 表示活化能)是CH 与Cl 生成CH Cl的部分反应过程中各物质的能量变化关系图,下列说法正
a 4 2 3
确的是( )
A.CH 与Cl 反应为吸热反应
4 2
B.升高温度,E 、E 均减小,反应速率加快
a1 a2
C.第一步反应的方程式可表示为ClCH CH HCl
4 3
D.第一步反应的速率大于第二步反应的速率
4
{#{QQABRQAEggiAAhBAABhCQwVQCgCQkhGCCSgGxFAEoAABiANABAA=}#}第Ⅱ卷 非选择题(共 55 分)
二、非选择题(本大题包含4个小题,共55分)
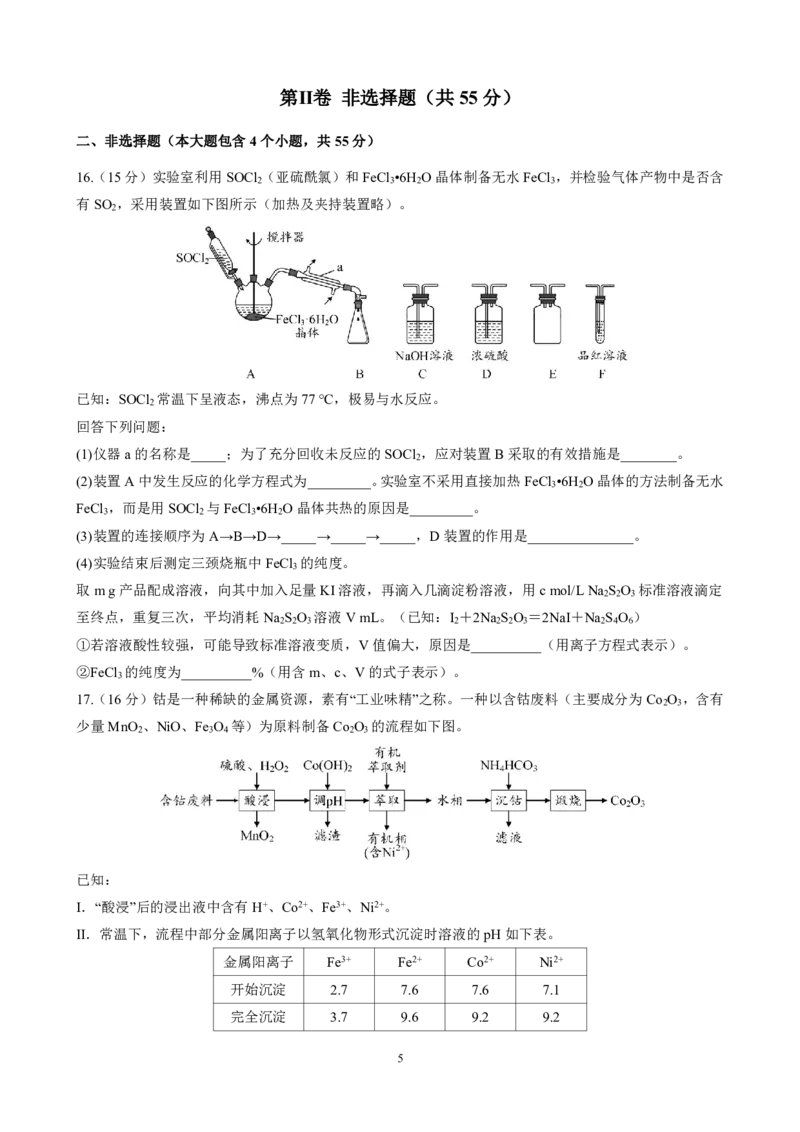
16.(15分)实验室利用SOCl(亚硫酰氯)和FeCl •6H O晶体制备无水FeCl ,并检验气体产物中是否含
2 3 2 3
有SO ,采用装置如下图所示(加热及夹持装置略)。
2
已知:SOCl 常温下呈液态,沸点为77℃,极易与水反应。
2
回答下列问题:
(1)仪器a的名称是_____;为了充分回收未反应的SOCl ,应对装置B采取的有效措施是________。
2
(2)装置A中发生反应的化学方程式为_________。实验室不采用直接加热FeCl •6H O晶体的方法制备无水
3 2
FeCl ,而是用SOCl 与FeCl •6H O晶体共热的原因是_________。
3 2 3 2
(3)装置的连接顺序为A→B→D→_____→_____→_____,D装置的作用是_______________。
(4)实验结束后测定三颈烧瓶中FeCl 的纯度。
3
取mg产品配成溶液,向其中加入足量KI溶液,再滴入几滴淀粉溶液,用cmol/LNa S O 标准溶液滴定
2 2 3
至终点,重复三次,平均消耗Na S O 溶液VmL。(已知:I +2Na S O =2NaI+Na S O )
2 2 3 2 2 2 3 2 4 6
①若溶液酸性较强,可能导致标准溶液变质,V值偏大,原因是__________(用离子方程式表示)。
②FeCl 的纯度为__________%(用含m、c、V的式子表示)。
3
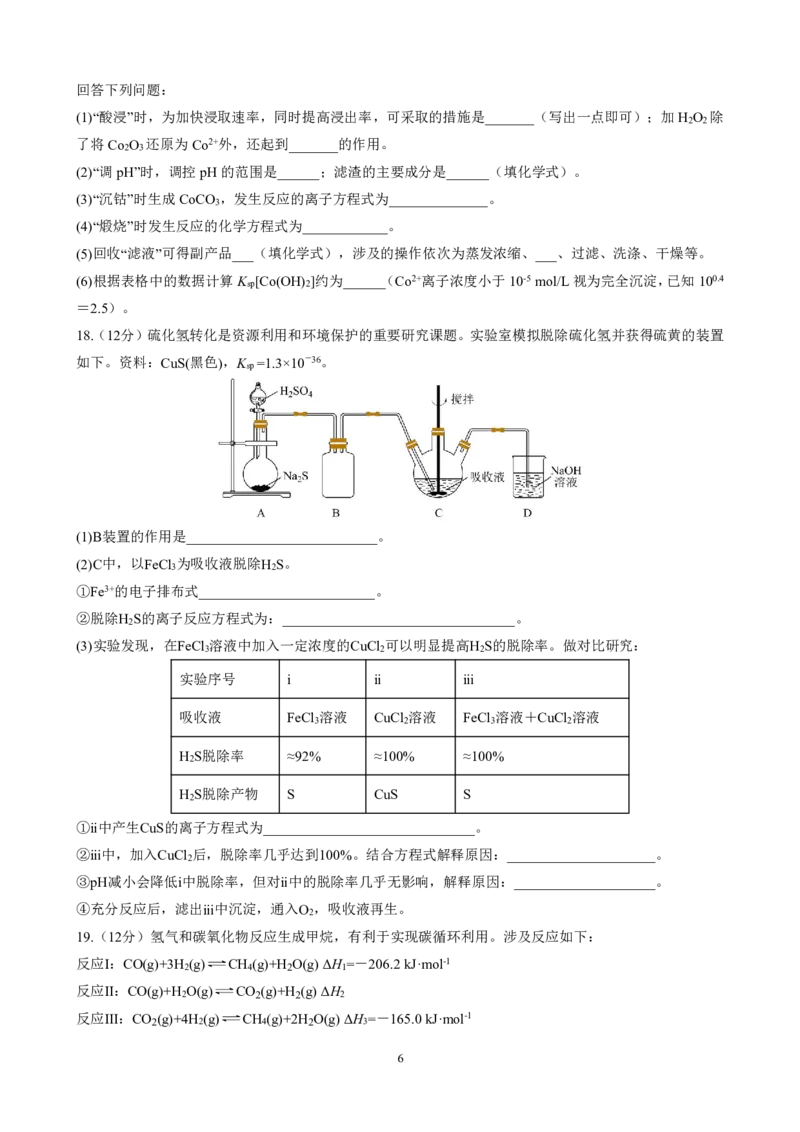
17.(16分)钴是一种稀缺的金属资源,素有“工业味精”之称。一种以含钴废料(主要成分为Co O ,含有
2 3
少量MnO 、NiO、Fe O 等)为原料制备Co O 的流程如下图。
2 3 4 2 3
已知:
I.“酸浸”后的浸出液中含有H+、Co2+、Fe3+、Ni2+。
Ⅱ.常温下,流程中部分金属阳离子以氢氧化物形式沉淀时溶液的pH如下表。
金属阳离子 Fe3+ Fe2+ Co2+ Ni2+
开始沉淀 2.7 7.6 7.6 7.1
完全沉淀 3.7 9.6 9.2 9.2
5
{#{QQABRQAEggiAAhBAABhCQwVQCgCQkhGCCSgGxFAEoAABiANABAA=}#}回答下列问题:
(1)“酸浸”时,为加快浸取速率,同时提高浸出率,可采取的措施是_______(写出一点即可);加H O 除
2 2
了将Co O 还原为Co2+外,还起到_______的作用。
2 3
(2)“调pH”时,调控pH的范围是______;滤渣的主要成分是______(填化学式)。
(3)“沉钴”时生成CoCO ,发生反应的离子方程式为______________。
3
(4)“煅烧”时发生反应的化学方程式为____________。
(5)回收“滤液”可得副产品___(填化学式),涉及的操作依次为蒸发浓缩、___、过滤、洗涤、干燥等。
(6)根据表格中的数据计算K [Co(OH) ]约为______(Co2+离子浓度小于10-5mol/L视为完全沉淀,已知100.4
sp 2
=2.5)。
18.(12分)硫化氢转化是资源利用和环境保护的重要研究课题。实验室模拟脱除硫化氢并获得硫黄的装置
如下。资料:CuS(黑色),K =1.3×10-36。
sp
(1)B装置的作用是___________________________。
(2)C中,以FeCl 为吸收液脱除H S。
3 2
①Fe3+的电子排布式_________________________。
②脱除H S的离子反应方程式为:_________________________________。
2
(3)实验发现,在FeCl 溶液中加入一定浓度的CuCl 可以明显提高H S的脱除率。做对比研究:
3 2 2
实验序号 ⅰ ⅱ ⅲ
吸收液 FeCl 溶液 CuCl 溶液 FeCl 溶液+CuCl 溶液
3 2 3 2
H S脱除率 ≈92% ≈100% ≈100%
2
H S脱除产物 S CuS S
2
①ⅱ中产生CuS的离子方程式为______________________________。
②ⅲ中,加入CuCl 后,脱除率几乎达到100%。结合方程式解释原因:_____________________。
2
③pH减小会降低ⅰ中脱除率,但对ⅱ中的脱除率几乎无影响,解释原因:____________________。
④充分反应后,滤出ⅲ中沉淀,通入O ,吸收液再生。
2
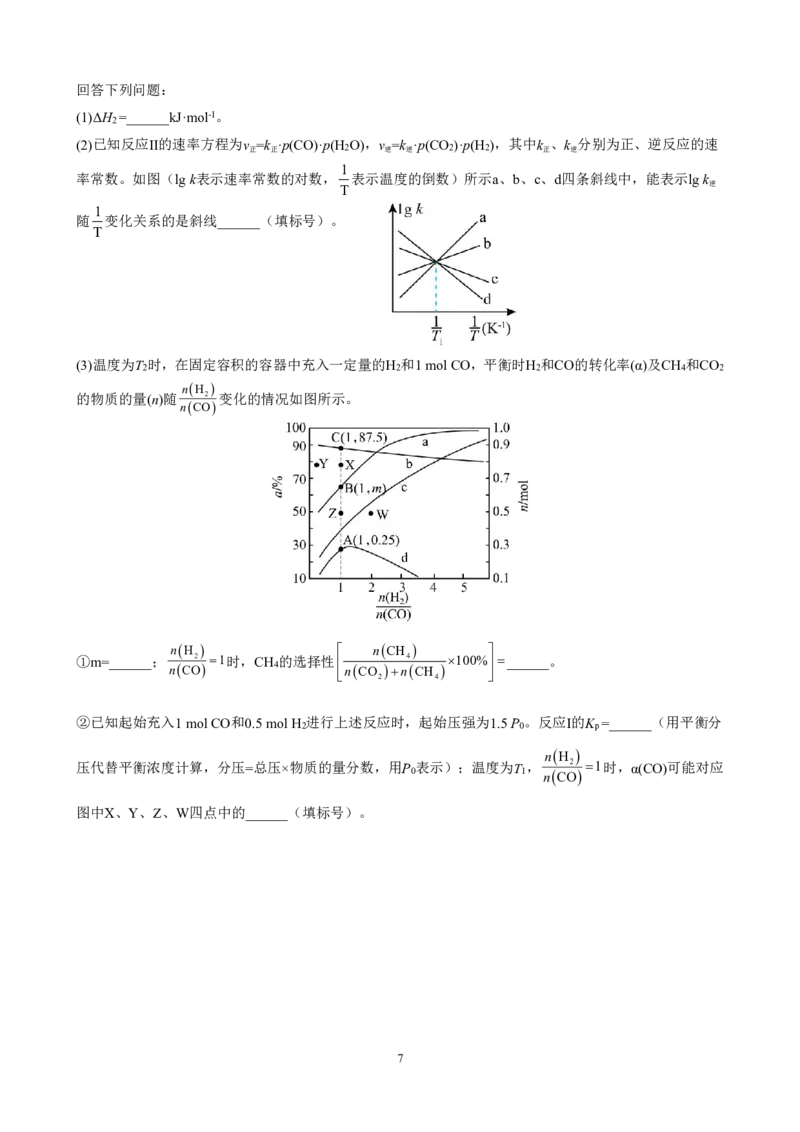
19.(12分)氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。涉及反应如下:
反应Ⅰ:CO(g)+3H (g) CH (g)+H O(g)ΔH =-206.2kJ·mol-1
2 4 2 1
反应Ⅱ:CO(g)+H O(g) CO (g)+H (g)ΔH
2 2 2 2
反应Ⅲ:CO (g)+4H (g) CH (g)+2H O(g)ΔH =-165.0kJ·mol-1
2 2 4 2 3
6
{#{QQABRQAEggiAAhBAABhCQwVQCgCQkhGCCSgGxFAEoAABiANABAA=}#}回答下列问题:
(1)ΔH =______kJ·mol-1。
2
(2)已知反应Ⅱ的速率方程为v =k ·p(CO)·p(H O),v =k ·p(CO )·p(H ),其中k 、k 分别为正、逆反应的速
正 正 2 逆 逆 2 2 正 逆
1
率常数。如图(lgk表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk
逆
T
1
随 变化关系的是斜线______(填标号)。
T
(3)温度为T 时,在固定容积的容器中充入一定量的H 和1molCO,平衡时H 和CO的转化率(α)及CH 和CO
2 2 2 4 2
nH
的物质的量(n)随 2 变化的情况如图所示。
nCO
nH nCH
①m=______; 2 1时,CH 的选择性 4 100%______。
nCO 4 nCO
2
nCH
4
②已知起始充入1molCO和0.5molH 进行上述反应时,起始压强为1.5P 。反应Ⅰ的K =______(用平衡分
2 0 p
nH
压代替平衡浓度计算,分压=总压×物质的量分数,用P 表示);温度为T , 2 1时,α(CO)可能对应
0 1 nCO
图中X、Y、Z、W四点中的______(填标号)。
7
{#{QQABRQAEggiAAhBAABhCQwVQCgCQkhGCCSgGxFAEoAABiANABAA=}#}