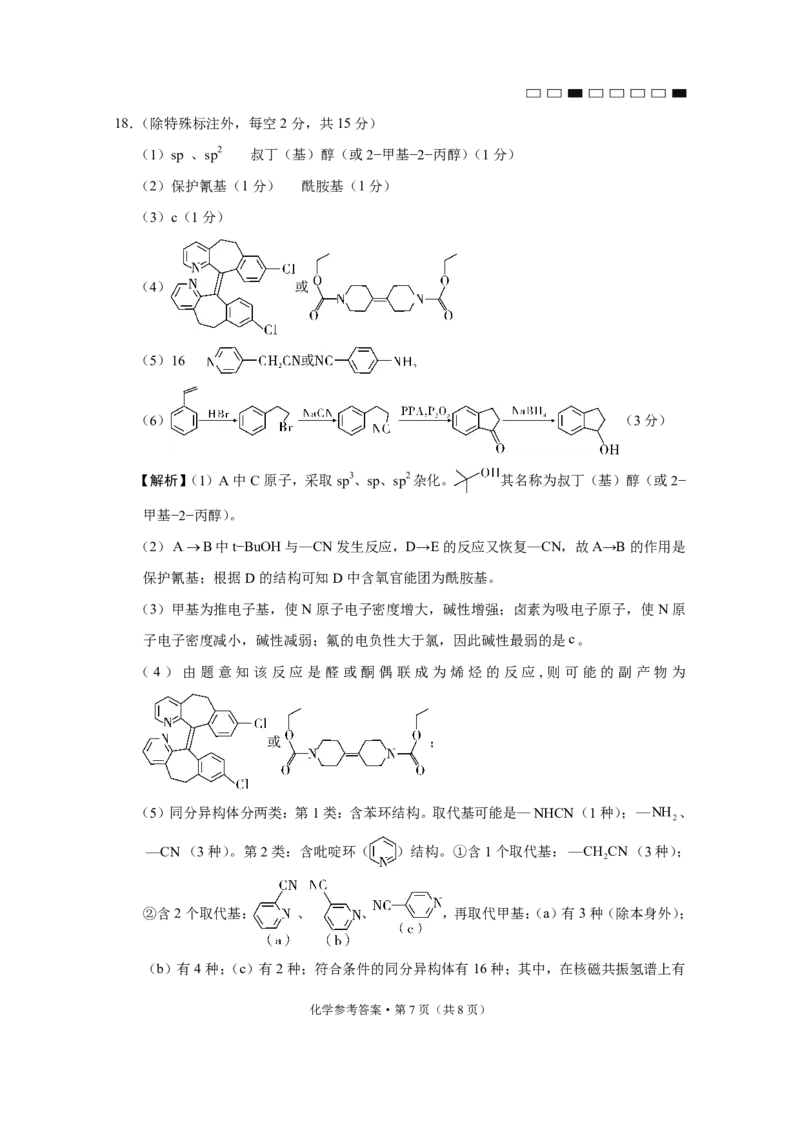
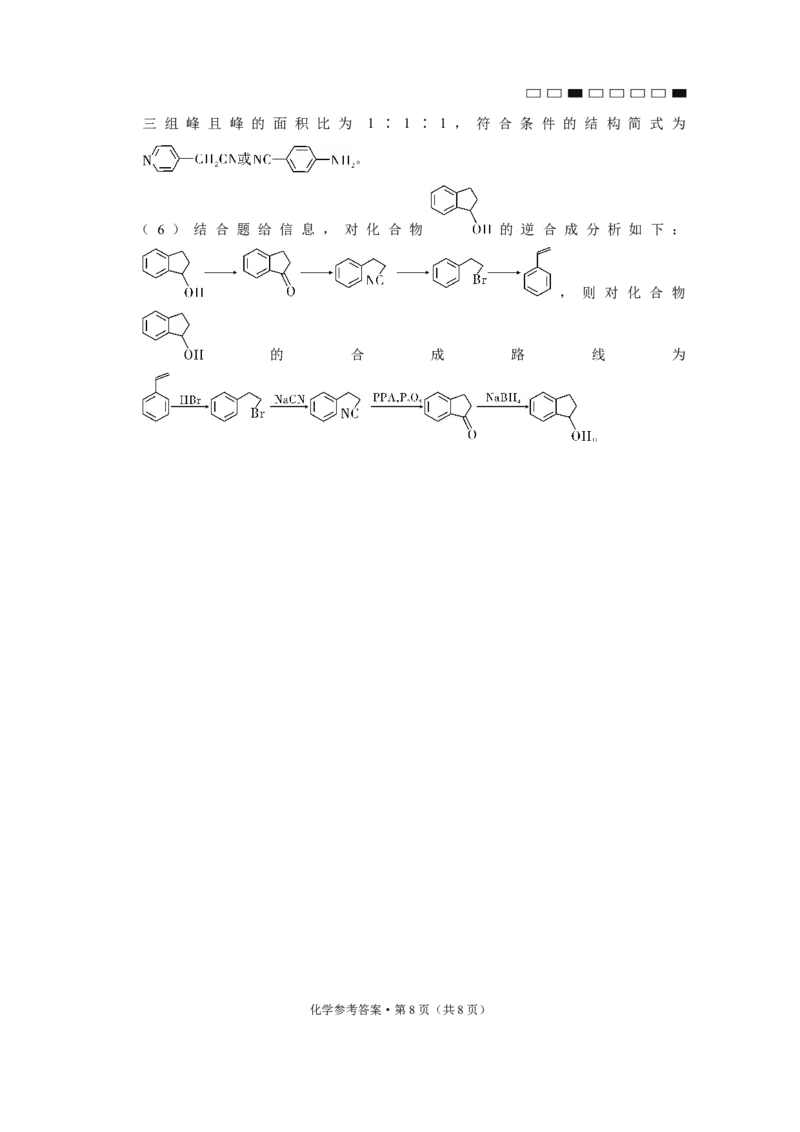
文档内容
化学参考答案
一、选择题:本题共14小题,每小题3分。
题号 1 2 3 4 5 6 7
答案 B D B D C D A
题号 8 9 10 11 12 13 14
答案 A D D B D D B
【解析】
1.硫酸钡属于强电解质,A错误。Al O 属于新型无机非金属材料,B正确。胶体需要是一种
2 3
分散系,所以纳米二氧化硅不是胶体,C 错误。酚醛树脂由苯酚和甲醛加成后通过缩聚反
应得到的,可用做电工材料,D错误。
2.图示表示的是顺式聚异戊二烯,A错误。乙醇的核磁共振氢谱应存在3组峰,B错误。三
氟化硼的VSEPR模型应为平面三角形,C错误。
3.A项,溴水具有氧化性能腐蚀橡胶,不能用碱式滴定管盛装,应用酸式滴定管盛装,故甲
装置不能达到实验目的。B项,闭合开关K 时惰性电极电解K SO 溶液实质是电解水产生
2 2 4
氢气和氧气,一段时间断开开关K 闭合K ,即可形成氢氧燃料电池,乙装置能达到实验
2 1
目的。C项,丙装置没有使用分液漏斗,生成的H 会从长颈漏斗逸出,不能准确地收集到
2
气体,甚至收集不到气体,无法测定化学反应速率,故丙装置不能达到实验目的;D项,
电石中有杂质硫化钙和磷化钙,与水反应生成的硫化氢和磷化氢也能使溴水褪色,实验不
能证明乙炔可使溴水褪色,丁装置不能达到实验目的。
4.D中SiO 与H O无法一步转化为H SiO 。
2 2 2 3
5.简单氢化物的键角大小顺序应该为CH >NH >PH >H O,A错误。腺嘌呤核苷酸和胸腺
4 3 3 2
嘧啶核苷酸存在磷酸酯基,水解后应该生成 H PO ,B 错误。胸腺嘧啶核苷酸所有元素中
3 4
电负性最高的是 O,C 正确。腺嘌呤核苷酸与胸腺嘧啶核苷酸中形成的氢键分别为
N—H···O和N—H···N,D错误。
6.根据8电子稳定结构的要求,砷原子要形成3条共价键,硫原子要形成2条共价键,结构
图示中黑球表示砷原子,白球表示硫原子,所以,As S 分子中不存在S—S键,A错误。
4 4
1mol FeC O 与足量酸性高锰酸钾溶液反应时,Fe2+被氧化为Fe3+ ,C O2被氧化为CO ,
2 4 2 4 2
故 1mol FeC O 与足量酸性高锰酸钾溶液反应,转移的电子数为 3N ,B 错误。C H 可
2 4 A 3 4
化学参考答案·第1页(共8页)
{#{QQABJYyAggioAAIAAQgCAw0QCEMQkhECCYgGhAAAsAAACAFABAA=}#}能为环丙烯( ),则标准状况下 22.4 L C H 中只含 N 个 π键,C错误。常温下,若
3 4 A
为 1 L 0.1 mol·L−1 NH HSO 溶液,则由水电离出的H+数目为10−13N ,但NH的水解会
4 4 A 4
促进水的电离,故1L 0.1mol·L−1 NH HSO 溶液中,由水电离出的H+数目应大于10−13N ,
4 4 A
D正确。
7.NaHCO 溶液中通入少量Cl ,先和水反应生成盐酸和次氯酸,盐酸和碳酸氢根离子反应,
3 2
离子方程式为HCO+Cl =CO +Cl-+HClO,A正确。向碳酸氢镁溶液中加入过量澄清
3 2 2
△
石灰水溶液产生碳酸钙、氢氧化镁和水,离子方程式为2Ca2 4OH 2HCO Mg2=====
3
2CaCO ↓Mg(OH) ↓2H O,B 错误。向 NaHSO 溶液中滴入过量 Fe(NO ) 溶液,生
3 2 2 3 3 3
成硫酸根离子和NO,离子方程式为2NO 3HSO=3SO2 2NO↑H+H O,C错
3 3 4 2
误。FeS不溶于水,正确的离子方程式为Pb2+ FeS=Fe2+ PbS↓,D错误。
8.LiPF 和LiF中的阴离子分别是PF和F-,PF半径更大,则LiPF 熔点更低,A正确。Cs
6 6 6 6
与 F 的电负性差值大于 K 与 I,则 CsF 离子键的成分百分数高于 KI,B 错误。MgO 中的
离子所带电荷高于NaCl,NaCl的熔点比MgO低,Na+(g)+Cl-(g)NaCl(s)放出的热量
更少,则H 更大,C错误。由于C H NH 中乙基为推电子基导致其碱性强于NH ,因此
2 5 2 3
常温下等浓度C H NH NO 与NH NO 水溶液的pH前者大于后者。
2 5 3 3 4 3
9.Pd的价层电子数为10,由于不存在单电子,所以价层电子排布式为4d10,A错误。Pd(PPh )
3 3
中的元素有C、P、H、Pd,位于p 区的只有C、P,B 错误。PPh 中P的价层电子对数为
3
531
3+ =4,Pd(PPh ) 中Pd的成键电子对数为3,所以一定不可能是sp杂化,C错误。
3 3
2
反应 中Pd从0价升为+2价,D正确。
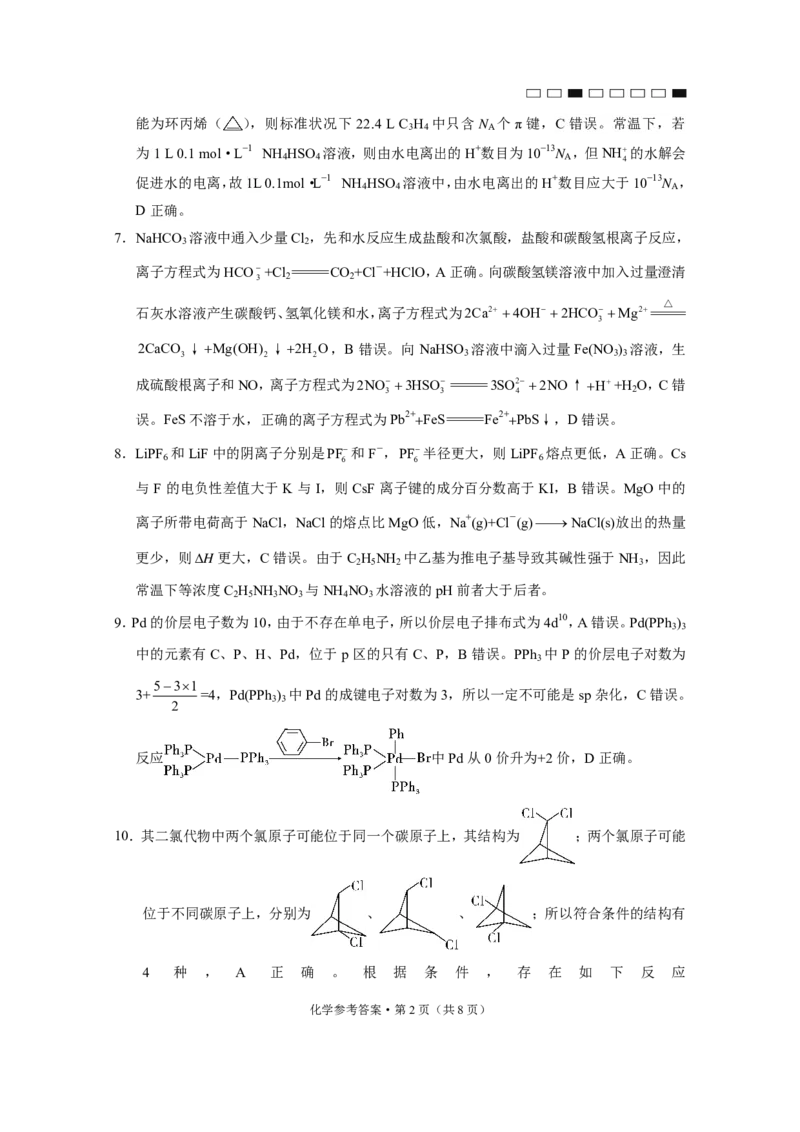
10.其二氯代物中两个氯原子可能位于同一个碳原子上,其结构为 ;两个氯原子可能
位于不同碳原子上,分别为 、 、 ;所以符合条件的结构有
4 种 , A 正 确 。 根 据 条 件 , 存 在 如 下 反 应
化学参考答案·第2页(共8页)
{#{QQABJYyAggioAAIAAQgCAw0QCEMQkhECCYgGhAAAsAAACAFABAA=}#},苯酚与FeCl 发生显色反应,B正确。
3
不饱和的油酸甘油酯通过催化加氢后,由液态变为固态,产物的熔点升高,C正确。在人
体内缓慢释放阿司匹林的过程是水解反应,D错误。
11.硝酸受热分解也会生成二氧化氮气体,不能说明木炭具有还原性,能还原HNO ,A错误。
3
硫酸剩余会与氢氧化钠反应,故需要一段时间再与硫酸铜反应生成蓝色沉淀,B 正确。
25℃,测得MR溶液的pH=7,不能证明可溶性MR为强酸强碱盐,也可能是水解程度相
同的弱酸弱碱盐,C 错误。NaHCO 溶液与 Na[Al(OH) ]溶液混合后产生白色沉淀氢氧化
3 4
铝是因为碳酸氢根离子电离出氢离子,氢离子与[Al(OH) ]-生成水、氢氧化铝。反应中碳
4
酸氢根离子为酸,[Al(OH) ]-离子为碱,产物氢氧化铝和CO2分别充当酸和碱。该反应
4 3
属于酸性较强的酸制酸性较弱的酸的反应,D错误。
12.据图分析,O2的配位数为4,根据CeO 的化学式可知Ce4的配位数为8,A错误。由晶
2
胞结构示意图可知,CeO 晶胞中两个Ce4间的最小距离应为面对角线的二分之一,由此
2
1
可得晶胞参数为 2 a pm,Ce4 与O2 的最小核间距离为晶胞体对角线长的 ,即为
4
6 3 3 1
pm,B错误。根据晶胞中N点的位置可以看出,N点原子的分数坐标为( , , ),
4 4 4 4
C 错误。氧化铈(CeO )晶胞中掺杂YO ,Y3占据原来Ce4的位置,未掺杂之前,每个
2 2 3
晶胞中有 4 个 Ce,8 个 O,若掺杂YO 后得到 n(CeO )∶n(Y O )=3∶1 的晶体,每个晶
2 3 2 2 3
胞中Ce和Y共4个时,分别含有2.4个Ce4和1.6个Y3,则含有2.42+0.83=7.2个O2,
87.2
则此晶体中O2的空缺率为 100%10%,D正确。
8
13.根据图像可知初始阶段电流的方向均是一致的,这说明 M 点时铁均作负极,发生氧化反
应A错误。硝酸较浓时,正极电极反应为NO+e-+2H+=NO ↑+H O,随着时间的推
3 2 2
移,硝酸浓度降低,正极电极反应变为NO+3e-+4H+=NO↑+2H O,B错误。铁被完
3 2
全钝化后会发生电极反转,N点时Cu为负极,C错误。原电池电极反转的硝酸溶液浓度
的临界值越低,越有利于储存硝酸,D正确。
化学参考答案·第3页(共8页)
{#{QQABJYyAggioAAIAAQgCAw0QCEMQkhECCYgGhAAAsAAACAFABAA=}#}14.CaC
2
O
4
为强碱弱酸盐,其溶液呈碱性,体系中存在一系列平衡,CaC
2
O
4
(s)
Ca2+(aq)+C O2(aq) 、 C O2+H O HC O+OH 、 HC O+H O
2 4 2 4 2 2 4 2 4 2
H C O +OH,所以在 CaC O 溶液中,c(Ca2+)>c(C O2)>c(HC O)>c(H C O ),即
2 2 4 2 4 2 4 2 4 2 2 4
c(HC O)c(H)
①表示C O2、②表示H C O 、③表示HC O、④表示Ca2+。K 2 4 ,
2 4 2 2 4 2 4 a1 c(H C O )
2 2 4
②③相交时 c(H C O )=c(HC O),从图中可知此时 pH 大于 1 小于 2,所以K (H C O )
2 2 4 2 4 a1 2 2 4
的数量级为 10−2,A 错误。由图像可知 A 点时溶液中 c(C O2)=c(HC O),溶液中存在
2 4 2 4
电荷守恒:2c(Ca2+)+c(H+)=2c( C O2 )+c( HC O )+c(OH-),所以 2c(Ca2+)+c(H+)=
2 4 2 4
3c( C O2 )+c(OH-),A 点时 pH<7,c(H+)>c(OH-),则 2c(Ca2+)<3c( C O2 ),即
2 4 2 4
3
c(Ca2+)< c(C O2),B 正确。曲线③表示HC O随 pH 的变化关系,C 错误。由图像可
2 2 4 2 4
知 , pH > 10 时 , 如 pH=13 , c(OH - )=0.1mol/L 、 c(Ca2+)=10−4.5mol/L , 此 时
Q[Ca(OH) ]=104.5(101)2=106.5