文档内容
2025 年湖北省“新八校”协作体高三 5 月联考
高三化学试卷参考答案
1 2 3 4 5 6 7 8
C B B D C B C D
9 10 11 12 13 14 15
B D C C C D C
16.(14分,除注明外,每空2分)
(1)[Cr(CH COO) ] •2H O或(CH COO) Cr·H O(2分,写分子式0分) 6(1分)
3 2 2 2 3 2 2
(2)抽滤瓶(或吸滤瓶)(1分)
(3)K (1分) K 、K (1分)
1 2 3
(4)14H++Cr O 2-+6Cl-=2Cr3++3Cl ↑+7H O(2分,少↑扣1分) 醋酸亚铬溶解在过量盐酸中,
2 7 2 2
产率降低(2分,意思对即可)
(5)冰水或冰浴(2分,写0℃水浴也给分,只写蒸馏水不给分)
(6)醋酸钠溶液要密封,可在左侧加一个装有蒸馏水的吸收装置,防止空气进入醋酸钠溶液。
(2分,答案合理均得分)
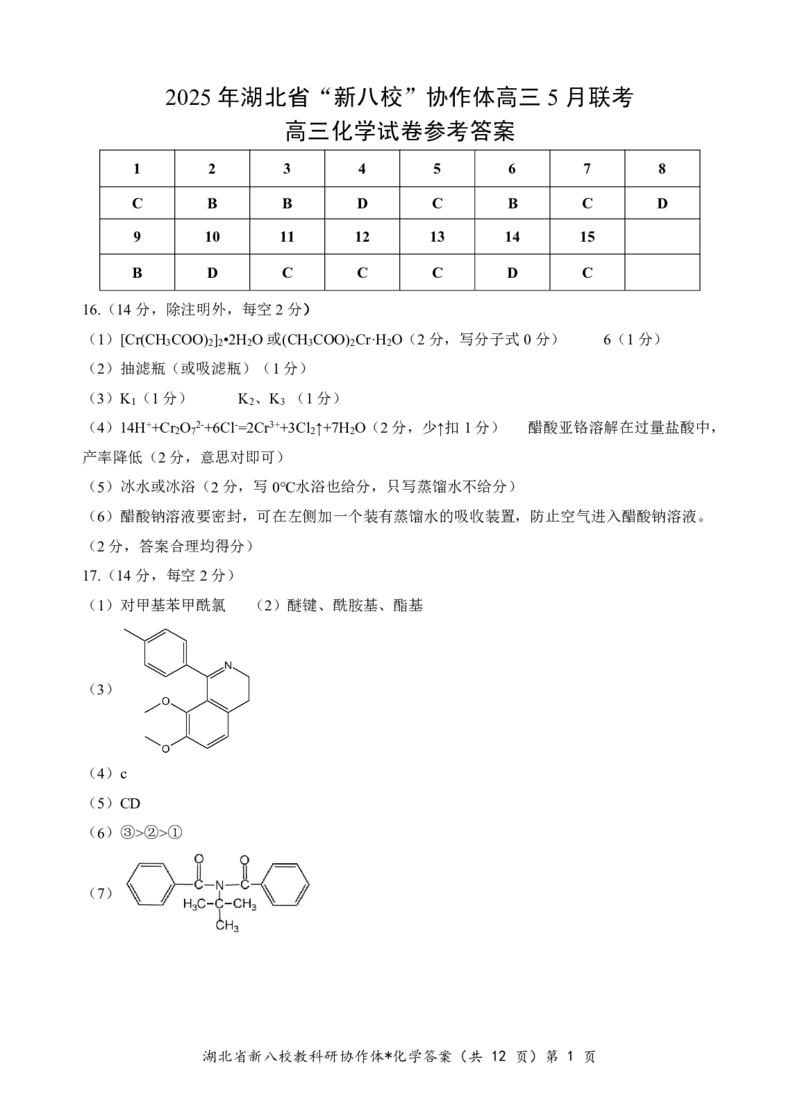
17.(14分,每空2分)
(1)对甲基苯甲酰氯 (2)醚键、酰胺基、酯基
(3)
(4)c
(5)CD
(6)③>②>①
(7)
湖北省新八校教科研协作体*化学答案(共 12 页)第 1 页18.(14分,每空2分)
(1)将烟尘研磨成细小颗粒、适当升高温度(2分,写其中一点即得分)
(2)Na CO 或碳酸钠 (2分) 酸浸(2分,无其他答案)
2 3
(3)H SiO (2分,多写Al(OH) 不扣分)
2 3 3
(4)Na+、K+、Al3+(2分,少写扣1分,见错0分)
(5)O>C>P(2分,写其他答案0分)
(6)[Ga(OH) ]-+3e-=Ga+4OH-或GaO -+3e-+2H O=Ga+4OH-。(2分,写成酸性条件0分)
4 2 2
19.(13分,除注明外,每空2分)
(1)①H S中H带正电、S带负电,Fe O 中Fe带正电,O带负电;甲吸附方式为同种电性微
2 2 3
粒靠近,乙吸附方式中为不同电性微粒靠近时,吸附能力强。
②生成的硫单质附着在催化剂表面,降低了催化剂的表面积;
(2)①高温(1分) ②20%;
③
(3)①2I-+2H S=6I-+S +4H+ ②光电催化法脱除硫化氢,能耗低,还能持续发电;碘离子
3 2 2
可循环利用,正极生成的过氧化氢可回收利用。
湖北省新八校教科研协作体*化学答案(共 12 页)第 2 页2025 年湖北省“新八校”协作体高三 5 月模拟考试
高三化学参考答案解析
1【答案】C
【知识点】焰色试验、淀粉和纤维素、化学科学对人类文明发展的意义
【详解】A.小苏打为NaHCO ,属于盐类,可作发酵粉成分,A正确;
3
B.焰色试验是灼烧某些金属或者它们的化合物时呈现的特征颜色,属于物理变化,B正确;
C.纸张的主要成分是纤维素,纤维素和淀粉都是有机高分子,但聚合度不同,不是同分异构体,
C错误;
D.做豆腐过程中涉及胶体的聚沉,胶体是一种分散系,D正确;
答案选C。
2【答案】B
【知识点】铝热反应、化学科学对人类文明发展的意义、金属与合金性能比较、常见金属的冶炼
【详解】A.必修一P81,A错误;
B.必修一P70,B正确;
C.储氢合金能够可逆地吸收和释放H ,形成金属氢化物,这种特性使其适用于储存氢气,并用
2
于氢燃料汽车,C错误;
D.稀土元素包括镧系15种元素及钪(Sc)、钇(Y),共17种元素,位于周期表第IIIB族,D
错误;
故选B。
3【答案】B
【知识点】轨道表示式、球棍模型、VSEPR模型、离子化合物的水合离子
【详解】A.不存在1p轨道,A错误;
7123
B.ClO中心原子价层电子对数为3+ =4,中心原子为sp3杂化,且含有1个孤电子对,
3 2
VSEPR模型: ,B正确;
C.钠离子半径小于氯离子,水合离子中心半径大的离子为水合氯离子,C错误;
D.O 与SO 属于等电子体,空间结构为V形,球棍模型为 ,D错误;
3 2
答案选B。
4【答案】D
【知识点】Fe3+的检验、盐类水解规律理解及应用、沉淀转化、化学实验方案的设计与评价
【详解】A.马口铁(镀锡铁)出现刮痕后浸泡在饱和食盐水中,形成原电池,铁失电子作负极,锡
作正极,滴入几滴K
3
FeCN
6
溶液,产生蓝色沉淀,发生原电池反应,A项错误;
湖北省新八校教科研协作体*化学答案(共 12 页)第 3 页B.向2支均盛有2mL0.1mol/L的NaOH溶液的试管中,分别加入2滴浓度均为0.1mol/L的AlCl
3
和FeCl 溶液,NaOH溶液与FeCl 发生复分解反应生成红褐色沉淀Fe(OH) ,而过量的NaOH溶
3 3 3
液与AlCl 溶液反应,生成NaAlOH 无色溶液,因此不能比较K FeOH 和
3 4 sp 3
K
sp
AlOH
3
的大小,B项错误;
C.两溶液浓度不同,需要测定等浓度NaA溶液和NaB溶液的pH,比较酸性强弱,C项错误;
D.向2mL0.1mol·L-1NaCl溶液中滴加2滴0.1mol·L-1AgNO 溶液,银离子完全生成白色氯化银沉
3
淀,再滴加4滴0.1mol·L-1KI溶液,白色氯化银沉淀转化为黄色碘化银沉淀,说明
K AgCl>K AgI,D正确;
sp sp
答案选D。
5【答案】C
【知识点】化学反应速率计算、温度对化学平衡移动的影响、化学实验方案的设计与评价
【详解】A.蒸馏操作中温度计的水银球应放在蒸馏烧瓶的支管口附近,A错误;
B.溴单质氧化碘离子生成碘单质,使得淀粉溶液变蓝色,不能判断反应终点,不能测定KI溶液
的浓度,且溴水具有氧化性,需装在酸式滴定管中,B错误;
C.N O(无色)2NO(红棕色),左侧氧化钙和水反应放出大量热,温度升高,右侧两者反应
2 4 2
吸收热量,温度降低,通过观察左侧与右侧中瓶内气体颜色的变化来验证温度对化学平衡的影响,
C正确;
D.由于CuCl 溶液加热过程中发生水解反应,生成的HCl气体挥发,无法制备无水CuCl ,D
2 2
错误;
故选C。
6【答案】B
【知识点】极性分子和非极性分子、氢键对物质性质的影响、晶体与非晶体判断、超分子
【详解】A.焰色试验是电子从高能级到低能级释放能量所发出的光波,A错误;
B.相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,B正确;
C.人体细胞和细胞器的膜是双分子膜,由大量两性分子组装而成,体现“自组装”特征C错误;
D.O 是非极性共价键形成的极性分子,但极性较弱,D错误;
3
故选B。
7【答案】C
【详解】A.从已知反应可知,该反应为放热反应,但未描述反应物和生成物的物质的量,故A
错误;
B.该反应为正向放热反应,升高温度,平衡逆向移动,苯的转化率降低,故B错误;
C.该反应为气体分子数不变的放热反应,结合GHTS0的反应可以自发进行,由此判
断该反应在一定条件下一定能自发进行,故C正确;
D.恒容容器充入惰性气体,对该反应的速率和平衡均无影响,故D错误。
故选C。
湖北省新八校教科研协作体*化学答案(共 12 页)第 4 页8【答案】D
【知识点】离子方程式的书写、物质分离、提纯综合应用、海带中碘的提取及检验
【分析】海带浸取液中的碘离子被加入的过氧化氢氧化得到含碘单质的水溶液;加入四氯化
碳振荡、静置分层、分液得到碘单质的四氯化碳溶液;向碘单质的四氯化碳溶液中加入氢氧化钠
溶液,碘单质和氢氧化钠反应得碘化钠和NaIO 溶液;振荡、静置分层,去掉四氯化碳层,再加
3
入稀硫酸酸化,碘化钠和NaIO 在酸性条件下发生氧化还原反应得到碘单质的悬浊液,通过过滤
3
得到碘单质。
【详解】A. H O 被称作绿色氧化剂,它是极性分子,故A错误;
2 2
B. 实验操作②为萃取碘单质的操作,操作②需要用到的玻璃仪器为烧杯、玻璃棒和分液漏斗;
故B错误
C. 四氯化碳密度大于水,则碘的CCl 溶液位于下层,呈紫色;故C错误
4
D. 碘化钠和NaIO 在酸性条件下发生归中反应得到碘单质:5I-+IO+6H+=3I ↓+3H O;故D正确
3 3 2 2
故选D。
9【答案】B
【知识点】根据原子结构进行元素种类推断、离子键概念及判断、电离能的概念及变化规律
【分析】Q、R、T、X、Y和Z是原子序数依次增大的短周期主族元素,阳离子结构中Q只形成
一个价键,则Q为IA族或VIIA族元素,阴离子结构中Z只形成一个价键,则Z为VIIA族元素,
Q、R、X和Z质子数均为奇数且和为22,Q的原子序数最小,则Q为H元素,Z为F元素;基
态T原子和Y原子最外层均有两个单电子,原子序数小于F,则T和Y的价电子排布式分别为
2s22p2、2s22p4,即T和Y分别为C、O元素;X原子序数介于C、O元素之间,则X为N元素;
R的原子序数为22-1-7-9=5,所以R为B元素,综上所述,Q、R、T、X、Y和Z分别为H、B、
C、N、O、F。
【详解】A.C元素的氢化物(烃)较多,碳原子较多的烃沸点可能高于O元素的氢化物,A错误;
B.由分析可知,T为C、R为B均可形成共价晶体,B正确;
C.该物质的阴离子和F-一样带一个单位的负电荷,阳离子和Na+一样带一个单位的正电荷,但NaF
的阴、阳离子半径小、离子键强,所以NaF的熔点更高,C错误;
D.Q为H,不能形成最外层8电子的稳定结构,D错误;
故选B。
10【答案】D
【详解】A.Cl 有强氧化性,能将S O2氧化为SO2-,离子反应方程式为:
2 2 3 4
S O2-+4Cl +5H O=2SO2-+8Cl-+10H+,A错误;
2 3 2 2 4
B.FeS难溶于水,离子反应方程式为:Pb2+aq+FeSs
PbSs+Fe2+aq,B错误;
C.NaClO具有强氧化性,SO 具有还原性,NaClO溶液中通入少量二氧化硫,反应生成硫酸根
2
离子、氯离子和次氯酸,3ClO-+SO +H O=SO2-+Cl-+2HClO ,C错误;
2 2 4
D.1mol/L的Na Al(OH) 溶液和2.5mol/L的HCl溶液等体积互相均匀混合的离子反应为
4
湖北省新八校教科研协作体*化学答案(共 12 页)第 5 页2 Al(OH) - +5H+=Al3++Al(OH) +5H O ,D正确;
4 3 2
故选D。
11【答案】C
【知识点】氧化还原反应方程式的书写、溶度积常数相关计算、电子排布式
【分析】烧渣主要成分Fe O 、SiO 及少量的Fe O 、CaO、MgO,加入稀盐酸,Fe O 、Fe O 、
2 3 2 3 4 2 3 3 4
CaO、MgO与稀盐酸生成相应的盐,SiO 不溶于盐酸,故浸渣的主要成分为SiO ,加入还原铁
2 2
粉将Fe3还原为Fe2,加入NaF以氟化物沉淀除去钙镁离子,再加入磷酸二氢铵、氨水、氧气
生成产物FePO 。
4
【详解】A.Fe元素原子序数为26,形成Fe3+时先失去最外层电子,故Fe3+基态核外电子排布式为
[Ar]3d5或1s22s22p63s23p63d5;故A正确
B. SiO 不溶于盐酸,故浸渣的主要成分为SiO ;故B正确
2 2
C.经测定“除钙镁”后的溶液中c F 2103molL1,
c
Ca2
c
Ca2
c
F2
K CaF 1.61010
sp 2 5:2;故C错误
c Mg2 c Mg2 c F2 K sp MgF 2 6.41011
D.根据题干条件,反应物为磷酸二氢铵、氨水、Fe2、O ,生成物为FePO ,根据元素守恒、
2 4
得失电子守恒、电荷守恒写出离子方程式为
4Fe2 O 4H PO 4NH H O4FePO 6H O4NH ;故D正确
2 2 4 3 2 4 2 4
故选C。
12【答案】C
【知识点】新型电池、原电池、电解池综合考查
【分析】由图可知,放电时,Zn失去电子生成ZnOH 2- ,则Zn板为负极,电极方程式为:
4
Zn+4OH--2e=ZnOH 2- ,正极为硝酸根离子被还原为氨气, 正极的电极反应式:
4
NO-+8e-+6H O=NH +9OH- ,此时通过离子交换膜 OH-由左侧移向右侧;充电时,阴极的电极
3 2 3
反应式:ZnOH 2- +2e=Zn+4OH-,阳极的乙醇被氧化为乙酸,电极方程式为:
4
C H OH-4e+4OH=CH COOH+3H O ,此时OH-通过离子交换膜由右侧移向左侧,且生成的氨
2 5 3 2
气和醋酸反应生成CH COONH ,据此解题。
3 4
【详解】A.放电时,正极的电极反应式:NO-+8e-+6H O=NH +9OH- ,A错误
3 2 3
B.放电时,锌板为负极, OH-通过离子交换膜由左侧移向右侧,B错误;
C.充放电过程中,分别产生氨气和醋酸,二者反应生成CH COONH ,故储液罐甲的液流体系
3 4
中可合成出CH COONH ,C正确;
3 4
D.充电时,每生成1molZn的同时消耗0.5mol乙醇,D错误;
湖北省新八校教科研协作体*化学答案(共 12 页)第 6 页故选C。
13【答案】C
【知识点】浓度对化学反应速率的影响、键能、键长、键角、利用杂化轨道理论判断分子的空间
构型、活化能对反应速率的影响
【详解】A.由图可知,(CH ) C-Br在NaOH溶液中反应的第I步反应活化能较大,反应速率较
3 3
慢,对水解速率影响较大,而OH-是第Ⅱ步参与反应,没有真正参与第I步反应,A错误;
B.(CH ) C+中心C原子形成3个共价键,没有孤电子对,杂化类型为sp2,为平面结构,4个碳
3 3
原子位于同一平面内,B错误;
C.根据已知②可知,碳卤键的碳原子上的甲基越多,溴代烷水解相对速率越大,C正确;
D.C-I键的键长更长,键能越小,在水中更易离解成(CH ) C+,D错误;
3 3
故本题选C。
14【答案】D
【知识点】分子的手性、醛类的银镜反应、逆合成分析法、多官能团有机物的结构与性质
【详解】
A.连接四个不同基团的碳原子为手性碳原子,用“*”标记出来,如图 ,存在手性碳原
子,故A错误;
B.丁二醛使溴水褪色是氧化反应,而乙烯使溴水褪色是加成反应,故B错误;
C.托品酮的分子式为C H NO,不能形成芳香族酰胺类化合物,故C错误;
8 13
D.由题中反应的反应机理和生成物的结构简式可知, 、HCHO、 在盐酸
溶液中共热生成主要产物 和次要产物 ,故D正确;
故答案选D。
15【答案】C
【详解】
A.曲线b表示微粒的物种分布系数先增大后减小,因开始时发生反应Cu2++ Cl- CuCl+, CuCl+
分布系数增大,后随着Cu2++ 2Cl- CuCl 的反应进行,CuCl+分布系数减小,故曲线b表示微
2
粒 CuCl+的物种分布系数;故A正确
B.由图可知,A点时CuCl-和CuCl2-物质分布系数几乎为0,可以忽略不计,主要含铜微粒为Cu2+、
3 4
CuCl+和CuCl
2
;ab曲线相交,则c Cu2+ =c CuCl+ ,根据反应:Cu2++ Cl- CuCl+可知,
湖北省新八校教科研协作体*化学答案(共 12 页)第 7 页c
CuCl+
K= =
1
=1.5,c
Cl-
=
2
mol/L;故B正确;
c
Cu2+
c
Cl-
c
Cl-
3
cCuCl
C.设c Cu2+ =c CuCl+ =x 、cCuCl 2 =y,据反应Cu2++ 2Cl- CuCl 2 ,K= c Cu2+ c2 2 Cl- =0.5,
2
y =0.5
2
,x=4.5y,由铜元素守恒,c Cu2+ +c CuCl+ +cCuCl
2
1.010-4mol/L ,则
x 3
4.5y+4.5y+y≈1.0×10-4mol/L,得y≈1.0×10-5mol/L;则Cu2+的氯化络合转化率为
c CuCl+ +cCuCl
2
100%=
4.510-5+1.010-5
=55%
;故C错误
1.010-4 1.010-4
D.用电化学方法可实现酸性刻蚀液的再生,故在电解池的阳极实现CuCl2-转化为CuCl2-,电极
3 4
反应式为CuCl2--e-+Cl-=CuCl2-。故D正确
3 4
故答案选C。
16.(13分)
【答案】(1)[Cr(CH COO) ] •2H O或(CH COO) Cr·H O(2分,写分子式0分) 6(1分)
3 2 2 2 3 2 2
(2)抽滤瓶(或吸滤瓶)(1分)
(3)K (1分) K 、K (1分)
1 2 3
(4)14H++Cr O 2-+6Cl-=2Cr3++3Cl ↑+7H O(2分,少↑扣1分) 盐酸过量,会溶解醋酸亚铬,
2 7 2 2
不利于醋酸亚铬的生成(2分,意思对即可)
(5)冰水或冰浴(1分,写0℃水浴也给分,只写蒸馏水不给分)
(6)醋酸钠溶液要密封,可在左侧加一个装有蒸馏水的吸收装置,防止空气进入醋酸钠溶液。
(2分,答案合理均得分)
【分析】实验时,关闭K ,打开K 、K ,让抽滤瓶内锌粒与盐酸反应产生氢气,同时锌粒与Cr O 2-
1 2 3 2 7
反应生成Cr2+,氢气可排除瓶内空气、保护Cr2+不被氧化,然后关闭K 、K ,打开K ,利用反
2 3 1
应产生的H 将锥形瓶内的溶液压入醋酸钠溶液中,让醋酸钠与CrCl 发生反应,从而制得醋酸亚
2 2
铬。但醋酸亚铬可被空气中的氧气氧化,因此该装置存在一定的缺陷,需要将醋酸钠溶液密封,
且在后面加一个装有蒸馏水的吸收装置,防止空气进入醋酸钠溶液中。
【详解】(1)结合醋酸亚铬晶体的几何结构图,可知醋酸亚铬晶体中含四个CH COO-和2分子
3
H O,因此醋酸亚铬晶体化学式为[Cr(CH COO) ] •2H O或(CH COO) Cr·H O,铬离子周围形成6
2 3 2 2 2 3 2 2
个化学键,配位数是6。
(2)装锌粒和K Cr O 粉末的仪器是含有支管的锥形瓶,名称是抽滤瓶(或吸滤瓶);
2 2 7
(3)实验开始时,应先关闭K ,打开K 、K ,让锥形瓶内锌粒与盐酸反应产生氢气,同时锌粒
1 2 3
与Cr O 2-反应生成Cr2+,氢气可排除瓶内空气、保护Cr2+不被氧化。
2 7
(4)该实验中若盐酸浓度太高,可能发生副反应:14H++Cr O 2-+6Cl-=2Cr3++3Cl ↑+7H O,产生
2 7 2 2
有毒气体Cl ,同时盐酸也必须适量,因为醋酸亚铬晶体易溶于酸,过量盐酸会溶解醋酸亚铬,
2
湖北省新八校教科研协作体*化学答案(共 12 页)第 8 页不利于醋酸亚铬晶体的生成。
(5)醋酸亚铬晶体为砖红色难溶于冷水的固体,因此当CrCl 溶液转移到醋酸钠溶液中后,用冰
2
水或冰浴冷却,以便析出更多沉淀。
(6)醋酸亚铬可被空气中的氧气氧化,因此该实验装置有一定的缺陷,醋酸钠溶液要密封,且
在左侧加一个装有蒸馏水的吸收装置,防止空气进入醋酸钠溶液。
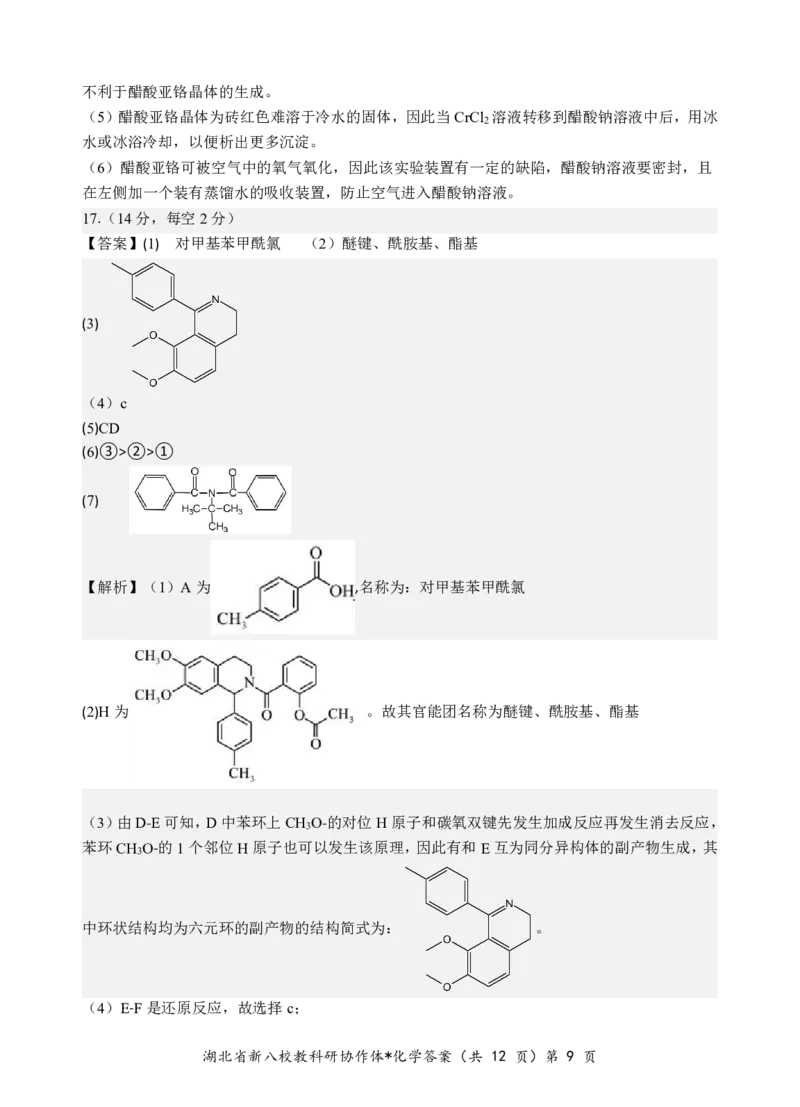
17.(14分,每空2分)
【答案】(1) 对甲基苯甲酰氯 (2)醚键、酰胺基、酯基
(3)
(4)c
(5)CD
(6)③>②>①
(7)
【解析】(1)A为 ,名称为:对甲基苯甲酰氯
(2)H为 。故其官能团名称为醚键、酰胺基、酯基
(3)由D-E可知,D中苯环上CH O-的对位H原子和碳氧双键先发生加成反应再发生消去反应,
3
苯环CH O-的1个邻位H原子也可以发生该原理,因此有和E互为同分异构体的副产物生成,其
3
中环状结构均为六元环的副产物的结构简式为: 。
(4)E-F是还原反应,故选择c;
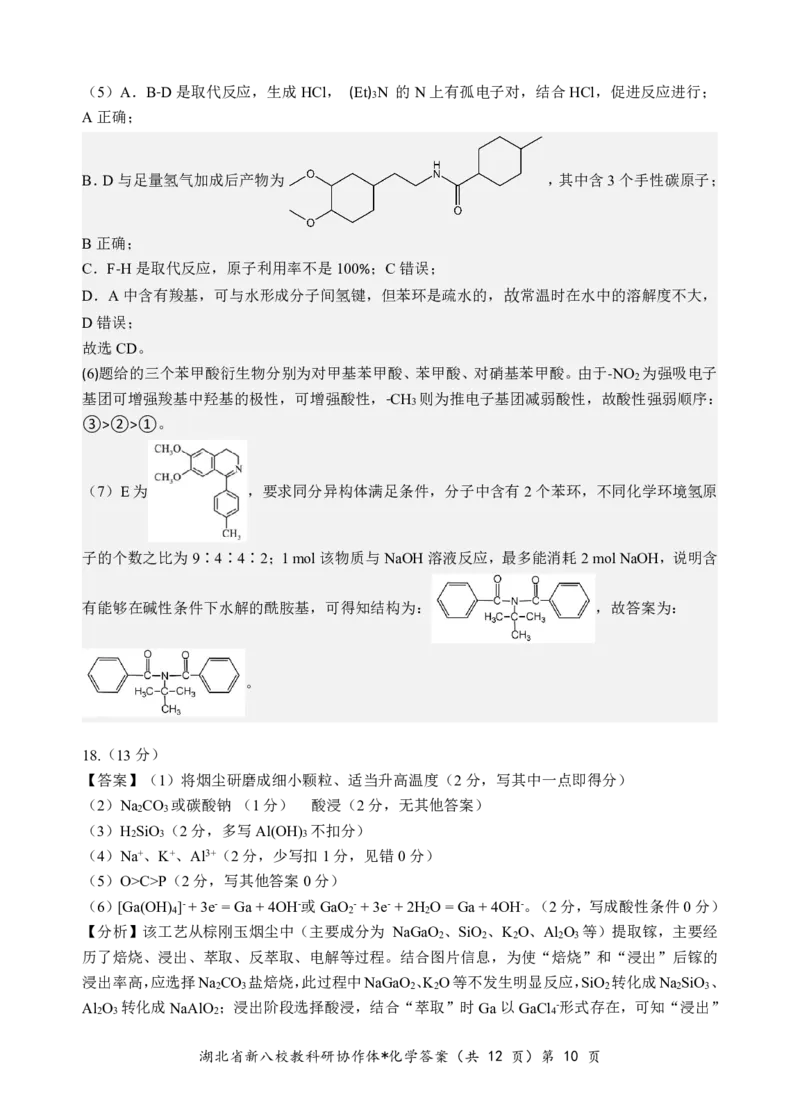
湖北省新八校教科研协作体*化学答案(共 12 页)第 9 页(5)A.B-D是取代反应,生成HCl, (Et) N 的N上有孤电子对,结合HCl,促进反应进行;
3
A正确;
B.D与足量氢气加成后产物为 ,其中含3个手性碳原子;
B正确;
C.F-H是取代反应,原子利用率不是100%;C错误;
D.A中含有羧基,可与水形成分子间氢键,但苯环是疏水的,故常温时在水中的溶解度不大,
D错误;
故选CD。
(6)题给的三个苯甲酸衍生物分别为对甲基苯甲酸、苯甲酸、对硝基苯甲酸。由于-NO 为强吸电子
2
基团可增强羧基中羟基的极性,可增强酸性,-CH 则为推电子基团减弱酸性,故酸性强弱顺序:
3
③>②>①。
(7)E为 ,要求同分异构体满足条件,分子中含有2个苯环,不同化学环境氢原
子的个数之比为9∶4∶4∶2;1mol该物质与NaOH溶液反应,最多能消耗2molNaOH,说明含
有能够在碱性条件下水解的酰胺基,可得知结构为: ,故答案为:
。
18.(13分)
【答案】(1)将烟尘研磨成细小颗粒、适当升高温度(2分,写其中一点即得分)
(2)Na CO 或碳酸钠 (1分) 酸浸(2分,无其他答案)
2 3
(3)H SiO (2分,多写Al(OH) 不扣分)
2 3 3
(4)Na+、K+、Al3+(2分,少写扣1分,见错0分)
(5)O>C>P(2分,写其他答案0分)
(6)[Ga(OH) ]-+3e-=Ga+4OH-或GaO -+3e-+2H O=Ga+4OH-。(2分,写成酸性条件0分)
4 2 2
【分析】该工艺从棕刚玉烟尘中(主要成分为 NaGaO 、SiO 、K O、Al O 等)提取镓,主要经
2 2 2 2 3
历了焙烧、浸出、萃取、反萃取、电解等过程。结合图片信息,为使“焙烧”和“浸出”后镓的
浸出率高,应选择Na CO 盐焙烧,此过程中NaGaO 、K O等不发生明显反应,SiO 转化成Na SiO 、
2 3 2 2 2 2 3
Al O 转化成NaAlO ;浸出阶段选择酸浸,结合“萃取”时Ga以GaCl -形式存在,可知“浸出”
2 3 2 4
湖北省新八校教科研协作体*化学答案(共 12 页)第 10 页阶段选择盐酸“酸浸”,浸出液含GaCl -、Na+、K+、Al3+等离子,Na SiO 生成H SiO 沉淀,萃
4 2 3 2 3
取时发生如下平衡:nTBP+H++GaCl - HGaCl ·nTBP,GaCl -转化为HGaCl ·nTBP进入“萃
4 4 4 4
取液”,Na+、K+、Al3+等在萃余液中;然后加入NaOH溶液等碱性物质进行“反萃取”,为了
避免“电解”提取镓的过程中析出大量氢气,NaOH溶液应适当过量,此时Ga以GaO -或者Ga(OH) -
2 4
的形式进入“富镓反萃取液”,含TBP的空载有机相可以作为“萃取剂”循环利用;最后GaO -
2
或者Ga(OH) -通过电解在阴极得电子生成镓。
4
(1)焙烧通常是高温处理固体原料的过程,效率可能受温度、颗粒大小、搅拌等因素影响。为
提高“焙烧”效率,可采取的措施包括将原料粉碎以增大接触面积,或者适当提高焙烧温度,或
者延长焙烧时间。
(2)结合图中的信息,为使Ga的浸出率较高,应选择的钠盐是Na CO ,浸出方式选择“酸浸”。
2 3
(3)“过滤、洗涤”后的“浸出渣”主要成分是H SiO 沉淀,但因为“酸浸”后,Al的浸出率
2 3
约50%,因此“浸出渣”中可能含有部分Al(OH) 沉淀。
3
(4)“萃取”过程主要存在如下平衡:nTBP + H+ + GaCl - ⇌ HGaCl ·nTBP,GaCl -转化为
4 4 4
HGaCl ·nTBP进入“萃取液”,Na+、K+、Al3+等留在萃余液中,从而实现Ga元素与其他杂质金
4
属离子的分离;
(5)TBP是磷酸三丁酯,该物质中C、O、P原子均采取sp³杂化,三种的元素的电负性由大到
小的顺序为O>C>P。
(6)为了避免电解提取镓的过程中析出大量氢气,“反萃取剂”NaOH溶液应适当过量,此时
Ga以GaO -或者Ga(OH) -的形式进入“富镓反萃取液”,“电解”“富镓反萃取液”提取镓的电
2 4
极方程式为[Ga(OH) ]-+3e-=Ga+4OH-或GaO -+3e-+2H O=Ga+4OH-。
4 2 2
19.(13分,除注明外,每空2分
【答案】(1) H S中H带正电、S带负电,Fe O 中Fe带正电,O带负电;甲吸附方式为同种
2 2 3
电性微粒靠近,乙吸附方式中为不同电性微粒靠近时,吸附能力强。
①
生成的硫单质附着在催化剂表面,降低了催化剂的表面积;
(2)①高温(1分) ②20%;
②
2 2
0.006 0.6 0.006 0.6
pS p2H
7
100kPa
7
100kPa
7
7
③Kr 2 2
p p2H Sp
0.68
2
0.68
2
2 0 100kPa 100kPa
7 7
(3) 2I-+2H S=6I-+S +4H+ 光电催化法脱除硫化氢,能耗低,还能持续发电;碘离
3 2 2
子可循环利用,正极生成的过氧化氢可回收利用
① ②
【解析】 1 H S中H带正电、S带负电,Fe O 中Fe带正电,O带负电;甲吸附方式为同种
2 2 3
电性微粒靠近,乙吸附方式中为不同电性微粒靠近时,吸附能力强。故答案为:H S中H带正电、
( )① 2
S带负电,Fe O 中Fe带正电,O带负电;甲吸附方式为同种电性微粒靠近,乙吸附方式中为不
2 3
同电性微粒靠近时,吸附能力强。
脱除一段时间后,催化剂的活性降低,原因是反应生成的硫单质附着在催化剂表面,降低了催
化剂的表面积;
②
湖北省新八校教科研协作体*化学答案(共 12 页)第 11 页2 ①反应Ⅲ=反应Ⅰ+反应Ⅱ,根据盖斯定律可知,
(
H)3 H
1
H
2
169.863.7223.5kJmol1;
GH TS ,G0时,反应可以自发进行,该反应H 0,S 0,可知高温能自发进
行;
②T ℃时,H S的转化率为32%,S 的收率为4%,设起始投料H S为1mol,则反应的H S为0.32mol,
1 2 2 2 2
S 和CS 中总的S原子为0.32mol,S 中的S原子为0.04mol,则CS 中S原子为0.28mol,CS
2 2 2 2 2
中C原子为0.14mol,则消耗的CH 为0.14mol,H 中总的H原子为0.32mol×2+0.14×4=1.2mol,
4 2
1.2mol 1.2mol
则H 的收率为 20%;
2
1mol21mol4 6mol
③T ℃时,H S的转化率为32%,S 的收率为4%,设起始投料H S为1mol,CH 为1mol,Ar为
1 2 2 2 4
4.7mol
则反应的H S为0.32mol,剩余的H S为0.68mol,S 和CS 中总的S原子为0.32mol,S 中的S
2 2 2 2 2
原子为0.04mol,S 为0.02mol,则CS 中S原子为0.28mol,CS 为0.14mol,CS 中C原子为0.14mol,
2 2 2 2
则消耗的CH 为0.14mol,剩余的CH 为0.86mol,由氢原子守恒知,H 为0.6mol,体系总的物
4 4 2
质的量为7mol,反应Ⅰ的相对压力平衡常数为
。
3 根据图象可知,反应的离子方程式为:2I-+2H S=6I-+S +4H+;
3 2 2
(故)答①案为:2I-+2H S=6I-+S +4H+
3 2 2
光电催化法脱除硫化氢,能耗低,还能持续发电;碘离子可循环利用,正极生成的过氧化氢可
回收利用;
②
故答案为:光电催化法脱除硫化氢,能耗低,还能持续发电;碘离子可循环利用,正极生成的过
氧化氢可回收利用;
湖北省新八校教科研协作体*化学答案(共 12 页)第 12 页