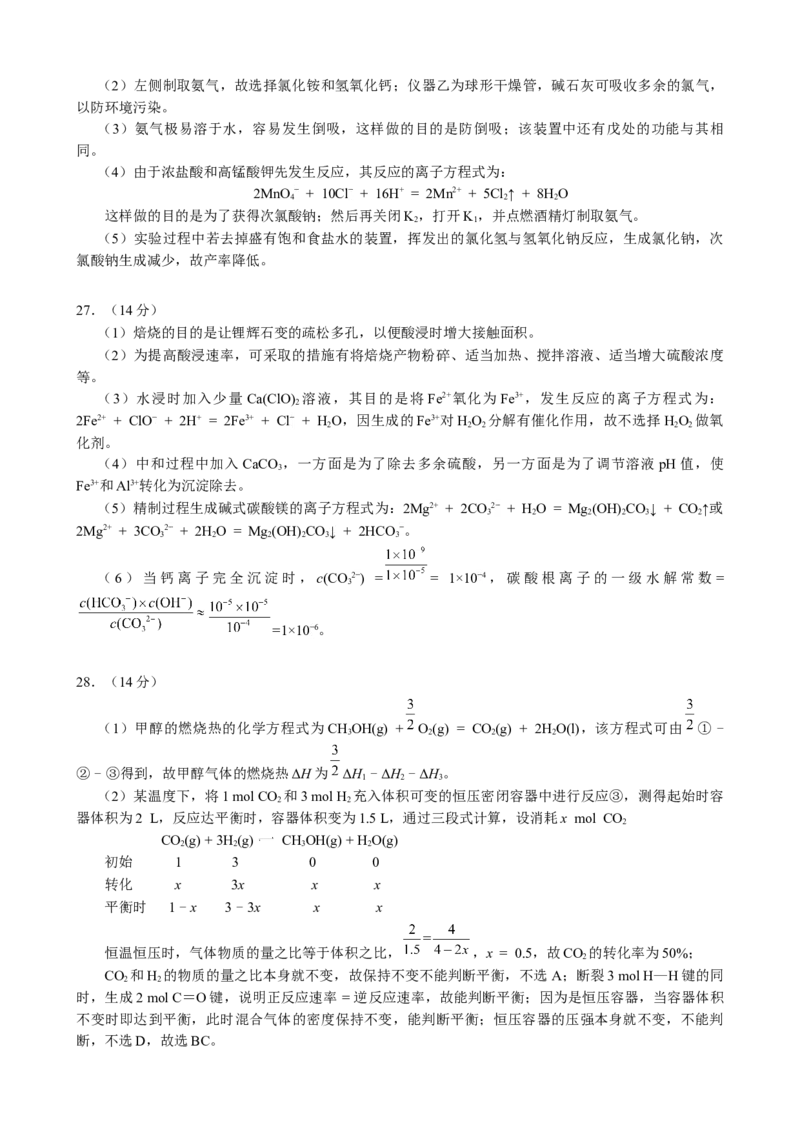文档内容
2024 届高三第一次联考
化学参考答案及评分标准
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
7.B 8.D 9.C 10.A 11.C 12.D 13.B
三、非选择题:共58分。
注意:1.只要答案合理,均可酌情给分;
2.化学方程式书写,反应物、生成物写错或未配平均为0分,无条件或错误或无“↑”“↓”扣
1分。
26.(15分,除标注外,每空2分)
(1)不是(1分)
(2)NH Cl和Ca(OH) (2分,1分1个) 球形干燥管(1分)
4 2
吸收多余的氯气,以防环境污染
(3)防倒吸(1分) 戊(1分)
(4)2MnO − + 10Cl− + 16H+ = 2Mn2+ + 5Cl↑ + 8HO
4 2 2
较多的次氯酸钠(1分) 点燃酒精灯(1分)
(5)有(1分)
浓HCl具有挥发性,挥发出的HCl与NaOH反应生成氯化钠,次氯酸钠生成减少,故产率降低
27.(14分,除标注外,每空2分)
(1)让锂辉石变得疏松多孔,以便酸浸时增大接触面积(只答到“将 - 锂辉石转变为 - 锂辉石”
或其他不完整的回答给1分)
(2)将焙烧产物粉碎、适当加热、搅拌溶液、适当增大硫酸浓度(答一条即可,1分)
(3)将Fe2+氧化为Fe3+(1分) 2Fe2+ + ClO− + 2H+ = 2Fe3+ + Cl− + HO
2
Fe3+对HO 的分解有催化作用
2 2
(4)调节溶液pH值,使Fe3+和Al3+转化为沉淀除去
( 5 ) 2Mg2+ + 2CO2− + HO = Mg(OH) CO↓ + CO↑ ( 或 2Mg2+ + 3CO2− + 2HO =
3 2 2 2 3 2 3 2
Mg(OH) CO↓ + 2HCO−)
2 2 3 3
(6)1×10−6
28.(14分,除标注外,每空2分)
(1) ΔH -ΔH -ΔH
1 2 3
(2)50% BC(2分,1分1个)
(3)Ⅰ 放热 低温(1分)
(4)副反应是吸热反应,温度升高,以副反应正向移动为主,CO 的平衡转化率升高,反应③是放热
2
反应,温度升高,平衡逆向移动,甲醇产率降低
(控制温度并)使用合适的催化剂(1分)
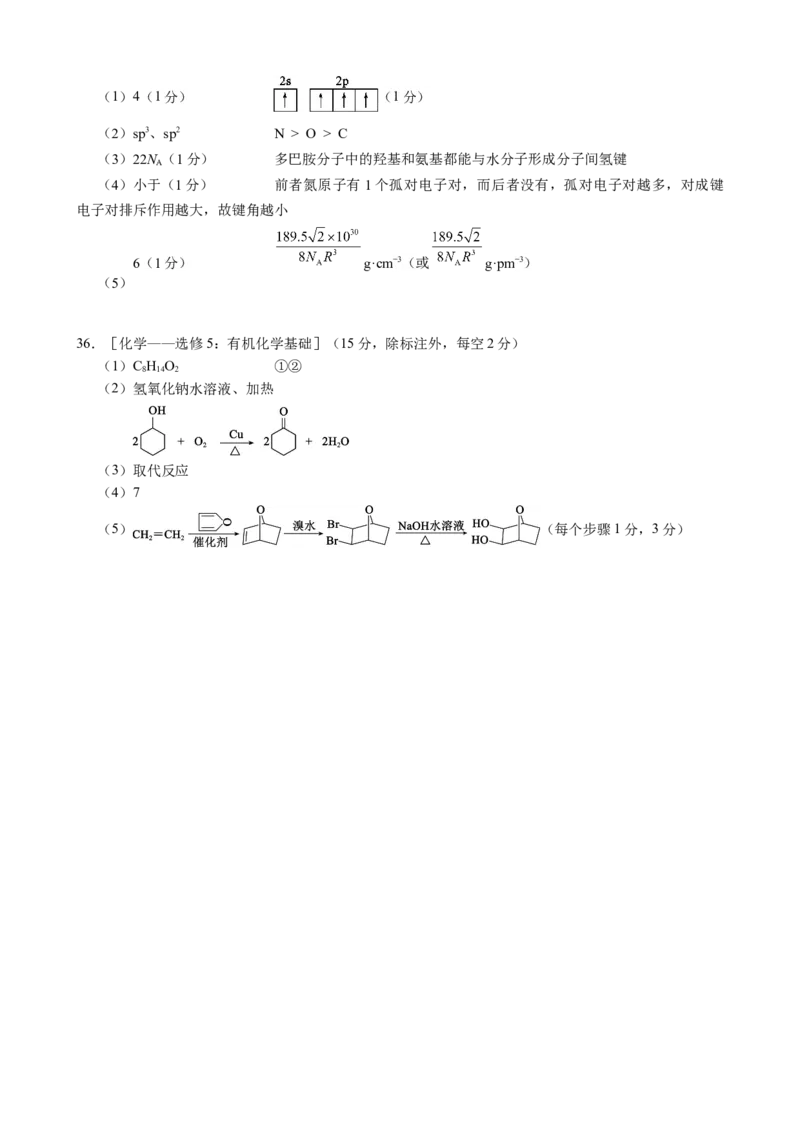
35.[化学——选修3:物质结构与性质](15分,除标注外,每空2分)(1)4(1分) (1分)
(2)sp3、sp2 N > O > C
(3)22N (1分) 多巴胺分子中的羟基和氨基都能与水分子形成分子间氢键
A
(4)小于(1分) 前者氮原子有1个孤对电子对,而后者没有,孤对电子对越多,对成键
电子对排斥作用越大,故键角越小
6(1分) g·cm−3(或 g·pm−3)
(5)
36.[化学——选修5:有机化学基础](15分,除标注外,每空2分)
(1)C H O ①②
8 14 2
(2)氢氧化钠水溶液、加热
(3)取代反应
(4)7
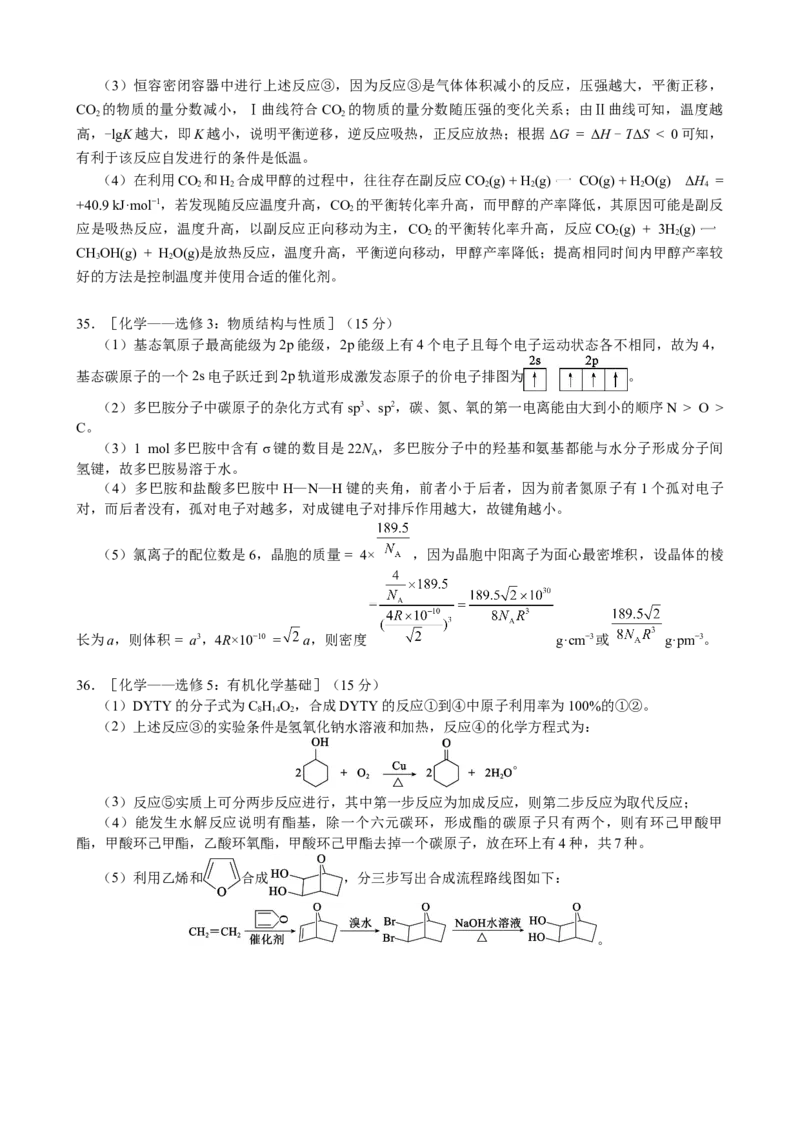
(5) (每个步骤1分,3分)【解析】
7.B
燃煤脱硫能减少酸雨,但是煤燃烧依然会产生大量CO,不利于实现“碳达峰”和“碳中和”,B错
2
误;故答案选B。
8.D
7.8 g Na O 与水充分反应,转移电子数应为0.1N ,A错误;标准状况下,氯仿不是气体,22.4 L氯
2 2 A
仿不是1 mol,无法计算含有的共价键数目,B错误;常温下,1 L pH = 1的硫酸溶液中含有水,水也含
有氢原子,氢原子数目远大于0.1N ,C错误;冰醋酸和葡萄糖的最简式均为 CHO,30 g冰醋酸和葡萄
A 2
糖的混合物含有1 mol CHO,原子总数为4N ,D正确;故答案选D。
2 A
9.C
该物质含有3种官能团,A错误;1 mol该物质最多能与7 mol H 加成,B错误;该物质苯环上有6
2
种等效氢,故该物质苯环上氢原子发生氯代时,一氯代物有6种,C正确;该物质所有碳原子可能全部共
平面,D错误;故答案选C。
10.A
根据题目信息可推出X、Y、Z元素分别是H、N、O,M、N元素可能是Mg、Al或Na、Si,H、
N、O形成的HNO 是共价化合物,NH NO 是离子化合物,A正确;原子半径应为M > N > Y > Z >
3 4 3
X,B错误;单质的熔点:N > M,C错误;简单氢化物的稳定性:Y < Z,D错误;故答案选A。
11.C
由题目信息可知电解池左池发生的主要反应为 + 6H+ + 6e− = ,C错误;电极D是阴极,电
极E是阳极,A是负极,B是正极,电子移动方向为:E → B,A → D,A正确;H+由电解池的右池移向
左池,B正确;右池发生的反应为4OH− - 4e− = O↑ + 2HO,产生2.8 mol气体可知转移电子总数为
2 2
11.2 mol,由左池数据可知,消耗1.2 mol苯,生成目标产物环己烷消耗电子数为7.2 mol,电流效率=
,D正确;故答案选C。
12.D
将少量Na投入CuSO 溶液中,先发生Na与水的反应,无法置换出 Cu,无法证明活泼性:Na >
4
Cu,A错误;将SO 通入漂白粉溶液,将发生氧化还原反应,无法证明酸性:HSO > HClO,B错误;
2 2 3
将少量稀硫酸滴入NaSO 溶液,反应的实质是2H+ + SO2− = S↓ + SO ↑ + HO,无法证明HSO 具有
2 2 3 2 3 2 2 2 4
氧化性,C错误;取适量淀粉水解液,滴入几滴碘水,观察到溶液变蓝,则淀粉未水解完全或未水解,溶
液不变蓝则水解完全,D正确;故答案选D。
13.B
由图可知,pH = 8时,溶液中CO2−全转化为HCO −,水解程度减小,水的电离程度减小,此时水的
3 3
电离程度不是最大,A错误;碳酸的第二步电离常数K = ,当pH = 10.5时,CO2−浓度
a2 3
等于 HCO −浓度,可求出 K = 10−10.5,当溶液中 c(HCO −):c(CO2−) = 2:1 时,K = = 10−10.5,
3 a2 3 3 a2
c(H+) = 2 × 10−10.5,pH = -lg(2 × 10−10.5) = 10.2,B正确;在同一溶液中,HCO 和CO2−不能大量共存,
2 3 3
C错误;pH = 7时,溶液主要成分为NaCl、NaHCO 、HCO ,且NaCl的物质的量大于NaHCO ,溶液中
3 2 3 3
离子浓度大小关系为:c(Na+) > c(Cl−) > c(HCO −) ,D错误;故答案选B。
3
26.(15分)
(1)该反应中各元素的化合价未改变,故不是氧化还原反应。(2)左侧制取氨气,故选择氯化铵和氢氧化钙;仪器乙为球形干燥管,碱石灰可吸收多余的氯气,
以防环境污染。
(3)氨气极易溶于水,容易发生倒吸,这样做的目的是防倒吸;该装置中还有戊处的功能与其相
同。
(4)由于浓盐酸和高锰酸钾先发生反应,其反应的离子方程式为:
2MnO − + 10Cl− + 16H+ = 2Mn2+ + 5Cl↑ + 8HO
4 2 2
这样做的目的是为了获得次氯酸钠;然后再关闭K,打开K,并点燃酒精灯制取氨气。
2 1
(5)实验过程中若去掉盛有饱和食盐水的装置,挥发出的氯化氢与氢氧化钠反应,生成氯化钠,次
氯酸钠生成减少,故产率降低。
27.(14分)
(1)焙烧的目的是让锂辉石变的疏松多孔,以便酸浸时增大接触面积。
(2)为提高酸浸速率,可采取的措施有将焙烧产物粉碎、适当加热、搅拌溶液、适当增大硫酸浓度
等。
(3)水浸时加入少量 Ca(ClO) 溶液,其目的是将Fe2+氧化为 Fe3+,发生反应的离子方程式为:
2
2Fe2+ + ClO− + 2H+ = 2Fe3+ + Cl− + HO,因生成的Fe3+对HO 分解有催化作用,故不选择HO 做氧
2 2 2 2 2
化剂。
(4)中和过程中加入CaCO ,一方面是为了除去多余硫酸,另一方面是为了调节溶液pH值,使
3
Fe3+和Al3+转化为沉淀除去。
(5)精制过程生成碱式碳酸镁的离子方程式为:2Mg2+ + 2CO2− + HO = Mg(OH) CO↓ + CO↑或
3 2 2 2 3 2
2Mg2+ + 3CO2− + 2HO = Mg(OH) CO↓ + 2HCO−。
3 2 2 2 3 3
(6)当钙离子完全沉淀时,c(CO2−) = = 1×10−4,碳酸根离子的一级水解常数=
3
=1×10−6。
28.(14分)
(1)甲醇的燃烧热的化学方程式为CHOH(g) + O(g) = CO(g) + 2HO(l),该方程式可由 ① -
3 2 2 2
②-③得到,故甲醇气体的燃烧热ΔH为 ΔH -ΔH -ΔH。
1 2 3
(2)某温度下,将1 mol CO 和3 mol H 充入体积可变的恒压密闭容器中进行反应③,测得起始时容
2 2
器体积为2 L,反应达平衡时,容器体积变为1.5 L,通过三段式计算,设消耗x mol CO
2
CO(g) + 3H(g) CHOH(g) + H O(g)
2 2 3 2
初始 1 3 0 0
转化 x 3x x x
平衡时 1-x 3-3x x x
恒温恒压时,气体物质的量之比等于体积之比, ,x = 0.5,故CO 的转化率为50%;
2
CO 和H 的物质的量之比本身就不变,故保持不变不能判断平衡,不选A;断裂3 mol H—H键的同
2 2
时,生成2 mol C=O键,说明正反应速率 = 逆反应速率,故能判断平衡;因为是恒压容器,当容器体积
不变时即达到平衡,此时混合气体的密度保持不变,能判断平衡;恒压容器的压强本身就不变,不能判
断,不选D,故选BC。(3)恒容密闭容器中进行上述反应③,因为反应③是气体体积减小的反应,压强越大,平衡正移,
CO 的物质的量分数减小,Ⅰ曲线符合CO 的物质的量分数随压强的变化关系;由Ⅱ曲线可知,温度越
2 2
高,-lgK越大,即K越小,说明平衡逆移,逆反应吸热,正反应放热;根据 ΔG = ΔH-TΔS < 0可知,
有利于该反应自发进行的条件是低温。
(4)在利用CO 和H 合成甲醇的过程中,往往存在副反应CO(g) + H (g) CO(g) + H O(g) ΔH =
2 2 2 2 2 4
+40.9 kJ·mol−1,若发现随反应温度升高,CO 的平衡转化率升高,而甲醇的产率降低,其原因可能是副反
2
应是吸热反应,温度升高,以副反应正向移动为主,CO 的平衡转化率升高,反应CO(g) + 3H(g)
2 2 2
CHOH(g) + HO(g)是放热反应,温度升高,平衡逆向移动,甲醇产率降低;提高相同时间内甲醇产率较
3 2
好的方法是控制温度并使用合适的催化剂。
35.[化学——选修3:物质结构与性质](15分)
(1)基态氧原子最高能级为2p能级,2p能级上有4个电子且每个电子运动状态各不相同,故为4,
基态碳原子的一个2s电子跃迁到2p轨道形成激发态原子的价电子排图为 。
(2)多巴胺分子中碳原子的杂化方式有sp3、sp2,碳、氮、氧的第一电离能由大到小的顺序N > O >
C。
(3)1 mol多巴胺中含有σ键的数目是22N ,多巴胺分子中的羟基和氨基都能与水分子形成分子间
A
氢键,故多巴胺易溶于水。
(4)多巴胺和盐酸多巴胺中H—N—H键的夹角,前者小于后者,因为前者氮原子有1个孤对电子
对,而后者没有,孤对电子对越多,对成键电子对排斥作用越大,故键角越小。
(5)氯离子的配位数是6,晶胞的质量 = 4× ,因为晶胞中阳离子为面心最密堆积,设晶体的棱
长为a,则体积= a3,4R×10−10 = a,则密度 g·cm−3或 g·pm−3。
36.[化学——选修5:有机化学基础](15分)
(1)DYTY的分子式为C H O,合成DYTY的反应①到④中原子利用率为100%的①②。
8 14 2
(2)上述反应③的实验条件是氢氧化钠水溶液和加热,反应④的化学方程式为:
。
(3)反应⑤实质上可分两步反应进行,其中第一步反应为加成反应,则第二步反应为取代反应;
(4)能发生水解反应说明有酯基,除一个六元碳环,形成酯的碳原子只有两个,则有环己甲酸甲
酯,甲酸环己甲酯,乙酸环氧酯,甲酸环己甲酯去掉一个碳原子,放在环上有4种,共7种。
(5)利用乙烯和 合成 ,分三步写出合成流程路线图如下:
。