文档内容
秘密★启用前
嘉陵一中高 2023 级高二上期第三次月考化学试题
(考试时间:75分钟 总分:100分)
注意事项:
1.答题前,考生务必将自己的姓名、班级填写在答题卡上。将考号条形码粘贴在答题卡上的指定位置。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试卷、草稿纸和
答题卡上的非答题区域均无效。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡上对应的答题区域内。写在试卷、草
稿纸和答题卡上的非答题区域均无效。
4.考生必须保持答题卡的整洁。
可能用到的相对原子质量:H—1 C—12 N—14 O—16
一、选择题 (每小题只有一个选项符合题意,每小题3分,共45分)
1.酸碱中和滴定实验中不需要的仪器是
A. B. C. D.
2.化学反应速率的调控被广泛应用于生活、生产中。下列操作可减慢化学反应速率的是
A.工业制硫酸时采用400~500℃高温 B.向炉膛内鼓风可以使炉火更旺
C.用冰箱冷藏保鲜食物 D.工业合成氨使用催化剂
3.下列化学用语表示不正确的是
A.Mg2+的结构示意图:
B.基态氧原子的轨道表示式:
C. 基态Cr原子的价层电子排布式:3d44s2
D.S2-的电子排布式:1s22s22p63s23p6
4、下列各组元素的性质比较,正确的是
A. 第一电离能:B>Al>Ga B. 电负性:F> N>O
C. 最高正价:F>Si >S D. 原子半径:P >N> C
5.利用反应2NO(g)+2CO(g) 2CO (g)+N (g) △H= -746.8kJ·mol-1,可净化汽车尾气,若要提高
2 2
NO的转化率,可采取的措施是
A.升高温度
B.恒容时通入氦气
C.增大容器体积
D.分离出部分CO 和N
2 2
第 1 页 共 8 页6.设N 为阿伏加德罗常数的值, 下列说法正确的是
A
A.1LpH 3的硫酸溶液中含有的 H数为1103N
A
B.常温常压下,23gNO 中含有的原子总数为0.5N
2 A
C. 1molL1 NH Cl溶液中含有的NH数小于N
4 4 A
D.氢氧燃料电池工作时,正极消耗11.2L 气体,电路中转移电子数一定为N
A
7.下列离子方程式与所述事实相符且正确的是
A.NaHS 溶液显碱性的原因:HS-+H O H O++S2-
2 3
B.Al (SO ) 可以净水:Al3++3H O=Al(OH) ↓+3H+
2 4 3 2 3
C.用纯碱清洗油污:CO 2-+2H O H CO +2OH-
3 2 2 3
D.向氢氧化镁饱和溶液中滴加氯化铁溶液,出现红褐色沉淀:
3Mg(OH) (s)+2Fe3+(aq) 2Fe(OH) (s)+3Mg2+(aq)
2 3
8.已知N (g)+3H (g) 2NH (g),在恒温恒容下进行,能证明反应达平衡状态的是
2 2 3
A.3v (H )=2v (NH )
正 2 逆 3
B.当有1molN≡N断裂的同时,有6molN-H 生成
C.容器中气体压强不再发生改变
D.n(N ):n(H ):n(NH )=1:3:2
2 2 3
9.某小组同学模拟工业上离子交换膜法制烧碱,用惰性电极电解硫酸钾溶液来制取氢气、氧气、硫酸
和氢氧化钾,装置如图所示,下列说法不正确的是
A. 通电开始后,阴极附近溶液pH会增大
B. 通过阴离子交换膜的离子数等于通过阳离子交换膜的离子数
C. 阳极的电极反应式为2H O-4e-=4H++O ↑
2 2
D. 若阴极产生0.5mol气体,则反应转移的电子数为N
A
第 2 页 共 8 页10.下列有关电解质溶液的说法正确的是
c
NH
A.向盐酸中加入氨水至中性,溶液中 4 1
c
Cl
B.室温下,pH=3 的CH COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH<7
3
c
CH
COO
C.将CH COONa溶液从20℃升温至30℃,溶液中 3 增大
3 cCH COOHc OH
3
D.浓度均为0.1molL1的Na CO 、NaHCO 混合溶液中:
2 3 3
c CO2 c HCO,且3c Na 2c CO2 c HCO cH CO
3 3 3 3 2 3
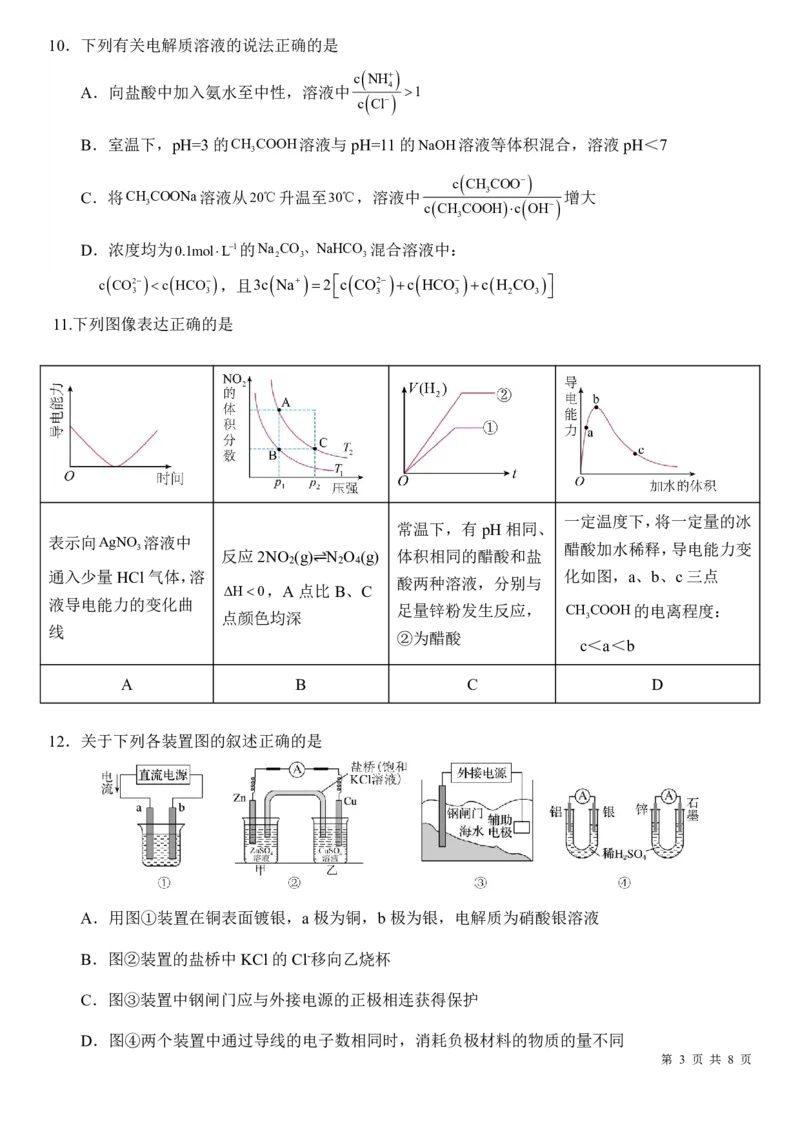
11.下列图像表达正确的是
一定温度下,将一定量的冰
常温下,有pH相同、
表示向AgNO 溶液中
3 醋酸加水稀释,导电能力变
反应2NO (g) N O (g) 体积相同的醋酸和盐
2 2 4
通入少量HCl 气体,溶
酸两种溶液,分别与
化如图,a、b、c 三点
H0,A点比B、C
液导电能力的变化曲
足量锌粉发生反应, CH COOH的电离程度:
点颜色均深 3
线
②为醋酸
c<a<b
A B C D
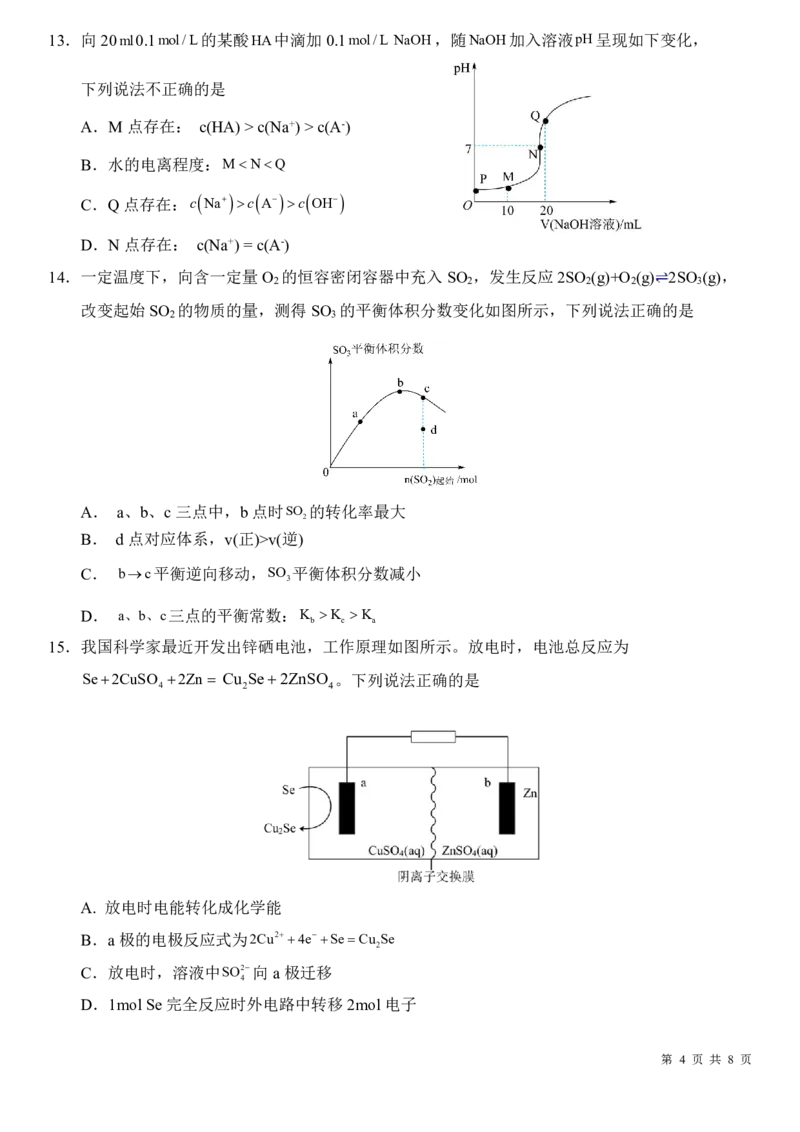
12.关于下列各装置图的叙述正确的是
A.用图①装置在铜表面镀银,a极为铜,b极为银,电解质为硝酸银溶液
B.图②装置的盐桥中KCl的Cl-移向乙烧杯
C.图③装置中钢闸门应与外接电源的正极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
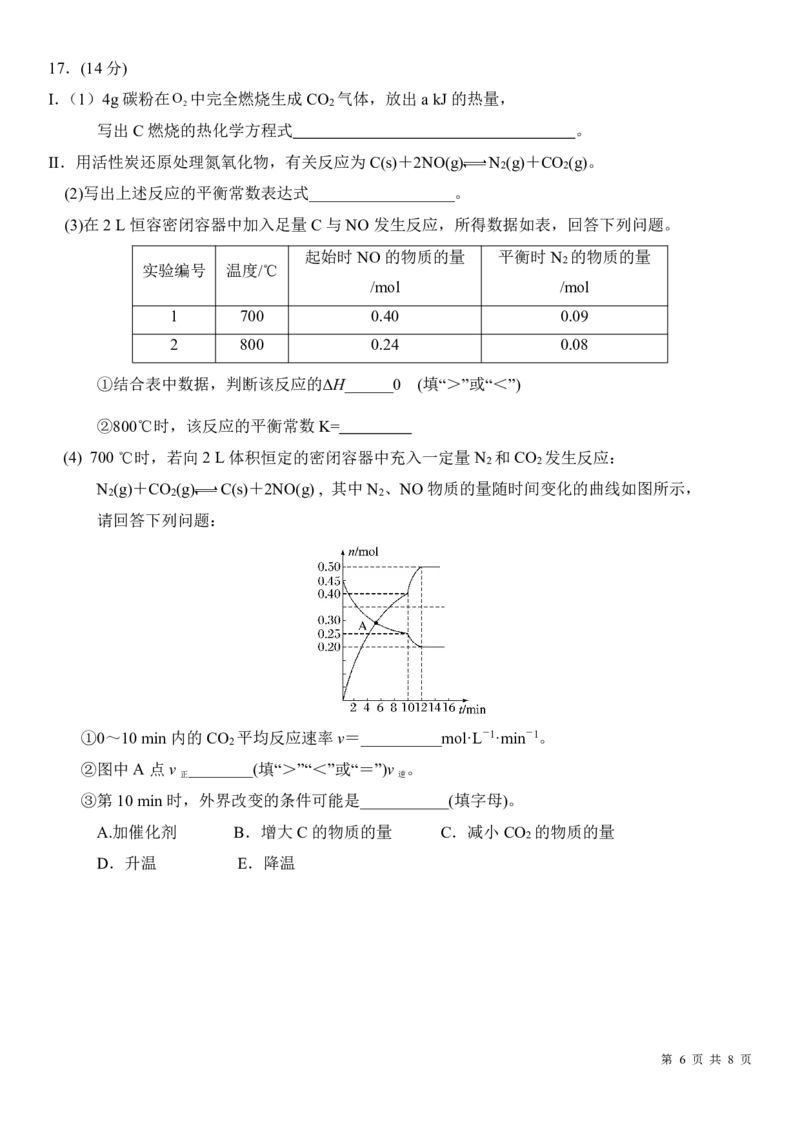
第 3 页 共 8 页13.向20ml0.1mol/L的某酸HA中滴加0.1mol/L NaOH,随NaOH加入溶液pH呈现如下变化,
下列说法不正确的是
A.M 点存在: c(HA) > c(Na+) >c(A-)
B.水的电离程度:MNQ
C.Q点存在:c
Na
c
A
c
OH
D.N点存在: c(Na+)= c(A-)
14.一定温度下,向含一定量O 的恒容密闭容器中充入SO ,发生反应2SO (g)+O (g) 2SO (g),
2 2 2 2 3
改变起始SO 的物质的量,测得SO 的平衡体积分数变化如图所示,下列说法正确的是
2 3
A. a、b、c 三点中,b点时SO 的转化率最大
2
B. d点对应体系,v(正)>v(逆)
C. bc平衡逆向移动,SO 平衡体积分数减小
3
D. a、b、c三点的平衡常数:K K K
b c a
15.我国科学家最近开发出锌硒电池,工作原理如图所示。放电时,电池总反应为
Se2CuSO 2Zn Cu Se2ZnSO 。下列说法正确的是
4 2 4
A. 放电时电能转化成化学能
B.a极的电极反应式为2Cu2 4eSeCu Se
2
C.放电时,溶液中SO2向a极迁移
4
D.1molSe完全反应时外电路中转移2mol 电子
第 4 页 共 8 页二、填空题(本大题共4小题,共55分)
16.(13分)
现有七种元素,其中A、B、C、D、E 为短周期主族元素,F、G 为第四周期元素,它们的
原子序数依次增大。请根据下列相关信息回答问题:
元素 相关信息
A 元素的核外电子数和能层数相等,也是宇宙中最丰富的元素
B 元素原子的p轨道电子数比s 轨道电子数少1
原子的第一至第四电离能分别是
C
I =738kJ·mol-1;I =1451kJ·mol-1; I =7733kJ·mol-1;I =10540kJ·mol-1
1 2 3 4
D 原子核外最高能层p轨道半满
E 元素的主族序数与周期数的差为3
F 是前四周期中金属性最强的元素
G 价电子排布式为3d64s2
(1) A基态原子原子轨道的形状为_____形。
(2) B 位于第______族,属于_____区元素,
(3) C 的最高价氧化物的水化物的化学式为___________。
(4) D基态原子价电子排布式为__________。
(5) D和E 的基态原子中电离能较大的是__________(用元素符号表示)
(6) E和F 的简单离子半径由大到小顺序为______________(用离子符号表示)。
(7) 少量单质G与B 最高价含氧酸的稀溶液反应的化学方程式为 。
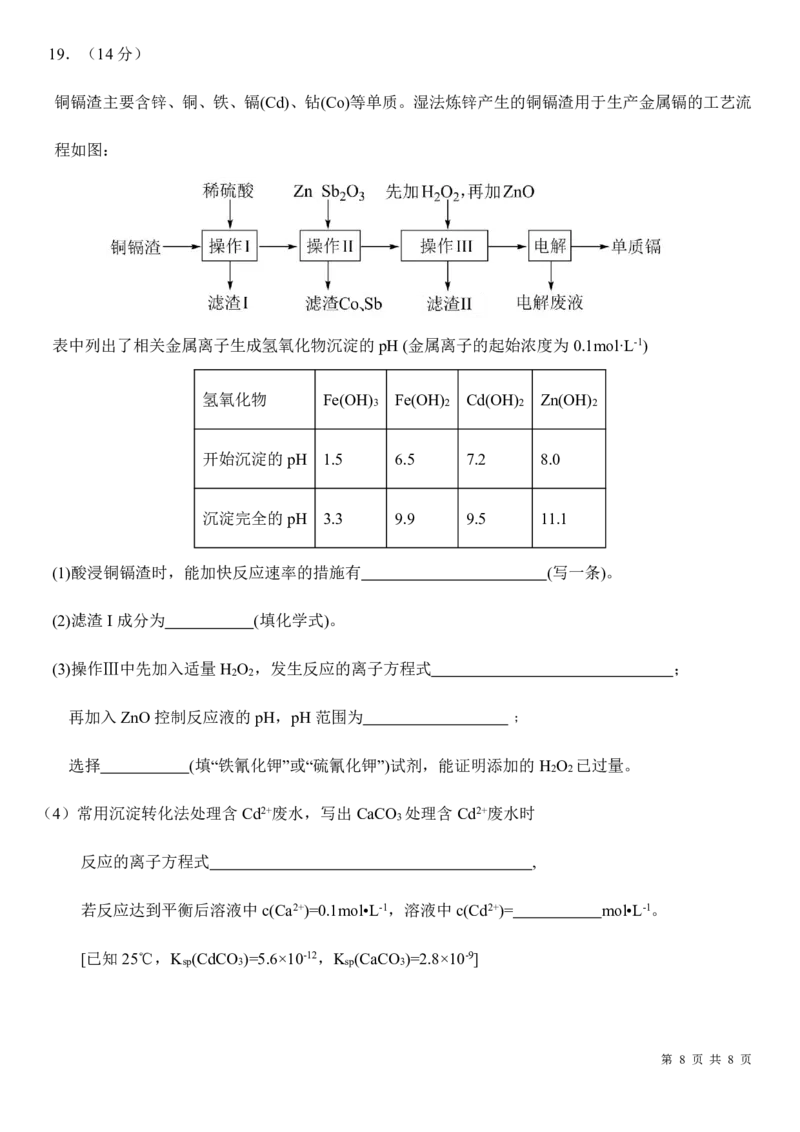
第 5 页 共 8 页17.(14分)
I.(1)4g碳粉在O 中完全燃烧生成CO 气体,放出a kJ 的热量,
2 2
写出C 燃烧的热化学方程式 。
II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) N (g)+CO (g)。
2 2
(2)写出上述反应的平衡常数表达式__________________。
(3)在2L恒容密闭容器中加入足量C 与NO 发生反应,所得数据如表,回答下列问题。
起始时NO的物质的量 平衡时N 的物质的量
2
实验编号 温度/℃
/mol /mol
1 700 0.40 0.09
2 800 0.24 0.08
①结合表中数据,判断该反应的ΔH______0 (填“>”或“<”)
②800℃时,该反应的平衡常数K=
(4) 700℃时,若向2L体积恒定的密闭容器中充入一定量N 和CO 发生反应:
2 2
N (g)+CO (g) C(s)+2NO(g) , 其中N 、NO物质的量随时间变化的曲线如图所示,
2 2 2
请回答下列问题:
①0~10min内的CO 平均反应速率v=__________mol·L-1·min-1。
2
②图中A点v ________(填“>”“<”或“=”)v 。
正 逆
③第10min时,外界改变的条件可能是___________(填字母)。
A.加催化剂 B.增大C的物质的量 C.减小CO 的物质的量
2
D.升温 E.降温
第 6 页 共 8 页18.(14分)
滴定是一种重要的定量实验方法。现拟用KMnO 溶液去测定市场上售卖的草酸(H C O )的纯度,
4 2 2 4
步骤如下: (已知:M(H C O ) =90g·mol-1)
2 2 4
①称取1.260g草酸样品,将其配制成100mL 溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适量的稀H SO ;
2 4
③用浓度为0.05000mol·L-1的KMnO 标准溶液进行滴定。
4
(1)已知草酸为二元弱酸, 写出其第一步电离的电离方程式:
(2)写出滴定过程中反应的离子方程式 。
(3)滴定时盛装KMnO 标准溶液所用仪器为 。
4
(4)由下图可知,消耗KMnO 溶液的体积为 mL
4
(5)达到滴定终点时的现象为 。
(6)通过上述数据,计算样品中草酸的质量分数为 % 。(小数点后保留两位有效数字)
(7)以标准KMnO 溶液滴定草酸溶液时,未用标准KMnO 溶液润洗滴定管,
4 4
引起实验结果 (偏大、偏小或无影响);
第 7 页 共 8 页19.(14分)
铜镉渣主要含锌、铜、铁、镉(Cd)、钻(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流
程如图:
表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
氢氧化物 Fe(OH) Fe(OH) Cd(OH) Zn(OH)
3 2 2 2
开始沉淀的pH 1.5 6.5 7.2 8.0
沉淀完全的pH 3.3 9.9 9.5 11.1
(1)酸浸铜镉渣时,能加快反应速率的措施有 (写一条)。
(2)滤渣I成分为 (填化学式)。
(3)操作Ⅲ中先加入适量H O ,发生反应的离子方程式 ;
2 2
再加入ZnO控制反应液的pH,pH范围为 ﹔
选择 (填“铁氰化钾”或“硫氰化钾”)试剂,能证明添加的H O 已过量。
2 2
(4)常用沉淀转化法处理含Cd2+废水,写出CaCO 处理含Cd2+废水时
3
反应的离子方程式 ,
若反应达到平衡后溶液中c(Ca2+)=0.1mol•L-1,溶液中c(Cd2+)= mol•L-1。
[已知25℃,K (CdCO )=5.6×10-12,K (CaCO )=2.8×10-9]
sp 3 sp 3
第 8 页 共 8 页