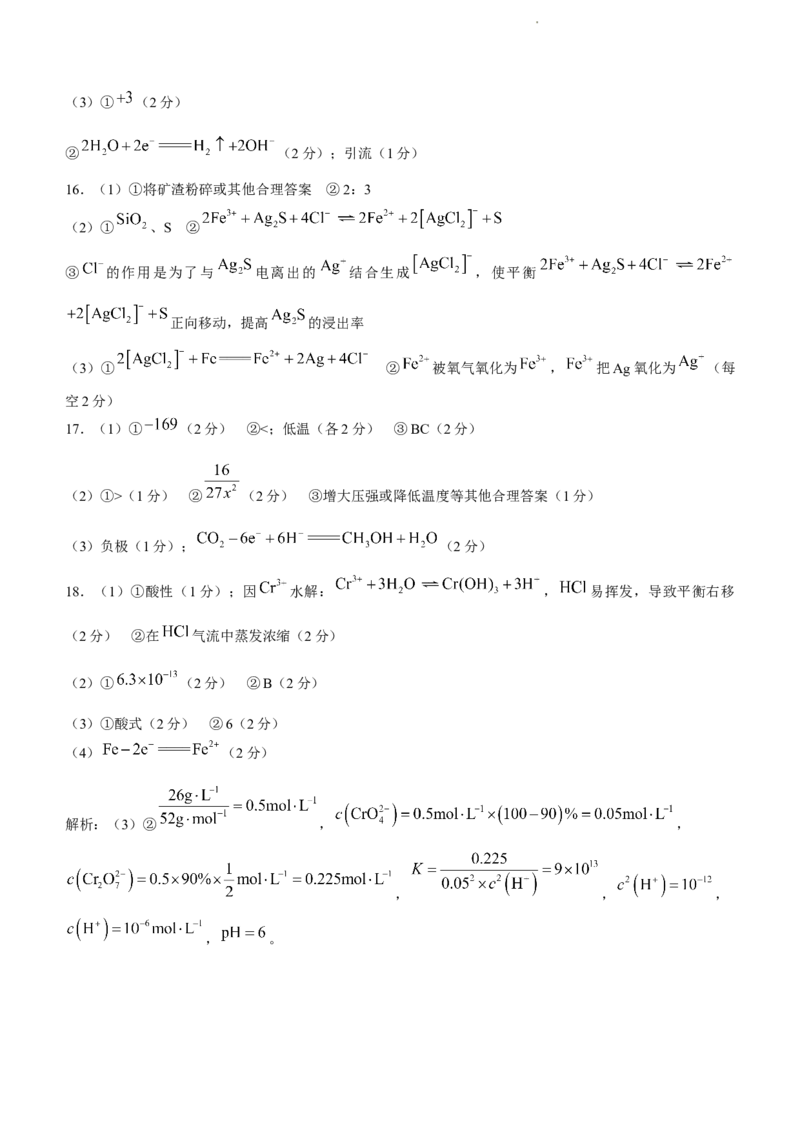文档内容
2023~2024 学年高三第四次联考(月考)试卷
化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签字笔在答题卡上各题的答题区
域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:前面联考内容(约 40%);化学反应与能量变化、电化学基础、化学反应
速率和化学平衡、电解质溶液(约60%)。
5.可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 Cr 52 Fe 56
一、选择题:本题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一
项是符合题目要求的。
1.化学与生活密切相关。下列说法正确的是( )
A.焰火中红色来源于钠盐灼烧 B.温室气体是形成酸雨的主要物质
C.家用陶瓷碗主要成分为 和 D.切开的茄子放置后切面变色涉及化学反应
2.下列说法正确的是( )
A. 电子式:
B. 电离:
C. 中P原子最外层达8电子稳定结构
D. 第一步水解:
3.用浓硫酸配制 时,一定要用到的仪器为( )
A. B. C. D.
4.下列各组离子在给定溶液中能大量共存的是( )
学科网(北京)股份有限公司A. 的 中: 、 、 、
B. 的 溶液中: 、 、 、
C. 的 溶液中: 、 、 、
D. 的 溶液中: 、 、 、
5.其他条件不变,升高温度,下列数据不一定增大的是( )
A. 的水解常数 B. 电离常数
C.可逆反应的化学平衡常数 D.蒸馏水中的 电离度
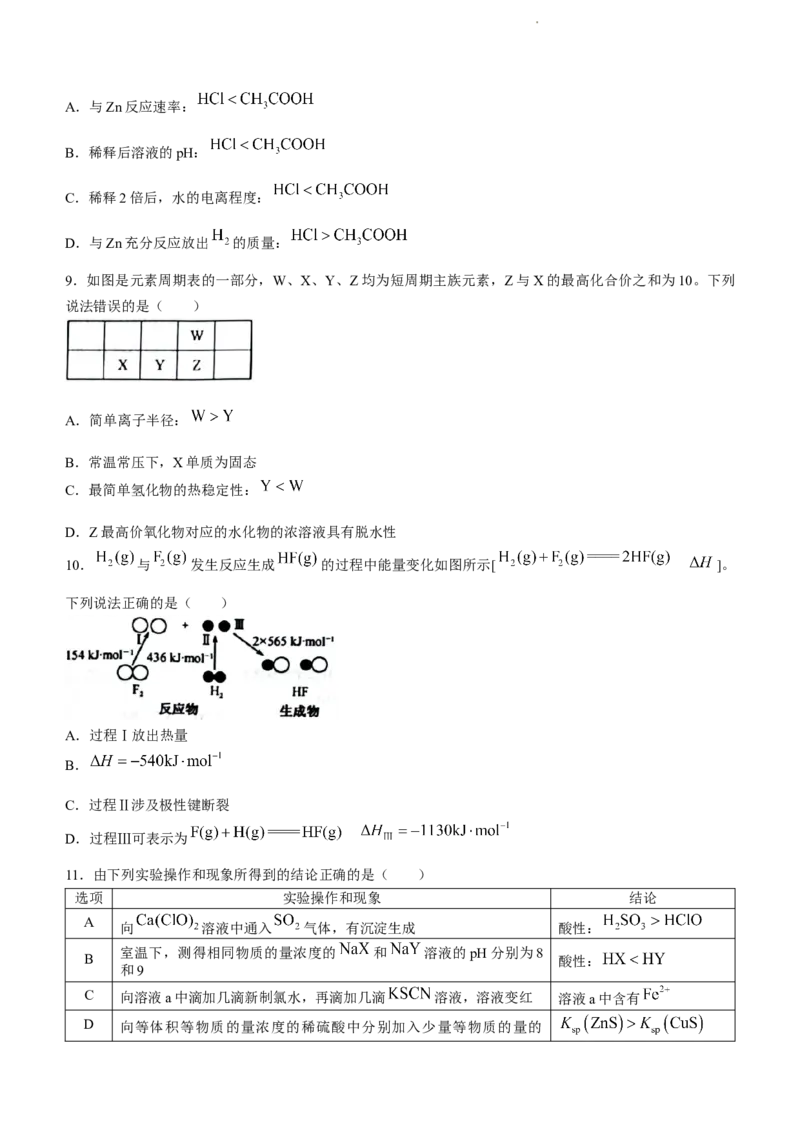
6.有机物M的结构简式如图所示。下列有关M的说法正确的是( )
A.分子中含有4种官能团
B.苯环上一氯代物有4种
C.能使酸性 溶液褪色
D.不存在结构含有 的同分异构体
7.将2.8g Fe加入 中,Fe完全溶解( 代表阿伏加德罗常数的值)。下列说法正
确的是( )
A.该反应转移电子的数目为
B.5.7g 含有中子的数目为
C.该 溶液中含有 的数目为
D.所得溶液中含有 的数目为
8.常温下,取pH均等于2的 和 各 分别稀释2倍后,再分别加入 锌粉,
在相同条件下充分反应。下列有关说法正确的是( )
学科网(北京)股份有限公司A.与Zn反应速率:
B.稀释后溶液的pH:
C.稀释2倍后,水的电离程度:
D.与Zn充分反应放出 的质量:
9.如图是元素周期表的一部分,W、X、Y、Z均为短周期主族元素,Z与X的最高化合价之和为10。下列
说法错误的是( )
A.简单离子半径:
B.常温常压下,X单质为固态
C.最简单氢化物的热稳定性:
D.Z最高价氧化物对应的水化物的浓溶液具有脱水性
10. 与 发生反应生成 的过程中能量变化如图所示[ ]。
下列说法正确的是( )
A.过程Ⅰ放出热量
B.
C.过程Ⅱ涉及极性键断裂
D.过程Ⅲ可表示为
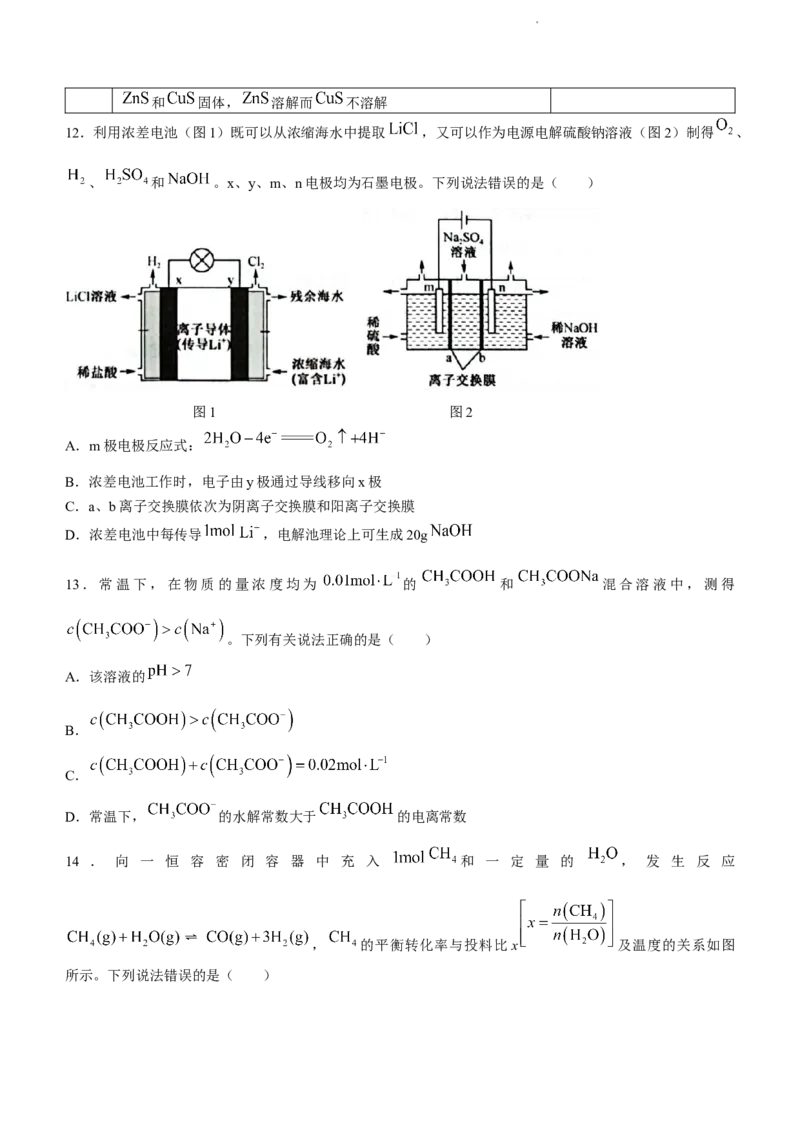
11.由下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A
向 溶液中通入 气体,有沉淀生成 酸性:
室温下,测得相同物质的量浓度的 和 溶液的pH分别为8
B 酸性:
和9
C 向溶液a中滴加几滴新制氯水,再滴加几滴 溶液,溶液变红 溶液a中含有
D 向等体积等物质的量浓度的稀硫酸中分别加入少量等物质的量的
学科网(北京)股份有限公司和 固体, 溶解而 不溶解
12.利用浓差电池(图1)既可以从浓缩海水中提取 ,又可以作为电源电解硫酸钠溶液(图2)制得 、
、 和 。x、y、m、n电极均为石墨电极。下列说法错误的是( )
图1 图2
A.m极电极反应式:
B.浓差电池工作时,电子由y极通过导线移向x极
C.a、b离子交换膜依次为阴离子交换膜和阳离子交换膜
D.浓差电池中每传导 ,电解池理论上可生成20g
13.常温下,在物质的量浓度均为 的 和 混合溶液中,测得
。下列有关说法正确的是( )
A.该溶液的
B.
C.
D.常温下, 的水解常数大于 的电离常数
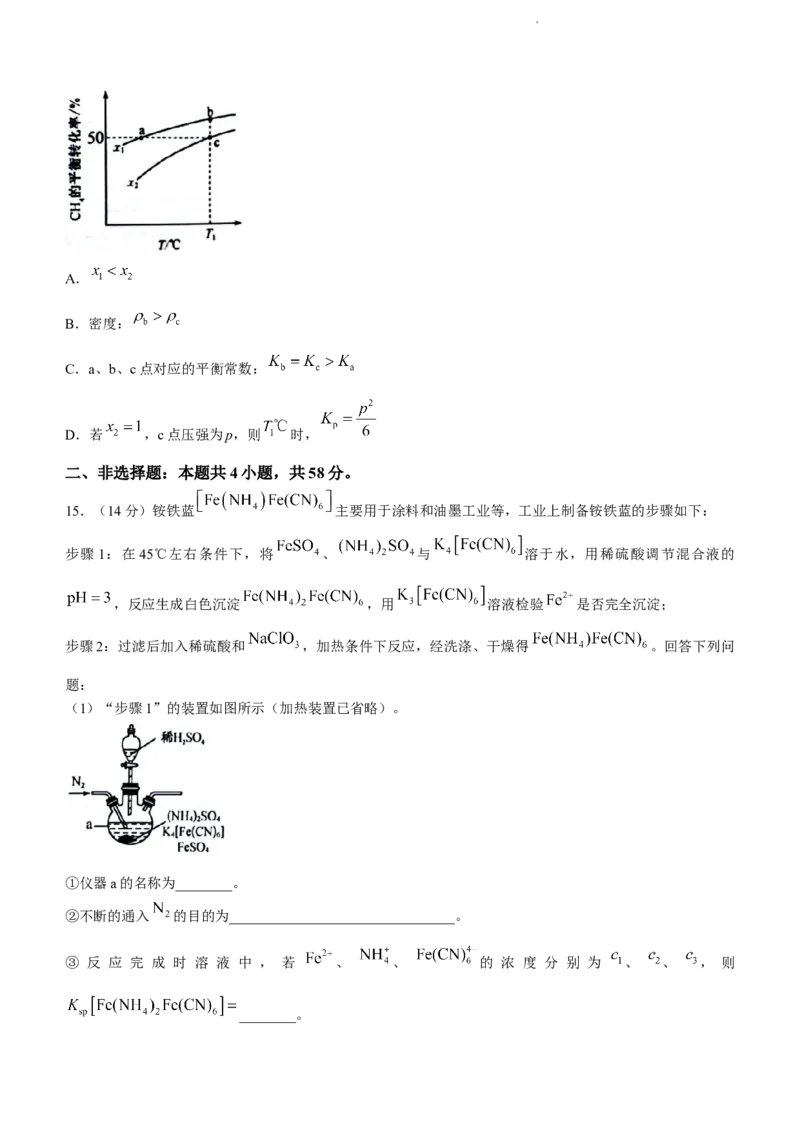
14 . 向 一 恒 容 密 闭 容 器 中 充 入 和 一 定 量 的 , 发 生 反 应
, 的平衡转化率与投料比x 及温度的关系如图
所示。下列说法错误的是( )
学科网(北京)股份有限公司A.
B.密度:
C.a、b、c点对应的平衡常数:
D.若 ,c点压强为p,则 时,
二、非选择题:本题共4小题,共58分。
15.(14分)铵铁蓝 主要用于涂料和油墨工业等,工业上制备铵铁蓝的步骤如下:
步骤1:在45℃左右条件下,将 、 与 溶于水,用稀硫酸调节混合液的
,反应生成白色沉淀 ,用 溶液检验 是否完全沉淀;
步骤2:过滤后加入稀硫酸和 ,加热条件下反应,经洗涤、干燥得 。回答下列问
题:
(1)“步骤1”的装置如图所示(加热装置已省略)。
①仪器a的名称为________。
②不断的通入 的目的为________________________________。
③ 反 应 完 成 时 溶 液 中 , 若 、 、 的 浓 度 分 别 为 、 、 , 则
________。
学科网(北京)股份有限公司(2)“步骤2”反应生成 的化学方程式为________________________;“洗涤”时,检
验产品是否洗涤干净的试剂为________。
(3)实验室制取并配制 溶液,用以检验 是否完全沉淀:将 的饱和溶液在
60℃以下进行电解,生成 及副产品 。待电解液中 含量达 时开始
冷却结晶、分离、干燥,制得 ,配制 的 溶液。
① 中Fe元素的化合价为________。
②电解时,阴极电极反应式为________________________________________________,“分离”时玻璃棒的
作用为________________________________________。
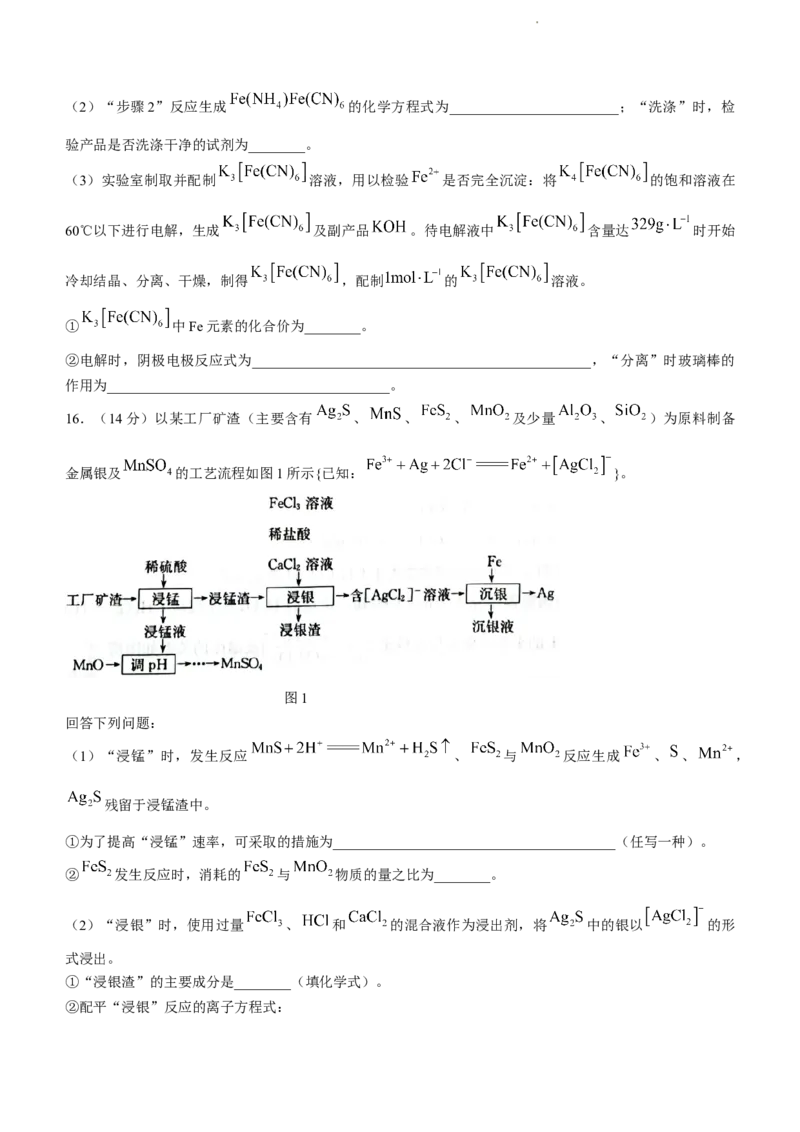
16.(14分)以某工厂矿渣(主要含有 、 、 、 及少量 、 )为原料制备
金属银及 的工艺流程如图1所示{已知: }。
图1
回答下列问题:
(1)“浸锰”时,发生反应 、 与 反应生成 、 、 ,
残留于浸锰渣中。
①为了提高“浸锰”速率,可采取的措施为________________________________________(任写一种)。
② 发生反应时,消耗的 与 物质的量之比为________。
(2)“浸银”时,使用过量 、 和 的混合液作为浸出剂,将 中的银以 的形
式浸出。
①“浸银渣”的主要成分是________(填化学式)。
②配平“浸银”反应的离子方程式:
学科网(北京)股份有限公司____ ____ ____ ____ ____ ____S。
③结合平衡移动原理,解释浸出剂中 的作用:________________________________________________。
(3)一定温度下,“沉银”时Ag的沉淀率随反应时间的变化如图2所示。
图2
① 参加反应的离子方程式为________________________________________________。
② 后Ag的沉淀率逐渐减小的原因可能是________________________________________________。
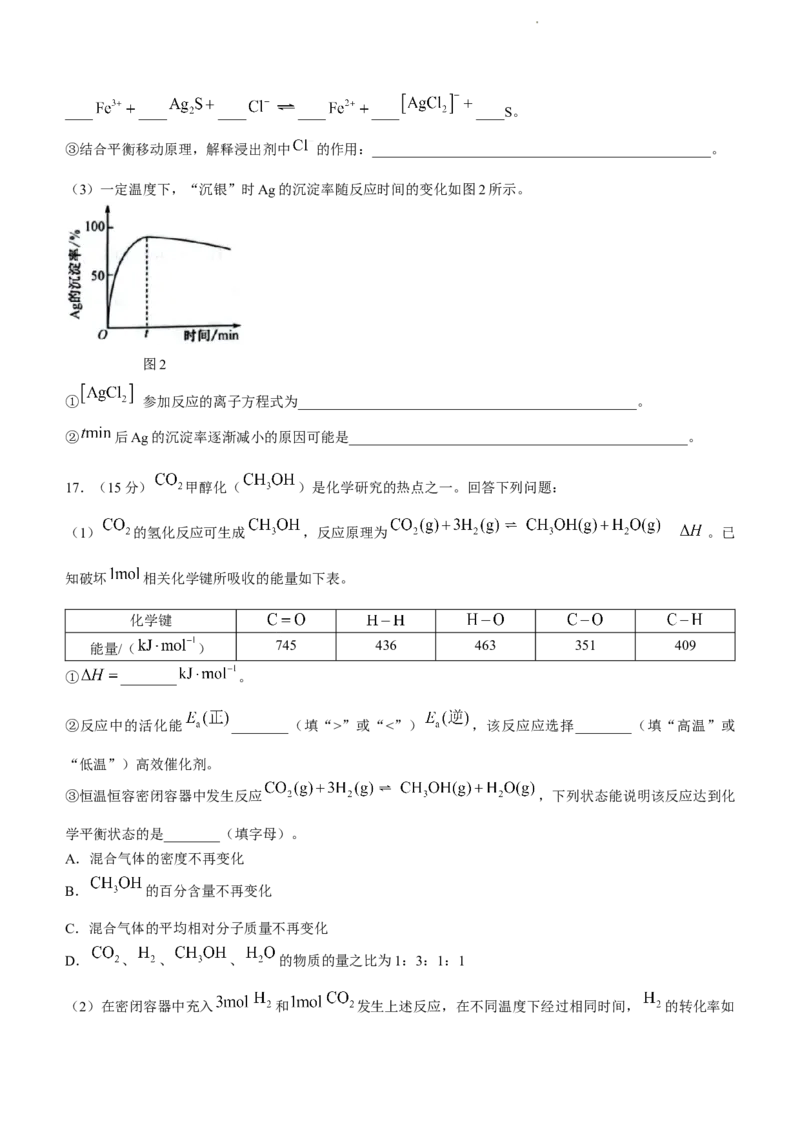
17.(15分) 甲醇化( )是化学研究的热点之一。回答下列问题:
(1) 的氢化反应可生成 ,反应原理为 。已
知破坏 相关化学键所吸收的能量如下表。
化学键
能量/( ) 745 436 463 351 409
① ________ 。
②反应中的活化能 ________(填“>”或“<”) ,该反应应选择________(填“高温”或
“低温”)高效催化剂。
③恒温恒容密闭容器中发生反应 ,下列状态能说明该反应达到化
学平衡状态的是________(填字母)。
A.混合气体的密度不再变化
B. 的百分含量不再变化
C.混合气体的平均相对分子质量不再变化
D. 、 、 、 的物质的量之比为1:3:1:1
(2)在密闭容器中充入 和 发生上述反应,在不同温度下经过相同时间, 的转化率如
学科网(北京)股份有限公司图1所示。
图1 图2
①a点时, ________(填“>”或“<”) 。
②若b点时 ,则 时反应的平衡常数 ________。
③反应达到平衡状态时,若要进一步提高 体积分数,可采取的措施有________(任写一种)。
(3)如图2为在室温条件下超快传输的氢负离子导体 ,应用于 制备 。
电极a为电源的________(填“正极”或“负极”),阳极的电极反应式为__________________________。
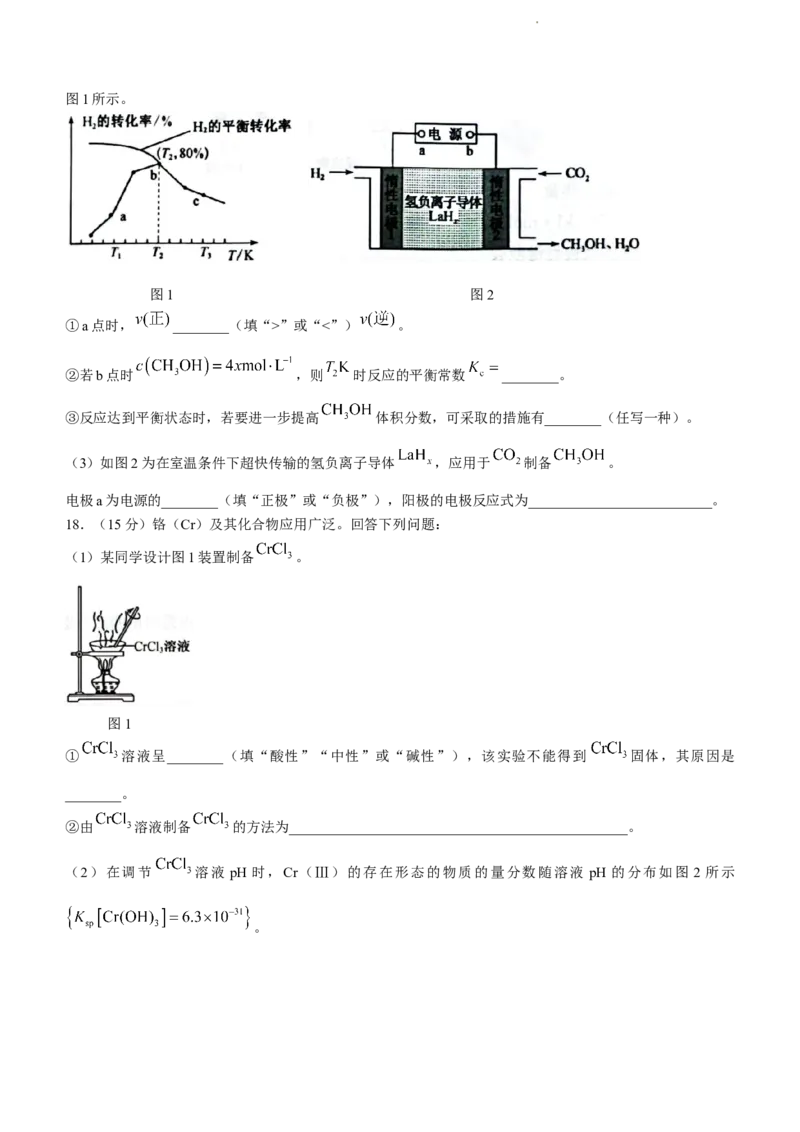
18.(15分)铬(Cr)及其化合物应用广泛。回答下列问题:
(1)某同学设计图1装置制备 。
图1
① 溶液呈________(填“酸性”“中性”或“碱性”),该实验不能得到 固体,其原因是
________。
②由 溶液制备 的方法为________________________________________________。
(2)在调节 溶液 pH 时,Cr(Ⅲ)的存在形态的物质的量分数随溶液 pH 的分布如图 2 所示
。
学科网(北京)股份有限公司图2
①向含有 的废水中加入石灰水调节并保持溶液 ,则反应完成时废水中的 ________
。
②由 溶液制备纯净的 的实验方案:取适量 溶液,加入过量________(填字母),充分
反应后过滤,用蒸馏水洗涤沉淀,低温烘干沉淀,得到 晶体。
A. 溶液 B.氨水 C. 溶液
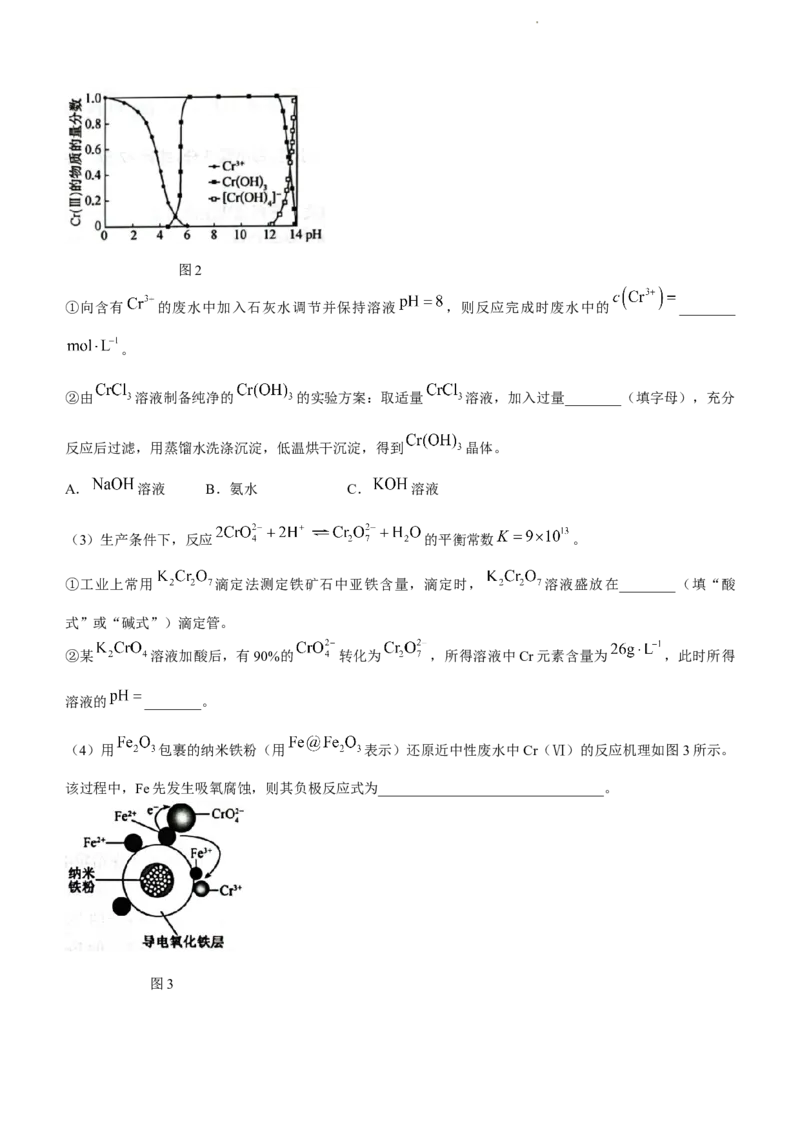
(3)生产条件下,反应 的平衡常数 。
①工业上常用 滴定法测定铁矿石中亚铁含量,滴定时, 溶液盛放在________(填“酸
式”或“碱式”)滴定管。
②某 溶液加酸后,有90%的 转化为 ,所得溶液中Cr元素含量为 ,此时所得
溶液的 ________。
(4)用 包裹的纳米铁粉(用 表示)还原近中性废水中Cr(Ⅵ)的反应机理如图3所示。
该过程中,Fe先发生吸氧腐蚀,则其负极反应式为________________________________。
图3
学科网(北京)股份有限公司化学四
参考答案、提示及评分细则
1.D 钠元素灼烧焰色呈黄色,A项错误;温室气体主要是指二氧化碳,形成酸雨的主要物质是硫氧化物、
氮氧化物等,B项错误;陶瓷的主要成分为硅酸盐,C项错误;茄子中存在一类叫“酚氧化酶”的物质,它
遇到氧气之后,发生化学反应生成一些有色的物质,D项正确。
2.D 是离子化合物,电子式为 ,A项错误; 是二元弱酸,电离分步进行,其一级电
离方程式为 ,B项错误; 中P原子最外层有10电子,C项错误; 第一步水
解方程式为 ,D项正确。
3.A 用浓硫酸配制 时,需要用到 规格的容量瓶,A项符合题意。
4.D 能与 反应,不能大量共存,A项错误; 能与 发生氧化还原反应,不能大量共存,B
项错误; 能与 发生配位反应,不能大量共存,C项错误;在碱性溶液中 、 、 、
均不会发生反应,能大量共存,D项正确。
5.C 升高温度促进 的水解,其水解常数 增大,A项不符合题意;弱电解质的电离是吸热过程,升
温能够促进 电离,电离常数 增大,B项不符合题意;若正反应为放热反应,升高温度平衡向
逆反应方向移动,化学平衡常数减小,C项符合题意;升高温度促进 的电离,其电离度 增大,D项不
符合题意。
6.C M分子中含有3种官能团,A项错误;苯环上一氯代物有3种,B项错误;分子中含有碳碳双键,能
使酸性高锰酸钾溶液褪色,C项正确;M的不饱和度为8,故存在结构含有 的同分异构体,D项
错误。
学科网(北京)股份有限公司7.B 2.8g Fe物质的量为 , 中 物质的量为 ,Fe完全溶解生成
,该反应转移电子 ,A项错误;5.7g 含有的中子数为 ,B项正确;该 溶液中
含有 的数目为 ,C项错误; 水解,反应后的溶液中含有 的数目小于 ,D项错
误。
8.A 稀释后,醋酸中 较大,反应速率较大,A项正确;稀释后,醋酸中 较大,pH较小,B项
错误;醋酸中 较大,对水的电离抑制程度更强,C项错误;与锌粉反应的 的物质的量相同,放出
氢气的质量相同,D项错误。
9.A 由题干可知:W、X、Y、Z分别为O、Si、P、S。简单离子半径: ,A项错误;常温常
压下,单质硅呈固态,B项正确;由非金属性: ,可知气态氢化物热稳定性: ,
C项正确;浓 具有脱水性,D项正确。
10.B 过程Ⅰ为共价键的断裂,需要吸收热量,A 项错误;
,B项正确;过程Ⅱ不涉及极性键断裂,C项错误;过程Ⅲ可表示为
,D项错误。
11.D 向 溶液中通入 气体,发生氧化还原反应生成 ,不能比较 和 的酸
性,A项错误;相同物质的量浓度的钠盐溶液,pH越大,酸根离子的水解程度越大,对应酸的酸性越弱,
HX溶液的酸性强于HY,B项错误; 检验时要先滴加 溶液后再滴加氯水,防止 干扰,C项
错误;相同条件下,组成和结构相似的难溶金属硫化物,溶解度大的物质先溶解于稀硫酸,向等体积等物质
的量浓度的稀硫酸中分别加入少量等物质的量的 和 固体, 溶解而 不溶解,说明溶度积:
,D项正确。
12.D m极电极反应式: ,A项正确;电池工作时,电子由y极通过导线移
向x极,B项正确;电解过程中,两个离子交换膜之间的硫酸钠溶液中, 通过阳离子交换膜b进入阴极
学科网(北京)股份有限公司(n极)区, 通过阴离子交换膜a进入阳极(m极)区,因此a、b离子交换膜依次为阴离子交换膜和阳
离子交换膜,C项正确;浓差电池中每传导 ,电路中通过 ,电解池理论上可生成
,D项错误。
13.C 根据电荷守恒式 及 可知,
,该溶液的 ,A项错误;因为溶液 ,混合液中以 的电离为主
故 , B 项 错 误 ; 物 料 守 恒 式
,C 项正确;由 A、B 项分析可知 ,
, ,D项错
误。
14.D 一定条件下,增大 的浓度,能提高 的平衡转化率,即x值越小, 的平衡转化率越
大,则 ,A项正确;b点和c点温度相同, 的起始物质的量都为 ,b点x值小于c点,则b
点加水多,密度大,B项正确;由图像可知,x一定时,温度升高, 的平衡转化率增大,说明正反应为
吸热反应,温度升高平衡正向移动,K 增大,温度相同,K 不变,则 a、b、c 点对应的平衡常数:
,C项正确;由三段式计算,c点 , ,
根据分压原理, , , ,D项错误。
15.(1)①三颈烧瓶(1分) ②排出装置内的空气,防止 被氧化(2分) ③ (2分)
(2) ;
溶液和稀硝酸或 溶液和稀盐酸等其他合理答案(各2分)
学科网(北京)股份有限公司(3)① (2分)
② (2分);引流(1分)
16.(1)①将矿渣粉碎或其他合理答案 ②2:3
(2)① 、S ②
③ 的作用是为了与 电离出的 结合生成 ,使平衡
正向移动,提高 的浸出率
(3)① ② 被氧气氧化为 , 把Ag氧化为 (每
空2分)
17.(1)① (2分) ②<;低温(各2分) ③BC(2分)
(2)①>(1分) ② (2分) ③增大压强或降低温度等其他合理答案(1分)
(3)负极(1分); (2分)
18.(1)①酸性(1分);因 水解: , 易挥发,导致平衡右移
(2分) ②在 气流中蒸发浓缩(2分)
(2)① (2分) ②B(2分)
(3)①酸式(2分) ②6(2分)
(4) (2分)
解析:(3)② , ,
, , ,
, 。
学科网(北京)股份有限公司