文档内容
兰州一中 2023-2024-1 学期期中考试试题
高三化学
说明:本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。考试
时间75分钟。答案写在答题卡上,交卷时只交答题卡
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 K-39 Cl-35.5 Fe-56
第 I 卷(选择题,共 42 分)
一、单选题(每小题只有一个选项符合题意,每小题3分)
1. 我国唐代垦地建畦生产盐已得到大力推广。唐人张守节在其《史记正义》对此有翔实的
记载:“河东盐池畦种,作畦若种韭一畦,天雨下池中,咸淡得均,既驮池中水上畦中,
深一尺许,以日曝之,五六日则成盐,若白矾石,大小若双陆(棋子)。及暮则呼为畦盐”。
上述记载中未涉及到的概念或操作是
A. 分散系 B. 分液 C. 蒸发 D. 结晶
2. 反应CO +3H =CH OH+H O可实现二氧化碳的资源化。下列说法正确的是
2 2 3 2
A. CO 的电子式为 B. H O的球棍模型为
2 2
C. H、D、T表示同一种核素 D. CH OH和H O能形成分子间氢键
3 2
3. 25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol/L KI溶液中:
兰州一中高三年级期中化学试卷 第1页,共6页
F e 2 + 、 N H +4 、Cl−、 S O 24 −
B. 麦芽糖溶液中:MnO−、Na+、SO2−、H+
4 4
C. 无色透明的溶液中:Cu2+、Al3+、SO 24 − 、NO−
3
D. 氨水中: K + 、 C u 2 + 、 N O −3 、 S O 24 −
4. 2023年1月18日,阿兹夫定片正式被纳入医保药品目
录。阿兹夫定能更有效地针对变异的艾滋病病毒发挥阻断
作用,具有低耐药性和高疗效的显著优点,其结构简式如
图所示。下列关于阿兹夫定的说法不正确的是
A. 五元环上有3种一氯代物
B. 该有机物中C原子的杂化方式有2种
C. 该有机物可以使酸性高锰酸钾溶液褪色
D. 1mol该有机物与足量的钠反应最多可产生2mol H
2
5. 联氨(N H )可用于新型高效的生物脱氮技术,是厌氧氨氧化法处理废水工艺中的重要
2 4
材料。实验室制备联氨的方法为2NH +NaClO===N H + NaCl+H O。下列说法正确的是
3 2 4 2
A. 每生成1 mol NaCl,转移的电子数目为N
A
B. 100 ml 1 mol/L的NaClO 溶液中ClO-的数目为0.1 N
A
C. 氧化产物与还原产物的物质的量之比为1:1
D. 2.24 L NH 反应生成的N H 的数目为0.05 N
3 2 4 A
{#{QQABBYKQggggAgAAAAgCEwVACgEQkAACAIoOhAAIIAIBwANABAA=}#}6. 下列离子方程式不正确的是
A. FeCl 溶液中加入过量的氨水:Fe3++3NH ·H O=Fe(OH) ↓+3NH
3 3 2 3
兰州一中高三年级期中化学试卷 第2页,共6页
+4
B. 醋酸钠溶液中滴入稀硫酸:CH COONa+H+=CH COOH+Na+
3 3
C. FeBr 溶液中通入少量Cl :
2 2
2 F e 2 + + C l
2
= 2 F e 3 + + 2 C l -
D. 澄清石灰水与过量二氧化碳气体反应:OH-+CO =HCO
2
−3
7. 下列实验装置正确且能够达到实验目的的是
A. 装置甲快速制取少量氨气 B. 装置乙分离I 和NH Cl
2 4
C. 装置丙制取并收集乙酸乙酯 D. 装置丁蒸发MgCl 溶液,得到无水MgCl
2 2
8. Cl O是HClO的酸酐,具有强氧化性,加热易分解,Cl O可通过如下反应制取:Na CO
2 2 2 3
+ 2Cl = 2NaCl + Cl O +CO 。下列说法不正确的是
2 2 2
A. 还原产物是NaCl
B. 氧化剂与还原剂的物质的量之比为1:1
C. Cl O完全溶于水微热,会产生黄绿色气体
2
D. Cl O与还原剂接触或加热能发生剧烈反应,甚至爆炸
2
9. 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为 [ C u ( N H
3
)
4
] C l
2
)为原料制备还原
性物质CuCl。下列说法不正确的是
A. “沉铜”得到的沉淀主要为Cu (OH)
2
B. “还原”时离子方程式为 S O 23 − + C u 2 + + C l - + H
2
O = C u C l + S O 24 − + 2 H +
甲 乙 丙 丁
C. “过滤”、“洗涤”时应该在隔绝空气的条件下进行
D. 可循环利用的物质为H SO
2 4
10. 拉贝洛尔(W)是一种甲型肾上腺受体阻断剂,常用于治疗高血压,可通过以下反应合成:
{#{QQABBYKQggggAgAAAAgCEwVACgEQkAACAIoOhAAIIAIBwANABAA=}#}以下说法正确的是
A. X的分子式为C H N
10 14
B. Y能发生水解反应和消去反应
C. W分子中所有碳原子可能共平面
D. W可与HCl反应生成盐酸盐
11. 向一定体积的Ba(OH) 溶液中逐滴加入离子浓度相当的稀硫酸,测得混合溶液的导电
2
能力随时间变化的曲线如图所示,下列说法正确的是
A. a处溶液的导电能力几乎为0,说明溶液中几乎没有自由移动的
离子
B. AB段溶液的导电能力不断减弱,说明生成的BaSO 不是电解质
4
C. BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH) 电
2
离出的离子导电
D. 该反应发生的离子方程式为Ba2++OH-+H++
兰州一中高三年级期中化学试卷 第3页,共6页
S O 24 - =BaSO ↓+H O
4 2
12. 化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原
子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。
下列说法不正确的是
A. 非金属性:X<Z<W
B. Q与W形成最简单化合物的沸点高于Q与X形成化合物的沸
点
C. 化合物甲中除Q外,其它原子均满足8电子稳定结构
D. 相同浓度的最高价氧化物对应水化物的酸性:Y>Z
13. 化学是以实验为基础的学科。下列实验操作或做法正确且能达到目的的是
选项 实验操作或做法 目的
取pH试纸于玻璃片上,用玻璃棒取少量溶液,点在试
A 检测新制氯水的pH
纸上观察颜色
溴乙烷和NaOH的乙醇溶液共热,将产生的气体直接通
B 检验反应生成了乙烯
入酸性高锰酸钾溶液中,溶液褪色
将稀盐酸滴入硅酸钠溶液中,振荡,观察到生成白色胶
C 证明非金属性:Cl>Si
状固体
先用稀硝酸酸化待测液,再滴加AgNO 溶液,生成白色
3
D 检验溶液中是否含有Cl-
沉淀
14. 已知CaCO 溶于水有如下平衡关系:CaCO(s)⇌ Ca2+(aq) + CO 2-(aq) △H>0。
3 3 3
不同温度下CaCO 在水中的沉淀溶解平衡曲线如图所示(注:CaCO 均未完全溶解)。下列
3 3
说法正确的是
{#{QQABBYKQggggAgAAAAgCEwVACgEQkAACAIoOhAAIIAIBwANABAA=}#}A. a点的K 大于e点的K
sp sp
B. 保持T 不变,向浊液中加入Na CO 固体能使a点变到e点
1 2 3
C.在b点,若温度从T 到T ,则b点可能变到d点
1 2
D. 升高温度时,c点的饱和溶液组成可以变到b点饱和溶液的组成
第Ⅱ卷(填空题,共 58 分)
二、填空题
15.(14分)高铁酸钾(K FeO )是一种集氧化、吸附、絮凝于一体的新型多功能水处理
2 4
剂,其生产工艺如下:
已知:
①Cl 与NaOH溶液反应的产物与反应温度有关,温度较低时产物为NaCl、NaClO、 H O;
2 2
温度较高时产物为NaCl、NaClO 、H O。
3 2
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出此工艺流程中Cl 通入KOH溶液的化学方程式: 。
2
(2)在“反应液I”中加入KOH固体的目的是① ,②提供碱性环境。
(3)写出Fe(NO ) 溶液与碱性KClO浓溶液反应的离子方程式: 。
3 3
(4)从“反应液II”中分离出K FeO 后,副产品是 (写化学式)。
2 4
(5)K FeO 可作为新型多功能水处理剂的原因是:① ,② 。
2 4
(6)该工艺每得到1.98 kg K FeO ,理论上消耗Cl 的物质的量为 mol。
2 4 2
16.(16分)硫酰氯(SO Cl )是一种重要的化工试剂,氯化法是合成硫酰氯(SO Cl )的常用
2 2 2 2
方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
已知:
① SO (g) + Cl (g) ⇌ SO Cl (l) ΔH=-97.3 kJ/mol。
2 2 2 2
兰州一中高三年级期中化学试卷 第4页,共6页
{#{QQABBYKQggggAgAAAAgCEwVACgEQkAACAIoOhAAIIAIBwANABAA=}#}② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为 。
(2)装置B的作用为 ,若缺少装置C,装置D中SO 与Cl 还可
2 2
能发生反应的化学方程式为 。
(3)仪器F的名称为 ,E中冷凝水的入口是 (填“a”或“b”),F
的作用除了防止空气中水蒸气进入D装置内之外,还可以 。
(4)当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到4.05 g纯净的硫酰氯,
则硫酰氯的产率为 。为提高本实验中硫酰氯的产率,在实验操作中需要注意的
事项有 (填序号)。
①加热三颈烧瓶 ②控制气流速率,不宜过快
③若三颈烧瓶发烫,可适当降温 ④先通冷凝水,再通气
(5)氯磺酸(ClSO H)加热分解,也能制得硫酰氯2ClSO H=SO Cl + H SO ,分离产物的方
3 3 2 2 2 4
法是 。
A.重结晶 B.过滤 C.蒸馏 D.萃取
17.(14分)2023年世界环境日的宣传主题为“建设人与自然和谐共生的现代化”。防治大
气污染、水体污染等是世界各国保护环境的最重要课题。
(1)将CH 催化重整为可用的化学品,对改善环境意义重大。
4
①某科研团队利用Ni-CaO-Fe O 三元催化剂在850℃下“超干重整”CH 和CO
3 4 4 2。
已知:
反应I:CH (g)+CO (g) ⇌ 2CO(g)+2H (g) ΔH = +247kJ/mol
4 2 2 1
反应Ⅱ:CO(g)+H O(g) ⇌ CO (g)+H (g) ΔH = -41kJ/mol
2 2 2 2
则反应Ⅲ:CH (g)+3CO (g) ⇌ 4CO(g)+2H O(g) ΔH = 。
4 2 2 3
②在容积为1L的刚性容器中按反应I进行“合成气催化重整”,当投料n(CH ):n(CO )=1.0
4 2
时,CO 的平衡转化率(α)与温度(T)、初始压强(p)的关系如图1所示。压强p p (填
2 1 2
“>”“=”或“<”,下同);当温度为T ,压强为p 时,a点的v v ;起始时向容
3 1 正 逆
器中加入1 mol CH 和1 mol CO ,在温度为T ,初始压强为p 时反应,该反应的K= 。
4 2 6 2
图1 图2 图3
(2)氮氧化物是造成大气污染的主要物质,研究氮氧化物的反应机理更有助于消除大气污染。
NH 催化还原NO是重要的烟气脱硝技术,研究发现在以Fe O 为主的催化剂上可能发生
3 2 3
兰州一中高三年级期中化学试卷 第5页,共6页
{#{QQABBYKQggggAgAAAAgCEwVACgEQkAACAIoOhAAIIAIBwANABAA=}#}的反应过程如图2所示。
①写出脱硝过程中总反应的化学方程式: 。
②不同温度条件下,n( NH ):n(NO)为2:1时,得到NO脱除率曲线如图3所示。脱除NO
3
的最佳温度是 。在温度超过1000℃时NO脱除率骤然下降的原因可能
是 。
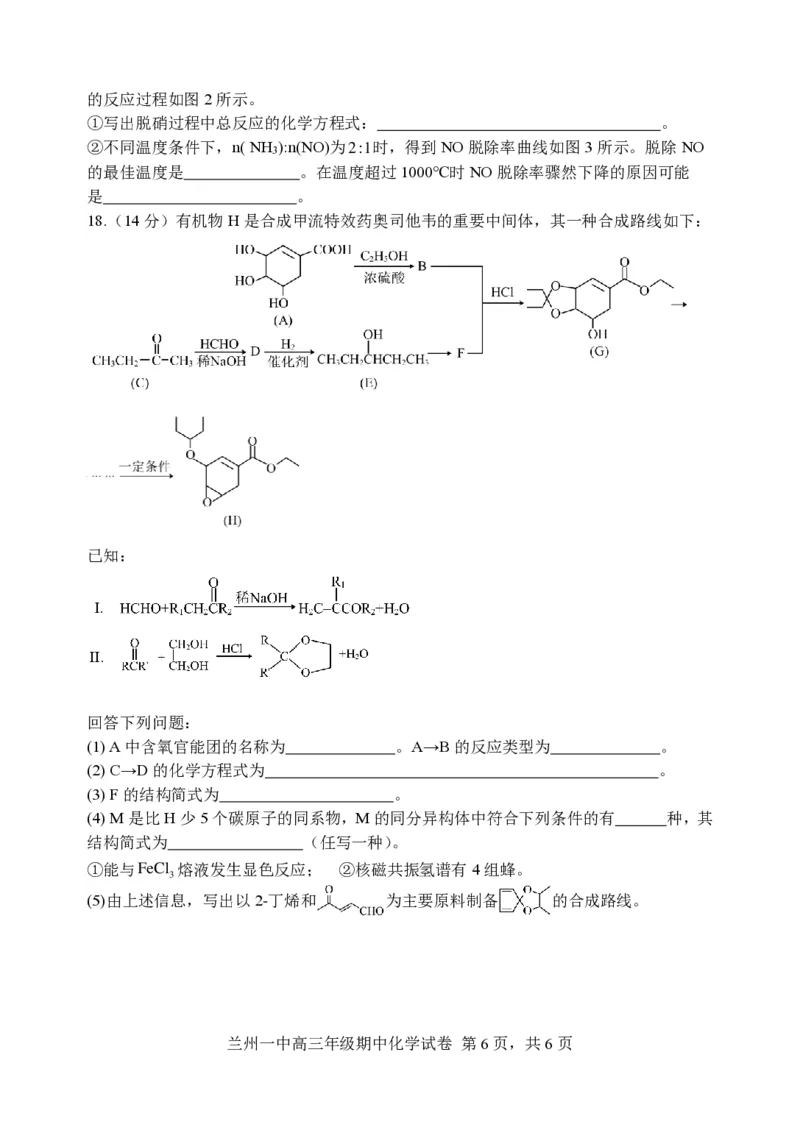
18.(14分)有机物H是合成甲流特效药奥司他韦的重要中间体,其一种合成路线如下:
已知:
Ⅰ.
Ⅱ.
回答下列问题:
(1) A中含氧官能团的名称为 。A→B的反应类型为 。
(2) C→D的化学方程式为 。
(3) F的结构简式为 。
(4) M是比H少5个碳原子的同系物,M的同分异构体中符合下列条件的有 种,其
结构简式为 (任写一种)。
①能与FeCl 熔液发生显色反应; ②核磁共振氢谱有4组蜂。
3
(5)由上述信息,写出以2-丁烯和 为主要原料制备 的合成路线。
兰州一中高三年级期中化学试卷 第6页,共6页
{#{QQABBYKQggggAgAAAAgCEwVACgEQkAACAIoOhAAIIAIBwANABAA=}#}