文档内容
树德中学高 2023 级高二下期 4 月阶段性测试化学试题 C.62g白磷(P )中共价键的数目为2N
4 A
命题人:曾静 审题人:童洁、许兴旺、奚洋海 D.15g甲基所含有的电子数是10N
A
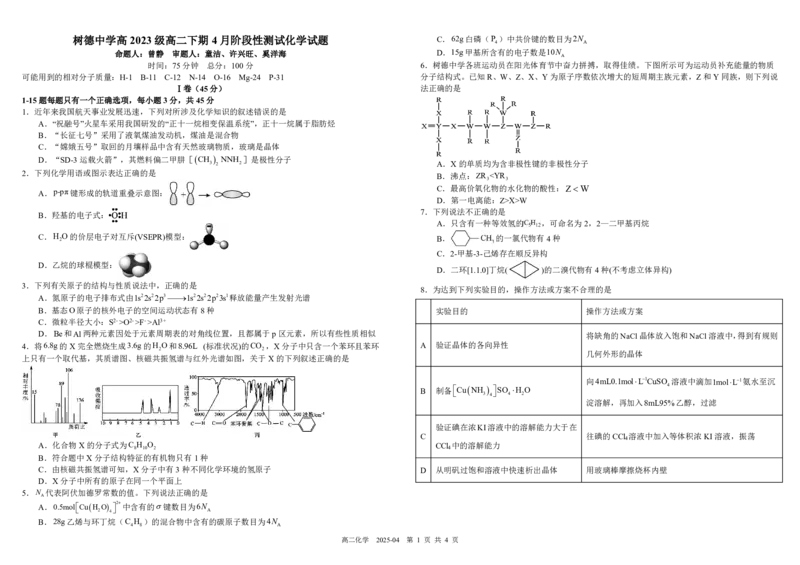
时间:75分钟 总分:100分 6.树德中学各班运动员在阳光体育节中奋力拼搏,取得佳绩。下图所示可为运动员补充能量的物质
可能用到的相对分子质量:H-1 B-11 C-12 N-14 O-16 Mg-24 P-31 分子结构式。已知R、W、Z、X、Y为原子序数依次增大的短周期主族元素,Z和Y同族,则下列说
Ⅰ卷(45分) 法正确的是
1-15题每题只有一个正确选项,每小题3分,共45分
1.近年来我国航天事业发展迅速,下列对所涉及化学知识的叙述错误的是
A.“祝融号”火星车采用我国研发的“正十一烷相变保温系统”,正十一烷属于脂肪烃
B.“长征七号”采用了液氧煤油发动机,煤油是混合物
C.“嫦娥五号”取回的月壤样品中含有天然玻璃物质,玻璃是晶体
D.“SD-3运载火箭”,其燃料偏二甲肼[CH NNH ]是极性分子
3 2 2 A.X的单质均为含非极性键的非极性分子
2.下列化学用语或图示表达正确的是
B.沸点:ZR X>W
B.羟基的电子式:
7.下列说法不正确的是
A.只含有一种等效氢的 ,可命名为2,2—二甲基丙烷
C.H
2
O的价层电子对互斥(VSEPR)模型: B. 的一氯代物有4种
C.2-甲基-3-己烯存在顺反异构
D.乙烷的球棍模型:
D.二环[1.1.0]丁烷( )的二溴代物有4种(不考虑立体异构)
3.下列有关原子的结构与性质说法中,正确的是
8.为达到下列实验目的,操作方法或方案不合理的是
A.氮原子的电子排布式由1s22s22p31s22s22p23s1释放能量产生发射光谱
B.基态O原子的核外电子的空间运动状态有8种 实验目的 操作方法或方案
C.微粒半径大小:S2->O2->F->Al3+
D.Be和Al两种元素因处于元素周期表的对角线位置,且都属于p区元素,所以有些性质相似 将缺角的NaCl晶体放入饱和NaCl溶液中,得到有规则
4.将6.8g的X完全燃烧生成3.6g的H O和8.96L (标准状况)的CO ,X分子中只含一个苯环且苯环 A 验证晶体的各向异性
2 2
几何外形的晶体
上只有一个取代基,其质谱图、核磁共振氢谱与红外光谱如图,关于X的下列叙述正确的是
向4mL0.1molL1CuSO 溶液中滴加1molL1氨水至沉
B 制备 CuNH 3 4 SO 4 H 2 O 4
淀溶解,再加入8mL95%乙醇,过滤
验证碘在浓KI溶液中的溶解能力大于在
C 往碘的CCl 溶液中加入等体积浓KI溶液,振荡
4
A.化合物X的分子式为C H O CCl 中的溶解能力
8 10 2 4
B.符合题中X分子结构特征的有机物只有1种
C.由核磁共振氢谱可知,X分子中有3种不同化学环境的氢原子 D 从明矾过饱和溶液中快速析出晶体 用玻璃棒摩擦烧杯内壁
D.X分子中所有的原子在同一个平面上
5.N 代表阿伏加德罗常数的值。下列说法正确的是
A
A.0.5mol CuH
2
O
4
2 中含有的键数目为6N
A
B.28g乙烯与环丁烷(C H )的混合物中含有的碳原子数目为4N
4 8 A
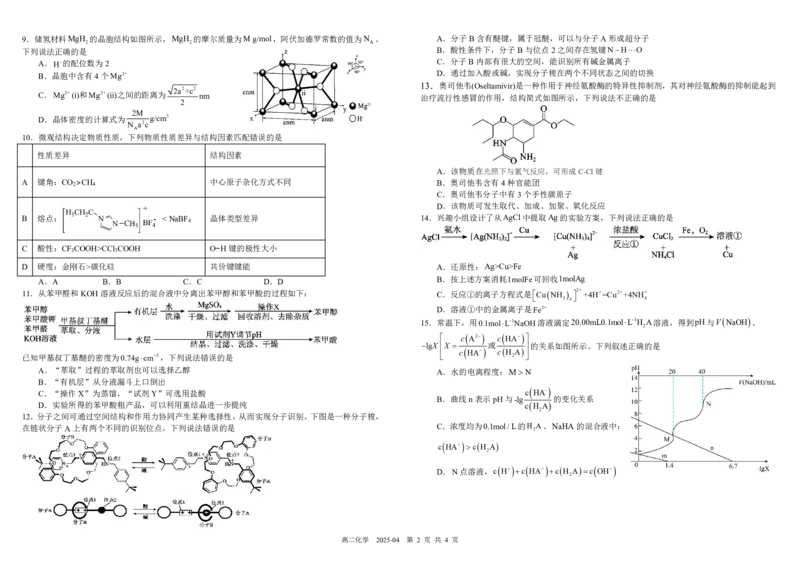
高二化学 2025-04 第 1 页 共 4 页9.储氢材料MgH 的晶胞结构如图所示,MgH 的摩尔质量为M g/mol,阿伏加德罗常数的值为N 。 A.分子B含有醚键,属于冠醚,可以与分子A形成超分子
2 2 A
下列说法正确的是 B.酸性条件下,分子B与位点2之间存在氢键NHO
A.H-的配位数为2 C.分子B内部有很大的空间,能识别所有碱金属离子
B.晶胞中含有4个Mg2+
D.通过加入酸或碱,实现分子梭在两个不同状态之间的切换
13.奥司他韦(Oseltamivir)是一种作用于神经氨酸酶的特异性抑制剂,其对神经氨酸酶的抑制能起到
2a2+c2
C.Mg2+(i)和Mg2+(ii)之间的距离为 nm 治疗流行性感冒的作用,结构简式如图所示,下列说法不正确的是
2
2M
D.晶体密度的计算式为 g/cm3
N a2c
A
10.微观结构决定物质性质,下列物质性质差异与结构因素匹配错误的是
性质差异 结构因素
A.该物质在光照下与氯气反应,可形成C-Cl键
A 键角:CO
2
>CH
4
中心原子杂化方式不同 B.奥司他韦含有4种官能团
C.奥司他韦分子中有3个手性碳原子
D.该物质可发生取代、加成、加聚、氧化反应
B 熔点: CCl COOH O−H键的极性大小
3 3
D 硬度:金刚石>碳化硅 共价键键能 A.还原性:Ag>Cu>Fe
A.A B.B C.C D.D B.按上述方案消耗1molFe可回收1molAg
11.从苯甲醛和KOH溶液反应后的混合液中分离出苯甲醇和苯甲酸的过程如下: C.反应①的离子方程式是CuNH 2+ +4H+=Cu2++4NH+
3 4 4
D.溶液①中的金属离子是Fe2+
15.常温下,用0.1molL1NaOH溶液滴定20.00mL0.1molL1H A溶液,得到pH与VNaOH、
2
c A2 c HA
lgX X 或 的关系如图所示。下列叙述正确的是
c
HA cH A
已知甲基叔丁基醚的密度为0.74gcm3,下列说法错误的是 2
A.“萃取”过程的萃取剂也可以选择乙醇 A.水的电离程度:MN
B.“有机层”从分液漏斗上口倒出
C.“操作X”为蒸馏,“试剂Y”可选用盐酸 c
HA-
B.曲线n表示pH与-lg 的变化关系
D.实验所得的苯甲酸粗产品,可以利用重结晶进一步提纯 cH A
2
12.分子之间可通过空间结构和作用力协同产生某种选择性,从而实现分子识别。下图是一种分子梭,
在链状分子A上有两个不同的识别位点。下列说法错误的是 C.浓度均为0.1mol/L的H
2
A、NaHA的混合液中:
c HA cH A
2
D.N点溶液,c H c HA cH Ac OH
2
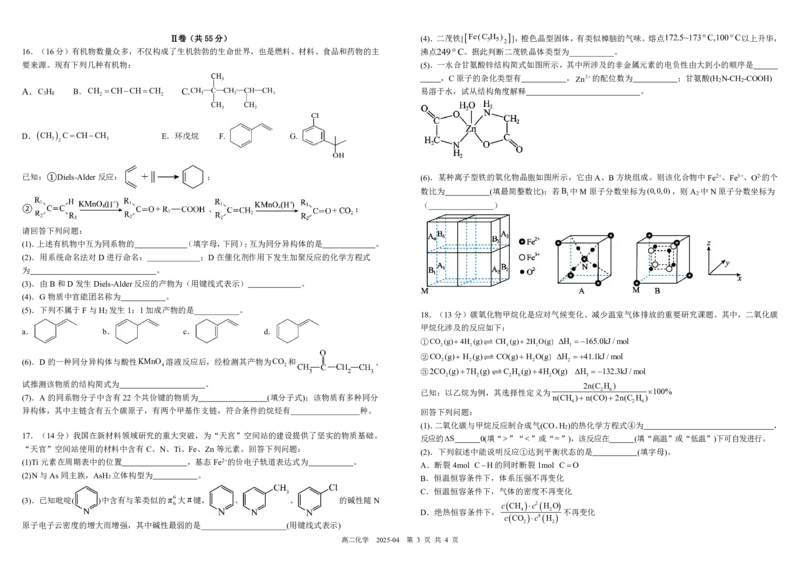
高二化学 2025-04 第 2 页 共 4 页Ⅱ卷(共55分) (4).二茂铁[ ],橙色晶型固体,有类似樟脑的气味。熔点 以上升华,
16.(16分)有机物数量众多,不仅构成了生机勃勃的生命世界,也是燃料、材料、食品和药物的主 沸点 。据此判断二茂铁晶体类型为___________。
要来源。现有下列几种有机物: (5).一水合甘氨酸锌结构简式如图所示,其中所涉及的非金属元素的电负性由大到小的顺序是
,C原子的杂化类型有 ,Zn2的配位数为 ;甘氨酸(H
2
N-CH
2
-COOH)
A.C H B.CH CHCHCH C. 易溶于水,试从结构角度解释 。
3 8 2 2
D.CH CCHCH E.环戊烷 F. G.
3 2 3
已知:①Diels-Alder反应: ; (6).某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个
数比为 (填最简整数比);若B 中M原子分数坐标为(0,0,0),则A 中N原子分数坐标为
1 2
( )
② ;
请回答下列问题:
(1).上述有机物中互为同系物的 (填字母,下同);互为同分异构体的是 。
(2).用系统命名法对D进行命名: ;D在催化剂作用下发生加聚反应的化学方程式
为 。
(3).由B和D发生Diels-Alder反应的产物为(用键线式表示) 。
(4).G物质中官能团名称为 。
(5).下列不属于F与H 发生1:1加成产物的是___________。
2 18.(13分)碳氧化物甲烷化是应对气候变化、减少温室气体排放的重要研究课题。其中,二氧化碳
甲烷化涉及的反应如下:
a. b. c. d.
①CO (g)4H (g) CH (g)2H O(g) H 165.0kJ/mol
2 2 4 2 1
②CO (g) H (g) CO(g) H O(g) H 41.1kJ/mol
(6).D的一种同分异构体与酸性KMnO 溶液反应后,经检测其产物为CO 和 , 2 2 2 2
4 2
③2CO (g)7H (g)C H (g)4H O(g) H 132.3kJ/mol
2 2 2 6 2 3
试推测该物质的结构简式为 。
2n(C H )
已知:以乙烷为例,其选择性定义为 2 6 100%
(7).A的同系物分子中含有22个共价键的物质为 (填分子式);该物质有多种同分 n(CH )n(CO)2n(C H )
4 2 6
异构体,其中主链含有五个碳原子,有两个甲基作支链,符合条件的烷烃有 种。 回答下列问题:
(1).二氧化碳与甲烷反应制合成气(CO、H )的热化学方程式④为 ,
2
17.(14分)我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。
反应的S 0(填“”“”或“”),该反应在 (填“高温”或“低温”)下可自发进行。
“天官”空间站使用的材料中含有C、N、Ti、Fe、Zn等元素。回答下列问题:
(2).下列叙述中能说明反应①达到平衡状态的是 (填字母)。
(1)Ti元素在周期表中的位置 ,基态Fe2+的价电子轨道表达式为 。
A.断裂4mol CH的同时断裂1mol CO
(2)N与As同主族,AsH
3
立体构型为 。
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
(3).已知吡啶( )中含有与苯类似的π6大π键, 、 、 的碱性随N
6 cCH c2H O
D.绝热恒容条件下, 4 2 不再变化
cCO c4H
原子电子云密度的增大而增强,其中碱性最弱的是_____________________(用键线式表示) 2 2
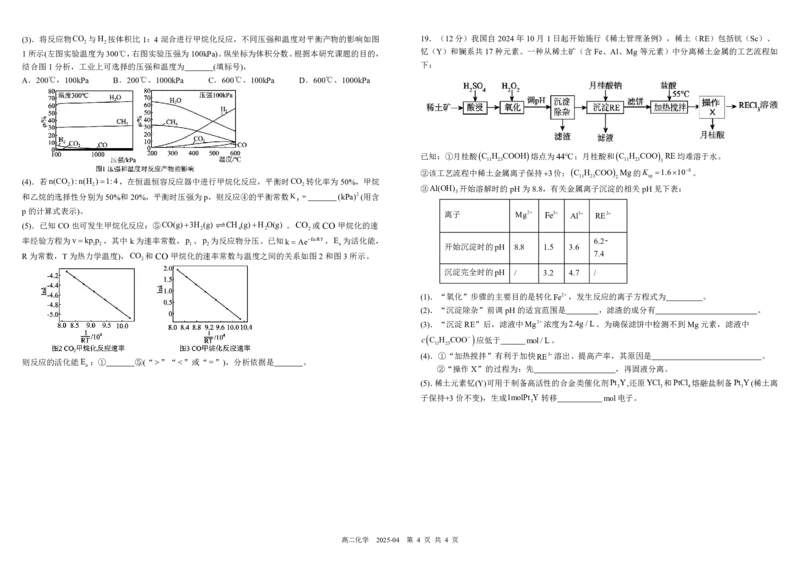
高二化学 2025-04 第 3 页 共 4 页(3).将反应物CO 与H 按体积比1:4混合进行甲烷化反应,不同压强和温度对平衡产物的影响如图 19.(12分)我国自2024年10月1日起开始施行《稀土管理条例》,稀土(RE)包括钪(Sc)、
2 2
1所示(左图实验温度为300℃,右图实验压强为100kPa)。纵坐标为体积分数。根据本研究课题的目的, 钇(Y)和镧系共17种元素。一种从稀土矿(含Fe、Al、Mg等元素)中分离稀土金属的工艺流程如
结合图1分析,工业上可选择的压强和温度为 (填标号), 下:
A.200℃,100kPa B.200℃、1000kPa C.600℃、100kPa D.600℃、1000kPa
已知:①月桂酸C H COOH熔点为44C;月桂酸和C H COO RE均难溶于水。
11 23 11 23 3
②该工艺流程中稀土金属离子保持3价;C H COO Mg的K 1.6108。
(4).若n(CO ):n(H )1:4,在恒温恒容反应器中进行甲烷化反应,平衡时CO 转化率为50%,甲烷 11 23 2 sp
2 2 2 ③Al(OH) 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见下表:
3
和乙烷的选择性分别为50%和20%,平衡时压强为p,则反应④的平衡常数K (kPa)2(用含
p
p的计算式表示)。
离子 Mg2 Fe3 Al3 RE3
(5).已知CO也可发生甲烷化反应:⑤CO(g)3H (g) CH (g)H O(g) 。CO 或CO甲烷化的速
2 4 2 2
率经验方程为vkpp ,其中k为速率常数,p 、p 为反应物分压。已知k AeEa/RT,E 为活化能, 6.2∼
1 2 1 2 a 开始沉淀时的pH 8.8 1.5 3.6
R为常数,T为热力学温度),CO 和CO甲烷化的速率常数与温度之间的关系如图2和图3所示。 7.4
2
沉淀完全时的pH / 3.2 4.7 /
(1).“氧化”步骤的主要目的是转化Fe2,发生反应的离子方程式为 。
(2).“沉淀除杂”前调pH的适宜范围是 ,滤渣的成分有 。
(3).“沉淀RE”后,滤液中Mg2浓度为2.4g/L。为确保滤饼中检测不到Mg元素,滤液中
c
C H
COO
应低于 mol/L。
11 23
(4).①“加热搅拌”有利于加快RE3溶出、提高产率,其原因是 。
则反应的活化能E :① ⑤(“”“”或“”),分析依据是 。
a ②“操作X”的过程为:先 ,再固液分离。
(5).稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt Y,还原YCl 和PtCl 熔融盐制备Pt Y(稀土离
3 3 4 3
子保持+3价不变),生成1molPt Y 转移 mol电子。
3
高二化学 2025-04 第 4 页 共 4 页树德中学高 2023 级高二下期 4 月阶段性测试化学试题参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B C B A D B A C B A C B C C
16.(16分,除标注外,每空1分)
催化剂
(1) AC DE (2)2-甲基-2-丁烯 nCH CCHCH (2分)
3 2 3
(3) (2分) (4) 碳氯键(氯原子)、羟基(2分)
(5) d(2分)
(6) CH =CCH CH CH (2分) (7) C H 4(2分)
2 3 2 3 7 16
17.(14分,除标注外,每空1分)
(1) 第四周期IVB族
(2) 三角锥形 (3) (2分) (4) 分子晶体
(5) O>N>C>H sp3和sp2(2分) 5 甘氨酸含有氨基和羧基,能与水形成氢键
3 1 1
(6) 1:2:4(2分) , ,
4 4 4
18.(13分,除标注外,每空2分)
(1) CO (g)CH (g) 2CO(g)2H (g) H 247.2kJ/mol >(1分) 高温(1分)
2 4 2 4
2.5 0.15
( p)2( p)2
4.3 4.3
(2)BD (3) A (4)
0.25 0.5
( p)( p)
4.3 4.3
(5) <(1分) 分析可知直线的斜率的绝对值表示活化能,则CO图像斜率更大,活化能更大
19.(12分,除标注外,每空2分)
(1)2Fe2 H O 2H 2Fe3 2H O (2) 4.7~6.2(1分) Fe(OH) 、Al(OH)
2 2 2 3 3
(3)4104
(4) 加热可以提高反应物粒子运动速度,搅拌增加溶剂与溶质的接触面积,使溶出更彻底,提高溶
出速度,提高产率 冷却结晶(1分)
(5) 15
高二化学 2025-04 第 5 页 共 4 页