文档内容
2024~2025学年度第二学期期中重点校联考
高二化学
出题学校:宝坻一中 芦台一中
可能用到的相对原子质量:H—1 B—11 C—12 N—14 O—16 Br—80
第Ⅰ卷(共39分)
一、选择题(共13小题,每题3分,共39分,每小题只有一个选项符合题意)
1.化学与科技相关,下列有关说法错误的是
A.神舟系列飞船返回舱使用氮化硅耐高温材料,Si N 属于共价晶体
3 4
B.“奋斗号”下潜突破万米,采用新型抗压材料钛合金,钛属于ⅡB族元素
C.颁奖礼仪服采用第二代石墨烯发热材料—石墨烯,与金刚石是同素异形体
D.第19届杭州亚运会开幕式上,主火炬塔的燃料首次使用废碳再生的“绿色燃料”甲醇,液态甲醇
中存在分子间氢键
2.下列化学用语或图示表达正确的是
A.2-丁炔的键线式为:
B.羟基的电子式:
C.SO 2-的VSEPR模型:
3
D.基态Cr原子的价层电子排布式:3d44s2
的
3.下列说法正确 是
A.熔点:正戊烷>2,3-二甲基丁烷>丙烷
B.酸性:CFCOOH>CCl COOH>CHCl COOH
3 3 2
C.同质量的物质燃烧耗O 量:甲烷>乙炔>苯
2
D.C H 与C H 互为同系物
2 4 3 6
4.下列关于物质的空间结构和性质说法正确的是
A.BF、NCl 分子中所有原子的最外层电子都满足了8电子稳定结构
3 3
B.HSO 是强电解质,硫酸晶体是能导电的
2 4
C.CH 分子间的氢键表示为:C-H…C-,三个原子共线
4
D.分子中键角的大小:CO>SO >CCl >HO
2 3 4 2
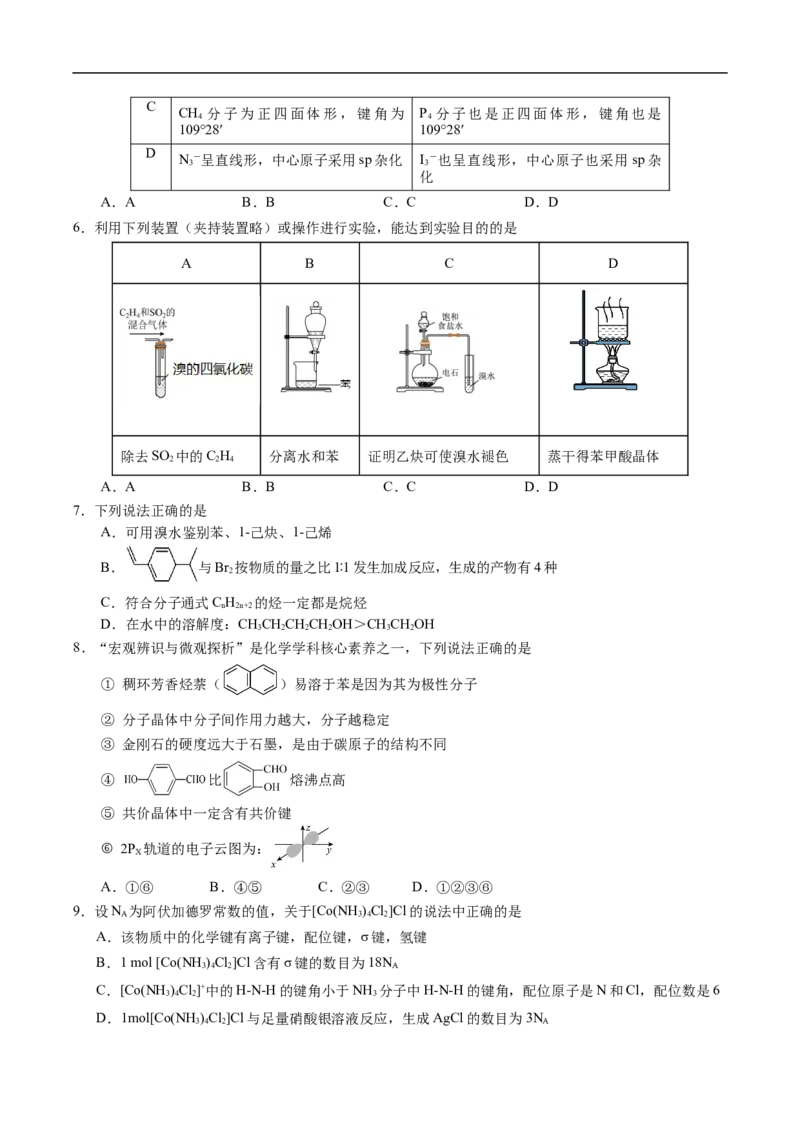
5.类比和推理是中学化学学习的重要方法,下列推测合理的是
A
冰晶体中HO分子采用非密堆积 氨晶体中NH 分子也采用非密堆积
2 3
B
CO 晶体是分子晶体 SiO 晶体也是分子晶体
2 2C
CH 分子为正四面体形,键角为 P 分子也是正四面体形,键角也是
4 4
109°28′ 109°28′
D
N-呈直线形,中心原子采用sp杂化 I -也呈直线形,中心原子也采用sp杂
3 3
化
A.A B.B C.C D.D
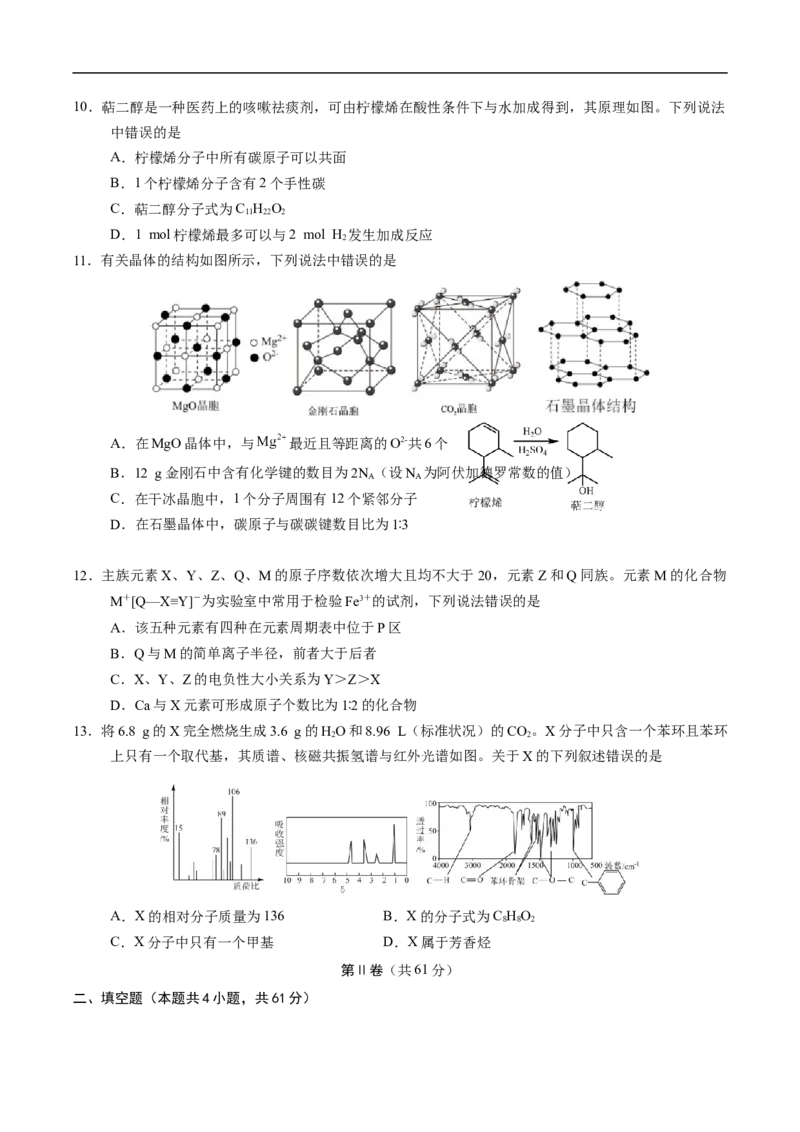
6.利用下列装置(夹持装置略)或操作进行实验,能达到实验目的的是
A B C D
除去SO 中的C H 分离水和苯 证明乙炔可使溴水褪色 蒸干得苯甲酸晶体
2 2 4
A.A B.B C.C D.D
7.下列说法正确的是
A.可用溴水鉴别苯、1-己炔、1-己烯
B. 与Br 按物质的量之比1∶1发生加成反应,生成的产物有4种
2
C.符合分子通式C H 的烃一定都是烷烃
n 2n+2
D.在水中的溶解度:CHCHCHCHOH>CHCHOH
3 2 2 2 3 2
8.“宏观辨识与微观探析”是化学学科核心素养之一,下列说法正确的是
① 稠环芳香烃萘( )易溶于苯是因为其为极性分子
② 分子晶体中分子间作用力越大,分子越稳定
③ 金刚石的硬度远大于石墨,是由于碳原子的结构不同
④ 比 熔沸点高
⑤ 共价晶体中一定含有共价键
⑥ 2P 轨道的电子云图为:
X
A.①⑥ B.④⑤ C.②③ D.①②③⑥
9.设N 为阿伏加德罗常数的值,关于[Co(NH )Cl]Cl的说法中正确的是
A 3 4 2
A.该物质中的化学键有离子键,配位键,σ键,氢键
B.1 mol [Co(NH)Cl]Cl含有σ键的数目为18N
3 4 2 A
C.[Co(NH )Cl]+中的H-N-H的键角小于NH 分子中H-N-H的键角,配位原子是N和Cl,配位数是6
3 4 2 3
D.1mol[Co(NH)Cl]Cl与足量硝酸银溶液反应,生成AgCl的数目为3N
3 4 2 A10.萜二醇是一种医药上的咳嗽祛痰剂,可由柠檬烯在酸性条件下与水加成得到,其原理如图。下列说法
中错误的是
A.柠檬烯分子中所有碳原子可以共面
B.1个柠檬烯分子含有2个手性碳
C.萜二醇分子式为C H O
11 22 2
D.1 mol柠檬烯最多可以与2 mol H 发生加成反应
2
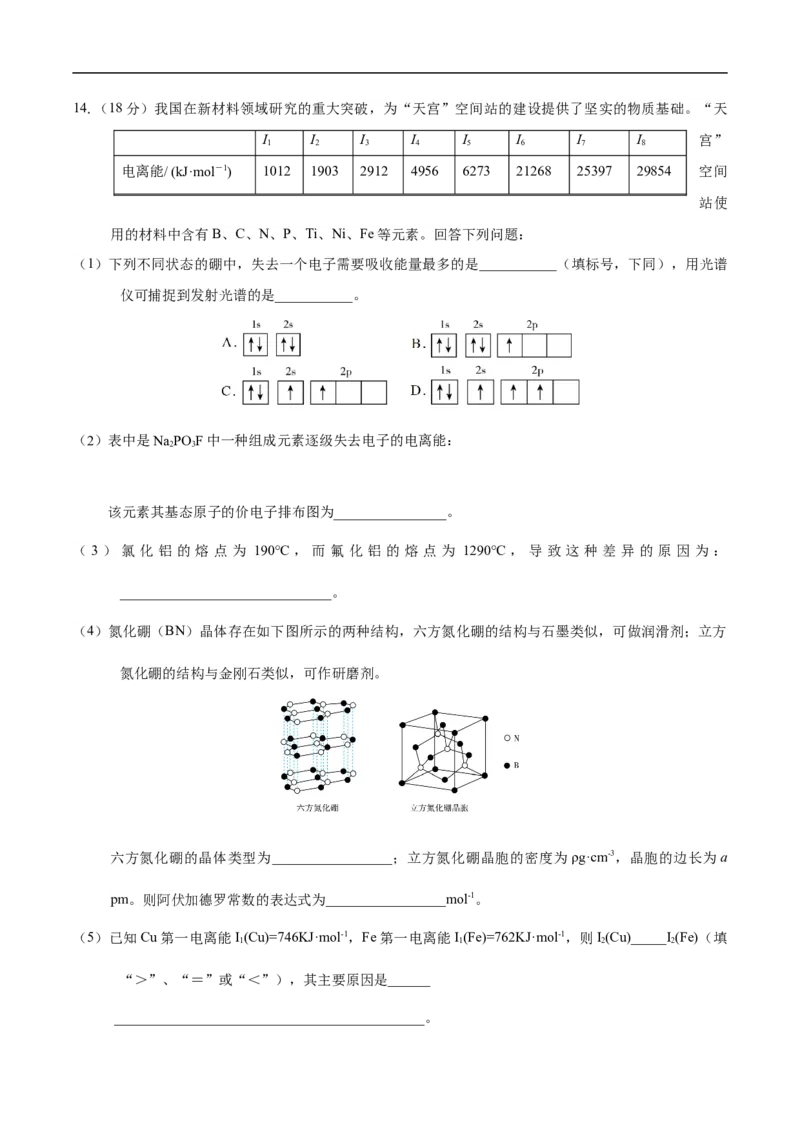
11.有关晶体的结构如图所示,下列说法中错误的是
A.在MgO晶体中,与 最近且等距离的O2-共6个
B.12 g金刚石中含有化学键的数目为2N (设N 为阿伏加德罗常数的值)
A A
C.在干冰晶胞中,1个分子周围有12个紧邻分子
D.在石墨晶体中,碳原子与碳碳键数目比为1∶3
12.主族元素X、Y、Z、Q、M的原子序数依次增大且均不大于20,元素Z和Q同族。元素M的化合物
M+[Q—X≡Y]-为实验室中常用于检验Fe3+的试剂,下列说法错误的是
A.该五种元素有四种在元素周期表中位于P区
B.Q与M的简单离子半径,前者大于后者
C.X、Y、Z的电负性大小关系为Y>Z>X
D.Ca与X元素可形成原子个数比为1∶2的化合物
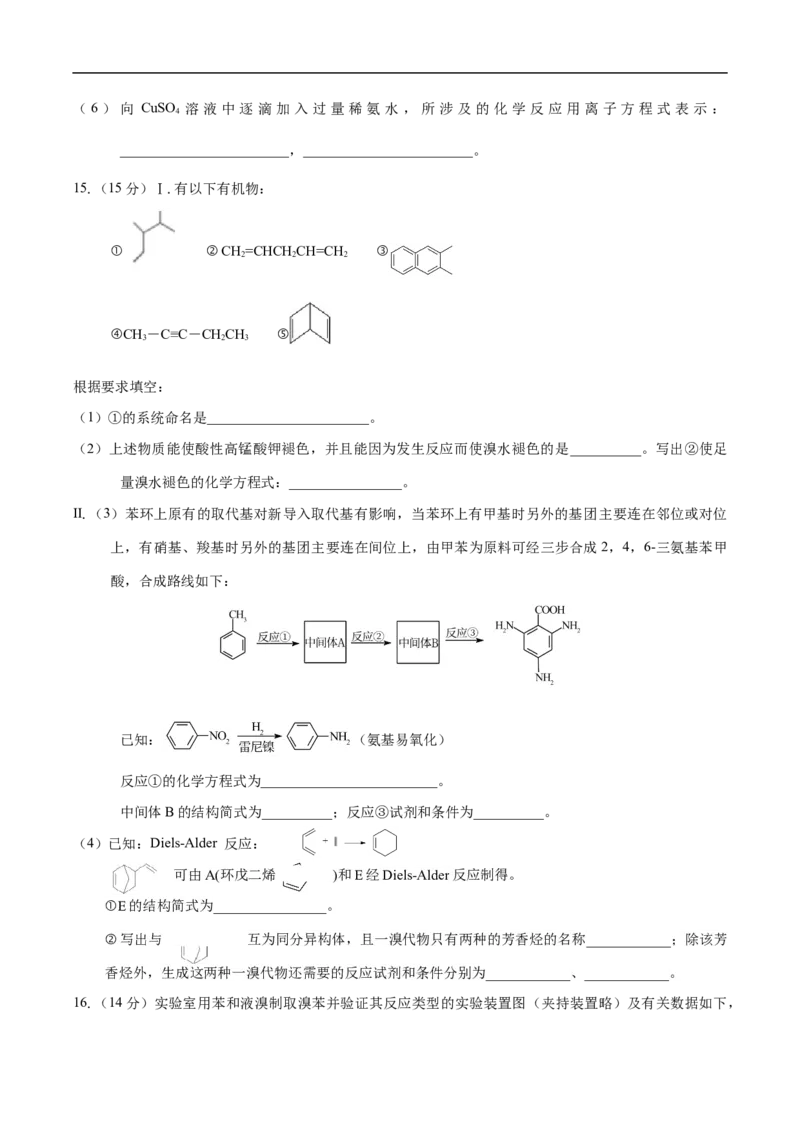
13.将6.8 g的X完全燃烧生成3.6 g的HO和8.96 L(标准状况)的CO。X分子中只含一个苯环且苯环
2 2
上只有一个取代基,其质谱、核磁共振氢谱与红外光谱如图。关于X的下列叙述错误的是
A.X的相对分子质量为136 B.X的分子式为C HO
8 8 2
C.X分子中只有一个甲基 D.X属于芳香烃
第Ⅱ卷(共61分)
二、填空题(本题共4小题,共61分)14.(18分)我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天
I I I I I I I I 宫”
1 2 3 4 5 6 7 8
电离能/ (kJ·mol-1) 1012 1903 2912 4956 6273 21268 25397 29854 空间
站使
用的材料中含有B、C、N、P、Ti、Ni、Fe等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号,下同),用光谱
仪可捕捉到发射光谱的是___________。
(2)表中是NaPO F中一种组成元素逐级失去电子的电离能:
2 3
该元素其基态原子的价电子排布图为________________。
( 3 ) 氯 化 铝 的 熔 点 为 190℃ , 而 氟 化 铝 的 熔 点 为 1290℃ , 导 致 这 种 差 异 的 原 因 为 :
______________________________。
(4)氮化硼(BN)晶体存在如下图所示的两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方
氮化硼的结构与金刚石类似,可作研磨剂。
六方氮化硼的晶体类型为_________________;立方氮化硼晶胞的密度为ρg·cm-3,晶胞的边长为a
pm。则阿伏加德罗常数的表达式为_________________mol-1。
(5)已知Cu第一电离能I(Cu)=746KJ·mol-1,Fe第一电离能I(Fe)=762KJ·mol-1,则I(Cu)_____I (Fe)(填
1 1 2 2
“>”、“=”或“<”),其主要原因是______
____________________________________________。(6)向 CuSO 溶液中 逐滴 加入过 量稀氨水,所 涉及 的化学反应用离子方 程式表示:
4
________________________,________________________。
15.(15分)Ⅰ.有以下有机物:
① ② CH =CHCHCH=CH ③
2 2 2
④CH -C≡C-CHCH ⑤
3 2 3
根据要求填空:
(1)①的系统命名是_______________________。
(2)上述物质能使酸性高锰酸钾褪色,并且能因为发生反应而使溴水褪色的是__________。写出②使足
量溴水褪色的化学方程式:________________。
Ⅱ.(3)苯环上原有的取代基对新导入取代基有影响,当苯环上有甲基时另外的基团主要连在邻位或对位
上,有硝基、羧基时另外的基团主要连在间位上,由甲苯为原料可经三步合成2,4,6-三氨基苯甲
酸,合成路线如下:
已知: (氨基易氧化)
反应①的化学方程式为_________________________。
中间体B的结构简式为__________;反应③试剂和条件为__________。
(4)已知:Diels-Alder 反应:
可由A(环戊二烯 )和E经Diels-Alder反应制得。
①E的结构简式为________________。
②写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称____________;除该芳
香烃外,生成这两种一溴代物还需要的反应试剂和条件分别为____________、____________。
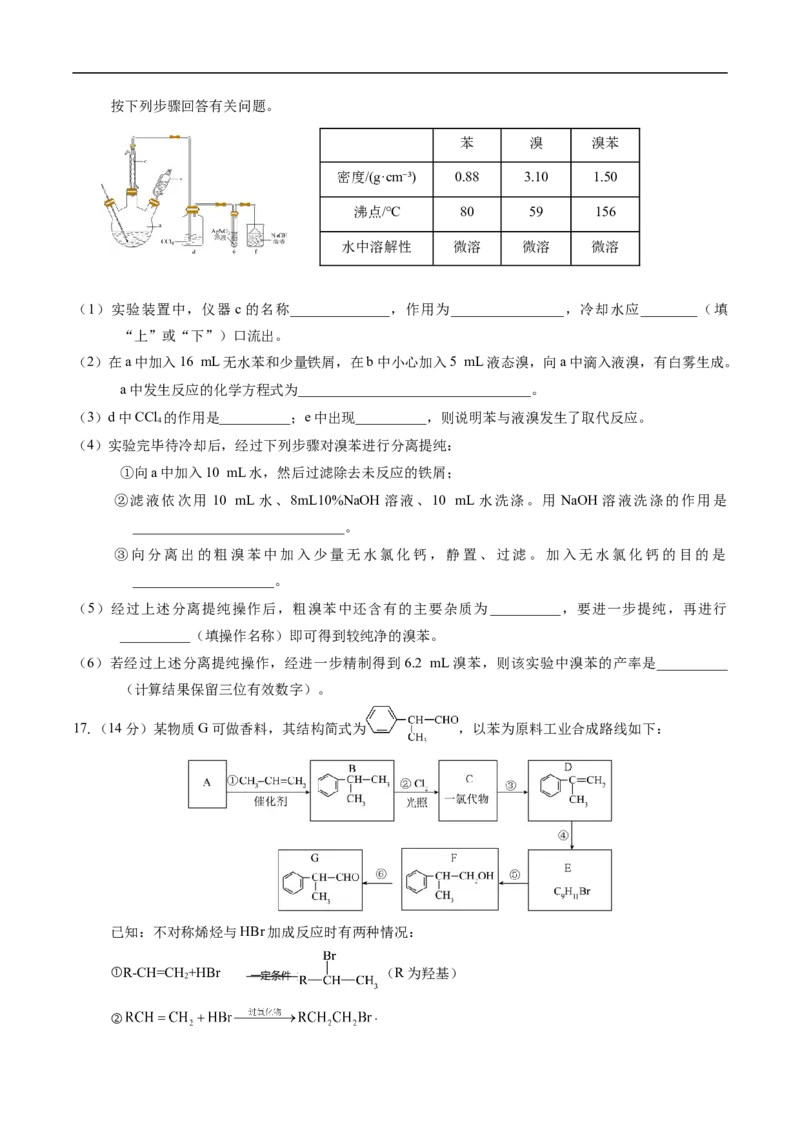
16.(14分)实验室用苯和液溴制取溴苯并验证其反应类型的实验装置图(夹持装置略)及有关数据如下,按下列步骤回答有关问题。
苯 溴 溴苯
密度/(g·cm⁻³) 0.88 3.10 1.50
沸点/℃ 80 59 156
水中溶解性 微溶 微溶 微溶
(1)实验装置中,仪器 c的名称______________,作用为________________,冷却水应________(填
“上”或“下”)口流出。
(2)在a中加入16 mL无水苯和少量铁屑,在b中小心加入5 mL液态溴,向a中滴入液溴,有白雾生成。
a中发生反应的化学方程式为_________________________________。
(3)d中CCl 的作用是__________;e中出现__________,则说明苯与液溴发生了取代反应。
4
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用 10 mL 水、8mL10%NaOH 溶液、10 mL 水洗涤。用 NaOH 溶液洗涤的作用是
______________________________。
③向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入无水氯化钙的目的是
____________________。
(5)经过上述分离提纯操作后,粗溴苯中还含有的主要杂质为__________,要进一步提纯,再进行
__________(填操作名称)即可得到较纯净的溴苯。
(6)若经过上述分离提纯操作,经进一步精制得到6.2 mL溴苯,则该实验中溴苯的产率是__________
(计算结果保留三位有效数字)。
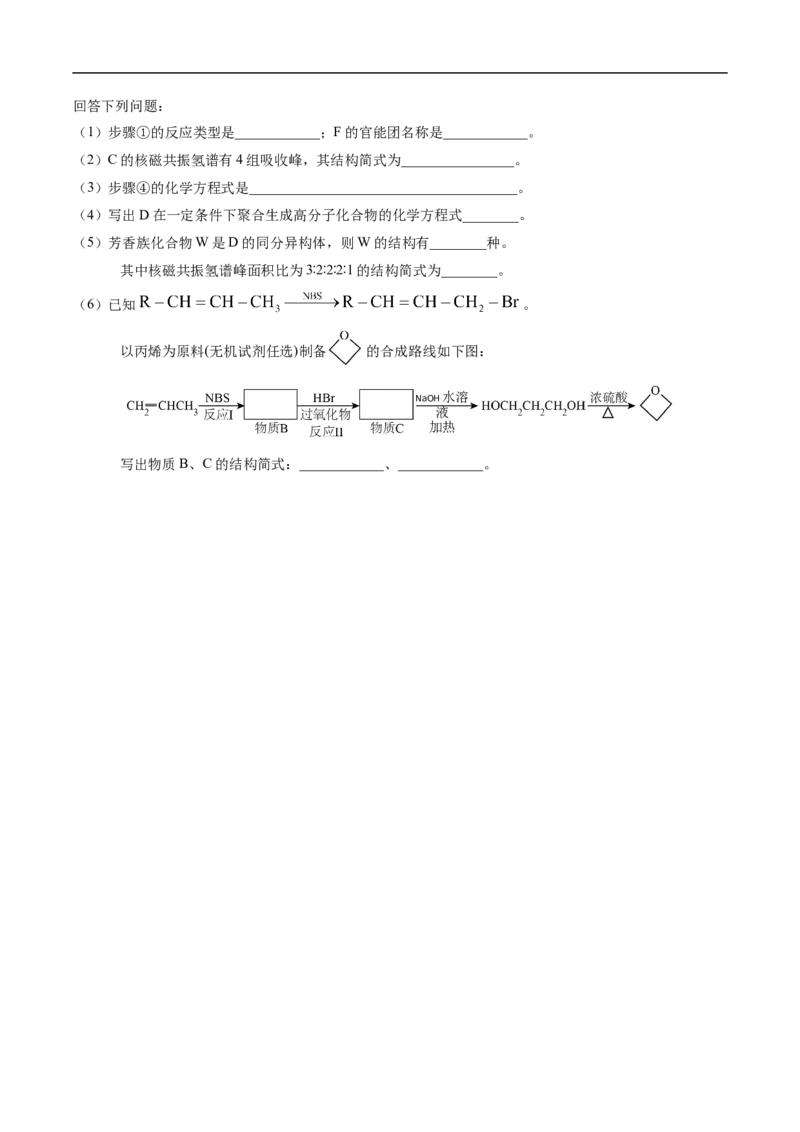
17.(14分)某物质G可做香料,其结构简式为 ,以苯为原料工业合成路线如下:
HBr 过氧化物
已知:不对称烯烃与HBr加成反应时有两种情况:
①R-CH=CH
2
+HBr
一 定 条 件
(R为羟基)
② ·回答下列问题:
(1)步骤①的反应类型是____________;F的官能团名称是____________。
(2)C的核磁共振氢谱有4组吸收峰,其结构简式为________________。
(3)步骤④的化学方程式是______________________________________。
(4)写出D在一定条件下聚合生成高分子化合物的化学方程式________。
(5)芳香族化合物W是D的同分异构体,则W的结构有________种。
其中核磁共振氢谱峰面积比为3∶2∶2∶2∶1的结构简式为________。
(6)已知 。
以丙烯为原料(无机试剂任选)制备 的合成路线如下图:
水溶
NaOH
液
加热
写出物质B、C的结构简式:____________、____________。2024~2025学年度第二学期期中重点校联考
高二化学参考答案
一、选择题(共13小题,每题3分,共39分,每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 B C B D A A C B B A D C D
二、填空题(本题共4小题,共61分)(标注的除外,每空2分)
14.(18分)
(1)A(1分) CD
(2)略(2分)
(3)氯化铝是分子晶体,氟化铝是离子晶体。
(4)混合型晶体 (1分)
(5)> Cu+ 的价电子排布式3d10,是全充满稳定结构,再失去一个电子较难
(6)Cu2++2NH▪H O=Cu(OH) ↓+2NH+ Cu(OH) +4NH= [Cu(NH )]2++2OH-
3 2 2 4 2 3 3 4
15.(15分)
(1)2,3-二甲基戊烷(1分)
(2)②④⑤(1分,选错少选均不得分)
CH=CHCHCH=CH+2Br →CHBrCHBrCH CHBrCH Br
2 2 2 2 2 2 2
(3)
H 雷尼镍
2
(4)①CH=CHCH=CH
2 2
②1,3,5-三甲苯 (1分)
液溴 光照,(1分)
液溴 铁(溴化铁)(1分)
16.(14分)
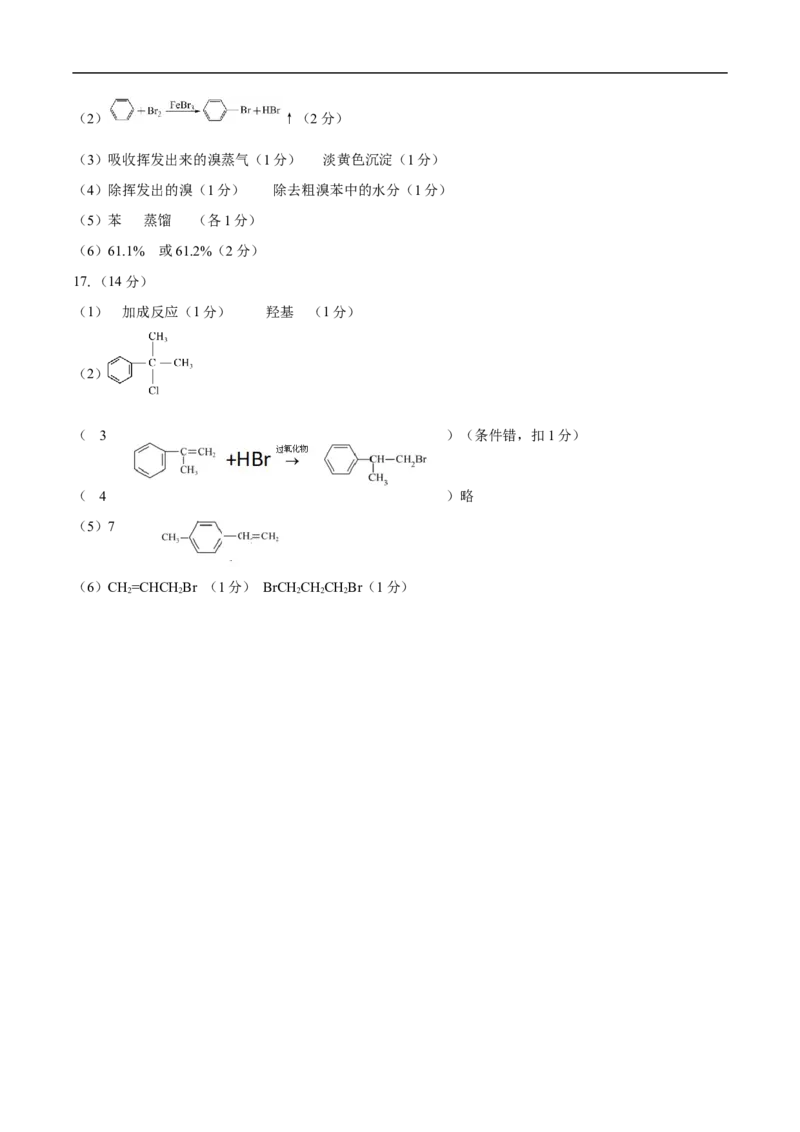
(1)球形冷凝管 (1分) 冷凝回流,导气(2分) 上(1分)(2) ↑(2分)
(3)吸收挥发出来的溴蒸气(1分) 淡黄色沉淀(1分)
(4)除挥发出的溴(1分) 除去粗溴苯中的水分(1分)
(5)苯 蒸馏 (各1分)
(6)61.1% 或61.2%(2分)
17.(14分)
(1) 加成反应(1分) 羟基 (1分)
(2)
( 3 )(条件错,扣1分)
( 4 )略
(5)7
(6)CH=CHCHBr (1分) BrCHCHCHBr(1分)
2 2 2 2 2