文档内容
秘密★考试结束前
丽江市2025届高中毕业生复习统一检测
化学试卷
(全卷两个大题,共18个小题,共8页;满分100分,考试用时75分钟)
注意事项:
1.本卷为试题卷。考生必须在答题卡上解题作答。答案应书写在答题卡的相应位置上,在
试题卷、草稿纸上作答无效。
2.考试结束后,请将答题卡交回。
可能用到的相对原子质量:H-1、C-12、N-14、O-16、S-32
一、单项选择题(本题共14个小题,每小题3分,共42分)
1.化学与生活、生产及科技密切相关。下列叙述错误的是( )
A.客家围屋建造过程中用作黏稠剂的糯米和鸡蛋清都属于混合物
B.奥运火炬“飞扬”外壳采用的耐高温碳纤维材料,属于新型无机非金属材料
C.生活中小苏打可用于治疗胃酸过多
D.永胜瓷厂制陶瓷以黏土为主要原料,在烧制过程中发生了复杂的物理变化
2.下列离子方程式书写正确的是( )
A.用醋酸处理水垢中的碳酸钙:
B.少量的Ba(OH) 稀溶液与NH HCO 稀溶液混合:
2 4 3
Ba2++2OH-+2HCO =BaCO ↓+CO +2H O
3 2
C.海水提溴的过程中用 的水溶液吸收溴蒸气:
D.向苯酚钠溶液中通入少量 :
3.下列化学用语表示正确的是( )
A.乙炔分子的空间填充模型:
B.羟基的电子式:
C.CS 的VSEPR模型为:平面三角形
2
D.碳原子核外价电子的轨道表示式:
化学试卷·第1页(共8页)
学科网(北京)股份有限公司4.设 为阿伏加德罗常数的值。下列有关描述正确的是( )
A.标准状况下, 的氧原子数为4.5
B.分别由 和 制备等量的氧气转移的电子数目相等
C. 和 在一定条件下充分反应后,混合物的分子数大于
D.273K、101kPa下,28g乙烯与丁烯混合物中含σ键的数目为5
5.常温下,下列离子在指定溶液中一定能大量共存的是( )
A.与Al反应能放出H 的溶液中:Na+、Ba2+、Cl-、ClO-
2
B.含大量NaHSO 的溶液中:K+、Fe2+、Cl-、
4
C.某中性溶液中:Fe3+、K+、 、
D.能使酚酞变红的溶液中:Na+、K+、 、
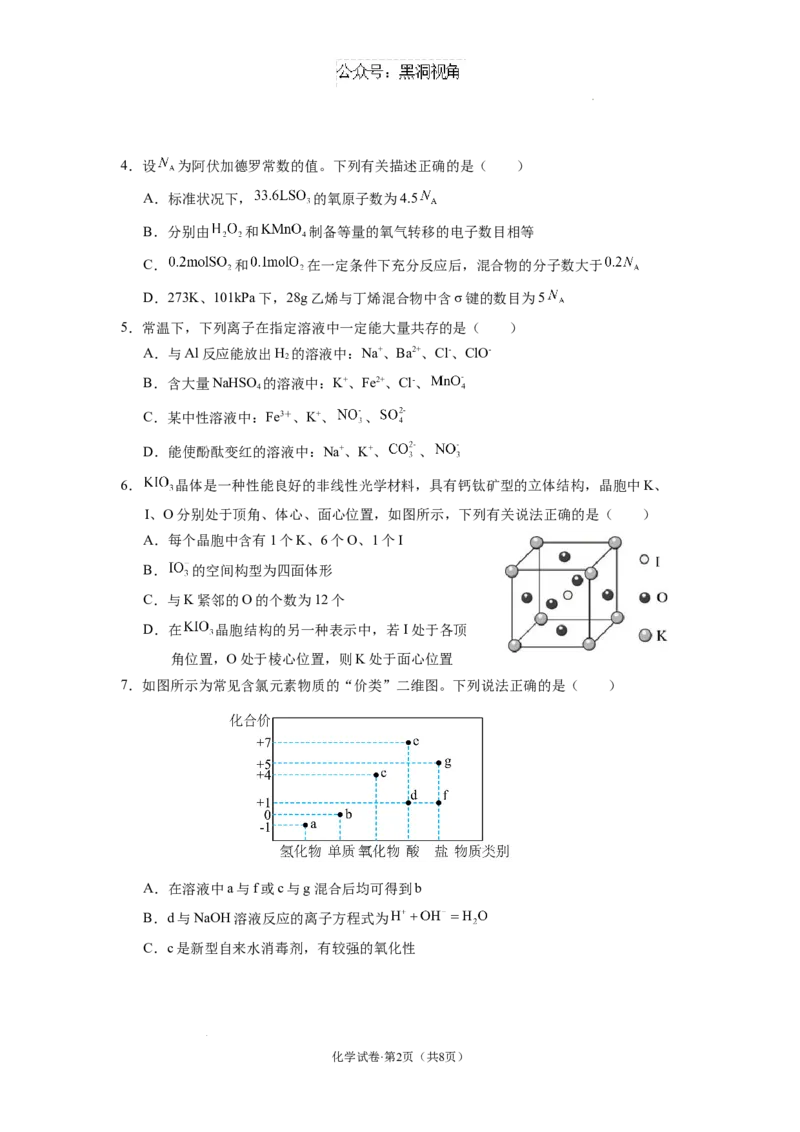
6. 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,晶胞中K、
I、O分别处于顶角、体心、面心位置,如图所示,下列有关说法正确的是( )
A.每个晶胞中含有1个K、6个O、1个I
B. 的空间构型为四面体形
C.与K紧邻的O的个数为12个
D.在 晶胞结构的另一种表示中,若I处于各顶
角位置,O处于棱心位置,则K处于面心位置
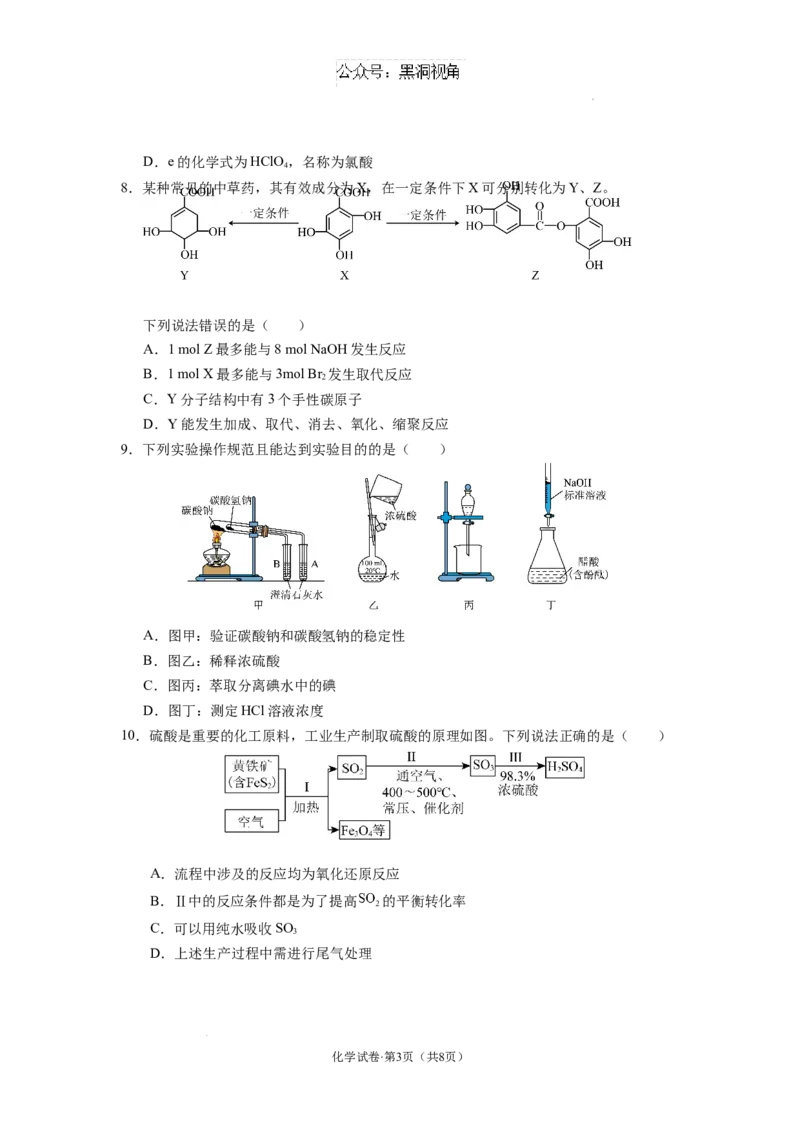
7.如图所示为常见含氯元素物质的“价类”二维图。下列说法正确的是( )
A.在溶液中a与f或c与g混合后均可得到b
B.d与NaOH溶液反应的离子方程式为
C.c是新型自来水消毒剂,有较强的氧化性
化学试卷·第2页(共8页)
学科网(北京)股份有限公司D.e的化学式为HClO,名称为氯酸
4
8.某种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
下列说法错误的是( )
A.1 mol Z最多能与8 mol NaOH发生反应
B.1 mol X最多能与3mol Br 发生取代反应
2
C.Y分子结构中有3个手性碳原子
D.Y能发生加成、取代、消去、氧化、缩聚反应
9.下列实验操作规范且能达到实验目的的是( )
A.图甲:验证碳酸钠和碳酸氢钠的稳定性
B.图乙:稀释浓硫酸
C.图丙:萃取分离碘水中的碘
D.图丁:测定HCl溶液浓度
10.硫酸是重要的化工原料,工业生产制取硫酸的原理如图。下列说法正确的是( )
A.流程中涉及的反应均为氧化还原反应
B.Ⅱ中的反应条件都是为了提高 的平衡转化率
C.可以用纯水吸收SO
3
D.上述生产过程中需进行尾气处理
化学试卷·第3页(共8页)
学科网(北京)股份有限公司11.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,已知W原子的
最外层电子数比内层电子数少3个,下列说法正确的是( )
A.Y单质与Z的氢化物水溶液反应,有沉淀生成
B.氧化物对应水化物的酸性:W>Z X Y
C.X元素的第一电离能小于Y元素 Z W
D.简单氢化物的稳定性:Z > W
12.下列实验操作、现象及结论均正确的是( )
选
实验操作 现象 结论
项
检验某有机物中的氯元素:
取样于试管,加入氢氧化钠
说明该有机物中不含氯元
A 的乙醇溶液共热,一段时间 未出现白色沉淀
素
后,加入稀硝酸酸化的
AgNO 溶液,振荡。
3
取 1mL 0.1mol/L 的 AgNO
3
溶液于试管,加入 2mL
0.1mol/L 的 KCl 溶液,振 先产生白色沉淀,
B K (AgCl)> K (AgI)
SP SP
荡 。 再 加 入 5 ~ 6 滴 后有黄色沉淀生成
0.1mol/L 的 KI 溶 液 于 试
管,振荡,静置。
验证FeI 溶液中Fe2+的还原
2
酸性 KMnO 溶液
4
C 性:取样于试管,加入酸性 Fe2+具有还原性
紫红色褪去
KMnO 溶液,振荡。
4
将SO 通入品红溶液中,品
2
D 红溶液褪色,加热褪色后的 溶液恢复成红色 HSO 具有不稳定性
2 3
品红溶液
13.通过电解废旧锂电池中的 可获得难溶性的 和 ,电解示意图如下
(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化
忽略不计)。下列说法正确的是( )
A.电极A为阳极,发生氧化反应
B.电极B的电极反应:4OH-+Mn2+-2e-=MnO+2H O
2 2
C.电解一段时间后溶液中 浓度减小
D.电解结束,可通过调节 除去 ,再加入
溶液以获得
化学试卷·第4页(共8页)
学科网(北京)股份有限公司14.柠檬酸是三元弱酸(简写为HA)。常温下,向10 mL 0.1 mol·L-1 HA溶液中滴加V mL
3 3
pH=13的NaOH溶液,溶液的pH与含A粒子分布系数如图所示。已知:HA的分布系
3
数表达式为δ(H A)= ×100%。 下列叙述正确的是(
3
)
A.曲线③表示的是HA-的变化
2
B.当V=20时,溶液中:c(HA2-) > c(A3-)> c(H A-)
2
C.K (H A)的数量级为:10-3
a1 3
D.pH=4.77时,溶液中:c(Na+) > 3c(HA2-)+3c(A3-)
二、非选择题(本题共4个小题,除特殊标注外,每空2分,共58分)
15.(14分)硫酸锌(ZnSO)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应
4
用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为 ZnCO ,杂质为SiO 以及Ca、
3 2
Mg、Fe、Cu等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
离子 Cu2+
回答下列问题:
(1)菱锌矿焙烧时生成的气体的电子式 。
(2)为了提高锌的浸取效果,可采取的措施有 。(任意写一条即
可)
(3)加入物质X调溶液 ,最适宜使用的X是 (填标号)。
a. NH ·H O b. c.
3 2
滤渣①的主要成分中全部由非金属元素组成的物质用途是 。(任意写一条即
可)
(4)Cu原子的价层电子排布式为________________。
(5)向 的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有 ,
该步反应的离子方程式为 。
(6)滤液②中加入锌粉的目的是 (用化学方程式表示)。
化学试卷·第5页(共8页)
学科网(北京)股份有限公司(7)滤渣④与浓 反应可以释放HF并循环利用,同时得到的副产物中阴离子的空间
结构为 。
16.(15分)双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、
乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复
合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
已知氰胺二聚反应机理为:
回答下列问题:
(1)已知:氰基是吸电子基团。氰氨 的碱性 氨的碱性。(填:
“大于”、“小于”或“等于”)
(2)写出步骤Ⅰ的化学反应方程式 。
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因是 。
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是 。
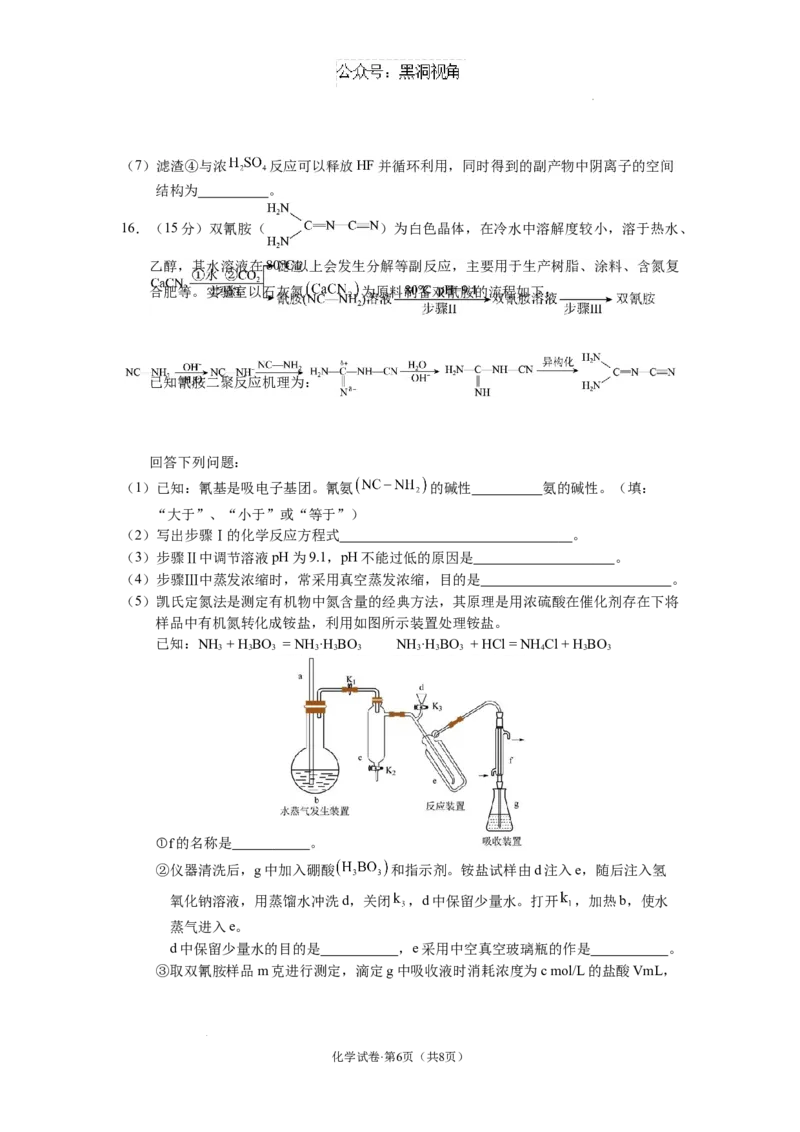
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将
样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:NH + H BO = NH ·H BO NH ·H BO + HCl = NH Cl + H BO
3 3 3 3 3 3 3 3 3 4 3 3
①f的名称是 。
②仪器清洗后,g中加入硼酸 和指示剂。铵盐试样由d注入e,随后注入氢
氧化钠溶液,用蒸馏水冲洗d,关闭 ,d中保留少量水。打开 ,加热b,使水
蒸气进入e。
d中保留少量水的目的是 ,e采用中空真空玻璃瓶的作是 。
③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为c mol/L的盐酸VmL,
化学试卷·第6页(共8页)
学科网(北京)股份有限公司则样品中氮元素的质量分数为 %。(用含c、m、V的代数式表示)
17.(14分)CO 既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能
2
源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向2L的密闭容器加入
一定量的活性炭和NO,发生反应C(s)+ 2NO(g) N(g)+CO (g) △H,在T ℃时,
2 2 1
反应进行到不同时间测得各物质的物质的量如下:
时间/min
0 10 20 30
物质的量/mol
NO 4.00 2.32 0.80 0.80
N 0 0.84 1.60 1.60
2
CO 0 0.84 1.60 1.60
2
①根据图表数据分析T ℃时,该反应在10~20 min内的平均反应速率 ν(CO )=
1 2
。
②平衡时测得容器的总压强为PKPa,则T ℃时该反应的分压平衡常数K=
0 1 p
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③若30 min后升高温度至T℃,达到平衡时,容器中NO、N、CO 的浓度之比为
2 2 2
3:5:5,该反应的△H 0(填“>”或“<”)。
④若30 min后只改变某一条件,NO、N、CO 的浓度分别变为0.6mol/L;1.2mol/L;
2 2
1.2mol/L,则改变的条件可能是 (填字母编号)。
A.适当缩小容器的体积 B.通入一定量的NO
C.加入一定量的活性炭 D.加入合适的催化剂
E.升高温度
(2)向恒容绝热的密闭容器中充入amolC与2a mol NO进行反应C(s)+2NO(g) N(g)
2
+CO (g),下列能判断反应已达化学平衡状态的是 。
2
①容器中混合气体密度不变 ②混合气体中c(N ) : c(CO)=1:1且保持不变
2 2
③ V 正 (NO)= V 逆 (N 2 ) ④容器内温度不变
⑤容器内压强不变
(3)工业上用CO 和H 反应合成二甲醚。已知:
2 2
CO(g)+3H(g) CHOH(g)+HO(g) △H =-49.1 kJ·mol-1
2 2 3 2 1
2CHOH(g) CHOCH (g)+HO(g) △H =-24.5 kJ·mol -1
3 3 3 2 2
写出CO(g)和H(g)转化为CHOCH (g)和HO(g)的热化学方程式 。
2 2 3 3 2
(4)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,某种二甲醚氧气电
化学试卷·第7页(共8页)
学科网(北京)股份有限公司池(电解质为KOH溶液)的负极反应式为 。
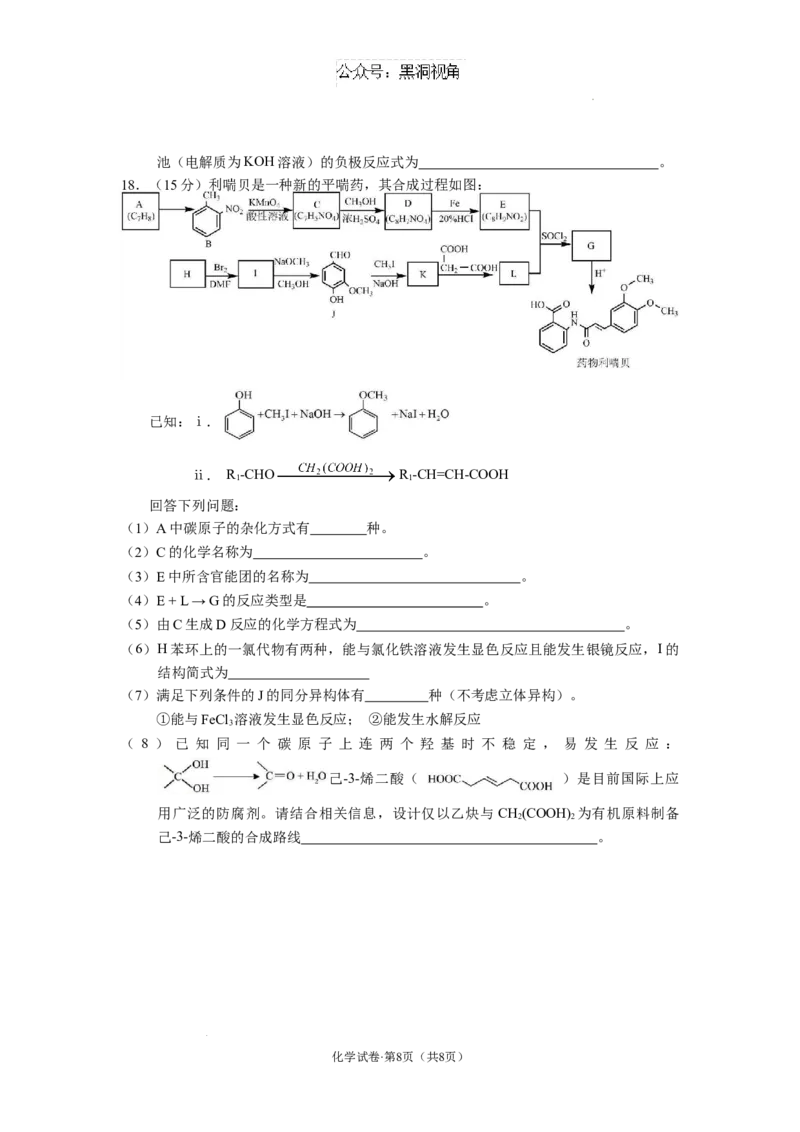
18.(15分)利喘贝是一种新的平喘药,其合成过程如图:
已知:ⅰ.
ⅱ. R -CHO R -CH=CH-COOH
1 1
回答下列问题:
(1)A中碳原子的杂化方式有 种。
(2)C的化学名称为 。
(3)E中所含官能团的名称为 。
(4)E + L → G的反应类型是 。
(5)由C生成D反应的化学方程式为 。
(6)H苯环上的一氯代物有两种,能与氯化铁溶液发生显色反应且能发生银镜反应,I的
结构简式为
(7)满足下列条件的J的同分异构体有 种(不考虑立体异构)。
①能与FeCl 溶液发生显色反应; ②能发生水解反应
3
( 8 ) 已 知 同 一 个 碳 原 子 上 连 两 个 羟 基 时 不 稳 定 , 易 发 生 反 应 :
己-3-烯二酸( )是目前国际上应
用广泛的防腐剂。请结合相关信息,设计仅以乙炔与 CH(COOH) 为有机原料制备
2 2
己-3-烯二酸的合成路线 。
化学试卷·第8页(共8页)
学科网(北京)股份有限公司