文档内容
A10 联盟 2023 级高二上学期 11 月期中考
化学(人教版)试题
命题单位:巢湖一中化学教研组 编审单位:合肥皖智教育研究院
满分100分,考试时间75分钟。请在答题卡上作答。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Fe-56
一、选择题(本大题共 14小题,每小题3分,共42分。每小题的四个选项中,只有一项是
最符合题目要求的)
1.“能源”是人们生活中不可或缺的一部分,高效利用能源是人类文明进步的重要标志。下列能量转化关
系错误的是( )
A B C D
燃油汽车 水电站 风力发电 氯碱工业制氯气
化学能→热能→动能 化学能→电能 风能→机械能→电能 电能→化学能
2.中华文明,源远流长。下列传统文化描述中,发生吸热反应的是( )
A.唐·张九龄“松叶堪为酒,春来酿几多”描述酿酒的工艺
B.明·于谦“千锤万凿出深山,烈火焚烧若等闲”描述石灰的形成
C.南宋·辛弃疾“东风夜放花千树,更吹落,星如雨”描述元宵夜焰火
D.唐·白居易“春寒赐浴华清池,温泉水滑洗凝脂”描述温泉水的恒温
3.我国学者对T℃时铜基催化剂表面甲醇( )的可逆反应机理进行了深入研究,揭示了反应过程
中的关键步骤及中间体的演化规律。一种反应机理如图所示:
下列有关说法正确的是( )
A. B.反应速率:反应Ⅰ>反应Ⅱ
C.该反应在高温下可自发进行 D.铜基催化剂使该反应的焓变减小
4.研究表明:铜镍合金( )因其良好的储氢条件成为固态储氢材料的热门研究对象。由于其优异的
储氢能力, ,镍氢电池已经逐渐取代有污染的镍镉电池。根据勒夏特列原理,欲使储氢材料释放更多 的条件是( )
A.高温低压 B.低温高压 C.使用优良催化剂 D.减小 的量
5.化学实验操作中,规范的操作直接影响实验结果的准确性和有效性。下列实验操作规范且能达到目的的
是( )
选项 A B C D
实验操作
实验目的 喷泉实验 测定反应速率 配制时转移溶液 中和热的测定
6.羰基硫( )毒性适中且易于降解,对环境危害较小,工业上是农药、医药、有机合成等生产
领域的重要中间体。已知羰基硫氢解反应: 中的键能如表所示。
下列说法错误的是( )
化学键
436 745 580 339 1076
A. 比 稳定 B. 中C为+4价
C.活化能: D.该反应焓变
阅读下列材料,完成7~8小题。
2024年10月9日17时45分,2024年诺贝尔化学奖授予了三位科学家,以表彰他们在蛋白质氨基酸
方面研究的突破性贡献。氮元素与蛋白质氨基酸关系密切,美国《科学》杂志曾报道:对于反应
,科学家提出了三步基元反应的历程:①
(快),② (快),③ (慢),整个反应的速率由第③
步 ( 决 速 步 ) 决 定 。 ,
, 、 为速率常数,受温度影响。
7.对于该反应的有关说法正确的是( )
A. 为该反应的催化剂
B.三步历程的活化能大小:②>③C.温度降低, 减小, 减小, 减小的更多
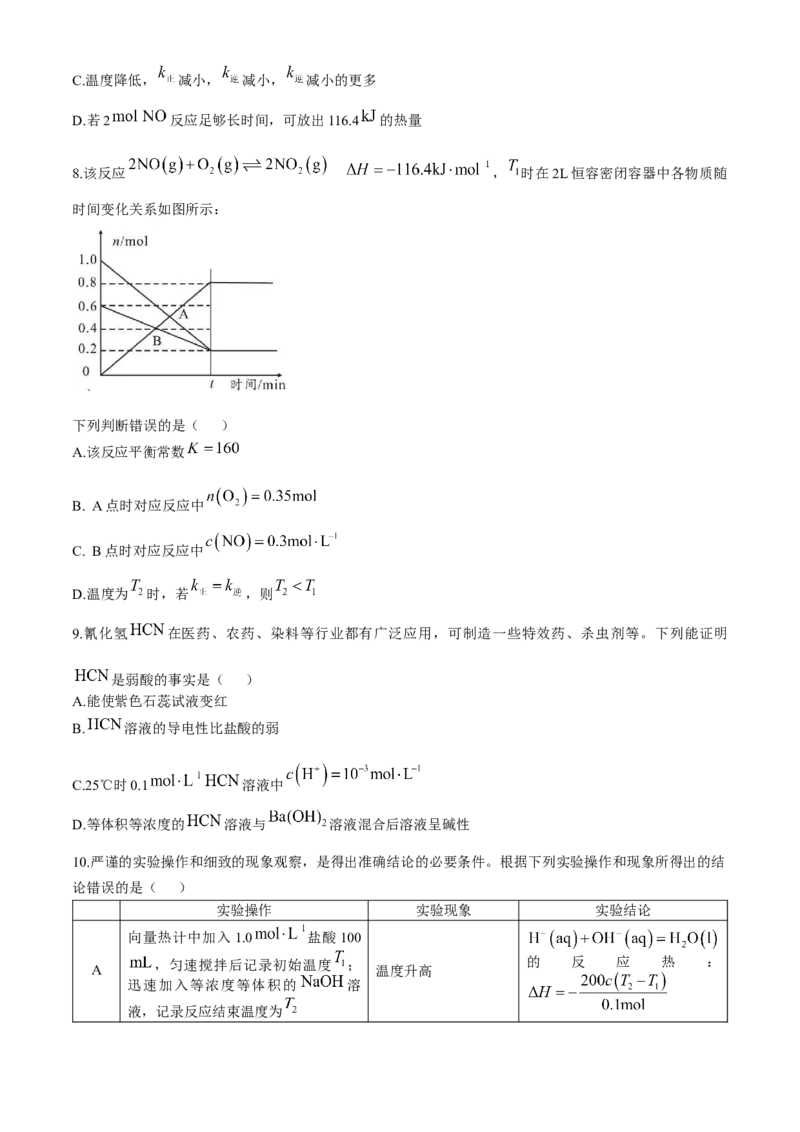
D.若2 反应足够长时间,可放出116.4 的热量
8.该反应 , 时在2L恒容密闭容器中各物质随
时间变化关系如图所示:
下列判断错误的是( )
A.该反应平衡常数
B. A点时对应反应中
C. B点时对应反应中
D.温度为 时,若 ,则
9.氰化氢 在医药、农药、染料等行业都有广泛应用,可制造一些特效药、杀虫剂等。下列能证明
是弱酸的事实是( )
A.能使紫色石蕊试液变红
B. 溶液的导电性比盐酸的弱
C.25℃时0.1 溶液中
D.等体积等浓度的 溶液与 溶液混合后溶液呈碱性
10.严谨的实验操作和细致的现象观察,是得出准确结论的必要条件。根据下列实验操作和现象所得出的结
论错误的是( )
实验操作 实验现象 实验结论
向量热计中加入1.0 盐酸100
,匀速搅拌后记录初始温度 ; 的 反 应 热 :
A 温度升高
迅速加入等浓度等体积的 溶
液,记录反应结束温度为室温下,向两支盛有相同 溶液
B 的试管中,分别加入1 不同浓度 浓 溶液产生 其它条件相同时, 浓
浑浊的时间更短 度越大,反应速率越快
的 溶液
电离平衡常数K:
C 常温下,向 溶液中滴加等浓 产生气泡
度等体积的醋酸溶液
溶液变成棕黄色,一
D 室温下,向盛有 溶液的试管中
段时间后,出现气泡 催化 分解产生
加入几滴酸化的硫酸亚铁溶液
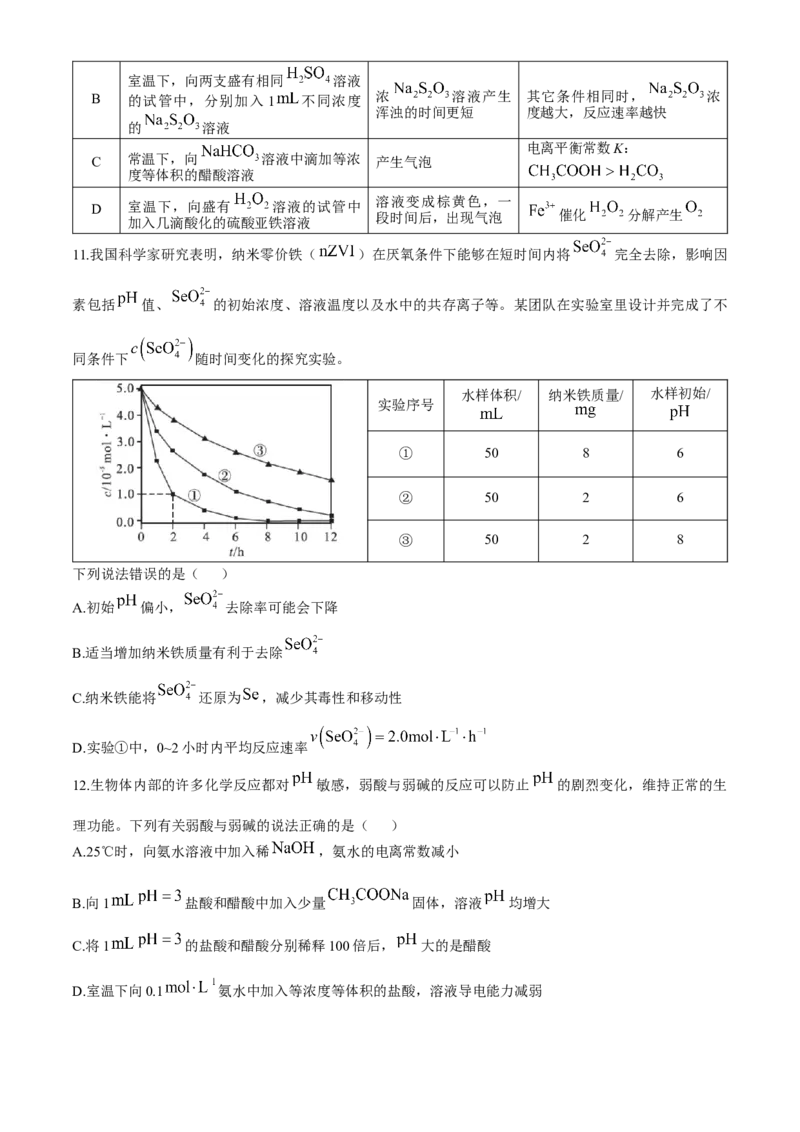
11.我国科学家研究表明,纳米零价铁( )在厌氧条件下能够在短时间内将 完全去除,影响因
素包括 值、 的初始浓度、溶液温度以及水中的共存离子等。某团队在实验室里设计并完成了不
同条件下 随时间变化的探究实验。
水样体积/ 纳米铁质量/ 水样初始/
实验序号
① 50 8 6
② 50 2 6
③ 50 2 8
下列说法错误的是( )
A.初始 偏小, 去除率可能会下降
B.适当增加纳米铁质量有利于去除
C.纳米铁能将 还原为 ,减少其毒性和移动性
D.实验①中,0~2小时内平均反应速率
12.生物体内部的许多化学反应都对 敏感,弱酸与弱碱的反应可以防止 的剧烈变化,维持正常的生
理功能。下列有关弱酸与弱碱的说法正确的是( )
A.25℃时,向氨水溶液中加入稀 ,氨水的电离常数减小
B.向1 盐酸和醋酸中加入少量 固体,溶液 均增大
C.将1 的盐酸和醋酸分别稀释100倍后, 大的是醋酸
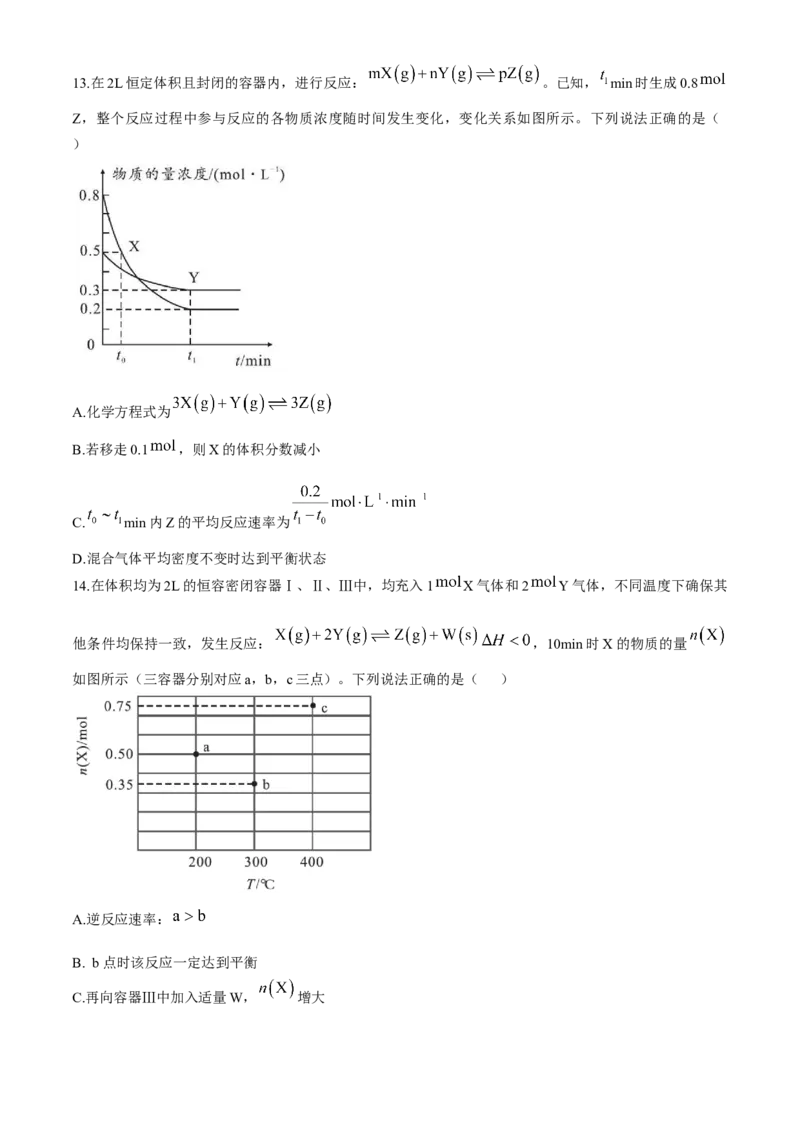
D.室温下向0.1 氨水中加入等浓度等体积的盐酸,溶液导电能力减弱13.在2L恒定体积且封闭的容器内,进行反应: 。已知, min时生成0.8
Z,整个反应过程中参与反应的各物质浓度随时间发生变化,变化关系如图所示。下列说法正确的是(
)
A.化学方程式为
B.若移走0.1 ,则X的体积分数减小
C. min内Z的平均反应速率为
D.混合气体平均密度不变时达到平衡状态
14.在体积均为2L的恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,均充入1 X气体和2 Y气体,不同温度下确保其
他条件均保持一致,发生反应: ,10min时X的物质的量
如图所示(三容器分别对应a,b,c三点)。下列说法正确的是( )
A.逆反应速率:
B. b点时该反应一定达到平衡
C.再向容器Ⅲ中加入适量W, 增大D.再向容器Ⅲ中充入0.6 X和0.2 Z,Y转化率不变
二、非选择题(本大题共4小题,共58分)
15.(14分)
Ⅰ.在固体催化剂( )表面合成氨的过程是一个典型的多相催化反应,通常称为哈伯-博
施过程(Haber-Bosch process)。这个过程在工业上用于从大气中的氮气( )和氢气( )
来合成氨气( ),其示意图如下:
(1)写出合成氨反应的热化学方程式:_______________________________________。
(2)已知合成氨反应分两步进行。吸附后,能量状态最高的是_________(填“甲”、“乙”或“丙”,
下同),能量状态最低的是_________。
Ⅱ.
(3)实验测得:101 时1g 完全燃烧生成液态水和 气体,放出55.6 的热量。写出表示
燃烧热的热化学方程式:_______________________________________。
(4)已知热化学方程式: ,在容器中充入1
和0.5 充分反应,最终放出的热量为_________。
A.等于196.64 B.大于98.32 C.等于98.32 D.小于98.32
Ⅲ.
(5) ,该反应是吸
热反应,常温下却可以自发进行,理由是_______________________________________。
(6)室温下,将 1 溶于水会使溶液温度降低,热效应为 ,将 1
溶于水会使溶液温度升高,热效应为 , 受热分解的热化学方程式为:
____________(用 和 表示),且________ (填“>”、“=”或“<”)。
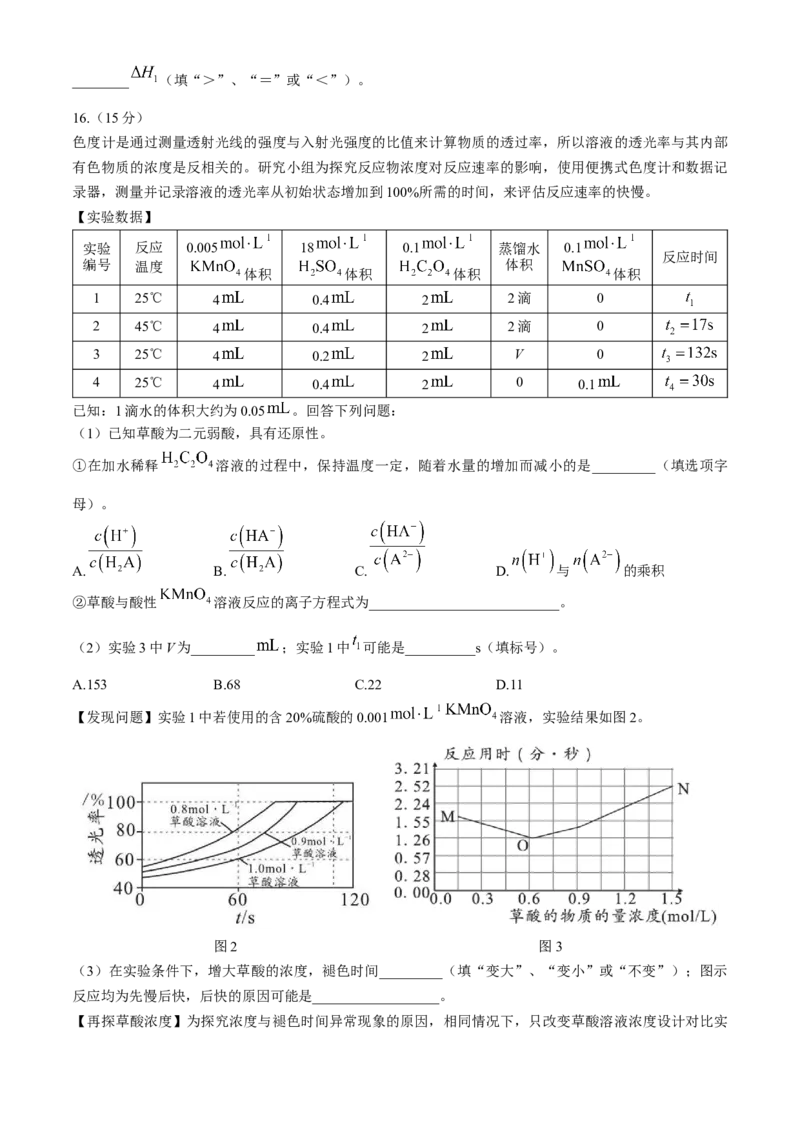
16.(15分)
色度计是通过测量透射光线的强度与入射光强度的比值来计算物质的透过率,所以溶液的透光率与其内部
有色物质的浓度是反相关的。研究小组为探究反应物浓度对反应速率的影响,使用便携式色度计和数据记
录器,测量并记录溶液的透光率从初始状态增加到100%所需的时间,来评估反应速率的快慢。
【实验数据】
实验 反应 0.005 18 0.1 蒸馏水 0.1
反应时间
编号 温度 体积
体积 体积 体积 体积
1 25℃ 4 0.4 2 2滴 0
2 45℃ 4 0.4 2 2滴 0
3 25℃ 4 0.2 2 V 0
4 25℃ 4 0.4 2 0 0.1
已知:1滴水的体积大约为0.05 。回答下列问题:
(1)已知草酸为二元弱酸,具有还原性。
①在加水稀释 溶液的过程中,保持温度一定,随着水量的增加而减小的是_________(填选项字
母)。
A. B. C. D. 与 的乘积
②草酸与酸性 溶液反应的离子方程式为___________________________。
(2)实验3中V为_________ ;实验1中 可能是__________s(填标号)。
A.153 B.68 C.22 D.11
【发现问题】实验1中若使用的含20%硫酸的0.001 溶液,实验结果如图2。
图2 图3
(3)在实验条件下,增大草酸的浓度,褪色时间_________(填“变大”、“变小”或“不变”);图示
反应均为先慢后快,后快的原因可能是__________________。
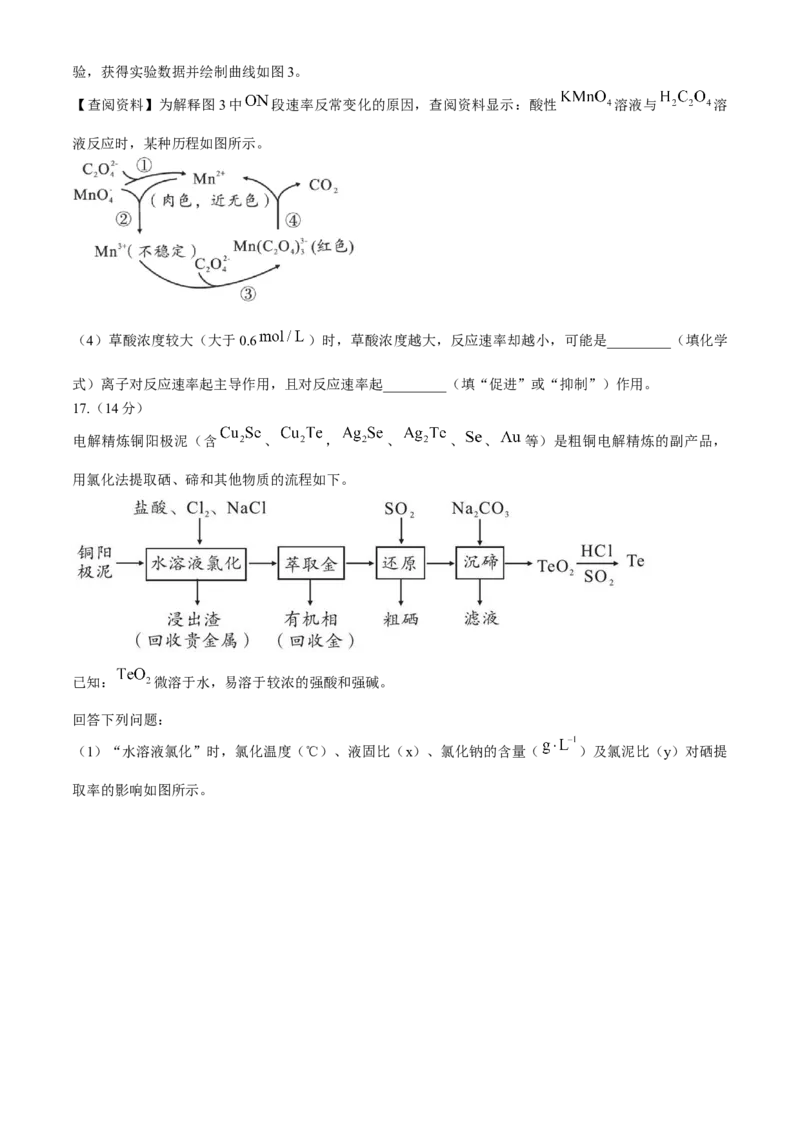
【再探草酸浓度】为探究浓度与褪色时间异常现象的原因,相同情况下,只改变草酸溶液浓度设计对比实验,获得实验数据并绘制曲线如图3。
【查阅资料】为解释图3中 段速率反常变化的原因,查阅资料显示:酸性 溶液与 溶
液反应时,某种历程如图所示。
(4)草酸浓度较大(大于0.6 )时,草酸浓度越大,反应速率却越小,可能是_________(填化学
式)离子对反应速率起主导作用,且对反应速率起_________(填“促进”或“抑制”)作用。
17.(14分)
电解精炼铜阳极泥(含 、 , 、 、 、 等)是粗铜电解精炼的副产品,
用氯化法提取硒、碲和其他物质的流程如下。
已知: 微溶于水,易溶于较浓的强酸和强碱。
回答下列问题:
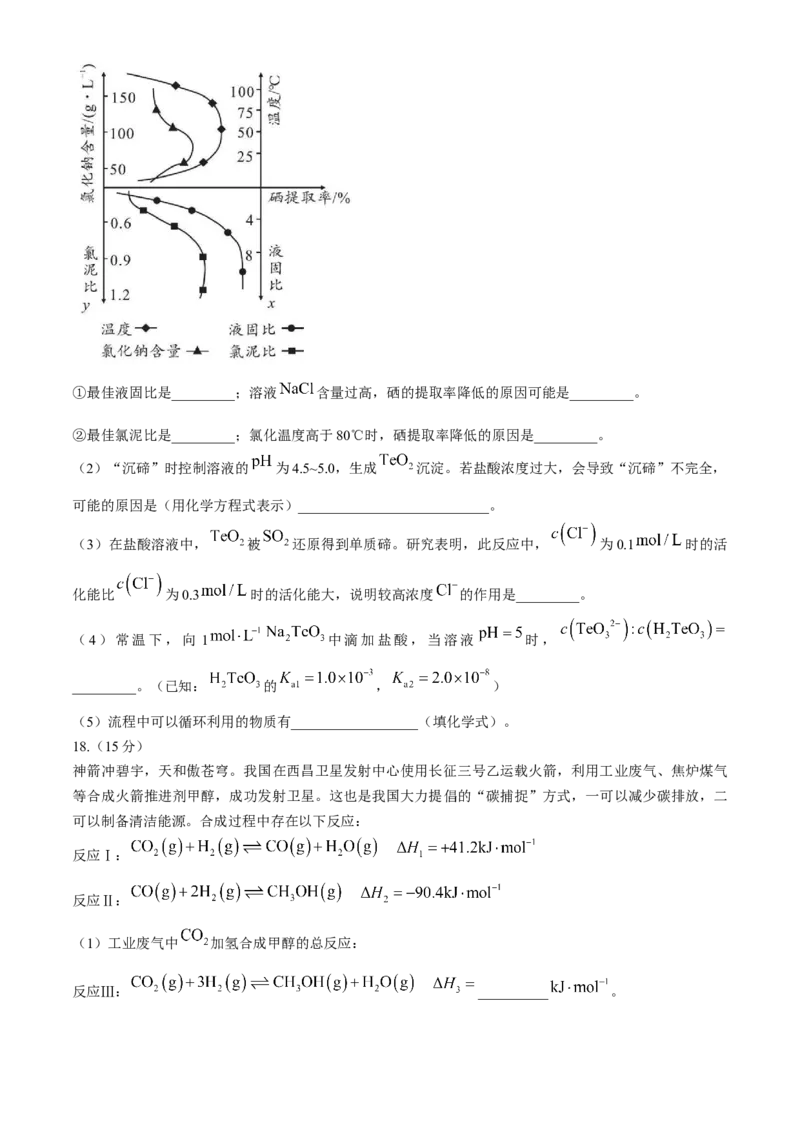
(1)“水溶液氯化”时,氯化温度(℃)、液固比(x)、氯化钠的含量( )及氯泥比(y)对硒提
取率的影响如图所示。①最佳液固比是_________;溶液 含量过高,硒的提取率降低的原因可能是_________。
②最佳氯泥比是_________;氯化温度高于80℃时,硒提取率降低的原因是_________。
(2)“沉碲”时控制溶液的 为4.5~5.0,生成 沉淀。若盐酸浓度过大,会导致“沉碲”不完全,
可能的原因是(用化学方程式表示)___________________________。
(3)在盐酸溶液中, 被 还原得到单质碲。研究表明,此反应中, 为0.1 时的活
化能比 为0.3 时的活化能大,说明较高浓度 的作用是_________。
(4)常温下,向 1 中滴加盐酸,当溶液 时,
_________。(已知: 的 , )
(5)流程中可以循环利用的物质有__________________(填化学式)。
18.(15分)
神箭冲碧宇,天和傲苍穹。我国在西昌卫星发射中心使用长征三号乙运载火箭,利用工业废气、焦炉煤气
等合成火箭推进剂甲醇,成功发射卫星。这也是我国大力提倡的“碳捕捉”方式,一可以减少碳排放,二
可以制备清洁能源。合成过程中存在以下反应:
反应Ⅰ:
反应Ⅱ:
(1)工业废气中 加氢合成甲醇的总反应:
反应Ⅲ: __________ 。(2)其他条件相同时,不同温度下加入相同的铜基催化剂,在相同时间段内,测得甲醇的产率、铜基催
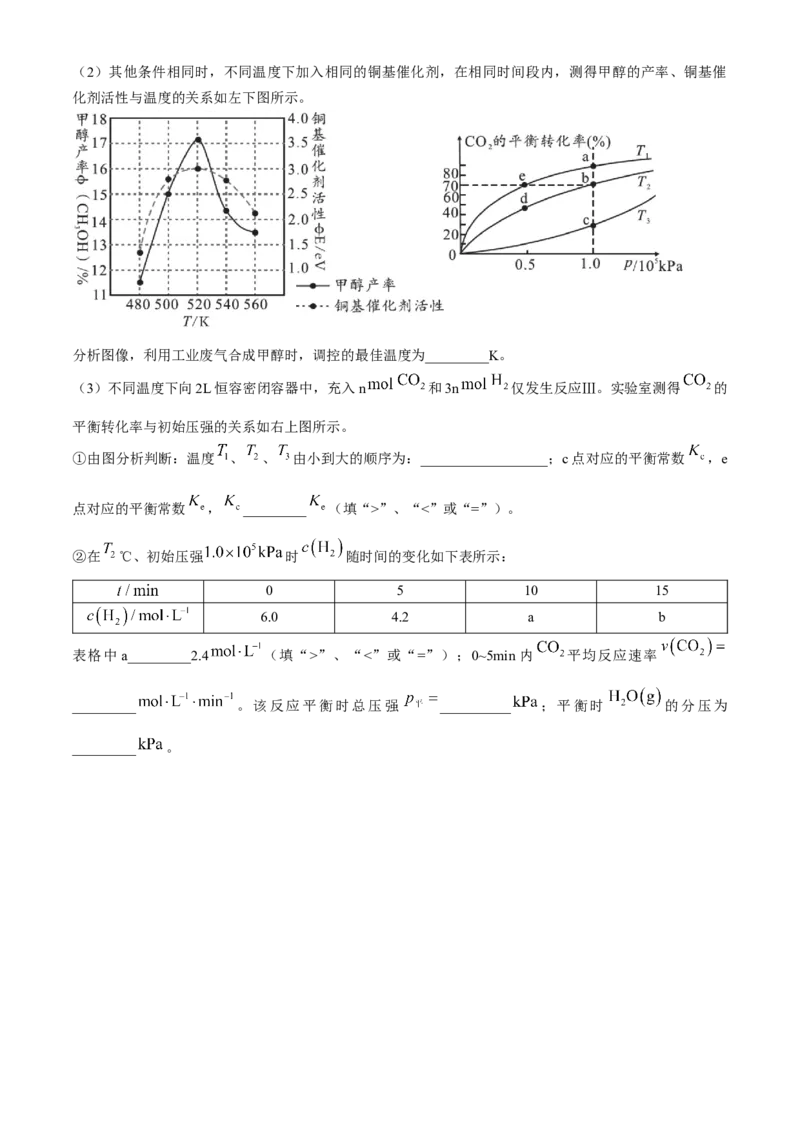
化剂活性与温度的关系如左下图所示。
分析图像,利用工业废气合成甲醇时,调控的最佳温度为_________K。
(3)不同温度下向2L恒容密闭容器中,充入n 和3n 仅发生反应Ⅲ。实验室测得 的
平衡转化率与初始压强的关系如右上图所示。
①由图分析判断:温度 、 、 由小到大的顺序为:__________________;c点对应的平衡常数 ,e
点对应的平衡常数 , _________ (填“>”、“<”或“=”)。
②在 ℃、初始压强 时 随时间的变化如下表所示:
0 5 10 15
6.0 4.2 a b
表格中 a_________2.4 (填“>”、“<”或“=”);0~5min 内 平均反应速率
_________ 。该反应平衡时总压强 __________ ;平衡时 的分压为
_________ 。A10 联盟 2023 级高二上学期 11 月期中考
化学(人教版)参考答案
一、选择题(本大题共 14小题,每小题3分,共42分。每小题的四个选项中,只有一项是
最符合题目要求的)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B B C A A D C D C A D B C D
1.B 燃油汽车行驶是化学能转化为热能,热能再转化为动能,属于化学能与热能的转化,A正确;水电站
是将水的重力势能转变为发电机动能再转变为电能的装置,不涉及化学变化,B错误;风力发电是利用风
能转换成机械能再转变为电能的装置,C正确;氯碱工业制氯气过程是将电能转化为化学能,是储存化学
能的过程,D正确。
2.B 粮食酿酒过程是淀粉水解、缓慢氧化生成乙醇,缓慢氧化过程是放热反应,A错误;碳酸钙分解反应
是吸热反应,B正确;焰火利用了金属元素的焰色试验,是电子由较高激发态到较低激发态或基态,跃迁
时释放能量而产生的,是物理变化过程,无吸热反应,C错误;保持温泉水恒温的能量主要来源于地热能,
没有发生吸热反应,D错误。
3.C 由图可知,反应Ⅰ吸热, ,反应Ⅱ放热, ,所以 ,A错误;反应Ⅱ的
活化能低于反应Ⅰ的活化能,则反应Ⅱ更容易发生,反应速率:反应Ⅰ<反应Ⅱ,B错误;总反应为吸热反
应, ,且气体总物质的量增加,即为熵增反应, ,所以高温下自发,C正确;铜基催化剂
降低反应的活化能,改变反应的速率,对焓变不影响,D错误。
4.A 欲使 释放出气态氢,即平衡向逆向移动,所以可以升高温度或降低压强,A正确;低温
高压正好相反,B错误;催化剂不能改变平衡,C错误; 是固体,不改变平衡移动,D错误。
5.A 二氧化氮、氧气、氢氧化钠溶液直接生成硝酸钠,烧瓶中气体压强突然变小,形成喷泉,A正确;定
量测定化学反应速率,应该把长颈漏斗改为分液漏斗,B错误;配制溶液时,转移溶液用玻璃棒引流,玻
璃棒末端要在容量瓶的刻度线以下,C错误;中和热的测定,量热器中大小烧杯杯口应相平,D错误。
6.D 键能为 1076 , 键能为 436 ,故 比 稳定,A正确; 结构为
, C 的 非 金 属 性 最 弱 , 所 以 C 为 +4 价 , B 正 确 ;
,反应的焓变 ,该反应为
吸热反应,所以 ,C正确;D错误。
7.C 是该反应的中间产物,不是催化剂,A错误;反应③为慢反应,所以活化能大,B错误;温度降低, 、 均减小,即 减小, 减小,但 的减小幅度更大,平衡正向移动,C正确;该反应
是可逆反应,不可能完全反应,D错误。
8.D 根据图像,t时刻达到平衡, , , ,温度为
时化学平衡常数 ,A正确;依据三步式代入数据,A
点时对应状态为: , ,B 正确;B 点时对应状态为:
, ,所以 ,C正确;温度为 时,
若 ,即该温度下 ,即 ,而该反应为放热反应,升温平衡常数减小,则 ,D
错误。
9.C 能使紫色石蕊试液变红色,说明溶液呈酸性,不能说明是弱酸,A错误;没有指明在相同条件下进行,
比如相同温度、相同浓度下, 溶液的导电性比盐酸溶液的弱,才能说明 为弱酸,B错误;假设
为强电解质,0.1 的 的 ,而溶液中 ,说明
部分电离,为弱酸,C正确;等体积等浓度的 与 混合, 过量使溶液呈碱性,
不能说明 是弱酸,D错误。
10.A 测定中和热的实验中,为保证盐酸完全反应,加入的 应该是稍过量,控制 浓度稍大,
实验操作的严谨性,还要测定 溶液的初始温度,A错误;增大反应物浓度,可加快反应速率,该反
应中 浓度越大,反应速率越快,产生浑浊的时间越短,B正确;产生气泡,说明醋酸酸性大于碳
酸,醋酸电离常数大,C正确; 具有强氧化性,能把 氧化成 ,溶液变成棕黄色,一段时间
后,溶液中出现气泡,说明 作催化剂,加速 的分解,D正确。
11.D 分析③和②可知,适当减小初始 , 去除效果更好,但 太小时,纳米铁与 反应速率加快,导致与 反应的纳米铁减少, 去除效果差,A正确;分析①和②可知,适当增加纳米铁
质量可加快反应速率,在相同时间内,实验①中 浓度的变化量大,有利于去除 ,B正确;纳
米铁具有还原作用,能将 还原为 ,减少其毒性和移动性,C正确;实验①中,0~2小时内
平均反应速率 ,丢掉了纵坐标中的单位/ ,D错误。
12.B 电离常数只与温度有关,温度不变,电离常数不变,A错误;盐酸中加醋酸钠,生成醋酸,
降低;醋酸中加醋酸钠,增大醋酸根离子浓度使醋酸电离逆向移动, 降低;两者 均增大,B正
确;醋酸是弱酸,部分电离,将1 的盐酸和醋酸分别稀释100倍后,醋酸电离程度增大,产生
的氢离子多, 小的是醋酸,C错误;氨水是弱碱,离子浓度很小,加入等浓度等体积的盐酸,生成的
溶质为氯化铵是强电解质,离子浓度比氨水大,溶液导电能力增强,D错误。
13.C 由 图 可 知 , X 、 Y 、 Z 三 种 气 体 的 转 化 量 之 比 为
, 化 学 计 量 数 之 比
,A错误;生成物只有Z一种气体,若移走气体Z等效于减小压强,从压强的角度,等
效于平衡向体积增大方向移动,即向逆向移动,X的体积分数增大,B错误; min内Z的平均反应速
率, ,C正确;反应体系全是气体,质量不变,体
积不变,混合气体的密度一直保持不变,不是变量,无法判断平衡状态,D错误。
14.D b点温度高,且产物物质的量多,逆反应速率是 ,A错误;根据图中信息,由于b点相对于a
点温度高,反应速率大, 减小,说明相同时间反应进行程度大,但反应不一定达到平衡,B错误;
根据图中信息,c点相对于b点, 增大,该反应是放热反应,说明c点反应一定达平衡,W为固体,
加入适量W,平衡不移动, 不变,C错误;c点时X为0.75 ,则Y为1.5 ,Z为0.25 ,,此时再向容器Ⅲ中充入0.6 X和0.2 Z,
, ,平衡不移动,Y的转化率不变,D正确。
二、非选择题(本大题共4小题,共58分)
15.(14分)
(1) (2分)
(2)乙(1分) 丙(1分)
(3) (2分)
(4)D(2分)
(5)熵增是反应自发的主导因素(2分,答出熵增占主导即给分)
(6) (2分) >(2分)
16.(15分)
(1)①C(2分) ② (2分)
(2)0.3(1分) B(2分)
(3)变大(2分) 生成物 对反应起催化作用(2分,答 也得分)
(4) (2分) 抑制(2分)
17.(14分)
(1)①8(1分) , 浓度过大时, 高,平衡逆向移动,
氯气的溶解度降低(2分) ②0.9(1分) 盐酸易挥发,氯气的溶解度降低(2分)
(2) (2分)
(3)催化剂(2分,或催化作用)
(4)0.2(2分)
(5) 、 (2分,答对1个给1分,出现错误不得分)
18.(15分)
(1)-49.2(2分)
(2)520(2分)
(3)① (1分) <(2分) ②>(2分) 0.12(2分) (2分) (2
分)