文档内容
射洪中学高 2022 级高三一模考试
化学试题
(时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的班级、姓名、考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡对应题号的位置上。写在本试卷上无效。
4.考试结束后,将答题卡交回。
可能用到的相对原子质量:H:1 C:12 N:14 O:16
Cl:35.5 V: 51 Fe:56 Sn:119
第 I 卷 选择题
一、本题共14小题,每小题3分,共42分
1.经过几代化学家的不懈努力,我国在化学工业科技领域获得了长足的进步。下列有关说法
错误的是( )
A.谢和平院士团队完成的“全新原理实现海水直接电解制氢”,开创了海水原位直接电
解制氢全新原理与技术,该技术实现了不消耗能源制取氢气
B.屠呦呦是第一位获得诺贝尔科学奖项的我国本土科学家,她发现的青蒿素
是一种烃的衍生物
C.“中国稀土之父”徐光宪院士提出“串级萃取理论”打破了国际垄断,彻底改写了我
国的稀土行业的产业结构,稀土全部是金属元素
D.我国化学家发明了电催化合成过氧化氢新工艺,实现了按需现场合成过氧化氢,过氧
化氢是一种极性分子
2.下列有关反应的离子方程式错误的是( )
A.盐酸和84消毒液混合:
B.用惰性电极电解饱和氯化钠溶液:
C. 溶液中加入过量浓氨水:
D.向 溶液中滴入 溶液使 恰好完全沉淀:
3.除去下列物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法均能达到实验目
的是( )
选项 混合物 试剂 分离方法
高三化学 第 1 页 共 8 页A 乙炔(硫化氢) NaOH溶液 洗气
B 溴苯(溴) 分液
C 苯(苯酚) 浓溴水 过滤
D 乙酸乙酯(乙酸) 饱和碳酸钠溶液 过滤
4.设 为阿伏加德罗常数的值。下列说法正确的是( )
A.78g 中含有π键的数目为
B.100mL 溶液中, 数目为
C.11.2L 中含有的分子数目为
D.Cu与 溶液反应生成1mol氧化产物,转移电子数目为
5. 为短周期主族元素,原子序数依次增大。W的某种原子核内无中子,
为同周期相邻元素,Z 是氧化性最强的单质,W的核外电子数与R的价层电子数
2
相等,下列有关说法正确的是( )
A.第一电离能:Z>Y>X
B.W Y 不稳定易分解的主要原因是分子间氢键较弱
2 2
C.Y和R反应生成的化合物中只含有离子键
D.XW 和WZ均为极性分子
3
6.下列化学用语表示正确的是( )
A.BF 的空间填充模型: B. 的电子式:
3
C.3,3-二甲基戊烷的键线式: D. 中共价键的电子云图:
7.下列实验方案合理的是( )
A.熔化NaOH固体 B.分离乙醇和乙酸
C.量取 标准溶液 D.测量 的体积
8.硫氰化铁常被用于电影特技和魔术表演,其制备原理为
。已知氯化铁固体的熔点为306℃、沸点为306℃,易
升华。下列说法正确的是( )
高三化学 第 2 页 共 8 页A. 晶体属于离子晶体 B.第一电离能:N>S
C. 的几何构型为V形 D. 中既有离子键又有共价键
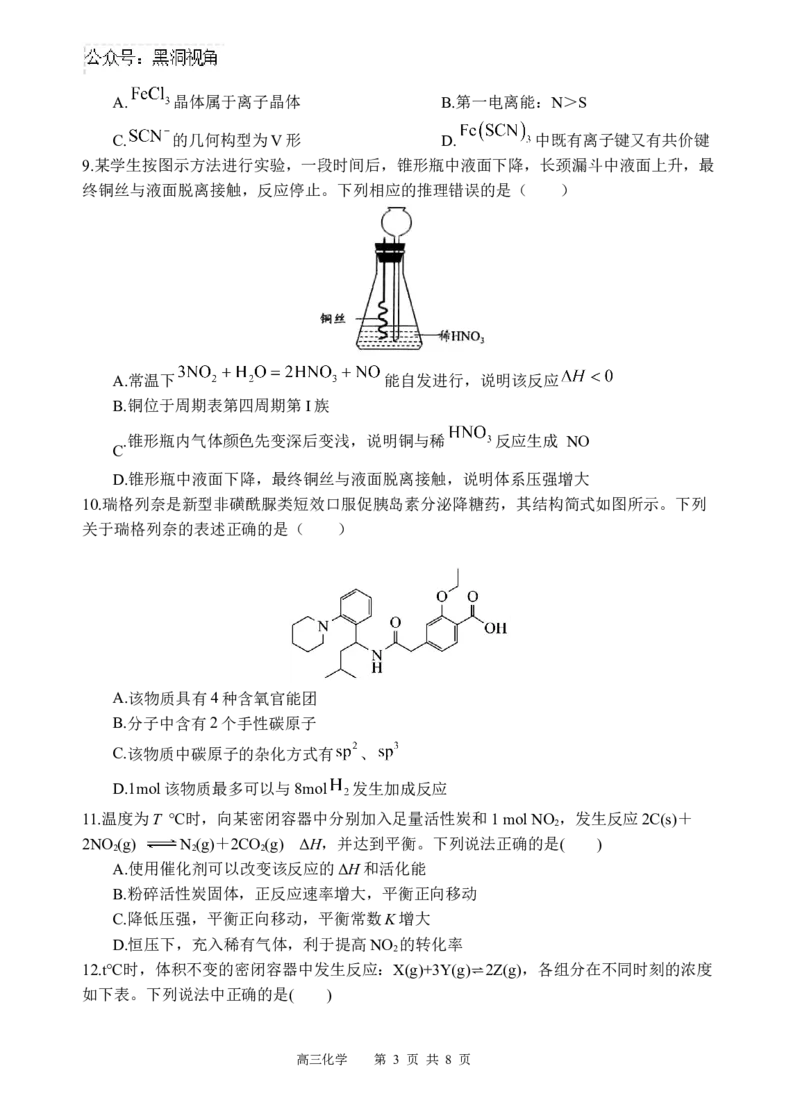
9.某学生按图示方法进行实验,一段时间后,锥形瓶中液面下降,长颈漏斗中液面上升,最
终铜丝与液面脱离接触,反应停止。下列相应的推理错误的是( )
A.常温下 能自发进行,说明该反应
B.铜位于周期表第四周期第I族
.锥形瓶内气体颜色先变深后变浅,说明铜与稀 反应生成 NO
C
D.锥形瓶中液面下降,最终铜丝与液面脱离接触,说明体系压强增大
10.瑞格列奈是新型非磺酰脲类短效口服促胰岛素分泌降糖药,其结构简式如图所示。下列
关于瑞格列奈的表述正确的是( )
A.该物质具有4种含氧官能团
B.分子中含有2个手性碳原子
C.该物质中碳原子的杂化方式有 、
D.1mol该物质最多可以与8mol 发生加成反应
11.温度为T ℃时,向某密闭容器中分别加入足量活性炭和1 mol NO ,发生反应2C(s)+
2
2NO (g) N (g)+2CO (g) ΔH,并达到平衡。下列说法正确的是( )
2 2 2
A.使用催化剂可以改变该反应的ΔH和活化能
B.粉碎活性炭固体,正反应速率增大,平衡正向移动
C.降低压强,平衡正向移动,平衡常数K增大
D.恒压下,充入稀有气体,利于提高NO 的转化率
2
12.t℃时,体积不变的密闭容器中发生反应:X(g)+3Y(g)⇌2Z(g),各组分在不同时刻的浓度
如下表。下列说法中正确的是( )
高三化学 第 3 页 共 8 页物质 X Y Z
初始浓度/mol·L−1 0.1 0.2 0
2min末浓度/ mol·L−1 0.08 a b
平衡浓度/ mol·L−1 0.05 0.05 0.1
A.平衡时,X的转化率为20%
B.t℃时,该反应的平衡常数为40
C.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L−1·min−1
D.增大平衡后的体系压强,v 增大,v 减小,平衡向正反应方向移动
正 逆
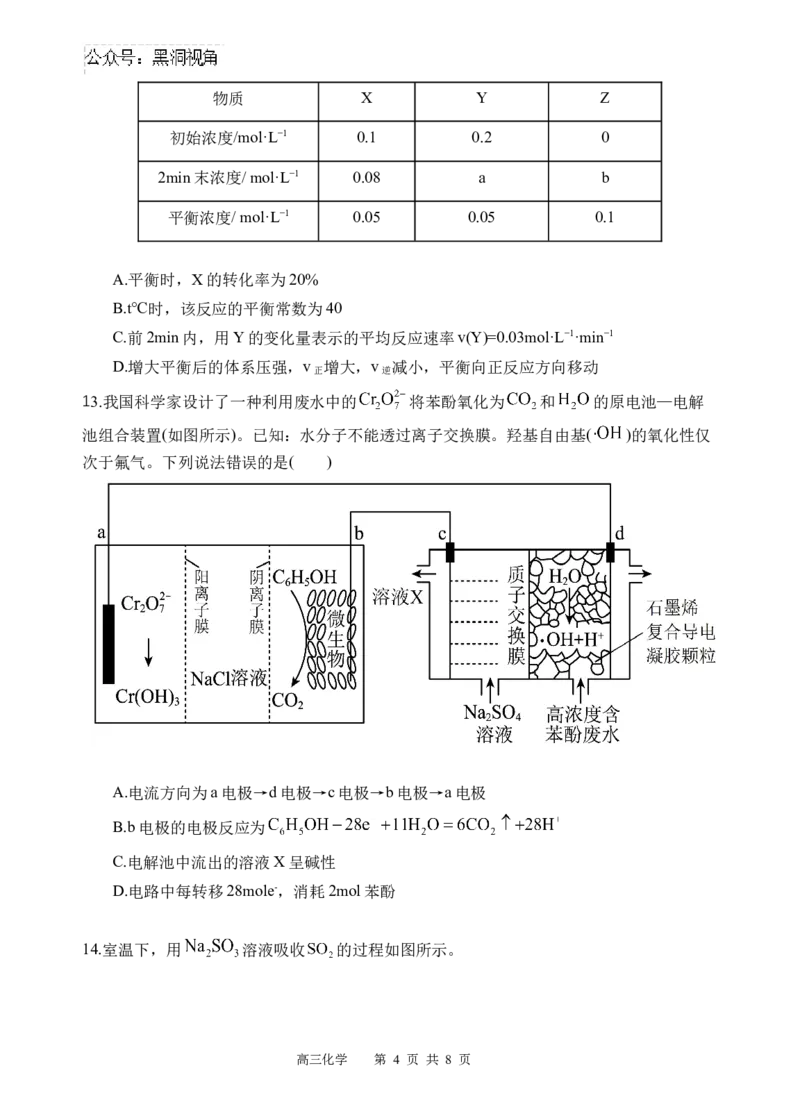
13.我国科学家设计了一种利用废水中的 将苯酚氧化为 和 的原电池—电解
池组合装置(如图所示)。已知:水分子不能透过离子交换膜。羟基自由基( )的氧化性仅
次于氟气。下列说法错误的是( )
A.电流方向为a电极→d电极→c电极→b电极→a电极
B.b电极的电极反应为
C.电解池中流出的溶液X呈碱性
D.电路中每转移28mole-,消耗2mol苯酚
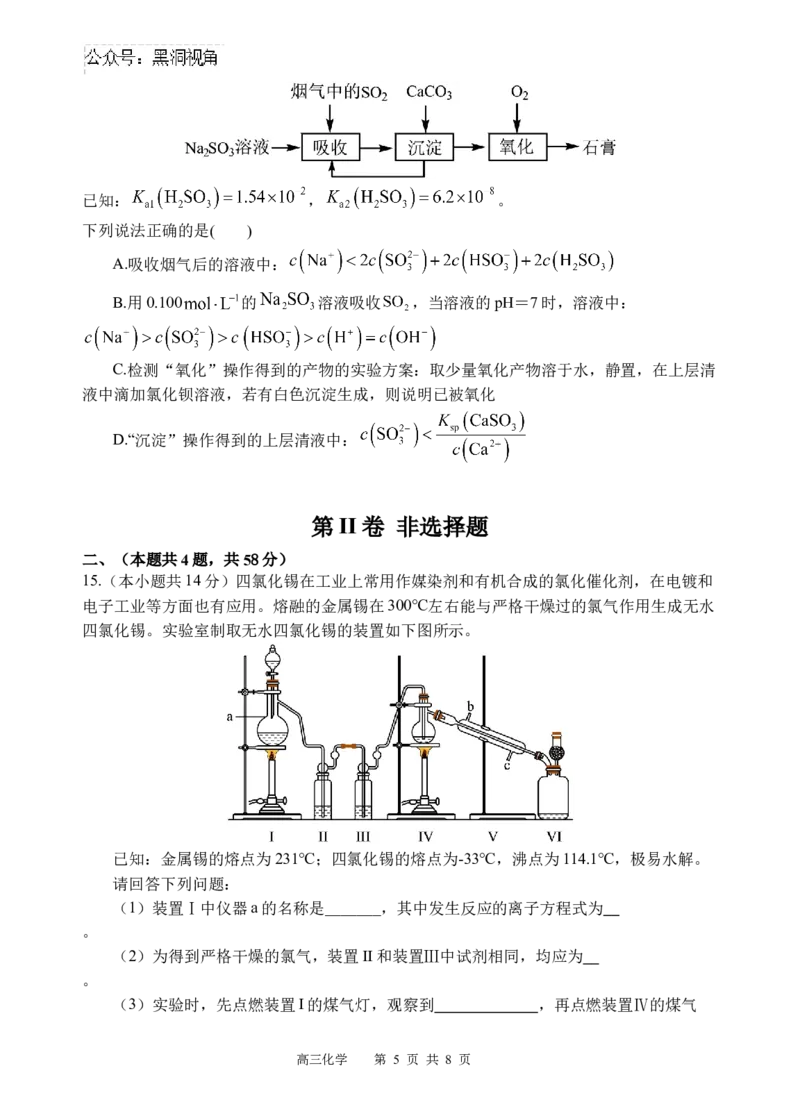
14.室温下,用 溶液吸收 的过程如图所示。
高三化学 第 4 页 共 8 页已知: , 。
下列说法正确的是( )
A.吸收烟气后的溶液中:
B.用0.100 的 溶液吸收 ,当溶液的pH=7时,溶液中:
C.检测“氧化”操作得到的产物的实验方案:取少量氧化产物溶于水,静置,在上层清
液中滴加氯化钡溶液,若有白色沉淀生成,则说明已被氧化
D.“沉淀”操作得到的上层清液中:
第 II 卷 非选择题
二、(本题共4题,共58分)
15.(本小题共14分)四氯化锡在工业上常用作媒染剂和有机合成的氯化催化剂,在电镀和
电子工业等方面也有应用。熔融的金属锡在300℃左右能与严格干燥过的氯气作用生成无水
四氯化锡。实验室制取无水四氯化锡的装置如下图所示。
已知:金属锡的熔点为231℃;四氯化锡的熔点为-33℃,沸点为114.1℃,极易水解。
请回答下列问题:
(1)装置Ⅰ中仪器a的名称是_______,其中发生反应的离子方程式为
。
(2)为得到严格干燥的氯气,装置II和装置Ⅲ中试剂相同,均应为
。
(3)实验时,先点燃装置I的煤气灯,观察到 ,再点燃装置Ⅳ的煤气
高三化学 第 5 页 共 8 页灯。
(4)装置Ⅴ中冷凝管的作用是_______,冷凝水应从_______口通入。
(5)装置VI中球形干燥管内试剂为碱石灰,若缺少该仪器,产生的影响是_______。
(6) 遇水反应生成白色粉末状 ,并释放出HCl而呈现白色烟雾,
该反应的化学方程式为_______。收集少量白色粉末并称量,质量为 ,然后加热至恒重
时质量为 ,则x=_______(用m、n表示)。
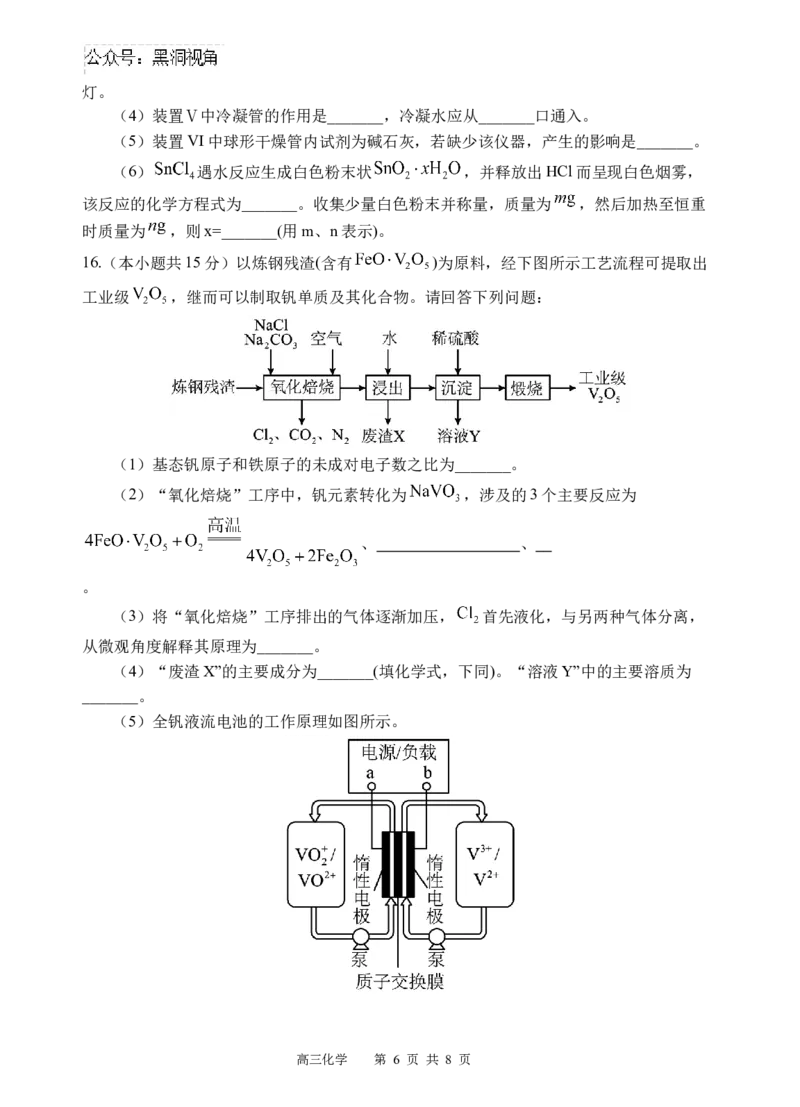
16.(本小题共15分)以炼钢残渣(含有 )为原料,经下图所示工艺流程可提取出
工业级 ,继而可以制取钒单质及其化合物。请回答下列问题:
(1)基态钒原子和铁原子的未成对电子数之比为_______。
(2)“氧化焙烧”工序中,钒元素转化为 ,涉及的3个主要反应为
、 、
。
(3)将“氧化焙烧”工序排出的气体逐渐加压, 首先液化,与另两种气体分离,
从微观角度解释其原理为_______。
(4)“废渣X”的主要成分为_______(填化学式,下同)。“溶液Y”中的主要溶质为
_______。
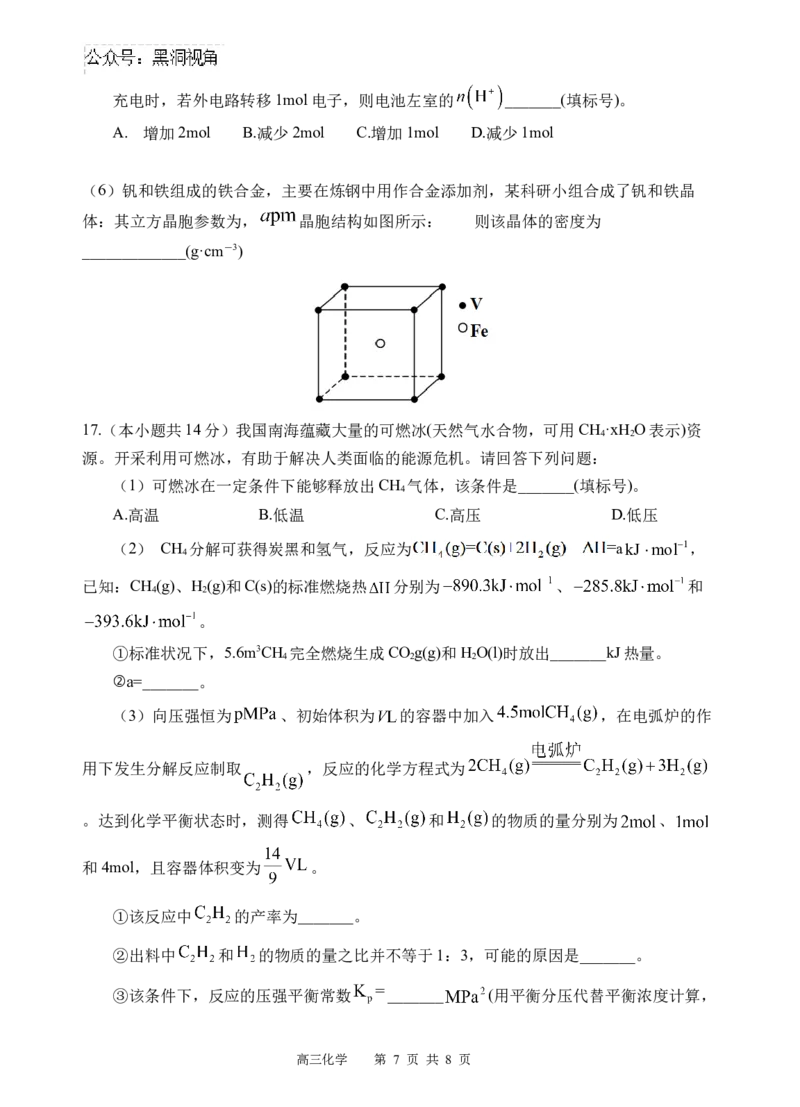
(5)全钒液流电池的工作原理如图所示。
高三化学 第 6 页 共 8 页充电时,若外电路转移1mol电子,则电池左室的 _______(填标号)。
A. 增加2mol B.减少2mol C.增加1mol D.减少1mol
(6)钒和铁组成的铁合金,主要在炼钢中用作合金添加剂,某科研小组合成了钒和铁晶
体:其立方晶胞参数为, 晶胞结构如图所示: 则该晶体的密度为
_____________(g·cm-3)
17.(本小题共14分)我国南海蕴藏大量的可燃冰(天然气水合物,可用CH ·xH O表示)资
4 2
源。开采利用可燃冰,有助于解决人类面临的能源危机。请回答下列问题:
(1)可燃冰在一定条件下能够释放出CH 气体,该条件是_______(填标号)。
4
A.高温 B.低温 C.高压 D.低压
(2) CH 分解可获得炭黑和氢气,反应为 akJ mol1,
4
已知:CH (g)、H (g)和C(s)的标准燃烧热 分别为 、 和
4 2
。
①标准状况下,5.6m3CH 完全燃烧生成CO g(g)和H O(l)时放出_______kJ热量。
4 2 2
②a=_______。
(3)向压强恒为 、初始体积为 的容器中加入 ,在电弧炉的作
用下发生分解反应制取 ,反应的化学方程式为
。达到化学平衡状态时,测得 、 和 的物质的量分别为 、
和4mol,且容器体积变为 。
①该反应中 的产率为_______。
②出料中 和 的物质的量之比并不等于1:3,可能的原因是_______。
③该条件下,反应的压强平衡常数 _______ (用平衡分压代替平衡浓度计算,
高三化学 第 7 页 共 8 页分压=总压 物质的量分数)。
(4)若以甲烷为燃料,以熔融碳酸盐(如 )为电解质构成燃料电池。则电池工作
时,负极的电极反应式为_______。
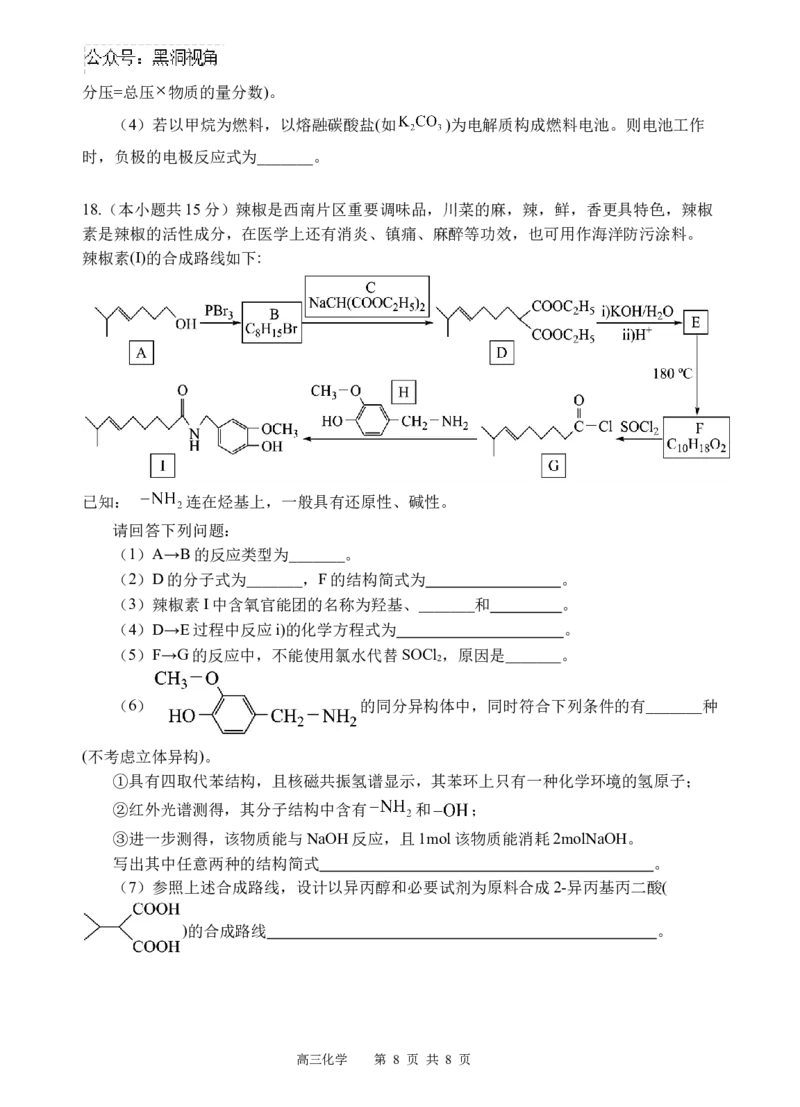
18.(本小题共15分)辣椒是西南片区重要调味品,川菜的麻,辣,鲜,香更具特色,辣椒
素是辣椒的活性成分,在医学上还有消炎、镇痛、麻醉等功效,也可用作海洋防污涂料。
辣椒素(I)的合成路线如下:
已知: 连在烃基上,一般具有还原性、碱性。
请回答下列问题:
(1)A→B的反应类型为_______。
(2)D的分子式为_______,F的结构简式为 。
(3)辣椒素I中含氧官能团的名称为羟基、_______和 。
(4)D→E过程中反应i)的化学方程式为 。
(5)F→G的反应中,不能使用氯水代替SOCl ,原因是_______。
2
(6) 的同分异构体中,同时符合下列条件的有_______种
(不考虑立体异构)。
①具有四取代苯结构,且核磁共振氢谱显示,其苯环上只有一种化学环境的氢原子;
②红外光谱测得,其分子结构中含有 和 ;
③进一步测得,该物质能与NaOH反应,且1mol该物质能消耗2molNaOH。
写出其中任意两种的结构简式 。
(7)参照上述合成路线,设计以异丙醇和必要试剂为原料合成2-异丙基丙二酸(
)的合成路线 。
高三化学 第 8 页 共 8 页