文档内容
乌鲁木齐市第四十中学 2023-2024 学年
高三上学期 11 月月考 化学试题
总分100分 考试时间90分钟
一、单项选择题(共15小题,每题3分共45分)
1.下列有关物质性质与用途具有对应关系的是
A.常温下铁能被浓硝酸钝化,可用铁制容器贮运浓硝酸
B.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C.浓硫酸有吸水性,可用于干燥二氧化硫和氨气
D.金属钠具有强还原性,可与TiCl 溶液反应制取金属Ti
4
2.随着科学技术的发展,人们可以利用很多先进的方法和手段来测定有机
物的组成和结构。下列说法正确的是
A.通过李比希元素分析仪可以确定有机物的分子式
B.对乙醇和二甲醚进行质谱分析,质谱图完全相同
C.利用红外光谱仪可以区分丁烯和环丁烷两种烃
D.X射线衍射图经过计算可获得键长、键角和键能等数据
3.化学与生产、生活密切相关。下列说法错误的是
A.氧化铝用于电解冶炼铝 B.氢化植物油用于生产代可可脂
C.亚硝酸钠用作食品添加剂 D.聚氯乙烯用于制造食品包装材
料
4.25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.无色透明的溶液中:K+、Cu2+、NO -、C1-
3
B.在中性溶液中:Mg2+、Fe3+、Na+、SO 2-
4
C.pH=12的溶液:Na+、K+、SiO 2-、C1-
3
D.使甲基橙变红的溶液中:Na+、Fe2+、NO -、C1-
3
5.化学是你,化学是我,化学带来美好生活,下列说法不正确的是
学科网(北京)股份有限公司A.氨基酸是组成蛋白质的基本结构单元
B.蚕丝、阿胶、棉花的主要成分均为蛋白质
C.油脂在碱性条件下水解生成的高级脂肪酸盐是肥皂的主要成分
D.棉麻料的衣服具有很好的吸汗性,是因为纤维素分子中羟基含量高
6.某物质灼烧时,焰色反应为黄色,下列判断中正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定含钾离子 D.该物质一定是金属钠
7.下列说法不正确的是
A. 和 一定是同系物 B. 与 互为同位素
C.淀粉和纤维素互为同分异构体 D.金刚石和C 互为同素异形体
60
8.下列说法正确的是
A.反应物的热效应与是否使用催化剂无关
B.4NO (g)+O (g)=2N O (g)的过程属于熵增加过程
2 2 2 5
C.由C(石墨)= C(金刚石)△H﹥0,可知金刚石比石墨稳定
D.对任何化学反应来说,反应速率越大,反应现象就越明显
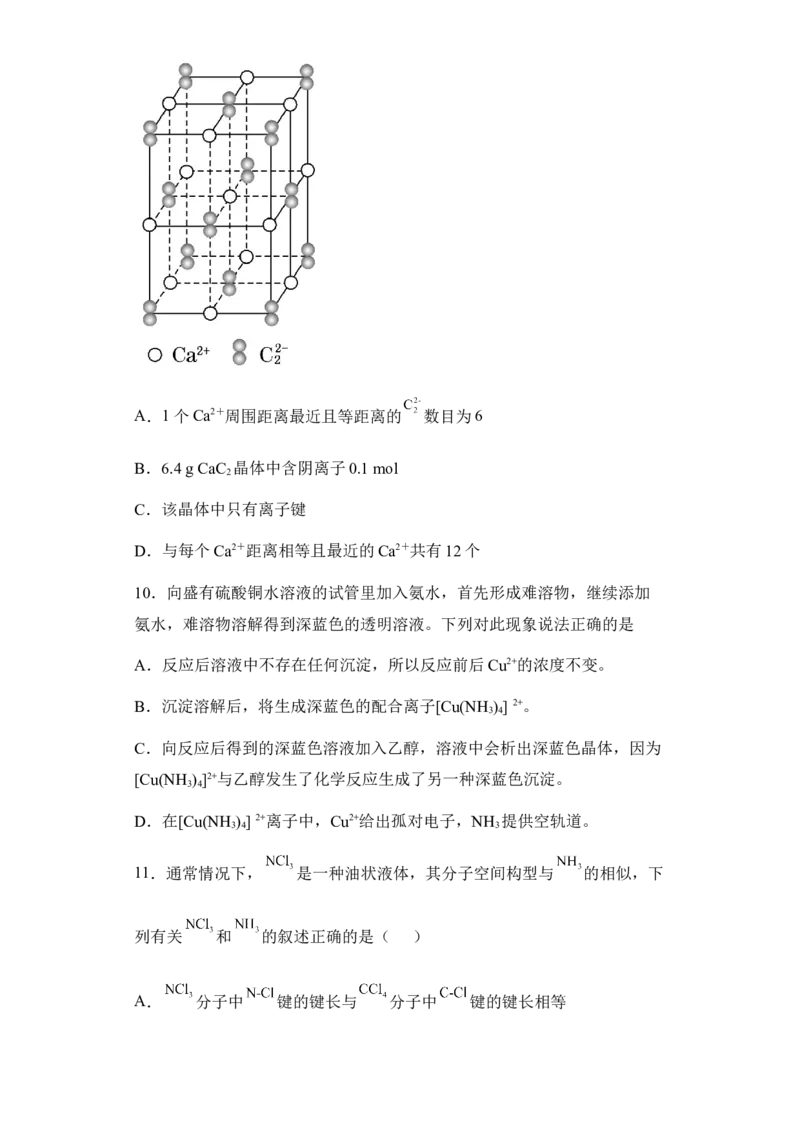
9.CaC 晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC 晶体中含
2 2
有的哑铃形+ 的存在,使晶胞沿一个方向拉长(该晶胞为长方体)。下列
关于CaC 晶体的说法中正确的是( )
2A.1个Ca2+周围距离最近且等距离的 数目为6
B.6.4 g CaC 晶体中含阴离子0.1 mol
2
C.该晶体中只有离子键
D.与每个Ca2+距离相等且最近的Ca2+共有12个
10.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加
氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH ) ] 2+。
3 4
C.向反应后得到的深蓝色溶液加入乙醇,溶液中会析出深蓝色晶体,因为
[Cu(NH ) ]2+与乙醇发生了化学反应生成了另一种深蓝色沉淀。
3 4
D.在[Cu(NH ) ] 2+离子中,Cu2+给出孤对电子,NH 提供空轨道。
3 4 3
11.通常情况下, 是一种油状液体,其分子空间构型与 的相似,下
列有关 和 的叙述正确的是( )
A. 分子中 键的键长与 分子中 键的键长相等
学科网(北京)股份有限公司B. 分子是非极性分子
C. 的熔沸点比 的低
D.在氨水中,大部分 与 以氢键结合形成 ,则 的结
构式为
12.氢氟酸是弱酸,电离方程式为HF H++F-,达到电离平衡的标志是
( )
A.c(H+)=c(F-) B.v(电离)=v(形成分子)
C.溶液显酸性 D.单位时间内,电离的HF分子数
与生成的F-数相等
13.已知三种有机物存在如图转化关系:
下列叙述错误的是
A.三种有机物中都存在2种官能团
B.乳酸和丙烯酸都能使酸性高锰酸钾溶液褪色
C.1mol乳酸最多能与2molNa发生反应
D.三种有机物均能发生聚合反应生成高分子化合物
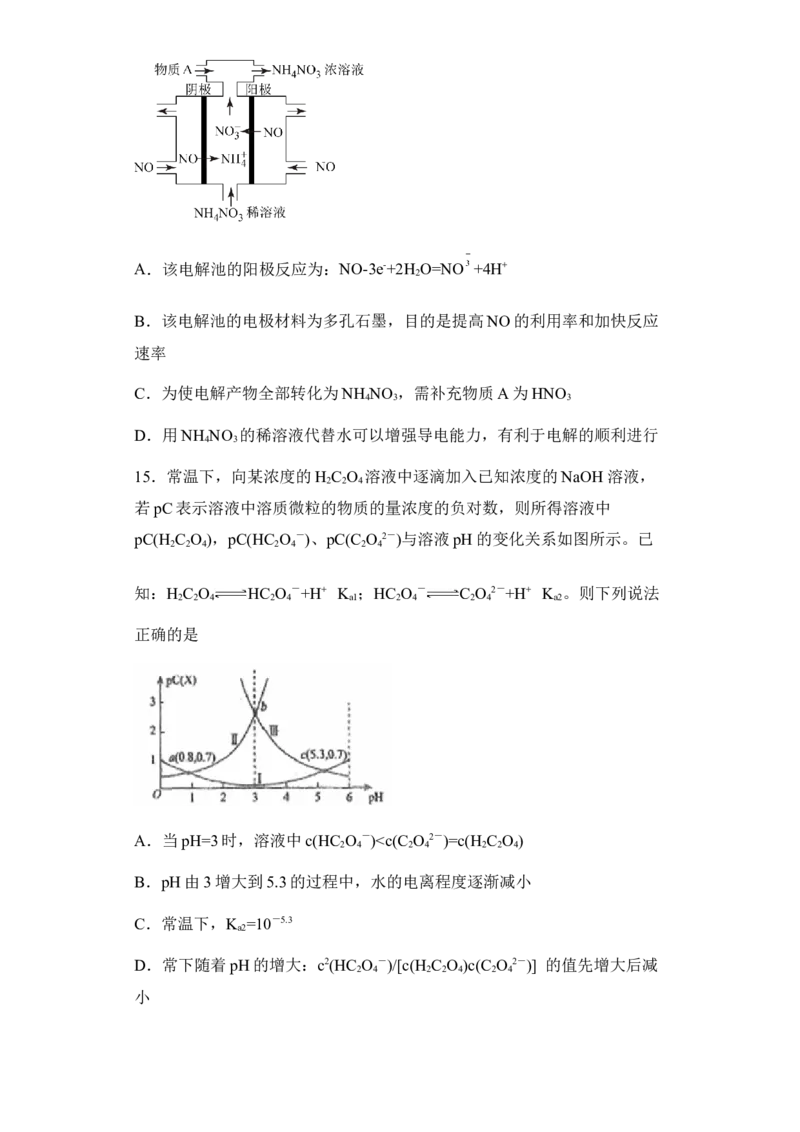
14.电解法处理烟道气中的NO,将其转化为NH NO 的原理如图所示,下
4 3
列说法错误的是A.该电解池的阳极反应为:NO-3e-+2H O=NO +4H+
2
B.该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应
速率
C.为使电解产物全部转化为NH NO ,需补充物质A为HNO
4 3 3
D.用NH NO 的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
4 3
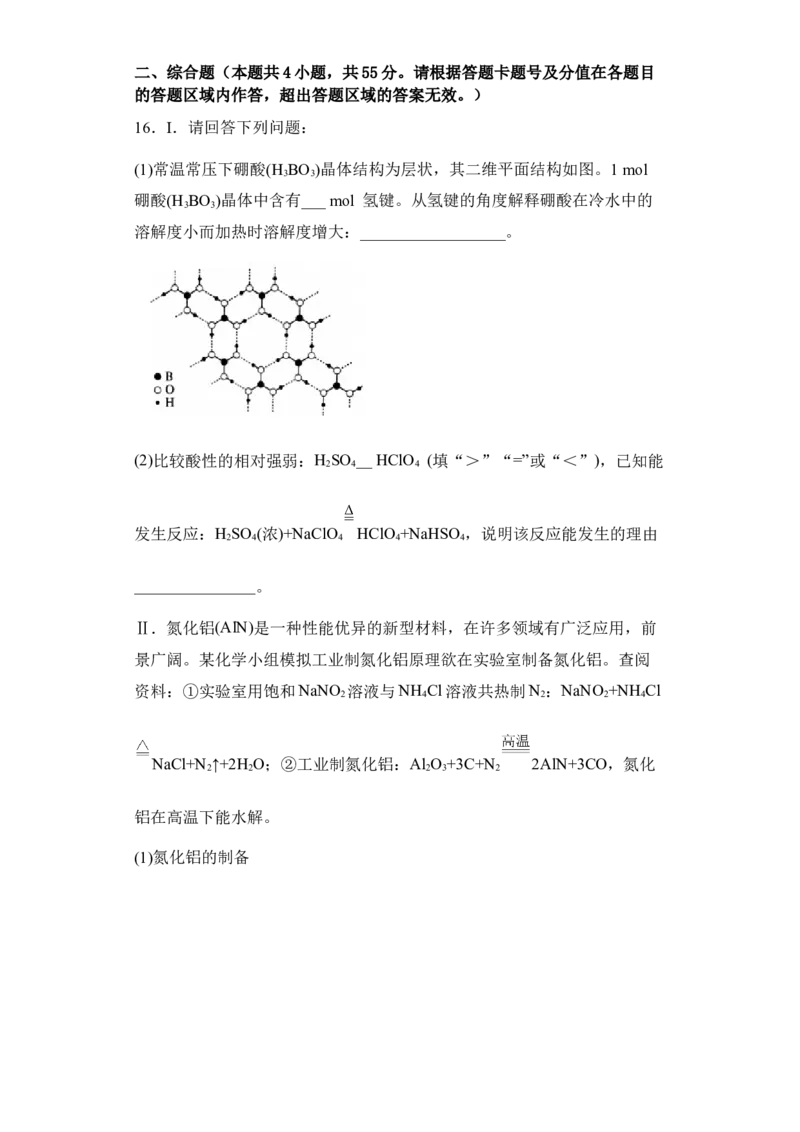
15.常温下,向某浓度的H C O 溶液中逐滴加入已知浓度的NaOH溶液,
2 2 4
若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中
pC(H C O ),pC(HC O -)、pC(C O 2-)与溶液pH的变化关系如图所示。已
2 2 4 2 4 2 4
知:H C O HC O -+H+ K ;HC O - C O 2-+H+ K 。则下列说法
2 2 4 2 4 a1 2 4 2 4 a2
正确的是
A.当pH=3时,溶液中c(HC O -)c(C O 2
2 4 2 4
-)=c(H C O ),A项错误;
2 2 4
B. pH=3时溶质主要是NaHC O ,向此时的溶液中加NaOH溶液,NaHC O 和
2 4 2 4
NaOH溶液之间会反应得到C O 2-,C O 2-的水解程度较大,对水的电离起到促
2 4 2 4
进作用,B项错误;
C.b点时,HC O -和C O 2-的浓度相同,K =[H+]=10-5.3,C项正确;
2 4 2 4 a2
D.温度不变时,c2(HC O -)/[c(H C O )c(C O 2-)]= =
2 4 2 2 4 2 4
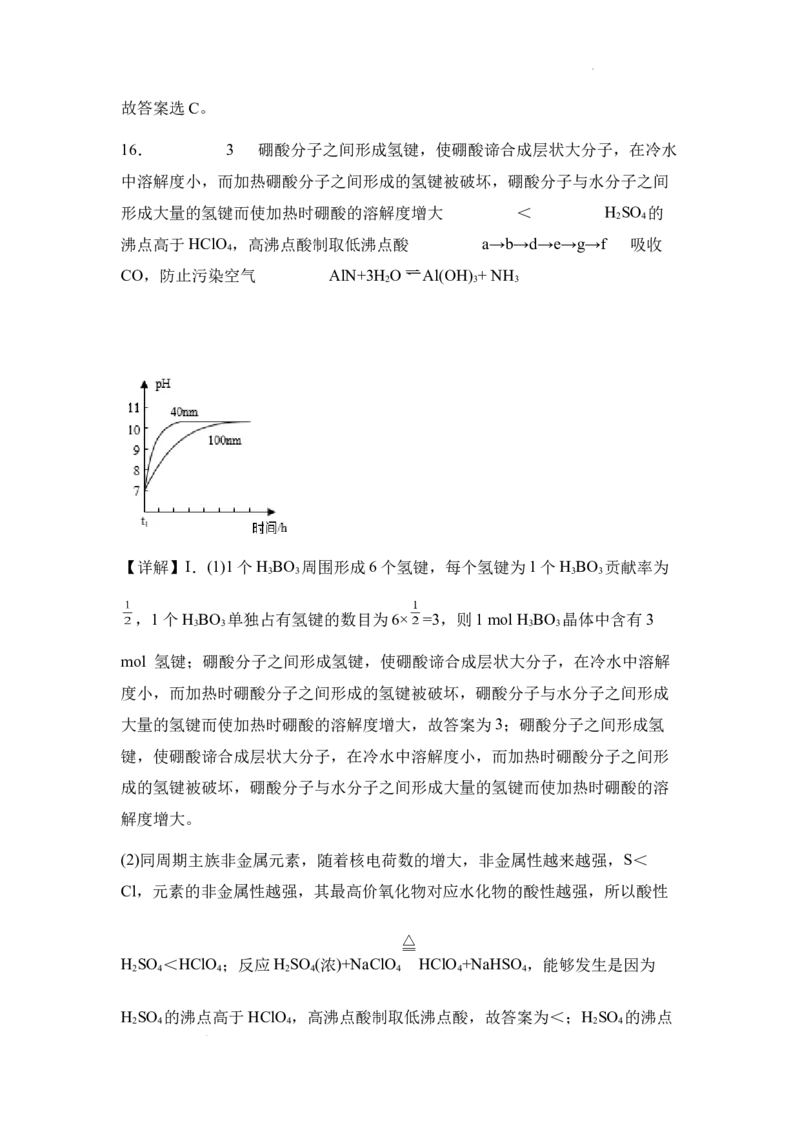
,显然不随pH的增大而变化,D项错误。故答案选C。
16. 3 硼酸分子之间形成氢键,使硼酸谛合成层状大分子,在冷水
中溶解度小,而加热硼酸分子之间形成的氢键被破坏,硼酸分子与水分子之间
形成大量的氢键而使加热时硼酸的溶解度增大 < H SO 的
2 4
沸点高于HClO ,高沸点酸制取低沸点酸 a→b→d→e→g→f 吸收
4
CO,防止污染空气 AlN+3H O Al(OH) + NH
2 3 3
【详解】I.(1)1个H BO 周围形成6个氢键,每个氢键为1个H BO 贡献率为
3 3 3 3
,1个H BO 单独占有氢键的数目为6× =3,则1 mol H BO 晶体中含有3
3 3 3 3
mol 氢键;硼酸分子之间形成氢键,使硼酸谛合成层状大分子,在冷水中溶解
度小,而加热时硼酸分子之间形成的氢键被破坏,硼酸分子与水分子之间形成
大量的氢键而使加热时硼酸的溶解度增大,故答案为3;硼酸分子之间形成氢
键,使硼酸谛合成层状大分子,在冷水中溶解度小,而加热时硼酸分子之间形
成的氢键被破坏,硼酸分子与水分子之间形成大量的氢键而使加热时硼酸的溶
解度增大。
(2)同周期主族非金属元素,随着核电荷数的增大,非金属性越来越强,S<
Cl,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,所以酸性
H SO <HClO ;反应H SO (浓)+NaClO HClO +NaHSO ,能够发生是因为
2 4 4 2 4 4 4 4
H SO 的沸点高于HClO ,高沸点酸制取低沸点酸,故答案为<;H SO 的沸点
2 4 4 2 4
学科网(北京)股份有限公司高于HClO ,高沸点酸制取低沸点酸。
4
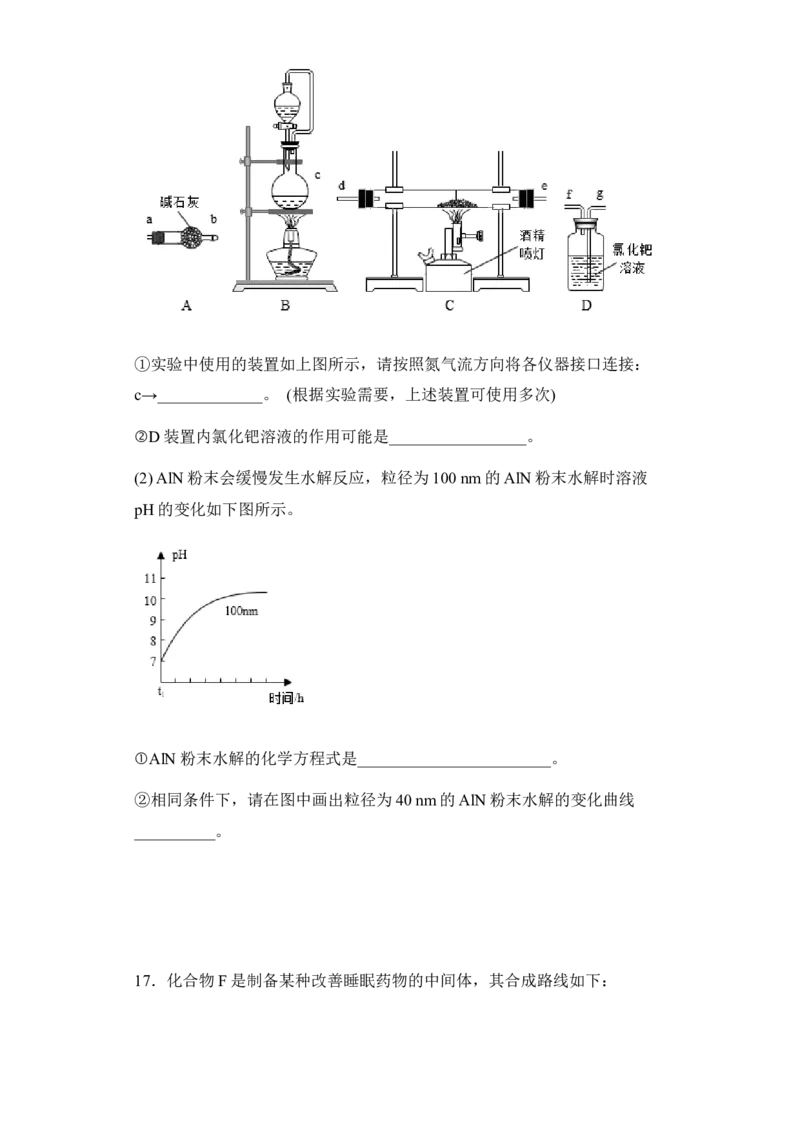
Ⅱ.(1)①A装置用来除去酸性气体和水蒸气,B装置用来制取N ,C装置用来
2
制取AlN,D装置用来吸收CO,防止污染空气,按照氮气流方向各仪器接口连
接顺序:c→a→b→d→e→g→f;
②D装置内氯化钯溶液的作用可能是吸收CO,防止污染空气,故答案为吸收
CO,防止污染空气。
(2)①AlN粉末会发生水解,生成Al(OH) 和NH ,水解的化学方程式为
3 3
AlN+3H O Al(OH) + NH ,故答案为AlN+3H O Al(OH) + NH 。
2 3 3 2 3 3
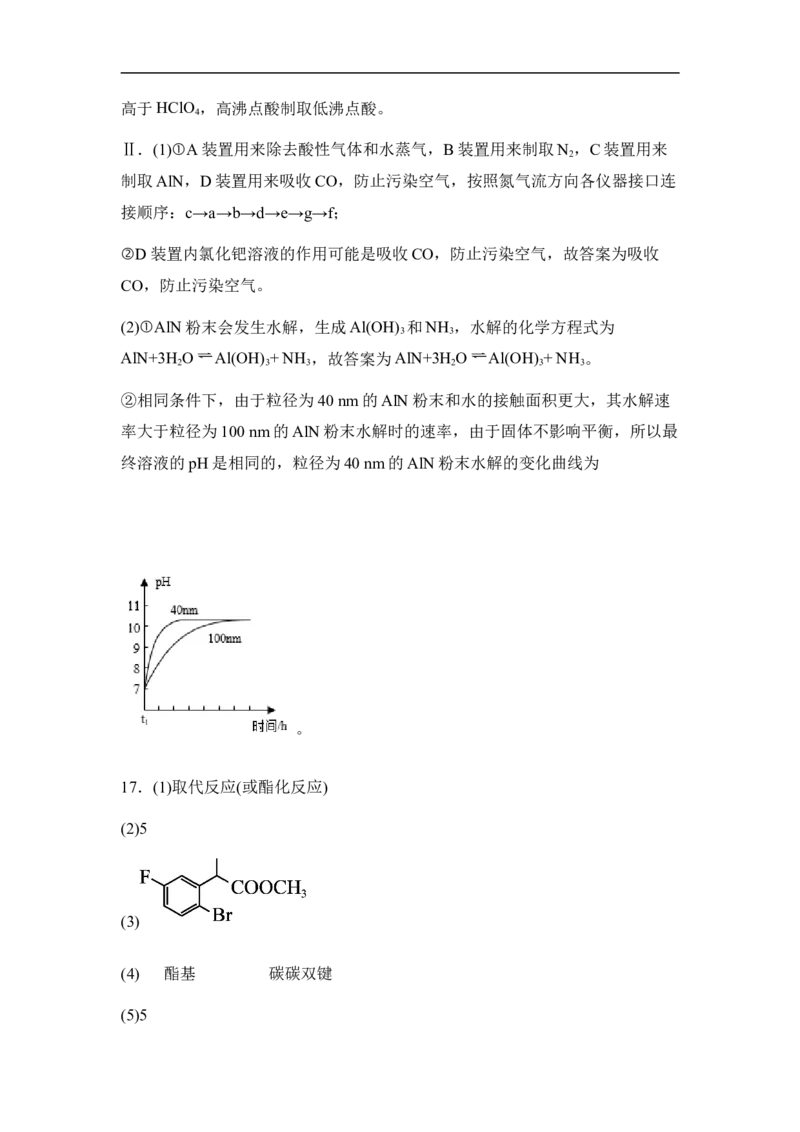
②相同条件下,由于粒径为40 nm的AlN粉末和水的接触面积更大,其水解速
率大于粒径为100 nm的AlN粉末水解时的速率,由于固体不影响平衡,所以最
终溶液的pH是相同的,粒径为40 nm的AlN粉末水解的变化曲线为
。
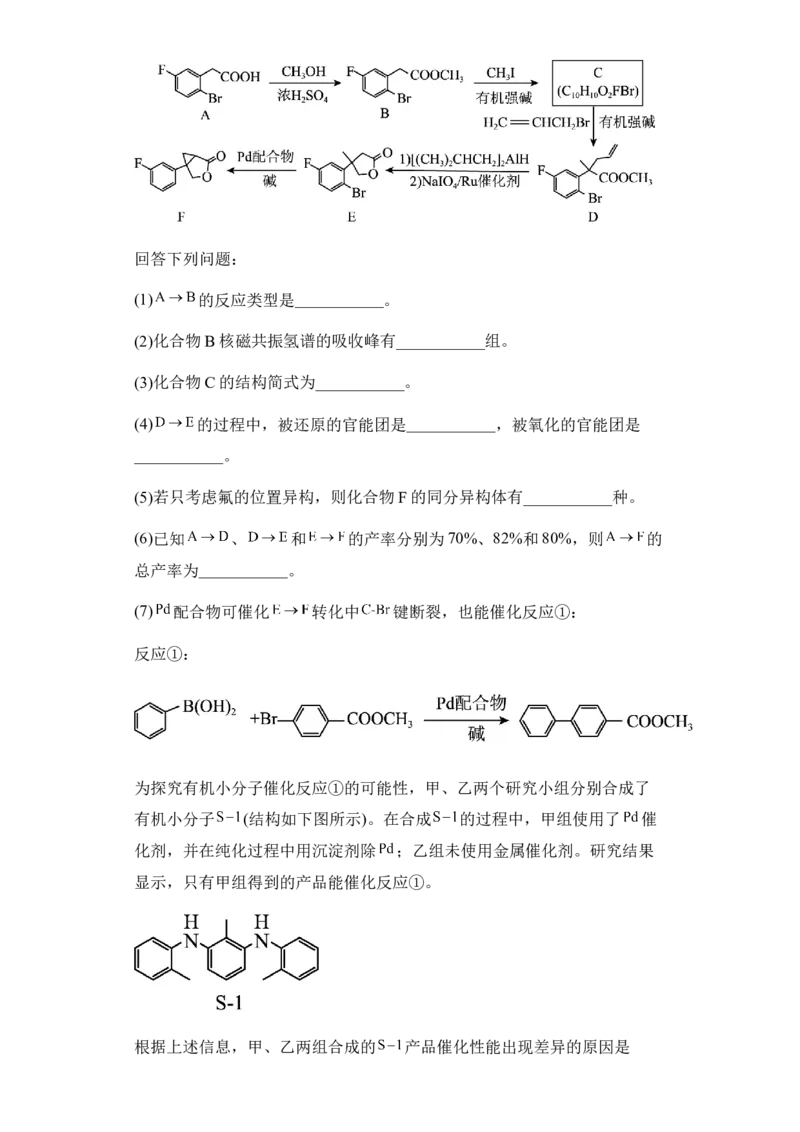
17.(1)取代反应(或酯化反应)
(2)5
(3)
(4) 酯基 碳碳双键
(5)5(6)45.92%
(7)甲组使用的Pd催化剂未完全除尽,继续催化反应①
【分析】A→B条件为甲醇和浓硫酸,该反应为酯化反应,B→C,条件为CH I
3
和有机强碱,结合C的分子式以及D的结构简式可分析得出C的结构简式为
,C与CH =CHCH Br发生取代反应生成D,由E的结构
2 2
可分析出,D中酯基被还原成醇羟基 ,碳碳双键被氧化
成羧基 ,然后发生酯化反应生成E,E与Pd配合物在碱
的催化下反应生成F。
【详解】(1)A→B条件为甲醇和浓硫酸,根据A和B的结构简式可分析出,
该反应为酯化反应,属于取代反应,故答案为:取代反应(或酯化反应);
(2)核磁共振氢谱的吸收峰数目等于有机物中氢元素的种类,即有多少种化学
环境不同的氢原子,由B的结构简式可知,B中有5种H,所以核磁共振氢谱
有五组吸收峰,故答案为5;
(3)B与CH I反应生成C,结合D的结构简式可推测出C的结构简式为
3
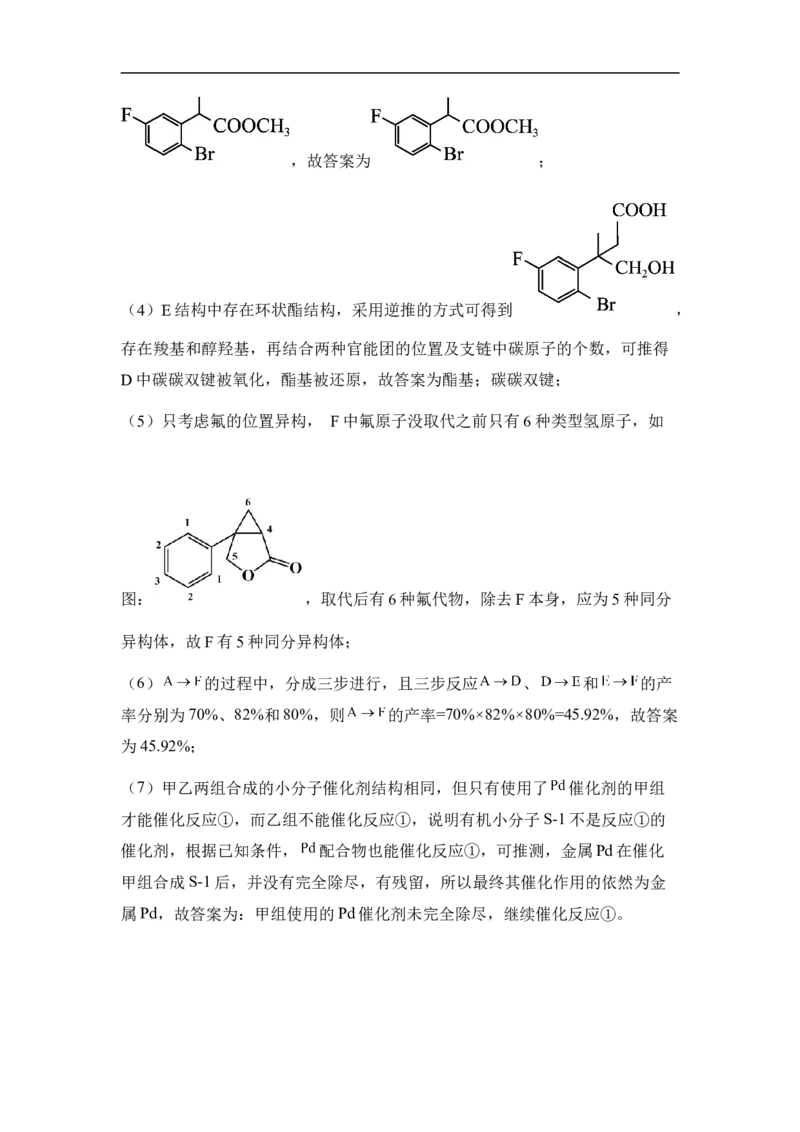
学科网(北京)股份有限公司,故答案为 ;
(4)E结构中存在环状酯结构,采用逆推的方式可得到 ,
存在羧基和醇羟基,再结合两种官能团的位置及支链中碳原子的个数,可推得
D中碳碳双键被氧化,酯基被还原,故答案为酯基;碳碳双键;
(5)只考虑氟的位置异构, F中氟原子没取代之前只有6种类型氢原子,如
图: ,取代后有6种氟代物,除去F本身,应为5种同分
异构体,故F有5种同分异构体;
(6) 的过程中,分成三步进行,且三步反应 、 和 的产
率分别为70%、82%和80%,则 的产率=70% 82% 80%=45.92%,故答案
为45.92%;
(7)甲乙两组合成的小分子催化剂结构相同,但只有使用了 催化剂的甲组
才能催化反应①,而乙组不能催化反应①,说明有机小分子S-1不是反应①的
催化剂,根据已知条件, 配合物也能催化反应①,可推测,金属Pd在催化
甲组合成S-1后,并没有完全除尽,有残留,所以最终其催化作用的依然为金
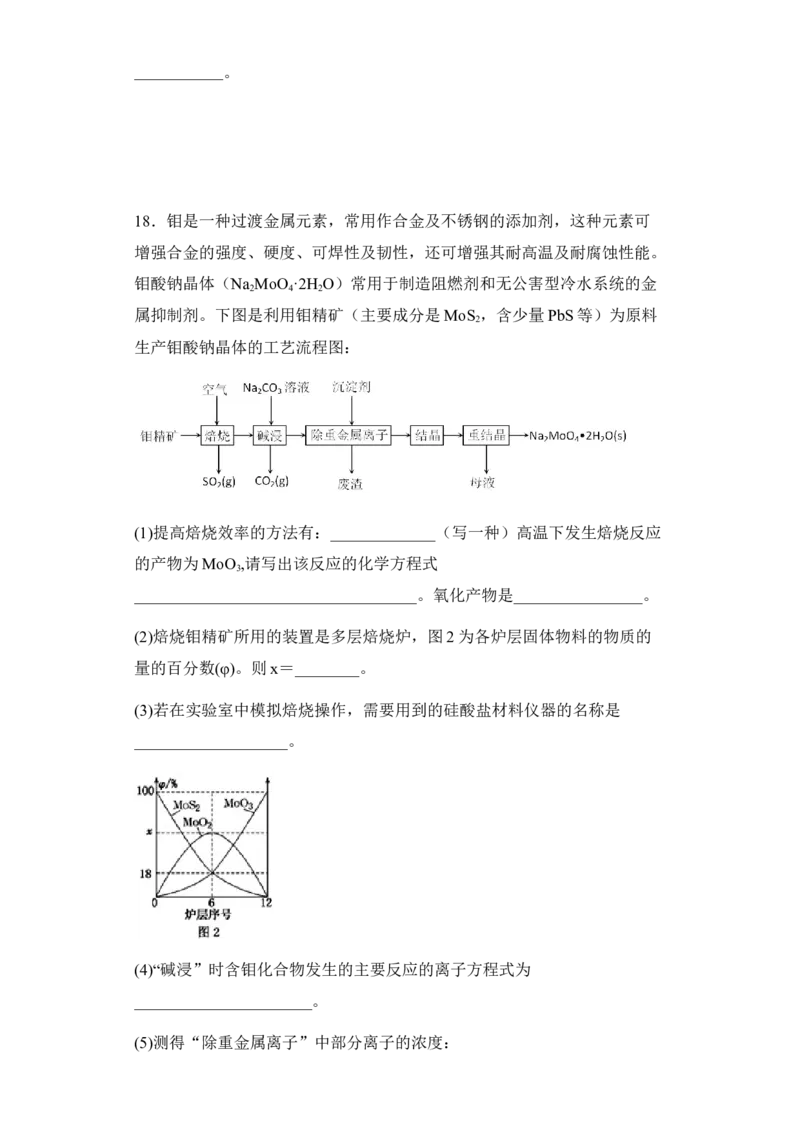
属Pd,故答案为:甲组使用的Pd催化剂未完全除尽,继续催化反应①。18. 粉碎固体 2MoS +7O 2MoO +4SO MoO 、
2 2 3 2 3
SO 64 坩埚 MoO +CO 2-=MoO 2-+CO ↑ 0.001mol/L
2 3 3 4 2
【分析】根据流程:钼精矿(主要成分是MoS ,含少量PbS等)通入空气焙烧,
2
MoS 转化为MoO ,反应为:2MoS +7O 2MoO +4SO ,同时2PbS+3O
2 3 2 2 3 2 2
2PbS+2SO ,加入碳酸钠碱浸,反应为:MoO +Na CO =Na MoO +CO ↑,
2 3 2 3 2 4 2
溶液还含有铅离子,加入沉淀剂Na S,将铅离子以PbS的形式除去,废渣为
2
PbS,溶液主要为Na MoO 溶液,将溶液结晶、重结晶得到Na MoO •2H O,据
2 4 2 4 2
此分析作答。
【详解】(1) 粉碎固体颗粒或者通入过量的空气可以提高矿石的利用率;根据
流程“焙烧”时反应的化学方程式为:2MoS +7O 2MoO +4SO ,其中
2 2 3 2
MoS 的Mo、S元素化合价均升高,发生氧化反应,故氧化产物为MoO 和
2 3
SO ;
2
(2) 由图2可知,6层中存在的固体物质分别为MoS 、MoO 、MoO ,图象分析
2 3 2
MoS 、MoO 的物质的量百分比均为18%,根据Mo元素守恒,则MoO 的物
2 3 2
质的量百分比为64%,则x为64;
(3) 由钼酸得到MoO 所用到的硅酸盐材料仪器的名称是瓷坩埚;
3
(4) Na CO 的加入与焙烧后的产物即MoO 作用生成CO ↑,而生产的最终产物
2 3 3 2
是钼酸钠晶体,且在后面加入的沉淀剂是为了除去杂质铅的,也就是说钼酸钠
在后续过程中没有发生变化,所以反应的化学方程式为
MoO +Na CO =Na MoO +CO ↑,则反应的离子方程式为MoO +CO 2-=MoO 2-
3 2 3 2 4 2 3 3 4
+CO ↑;
2
(5)已知 c(MoO 2-)=0.20mol•L−1,且K (BaMoO )=2.0×10−8,则当BaMoO 开始沉
4 sp 4 4
学科网(北京)股份有限公司淀时,c(Ba2+)= = mol•L−1=1.0×10−7mol•L−1,此时溶液中
c(SO 2-)= = mol•L−1=1.0×10−3mol•L−1。
4
19.(1)ab
(2)
(3) 无影响
(4) 负
【解析】(1)
二氧化碳为酸性气体,Li O、Na O、MgO均能吸收CO ,表现为碱性氧化物的
2 2 2
性质,与氧化性无关,IA、ⅡA族元素可以形成碱性氧化物,故答案为:ab;
(2)
反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则该反应的
(4×413+2×745-2×1075-2×436)kJ/mol=+120 kJ/mol。
(3)
①催化剂可以改变活化能,不影响反应热,则对过程Ⅰ反应的 无影响。
②过程Ⅱ的反应第一步是CO+CO +H +Fe O +CaO→H O+Fe+CaCO ,第二步反
2 2 3 4 2 3
应:Fe+CaCO +惰性气体→惰性气体+Fe O +CaO+CO,反应过程中有催化剂和
3 3 4
中间产物,因此过程Ⅱ总反应的化学方程式为 。(4)
左侧电极二氧化碳转化为丙烯,发生得到电子的还原反应,作阴极,氢离子移
向阴极,则电源的a极是负极,生成丙烯的电极反应式是
。
学科网(北京)股份有限公司