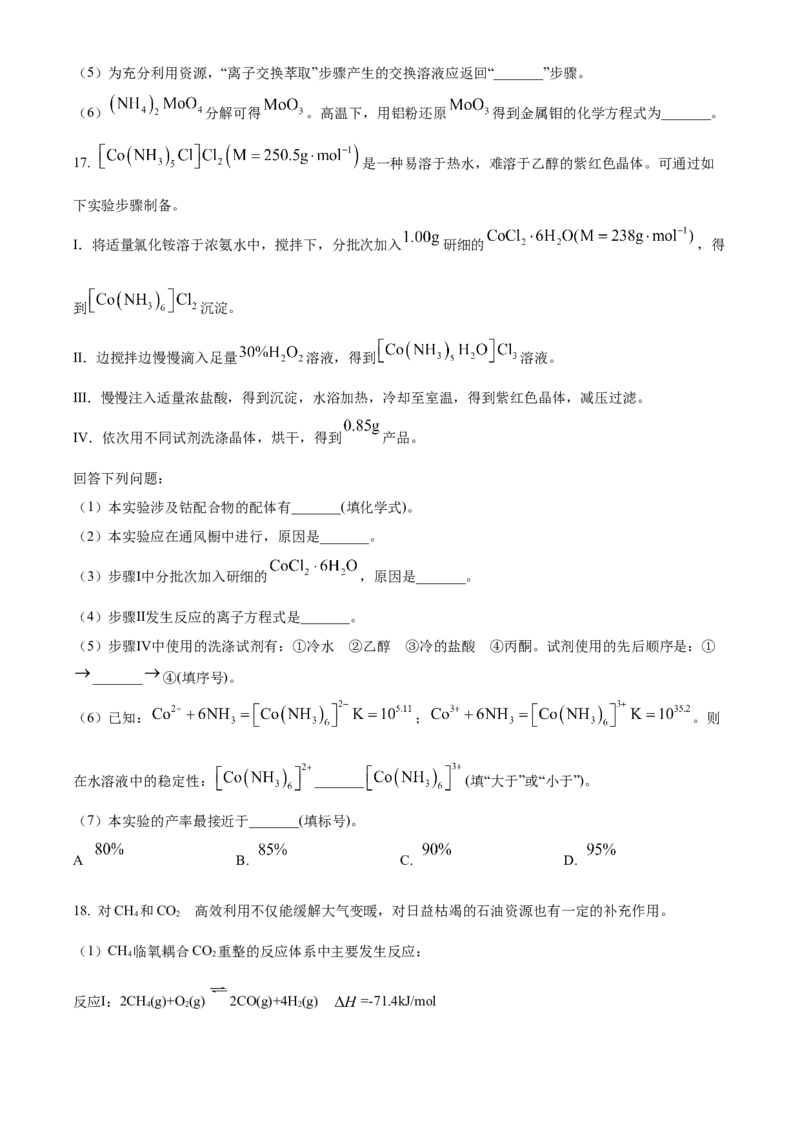文档内容
黑龙江省大庆市大庆中学 2023﹣2024 学年高三下学期开学考试
化学试题
说明:1.考试时间75分钟,满分100分。
2.本试卷包含Ⅰ、Ⅱ两卷。将卷Ⅰ答案用2B铅笔涂在答题卡上,将卷Ⅱ答案用黑色字迹的签字
笔书写在答题卡上。
3.可能用到的相对原子质量:H1 C12 O16 Na23 Cl35.5 Fe56 Zn65 Cu64
第I卷 (选择题共45分)
一、单选题(本题共15小题,每小题3分。每小题只有一个选项符合题意。)
1. 琴棋书画诗酒花是古人享受人生的七绝。下列物品的主要材料为金属的是
D.清外销银
C.稻谷耕作 浮雕人物龙柄
A.端石佛手 B.明玉雕凤
全景图通草纸 带“史溢泉、
砚 纹笔杆
外销画 开利店”铭啤
酒杯
A. A B. B C. C D. D
2. 下列化学用语正确的是
A. 基态 原子的价电子轨道表示式:
B. 连四硫酸根 (结构为“ ”)中S的化合价为+5价和0价
C. Fe在元素周期表中位于ds区
D. 用系统命名法命名 :2-甲基丁醇
3. 下列“类比”、“推理”合理的是A. 与 反应生成 ,则 与 反应可生成
B. 工业上通过电解熔融的 冶炼 ,则可以通过电解熔融的 冶炼
C. 是酸性氧化物,则 也是酸性氧化物
D. 与 反应生成 和 ,则 与 反应生成 和
4. 已知反应式: ,已知反应已达平衡,此时 ,其他
条件不变,容器缩小到原来的 ,一段时间后重新达到平衡,测得 ,下列说法一定正
确的是
A. 反应向逆方向移动
B. Y的转化率增大
C. 达到新平衡后,X、Y浓度都增大,Q、Z的浓度都减小
D. Z的体积分数减小
5. 用N 表示阿伏伽德罗常数的值,下列叙述正确的是
A
A. 4.6 g Na与含0.1 mol HCl的稀盐酸充分反应,转移电子数目为0.1N
A
B. 25℃时,pH=13的Ba(OH) 溶液中含有OH-的数目为0.2N
2 A
C. 常温下,14克C H 和C H 混合气体所含的原子数为3N
2 4 3 6 A
D. 等质量的1H18O与D16O,所含中子数前者大
2 2
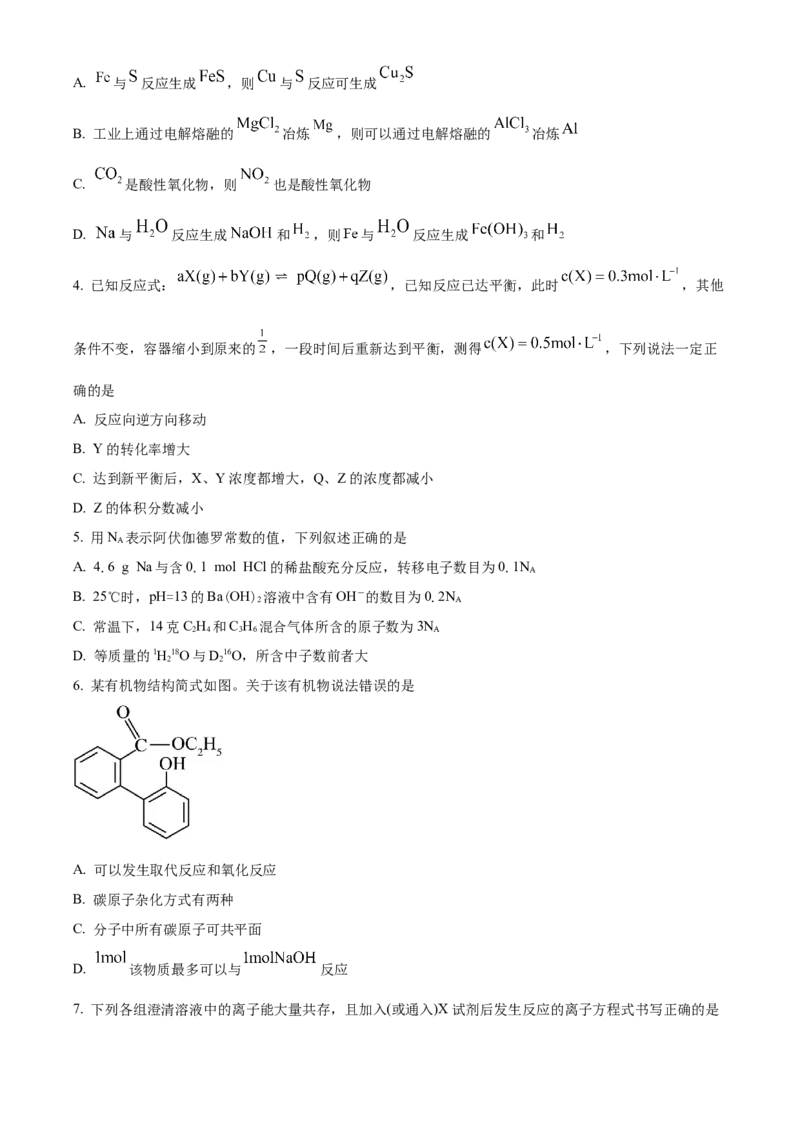
6. 某有机物结构简式如图。关于该有机物说法错误的是
A. 可以发生取代反应和氧化反应
B. 碳原子杂化方式有两种
C. 分子中所有碳原子可共平面
D. 该物质最多可以与 反应
7. 下列各组澄清溶液中的离子能大量共存,且加入(或通入)X试剂后发生反应的离子方程式书写正确的是选项 离子组 X试剂 离子方程式
A K+、Na+、ClO-、SO 足量SO SO +3ClO-+H O=SO +Cl-+2HClO
2 2 2
B Na+、Fe3+、Br-、SO 过量氨水 Fe3++3NH·H O=Fe(OH) ↓+3NH
3 2 3
C NH 、Na+、Fe3+、AlO 过量铜粉 2Fe3++Cu=2Fe2++Cu2+
D K+、Na+、HCO 、AlO 少量HCl H++AlO +H O=Al(OH) ↓
2 3
A. A B. B C. C D. D
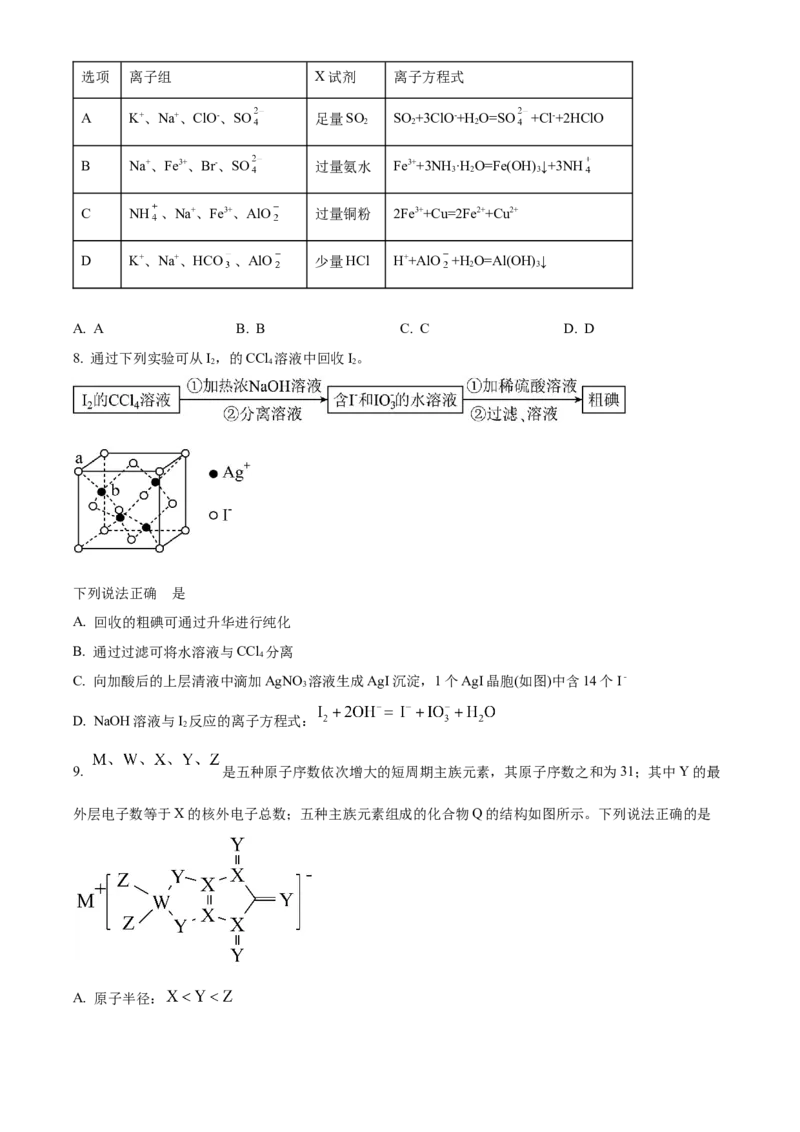
8. 通过下列实验可从I,的CCl 溶液中回收I。
2 4 2
下列说法正确 的是
A. 回收的粗碘可通过升华进行纯化
B. 通过过滤可将水溶液与CCl 分离
4
C. 向加酸后的上层清液中滴加AgNO 溶液生成AgI沉淀,1个AgI晶胞(如图)中含14个I﹣
3
D. NaOH溶液与I 反应的离子方程式:
2
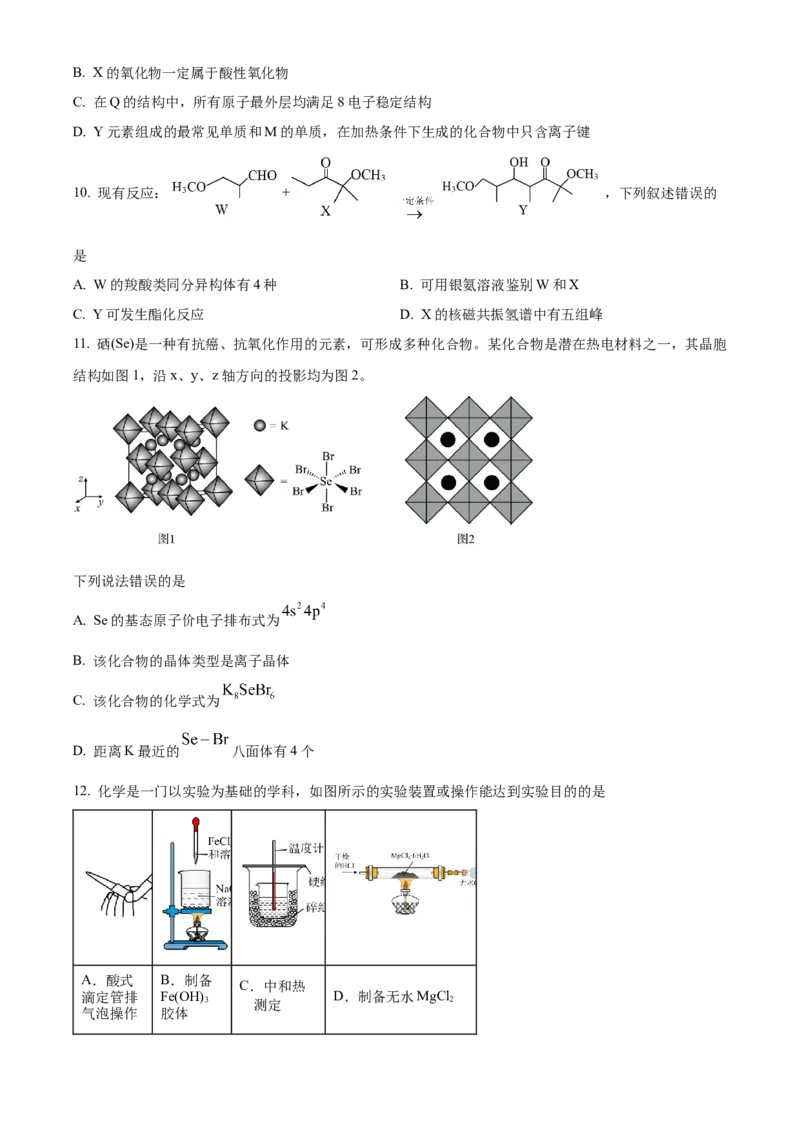
9. 是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最
外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
A. 原子半径:B. X的氧化物一定属于酸性氧化物
C. 在Q的结构中,所有原子最外层均满足8电子稳定结构
D. Y元素组成的最常见单质和M的单质,在加热条件下生成的化合物中只含离子键
10. 现有反应: + ,下列叙述错误的
是
A. W的羧酸类同分异构体有4种 B. 可用银氨溶液鉴别W和X
C. Y可发生酯化反应 D. X的核磁共振氢谱中有五组峰
11. 硒(Se)是一种有抗癌、抗氧化作用的元素,可形成多种化合物。某化合物是潜在热电材料之一,其晶胞
结构如图1,沿x、y、z轴方向的投影均为图2。
下列说法错误的是
A. Se的基态原子价电子排布式为
B. 该化合物的晶体类型是离子晶体
C. 该化合物的化学式为
D. 距离K最近的 八面体有4个
12. 化学是一门以实验为基础的学科,如图所示的实验装置或操作能达到实验目的的是
A.酸式 B.制备
C.中和热
滴定管排 Fe(OH) D.制备无水MgCl
3 的测定 2
气泡操作 胶体A. A B. B C. C D. D
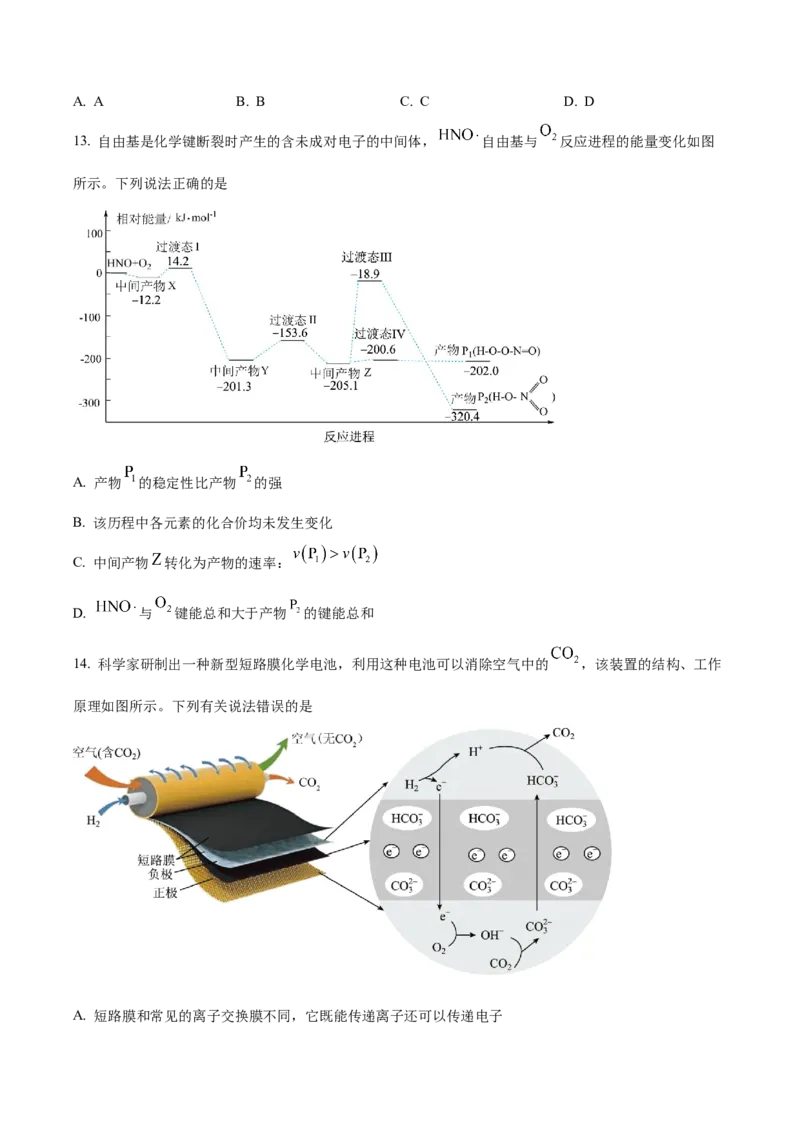
13. 自由基是化学键断裂时产生的含未成对电子的中间体, 自由基与 反应进程的能量变化如图
所示。下列说法正确的是
A. 产物 的稳定性比产物 的强
B. 该历程中各元素的化合价均未发生变化
C. 中间产物 转化为产物的速率:
D. 与 键能总和大于产物 的键能总和
14. 科学家研制出一种新型短路膜化学电池,利用这种电池可以消除空气中的 ,该装置的结构、工作
原理如图所示。下列有关说法错误的是
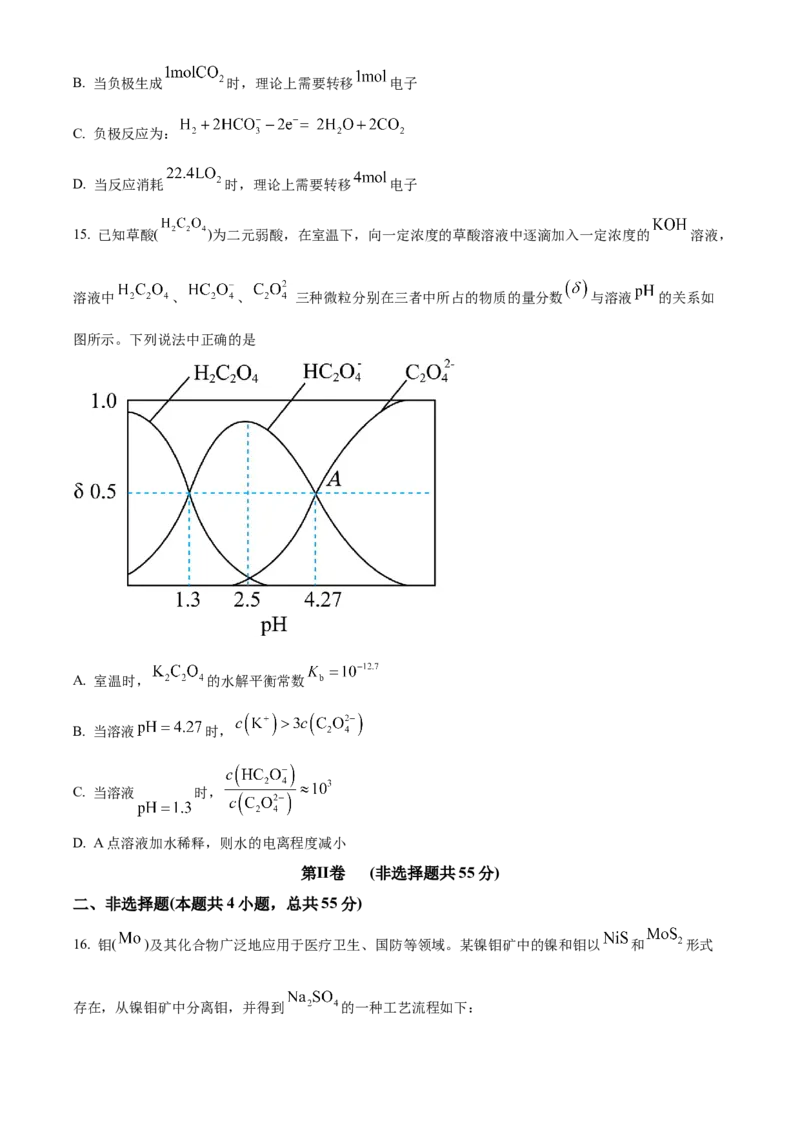
A. 短路膜和常见的离子交换膜不同,它既能传递离子还可以传递电子B. 当负极生成 时,理论上需要转移 电子
C. 负极反应为:
D. 当反应消耗 时,理论上需要转移 电子
15. 已知草酸( )为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的 溶液,
溶液中 、 、 三种微粒分别在三者中所占的物质的量分数 与溶液 的关系如
图所示。下列说法中正确的是
A. 室温时, 的水解平衡常数
B. 当溶液 时,
C. 当溶液 时,
D. A点溶液加水稀释,则水的电离程度减小
第Ⅱ卷 (非选择题共55分)
二、非选择题(本题共4小题,总共55分)
16. 钼( )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和 形式
存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:回答下列问题:
(1) 位于元素周期表第_______周期第_______族。 中钼元素的化合价为_______。
(2)“焙烧”中生成 的化学方程式为_______。
(3) 用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择 用
量为理论用量1.2倍的原因:_______。
(4) 的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作 ”应为
_______(填标号)。
A. 蒸发结晶 B. 低温结晶 C. 蒸馏 D. 萃取(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______”步骤。
(6) 分解可得 。高温下,用铝粉还原 得到金属钼的化学方程式为_______。
17. 是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如
下实验步骤制备。
Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入 研细的 ,得
到 沉淀。
Ⅱ.边搅拌边慢慢滴入足量 溶液,得到 溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到 产品。
回答下列问题:
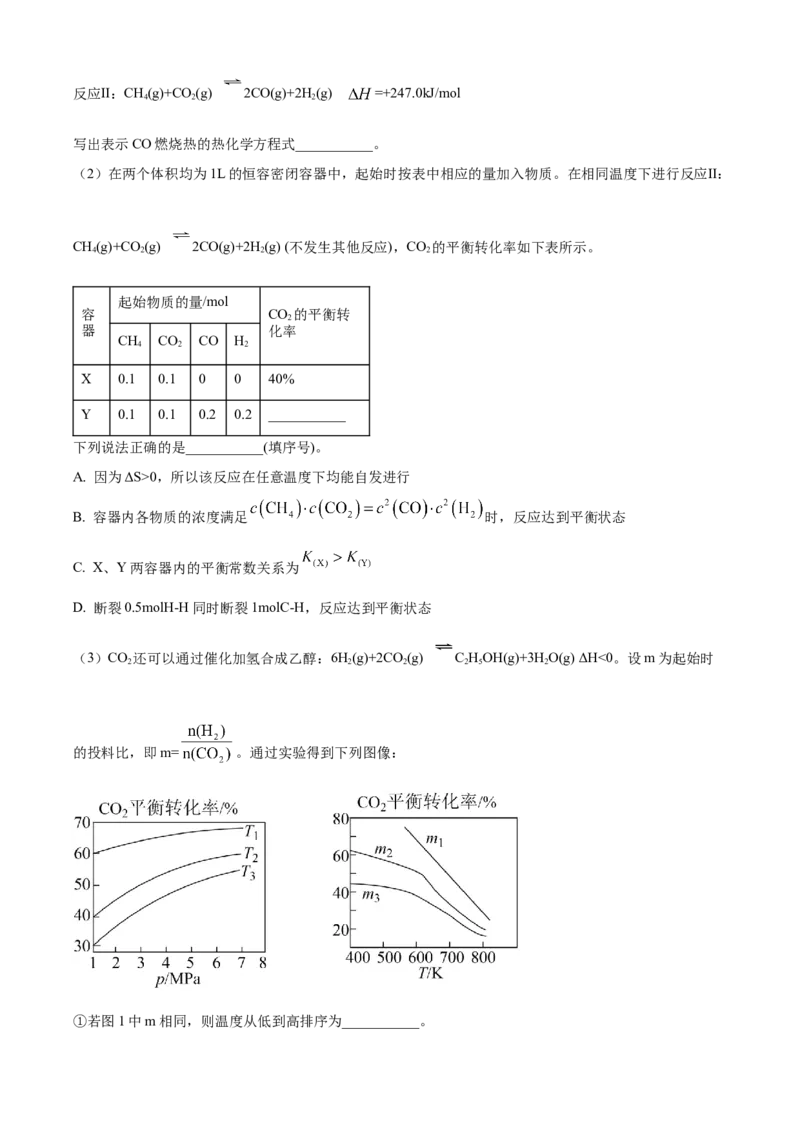
(1)本实验涉及钴配合物的配体有_______(填化学式)。
(2)本实验应在通风橱中进行,原因是_______。
(3)步骤Ⅰ中分批次加入研细的 ,原因是_______。
(4)步骤Ⅱ发生反应的离子方程式是_______。
(5)步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:①
_______ ④(填序号)。
(6)已知: ; 。则
在水溶液中的稳定性: _______ (填“大于”或“小于”)。
(7)本实验的产率最接近于_______(填标号)。
.
A B. C. D.
的
18. 对CH 和CO 高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。
4 2
(1)CH 临氧耦合CO 重整的反应体系中主要发生反应:
4 2
反应Ⅰ:2CH(g)+O(g) 2CO(g)+4H(g) =-71.4kJ/mol
4 2 2反应Ⅱ:CH(g)+CO (g) 2CO(g)+2H(g) =+247.0kJ/mol
4 2 2
写出表示CO燃烧热的热化学方程式___________。
(2)在两个体积均为1L的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应Ⅱ:
CH(g)+CO (g) 2CO(g)+2H(g) (不发生其他反应),CO 的平衡转化率如下表所示。
4 2 2 2
起始物质的量/mol
容 CO 的平衡转
2
器 化率
CH CO CO H
4 2 2
X 0.1 0.1 0 0 40%
Y 0.1 0.1 0.2 0.2 ___________
下列说法正确的是___________(填序号)。
A. 因为ΔS>0,所以该反应在任意温度下均能自发进行
B. 容器内各物质的浓度满足 时,反应达到平衡状态
C. X、Y两容器内的平衡常数关系为
D. 断裂0.5molH-H同时断裂1molC-H,反应达到平衡状态
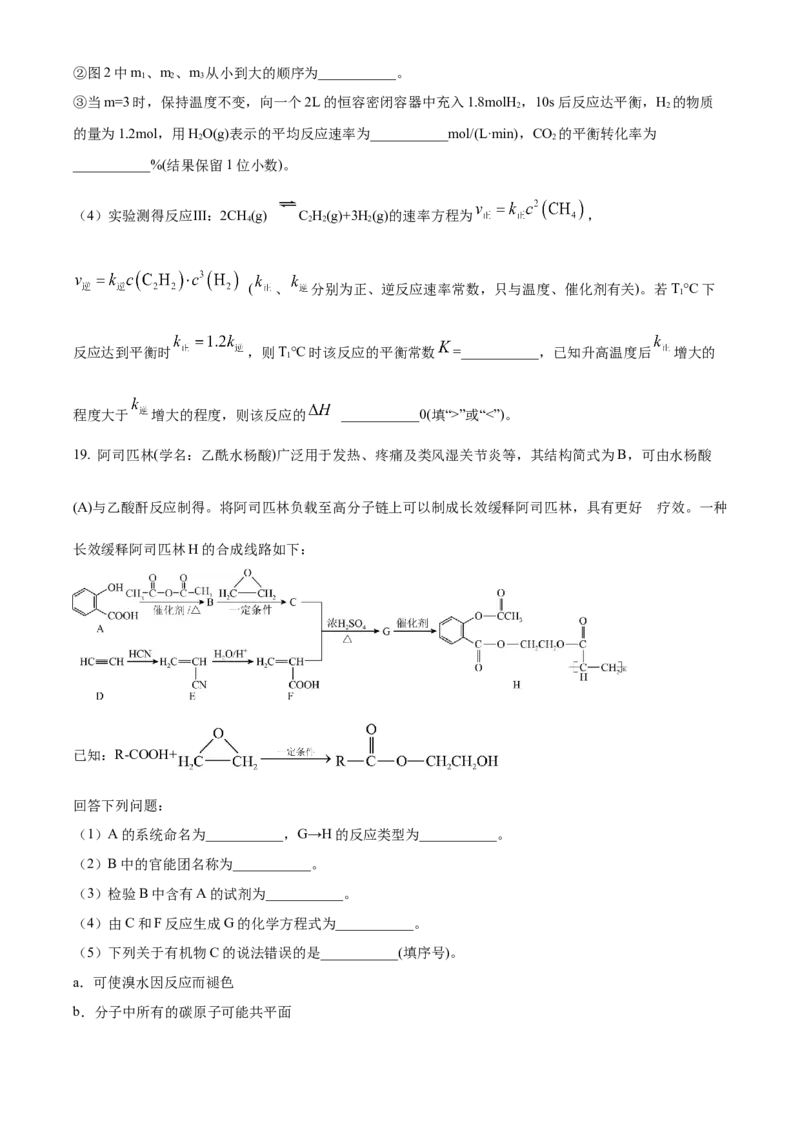
(3)CO 还可以通过催化加氢合成乙醇:6H(g)+2CO (g) C HOH(g)+3H O(g) ΔH<0。设m为起始时
2 2 2 2 5 2
的投料比,即m= 。通过实验得到下列图像:
①若图1中m相同,则温度从低到高排序为___________。②图2中m、m、m 从小到大的顺序为___________。
1 2 3
③当m=3时,保持温度不变,向一个2L的恒容密闭容器中充入1.8molH,10s后反应达平衡,H 的物质
2 2
的量为1.2mol,用HO(g)表示的平均反应速率为___________mol/(L·min),CO 的平衡转化率为
2 2
___________%(结果保留1位小数)。
(4)实验测得反应Ⅲ:2CH(g) C H(g)+3H(g)的速率方程为 ,
4 2 2 2
( 、 分别为正、逆反应速率常数,只与温度、催化剂有关)。若T°C下
1
反应达到平衡时 ,则T°C时该反应的平衡常数 =___________,已知升高温度后 增大的
1
程度大于 增大的程度,则该反应的 ___________0(填“>”或“<”)。
19. 阿司匹林(学名:乙酰水杨酸)广泛用于发热、疼痛及类风湿关节炎等,其结构简式为B,可由水杨酸
的
(A)与乙酸酐反应制得。将阿司匹林负载至高分子链上可以制成长效缓释阿司匹林,具有更好 疗效。一种
长效缓释阿司匹林H的合成线路如下:
已知:R-COOH+
回答下列问题:
(1)A的系统命名为___________,G→H的反应类型为___________。
(2)B中的官能团名称为___________。
(3)检验B中含有A的试剂为___________。
(4)由C和F反应生成G的化学方程式为___________。
(5)下列关于有机物C的说法错误的是___________(填序号)。
a.可使溴水因反应而褪色
b.分子中所有的碳原子可能共平面c.1molC与3molH 发生加成反应
2
d.可用酸性高锰酸钾鉴别有机物C和D
(6)在阿司匹林的同分异构体中,同时满足下列条件的共有___________种,写出其中一种能发生银镜反
应的同分异构体的结构简式___________。
①能与NaHCO 反应 ②能发生水解反应 ③苯环上有两个取代基
3