文档内容
高 2022 级高三上学期开学考试
可能用到的相对原子质量:H─1 C─12 N─14 O─16 F─19 P─31 Ca─40
第 I 卷 选择题(共 42分)
一、选择题(本大题包含14个小题,每题有且只有一个选项符合题意,每小题3分,共42分)
1.日常生活、生产、医疗与化学有着密切联系。下列说法正确的是
A.中国烟花的历史可以追溯到西汉时期,烟花观察到的是原子发射光谱
B.成都东门城墙始建于明朝,其墙体由青砖砌成,青砖的主要成分是Fe O
2 3
C.川酒的传统酿制技艺是我国的非物质文化遗产,酒的酿造过程不涉及氧化还原反应
D.工业上使用铁罐车运输浓硫酸是因为常温下铁与浓硫酸不反应
2.下列有关物质的结构、性质和用途说法正确的是
A. “杯酚”能分离 C
60
和 C
7 0
6.下列反应的离子方程式正确的是
A.向酸性KMnO 溶液中加入草酸溶液:2MnO —+5C O 2—+16H+==10CO ↑+2Mn2++8H O
4 4 2 4 2 2
B.过量Fe与稀硝酸反应:3Fe+2NO —+8H+==3Fe2++2NO↑+4H O
3 2
C.向Ba(OH) 溶液中滴加NaHSO 至溶液呈中性:Ba2++OH—+H++SO 2—==BaSO ↓+H O
2 4 4 4 2
D.向FeBr 溶液中通入过量Cl :2Fe2++2Br—+2Cl ==2Fe3++Br +4Cl—
2 2 2 2
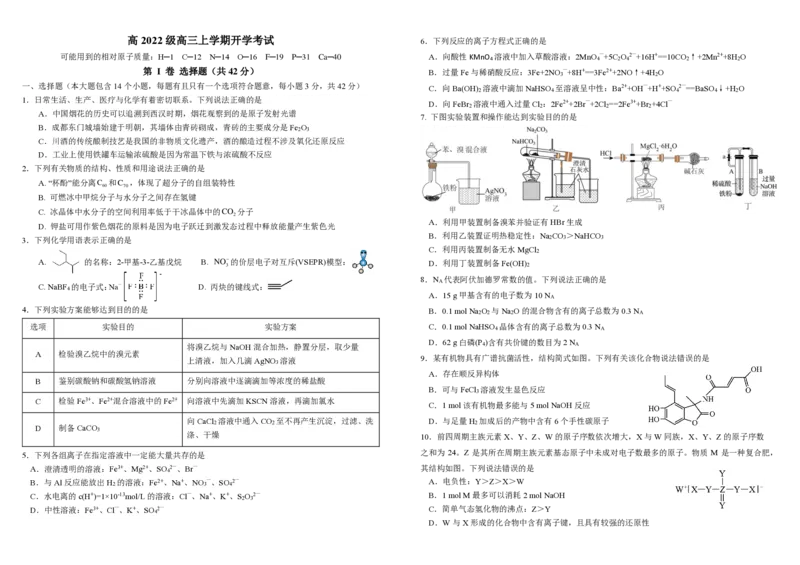
7. 下图实验装置和操作能达到实验目的的是
,体现了超分子的自组装特性
B. 可燃冰中甲烷分子与水分子之间存在氢键
C. 冰晶体中水分子的空间利用率低于干冰晶体中的 分子
A.利用甲装置制备溴苯并验证有HBr生成
D. 钾盐可用作紫色烟花的原料是因为电子跃迁到激发态过程中释放能量产生紫色光
B.利用乙装置证明热稳定性:Na CO >NaHCO
3.下列化学用语表示正确的是 2 3 3
C.利用丙装置制备无水MgCl
2
A. 的名称:2-甲基-3-乙基戊烷 B. 的价层电子对互斥(VSEPR)模型: D.利用丁装置制备Fe(OH)
2
8.N 代表阿伏加德罗常数的值。下列说法正确的是
A
C. NaBF 的电子式: D. 丙炔的键线式:
4
A.15 g甲基含有的电子数为10 N
A
4.下列实验方案能够达到目的的是 B.0.1 mol Na O 与Na O的混合物含有的离子总数为0.3 N
2 2 2 A
选项 实验目的 实验方案 C.0.1 mol NaHSO 晶体含有的离子总数为0.3 N
4 A
D.62 g白磷(P )含有共价键的数目为2 N
将溴乙烷与NaOH混合加热,静置分层,取少量 4 A
A 检验溴乙烷中的溴元素
上清液,加入几滴AgNO 溶液
9.某有机物具有广谱抗菌活性,结构简式如图。下列有关该化合物说法错误的是
3
A.存在顺反异构体
B 鉴别碳酸钠和碳酸氢钠溶液 分别向溶液中逐滴滴加等浓度的稀盐酸
B.可与FeCl 溶液发生显色反应
3
C 检验Fe3+、Fe2+混合溶液中的Fe2+ 向溶液中先滴加KSCN溶液,再滴加氯水
C.1 mol该有机物最多能与5 mol NaOH反应
向CaCl 溶液中通入CO 至不再产生沉淀,过滤、洗 D.与足量H 加成后的产物中含有6个手性碳原子
2 2 2
D 制备CaCO 3
涤、干燥 10.前四周期主族元素X、Y、Z、W的原子序数依次增大,X与W同族,X、Y、Z的原子序数
5.下列各组离子在指定溶液中一定能大量共存的是 之和为 24。Z 是其所在周期主族元素基态原子中未成对电子数最多的原子。物质 M 是一种复合肥,
A.澄清透明的溶液:Fe3+、Mg2+、SO 2—、Br— 其结构如图。下列说法错误的是
4
B.与Al反应能放出H 的溶液:Fe2+、Na+、NO —、SO 2— A.电负性:Y>Z>X>W
2 3 4
C.水电离的c(H+)=1×10-13mol/L的溶液:Cl—、Na+、K+、S O 2— B.1 mol M最多可以消耗2 mol NaOH
2 3
D.中性溶液:Fe3+、Cl—、K+、SO 2— C.简单气态氢化物的沸点:Z>Y
4
D.W与X形成的化合物中含有离子键,且具有较强的还原性
N
C
O
O
−3
211.实验室中用山梨酸和乙醇催化合成山梨酸乙酯的过程如下所示,下列说法错误的是
A.反应时不能用水浴进行加热
B.操作①和操作③基本原理相同,操作②和操作④基本原理不同
C.试剂a可以是 5 % N a O H 溶液,目的是除去滤液1中的山梨酸和硫酸杂质
D.加入无水MgSO 固体的目的是除去有机物中的水分 4
12.侯德榜提出的联合制碱法得到世界各国认可,其工业流程如图所示,下列说法正确的是
A.进行反应1时,往饱和食盐水中先通入CO ,再通入NH
2 3
B.试剂X是NaCl固体,其作用是增大c(Cl—),便于 N H
4
C l 析出
C.整个流程中能循环利用的物质只有CO
2
D.反应1的离子方程式为:2NH +CO +H O==CO 2—+2NH +
3 2 2 3 4
13.实验室制取HF的原理为 C a F
2
+ H
2
S O
4
( 浓 ) C a S O
4
+ 2 H F ,氢氟酸可用来刻蚀玻璃,发生反
应: S iO
2
+ 4 H F = S iF
4
+ 2 H
2
O 。CaF 的立方晶胞如图所示,其晶胞参数为a pm。下列说法错误的是
2
A.氢化物的稳定性:HF>H O 2
B.SiF 、H O、SO2−中心原子的价层电子对数相等
4 2 4
C. C a F
2
312 的晶体密度为 g/cm3 (N 为阿伏加德罗常数的值)
a310−30N A
A
D. C a F
2
晶体中F−与 C a 2 + 之间的最近距离为
4
6
a p m
14.铵明矾NH Al(SO ) 12H O广泛用作中和剂、膨松剂和水净化剂等。工业上以铝土矿(主要
4 4 2 2
成分是Al O ,含少量SiO 、Fe O 杂质)为原料制取铵明矾晶体的工艺流程如下:
2 3 2 2 3
下列说法正确的是
A.步骤III的离子方程式为:2[Al(OH) ]—+CO ==2Al(OH) ↓+CO 2—+H O 4 2 3 3 2
B.步骤VI应该通入过量NH
3
C.若经步骤Ⅱ得到的溶液与滤液c混合,则溶液中发生相互促进的水解反应
D.相同条件下,明矾除去铜器上铜锈[Cu (OH) CO ]的效果不如铵明矾
2 2 3
第 II 卷 非选择题(共 58分)
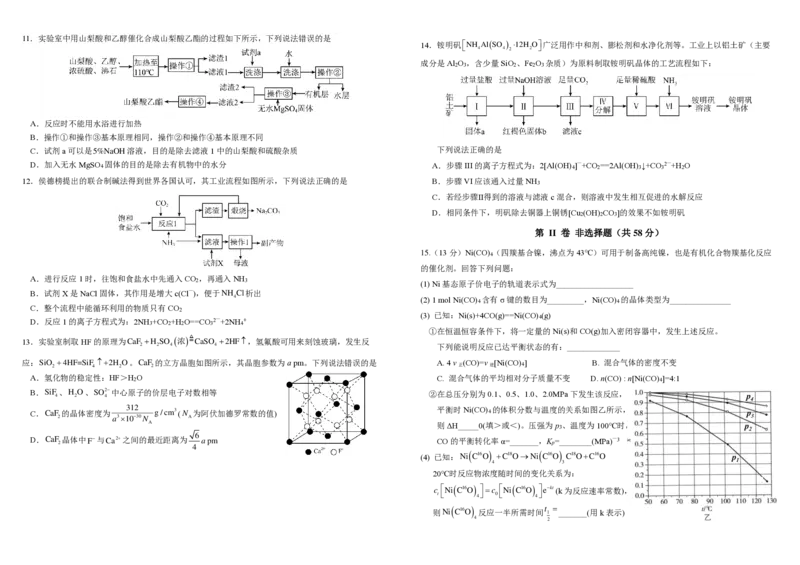
15.(13分)Ni(CO) (四羰基合镍,沸点为43℃)可用于制备高纯镍,也是有机化合物羰基化反应
4
的催化剂。回答下列问题:
(1) Ni基态原子价电子的轨道表示式为___________________
(2) 1 mol Ni(CO) 含有σ键的数目为_________,Ni(CO) 的晶体类型为_______________
4 4
(3) 已知:Ni(s)+4CO(g)==Ni(CO) (g)
4
①在恒温恒容条件下,将一定量的Ni(s)和CO(g)加入密闭容器中,发生上述反应。
下列能说明反应已达平衡状态的有:_____________
A. 4 v (CO)=v [Ni(CO) ] B. 混合气体的密度不变
正 逆 4
C. 混合气体的平均相对分子质量不变 D. n(CO) : n[Ni(CO) ]=4:1 4
②在总压分别为0.1、0.5、1.0、2.0MPa下发生该反应,
平衡时Ni(CO) 的体积分数与温度的关系如图乙所示, 4
则ΔH_____0(填>或<)。压强为p 、温度为100℃时,
3
CO的平衡转化率α=_______,K =________(MPa)—3
p
(4) 已知: N i ( C 1 6 O )
4
+ C 1 8 O → N i ( C 1 6 O )
3
C 1 8 O + C 1 6 O
20℃时反应物浓度随时间的变化关系为:
c Ni ( C16O ) =c Ni ( C16O ) e−kt(k为反应速率常数),
t 4 0 4
则Ni ( C16O ) 反应一半所需时间 t 1 = _______(用k表示)
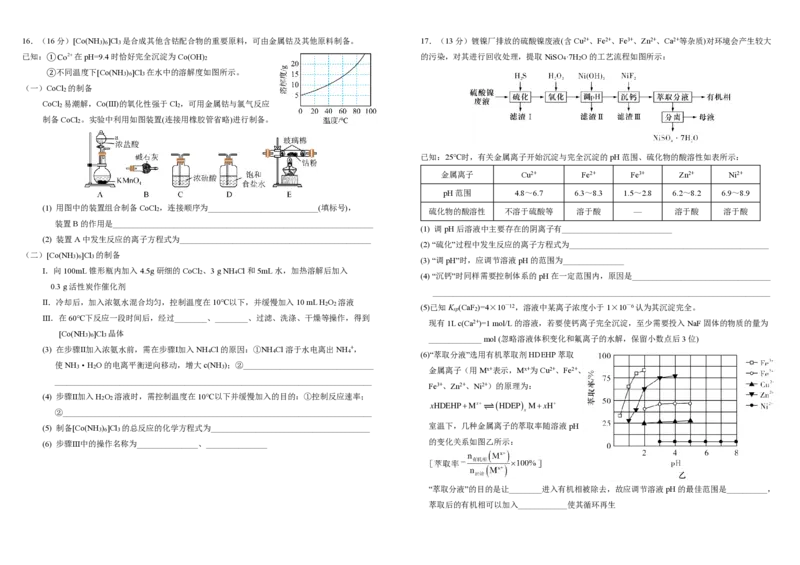
4 216.(16分)[Co(NH ) ]Cl 是合成其他含钴配合物的重要原料,可由金属钴及其他原料制备。
3 6 3
已知:① C o 2 +
17.(13分)镀镍厂排放的硫酸镍废液(含Cu2+、Fe2+、Fe3+、Zn2+、Ca2+等杂质)对环境会产生较大
在pH=9.4时恰好完全沉淀为Co(OH) 的污染,对其进行回收处理,提取NiSO ·7H O的工艺流程如图所示: 2 4 2
②不同温度下[Co(NH ) ]Cl 在水中的溶解度如图所示。
3 6 3
(一)CoCl 的制备
2
CoCl 易潮解,Co(Ⅲ)的氧化性强于Cl ,可用金属钴与氯气反应
2 2
制备CoCl 。实验中利用如图装置(连接用橡胶管省略)进行制备。
2
已知:25℃时,有关金属离子开始沉淀与完全沉淀的pH范围、硫化物的酸溶性如表所示:
金属离子 Cu2+ Fe2+ Fe3+ Zn2+ Ni2+
pH范围 4.8~6.7 6.3~8.3 1.5~2.8 6.2~8.2 6.9~8.9
(1) 用图中的装置组合制备CoCl ,连接顺序为___________________________(填标号),
2 硫化物的酸溶性 不溶于硫酸等 溶于酸 — 溶于酸 溶于酸
装置B的作用是________________________________________________________________
(1) 调pH后溶液中主要存在的阴离子有___________________________
(2) 装置A中发生反应的离子方程式为_______________________________________________
(2) “硫化”过程中发生反应的离子方程式为_________________________________________________
(二)[Co(NH ) ]Cl 的制备
3 6 3 (3) “调pH”时,应调节溶液pH的范围为_______________
Ⅰ.向100mL锥形瓶内加入4.5g研细的CoCl 、3 g NH Cl和5mL水,加热溶解后加入
2 4 (4) “沉钙”时同样需要控制体系的pH在一定范围内,原因是__________________________________
0.3 g活性炭作催化剂
___________________________________________________________________________________
Ⅱ.冷却后,加入浓氨水混合均匀,控制温度在10℃以下,并缓慢加入10 mL H O 溶液
2 2 (5)已知K (CaF )=4×10—12,溶液中某离子浓度小于1×10—6认为其沉淀完全。
sp 2
Ⅲ.在60℃下反应一段时间后,经过________、________、过滤、洗涤、干燥等操作,得到
现有1L c(Ca2+)=1 mol/L的溶液,若要使钙离子完全沉淀,至少需要投入NaF固体的物质的量为
[Co(NH ) ]Cl 晶体
3 6 3 _____________ mol (忽略溶液体积变化和氟离子的水解,保留小数点后3位)
(3) 在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ加入NH Cl的原因:①NH Cl溶于水电离出NH +,
4 4 4 (6)“萃取分液”选用有机萃取剂HDEHP萃取
使NH ·H O的电离平衡逆向移动,增大c(NH );②________________________________
3 2 3 金属离子(用Mx+表示,Mx+为Cu2+、Fe2+、
______________________________________________________________________________
Fe3+、Zn2+、Ni2+)的原理为:
(4) 步骤Ⅱ加入H O 溶液时,需控制温度在10℃以下并缓慢加入的目的:①控制反应速率;
2 2
xHDEHP+Mx+ (HDEP) M+xH+
②____________________________________________________________________________ x
(5) 制备[Co(NH ) ]Cl 的总反应的化学方程式为_______________________________________ 室温下,几种金属离子的萃取率随溶液pH
3 6 3
(6) 步骤Ⅲ中的操作名称为_______________、_______________ 的变化关系如图乙所示:
“萃取分液”的目的是让________进入有机相被除去,故应调节溶液pH的最佳范围是__________,
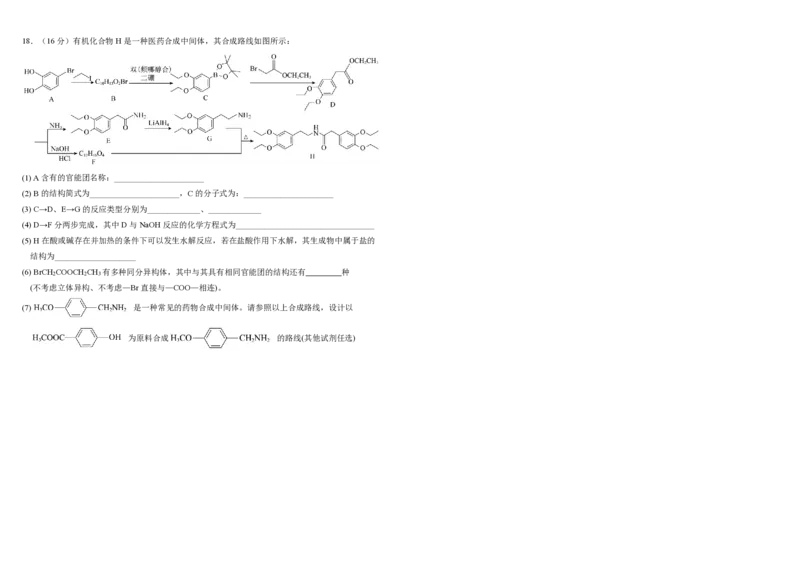
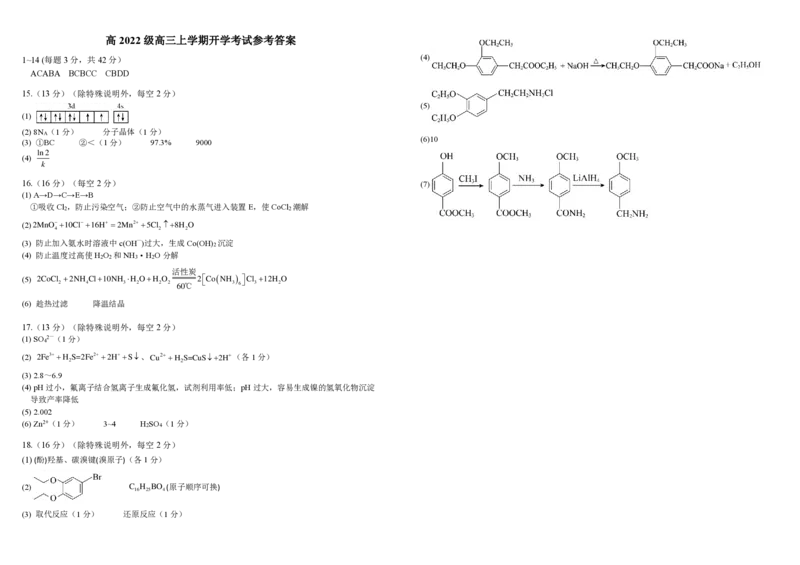
萃取后的有机相可以加入____________使其循环再生18.(16分)有机化合物H是一种医药合成中间体,其合成路线如图所示:
(1) A含有的官能团名称:______________________
(2) B的结构简式为______________________,C的分子式为:______________________
(3) C→D、E→G的反应类型分别为_____________、_____________
(4) D→F分两步完成,其中D与NaOH反应的化学方程式为__________________________________
(5) H在酸或碱存在并加热的条件下可以发生水解反应,若在盐酸作用下水解,其生成物中属于盐的
结构为____________________
(6) BrCH COOCH CH 有多种同分异构体,其中与其具有相同官能团的结构还有 种
2 2 3
(不考虑立体异构、不考虑—Br直接与—COO—相连)。
(7) 是一种常见的药物合成中间体。请参照以上合成路线,设计以
为原料合成 的路线(其他试剂任选)高 2022 级高三上学期开学考试参考答案
1~14 (每题3分,共42分) (4)
ACABA BCBCC CBDD
15.(13分)(除特殊说明外,每空2分)
(5)
(1)
(2) 8N (1分) 分子晶体(1分)
A
(6)10
(3) ①BC ②<(1分) 97.3% 9000
ln2
(4)
k
16.(16分)(每空2分) (7)
(1) A→D→C→E→B
①吸收Cl ,防止污染空气;②防止空气中的水蒸气进入装置E,使CoCl 潮解
2 2
(2)2MnO−+10Cl−+16H+ =2Mn2++5Cl +8H O
4 2 2
(3) 防止加入氨水时溶液中c(OH—)过大,生成Co(OH) 沉淀
2
(4) 防止温度过高使H O 和NH ·H O分解
2 2 3 2
活性炭
(5) 2CoCl +2NH Cl+10NH H O+H O 2Co(NH ) Cl +12H O
2 4 3 2 2 2 60℃ 3 6 3 2
(6) 趁热过滤 降温结晶
17.(13分)(除特殊说明外,每空2分)
(1) SO 2—(1分)
4
(2) 2Fe3++H S=2Fe2++2H++S、Cu2+ +H S=CuS+2H+(各1分)
2 2
(3) 2.8~6.9
(4) pH过小,氟离子结合氢离子生成氟化氢,试剂利用率低;pH过大,容易生成镍的氢氧化物沉淀
导致产率降低
(5) 2.002
(6) Zn2+(1分) 3~4 H SO (1分)
2 4
18.(16分)(除特殊说明外,每空2分)
(1) (酚)羟基、碳溴键(溴原子)(各1分)
(2) C H BO (原子顺序可换)
16 25 4
(3) 取代反应(1分) 还原反应(1分)