文档内容
成都七中 2025 届高三年级上期12月阶段性测试
考试时间:75分钟 总分:100分
可能用到的相对原子质量:
H:1;Li:7;C:12;O:16;Na:23;P:31;S:32;K:39;Mn:55;In:115
一、选择题:本题共 14小题,每小题 3分,共 42 分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.四川三星堆文明震惊世界,其以青铜合金为主的面具,更是给人类留下了无限的想象空间,下列关于合
金的说法不正确的是( )
...
A.合金的硬度、熔点都高于其单一成份纯金属
B.不锈钢的合金元素主要是Fe、Cr、Ni
C.纯铝的硬度和强度较小,不适宜制造机器零件
D.在钢中加入稀土元素可增加钢的耐腐蚀性和抗氧化性
2.科技的高度发达带来了化学品的极大丰富,下列说法正确的是( )
A.夏季可以在室内大量使用拟除虫菊酯以杀灭蚊虫
B.药物可以促进人类健康,例如阿司匹林可以作为日常保健药
C.亚硝酸钠有毒致癌,也是一种防腐剂和护色剂,在食品中少量添加可以达到防腐的目的
D.人们在不同年龄段都需要补充营养强化剂,以维持身体健康
3.常温下,下列各组离子在指定溶液中可以大量共存的是( )
A.pH=14的溶液中:Cr O 2—、SO 2—、K+、Al3+
2 7 4
B.NH Fe(SO ) 溶液中:Al(OH) —、Na+、K+、Cl—、
4 4 2 4
C.漂白液中:Br—、Na+、OH—、NO —
3
D.氨水中:K+、Ag+、NO —、SO 2—
3 4
4.设N 为阿伏伽德罗常数的值,下列说法正确的是( )
A
A.1mol晶体冰中含有的氢键数目为4N
A
B.1mol C 中含有的双键数目为30N
60 A
C.32g S 含有的σ键数目为8N
8 A
D.220g P O 中含有的孤电子对数为4N
4 6 A
5.结构决定性质,下列有关物质结构的说法错误的是( )
A.DNA中碱基间是通过氢键配对连接的,A与T之间形成2个氢键,C与G之间形成3个氢键
B.PCl 和NCl 分子中,中心原子的杂化类型都为sp3d2
5 5
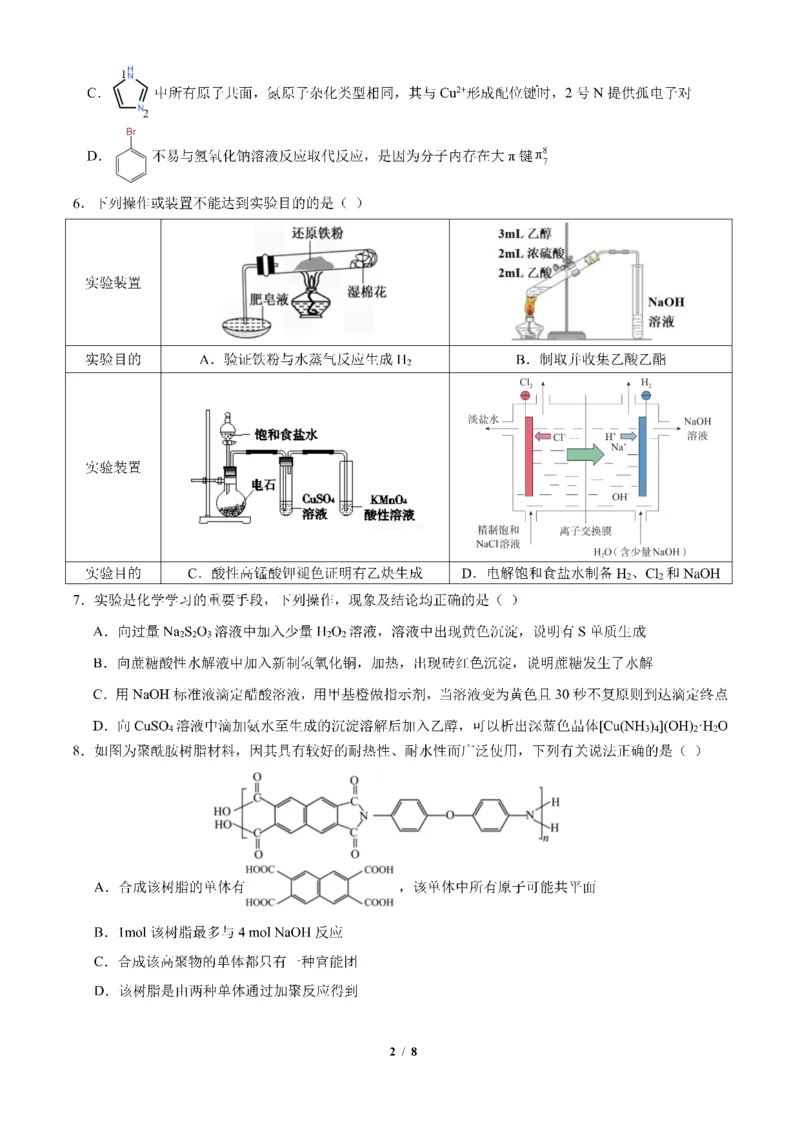
1 / 89.储氢合金能将气体的氢气以原子的形式储存,其储存密度可以大于液氢状态下的氢气密度,十分有利于
氢气的储存和运输,具有储氢密度高、安全性好的优点,如下为一种新型LiIn合金储氢后的晶胞(小球大
1 1
小不代表实际半径),已知Q点对应坐标为( , ,0)下列说法正确的是 ( )
2 2
A.In的价层电子轨道表示式为:5s25p1 B.该晶体的化学式为H LiIn
2
C.该晶体中N点的原子坐标为(
3
,
1
,
1
) D.该晶体中H 的密度为
492×1021
g/cm3
4 4 4 2 𝑁𝐴 𝑎3
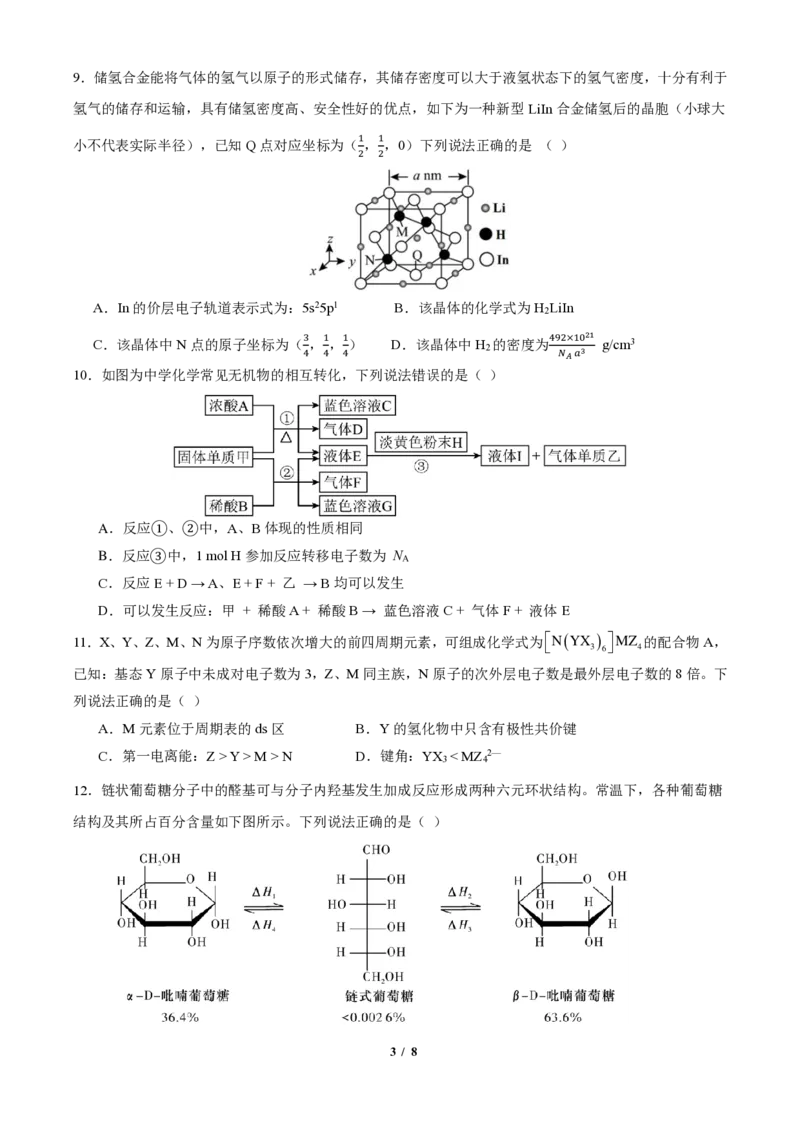
10.如图为中学化学常见无机物的相互转化,下列说法错误的是( )
A.反应①、②中,A、B体现的性质相同
B.反应③中,1 mol H参加反应转移电子数为 N
A
C.反应E + D → A、E + F + 乙 → B均可以发生
D.可以发生反应:甲 + 稀酸A + 稀酸B → 蓝色溶液C + 气体F + 液体E
11.X、Y、Z、M、N为原子序数依次增大的前四周期元素,可组成化学式为N(YX ) MZ 的配合物A,
3 6 4
已知:基态Y原子中未成对电子数为3,Z、M同主族,N原子的次外层电子数是最外层电子数的8倍。下
列说法正确的是( )
A.M元素位于周期表的ds区 B.Y的氢化物中只含有极性共价键
C.第一电离能:Z > Y > M > N D.键角:YX < MZ 2—
3 4
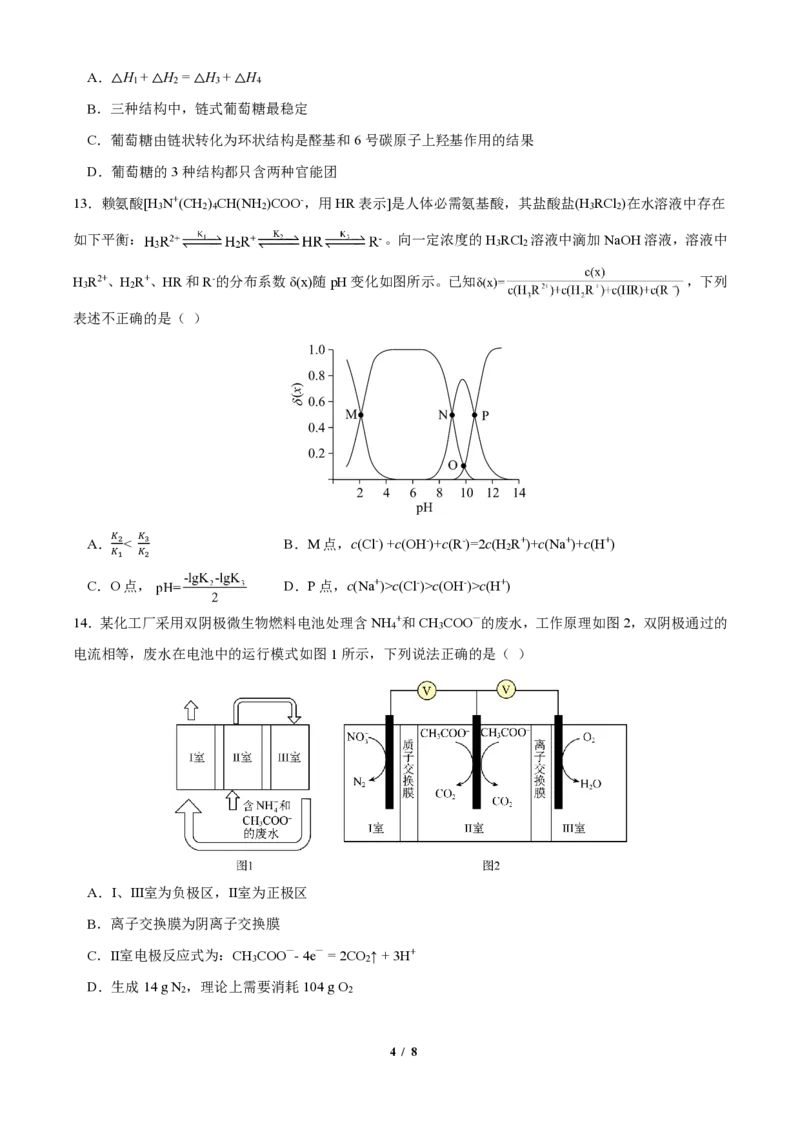
12.链状葡萄糖分子中的醛基可与分子内羟基发生加成反应形成两种六元环状结构。常温下,各种葡萄糖
结构及其所占百分含量如下图所示。下列说法正确的是( )
3 / 8A.△H + △H = △H + △H
1 2 3 4
B.三种结构中,链式葡萄糖最稳定
C.葡萄糖由链状转化为环状结构是醛基和6号碳原子上羟基作用的结果
D.葡萄糖的3种结构都只含两种官能团
13.赖氨酸[H N+(CH ) CH(NH )COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H RCl )在水溶液中存在
3 2 4 2 3 2
如下平衡: 。向一定浓度的H RCl 溶液中滴加NaOH溶液,溶液中
3 2
H R2+、H R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知 ,下列
3 2
表述不正确的是( )
A.
𝐾2< 𝐾3
B.M点,c(Cl-) +c(OH-)+c(R-)=2c(H R+)+c(Na+)+c(H+)
2
𝐾1 𝐾2
C.O点, D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
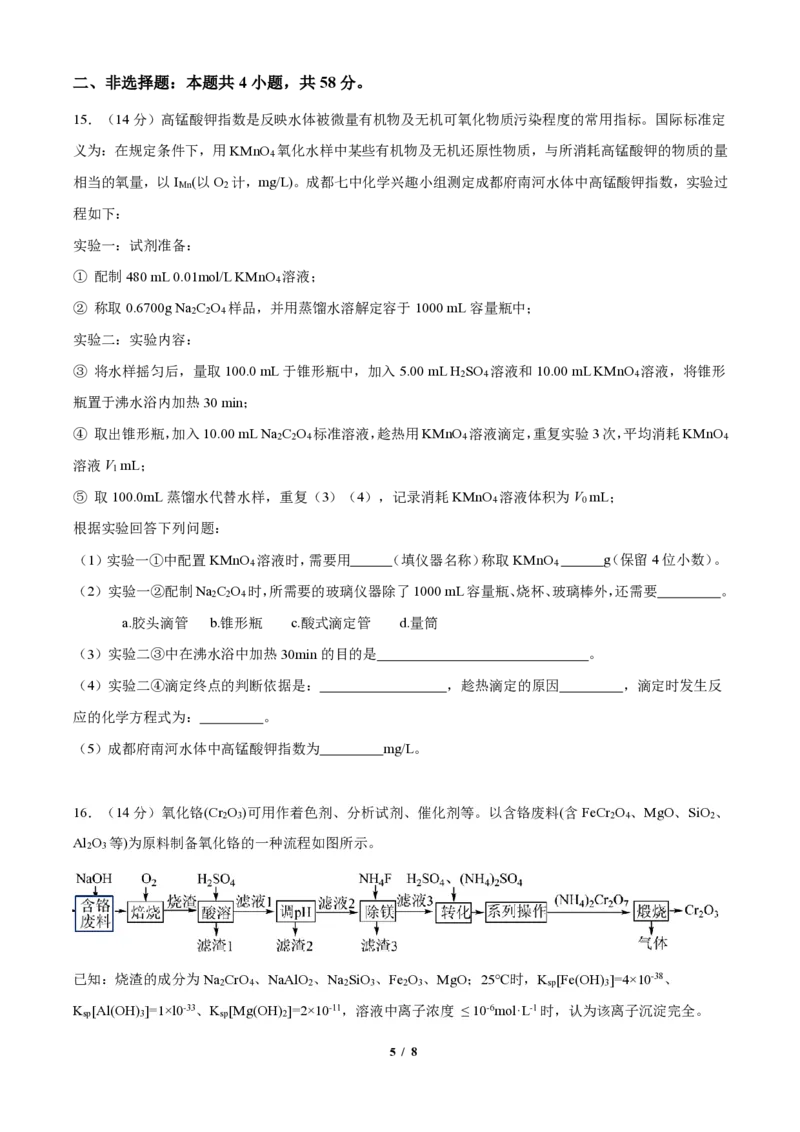
14.某化工厂采用双阴极微生物燃料电池处理含NH +和CH COO—的废水,工作原理如图2,双阴极通过的
4 3
电流相等,废水在电池中的运行模式如图1所示,下列说法正确的是( )
A.I、Ⅲ室为负极区,Ⅱ室为正极区
B.离子交换膜为阴离子交换膜
C.Ⅱ室电极反应式为:CH COO—- 4e— = 2CO ↑ + 3H+
3 2
D.生成14 g N ,理论上需要消耗104 g O
2 2
4 / 8二、非选择题:本题共 4 小题,共 58分。
15.(14分)高锰酸钾指数是反映水体被微量有机物及无机可氧化物质污染程度的常用指标。国际标准定
义为:在规定条件下,用KMnO 氧化水样中某些有机物及无机还原性物质,与所消耗高锰酸钾的物质的量
4
相当的氧量,以I (以O 计,mg/L)。成都七中化学兴趣小组测定成都府南河水体中高锰酸钾指数,实验过
Mn 2
程如下:
实验一:试剂准备:
① 配制480 mL 0.01mol/L KMnO 溶液;
4
② 称取0.6700g Na C O 样品,并用蒸馏水溶解定容于1000 mL容量瓶中;
2 2 4
实验二:实验内容:
③ 将水样摇匀后,量取100.0 mL于锥形瓶中,加入5.00 mL H SO 溶液和10.00 mL KMnO 溶液,将锥形
2 4 4
瓶置于沸水浴内加热30 min;
④ 取出锥形瓶,加入10.00 mL Na C O 标准溶液,趁热用KMnO 溶液滴定,重复实验3次,平均消耗KMnO
2 2 4 4 4
溶液V mL;
1
⑤ 取100.0mL蒸馏水代替水样,重复(3)(4),记录消耗KMnO 溶液体积为V mL;
4 0
根据实验回答下列问题:
(1) 实验一①中配置 KMnO
4
溶液时,需要用 (填仪器名称)称取 KMnO
4
g(保留4位小数)。
(2) 实验一②配制Na C O 时,所需要的玻璃仪器除了1000 mL容量瓶、烧杯、玻璃棒外,还需要 。
2 2 4
a.胶头滴管 b.锥形瓶 c.酸式滴定管 d.量筒
(3)实验二③中在沸水浴中加热30min的目的是 。
(4)实验二④滴定终点的判断依据是: ,趁热滴定的原因 ,滴定时发生反
应的化学方程式为: 。
(5)成都府南河水体中高锰酸钾指数为 mg/L。
16.(14 分)氧化铬(Cr
2
O
3
)可用作着色剂、分析试剂、催化剂等。以含铬废料(含 FeCr
2
O
4
、MgO、SiO
2
、
Al O 等)为原料制备氧化铬的一种流程如图所示。
2 3
已知:烧渣的成分为Na CrO 、NaAlO 、Na SiO 、Fe O 、MgO;25℃时,K [Fe(OH) ]=4×10-38、
2 4 2 2 3 2 3 sp 3
K [Al(OH) ]=1×l0-33、K [Mg(OH) ]=2×10-11,溶液中离子浓度 ≤ 10-6mol·L-1时,认为该离子沉淀完全。
sp 3 sp 2
5 / 8回答下列问题:
(1)Na CrO 中Cr的化合价为___________,该价态的Cr(基态)的电子排布式为_________。
2 4
(2)含铬废料用NaOH处理时,为了加快反应速率,可以采取的措施是_______________(写一种即可);
“焙烧”过程中发生的氧化还原的化学方程式为:_________;滤渣1的主要成分为___________。
(3)已知滤液l中金属离子的浓度均为0.1 mol·L-1,若在25℃条件下,需要调整pH最小值为_________。
(保留两位有效数字)。
(4)“转化”时加入适量H SO 的作用是_________(请结合离子方程式及必要文字说明)。
2 4
(5)“煅烧”反应生成了一种气态单质,该反应的化学方程式_________。
17.(15分)石油钻探过程会释放出 CO
2
、H
2
S 等气体。某种将CO
2
和H
2
S 共活化的工艺涉及如下反应:
回答下列问题:
(1)反应②在 (填“高温”“低温”或“任意温度”)下能自发进行;已知:298K时,18 g气态水转化
为液态水释放出44 kJ的能量;H S(g)的标准摩尔燃烧焓(△H)为-586 kJ·mol-1,则COS(g)的标准摩尔燃烧焓
2
(
6 / 8
H )为 kJ·mol-1。
(2)将等物质的量的CO (g)和H S(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平衡转化率、
2 2
COS或H O的选择性与温度关系如图所示。COS的选择性= 𝑛 生成 ( COS ) ×100%,H O的选择性= 𝑛 生成 (𝐻2𝑂) ×
2 𝑛
消耗
(𝐻2𝑆) 2 𝑛
消耗
(𝐻2𝑆)
100%。
①表示“COS的选择性”的是曲线 (填“a”或“b”);
②温度低于500℃时,H S的转化率与CO 的相等,原因是 。
2 2(3)一定条件下,向起始压强为200 kPa的恒容密闭容器中通入等物质的量的CO (g)和H S(g)混合气体,
2 2
发生上述反应,25 min时,测得体系总压强为210 kPa,S (g)的平均反应速率为 kPa·min-1。达到
2
平衡时,测得体系总压强为230 kPa, ,此时H S(g)的平衡转化率为 ,
2
反应②的标准平衡常数𝐾𝛩 = (已知:分压=总压×该组分物质的量分数,对于反应𝑑𝐷(𝑔)+𝑒𝐸(𝑔)⇌
𝑔 ℎ
(
𝑝𝐶)
⋅(
𝑝𝐻)
𝑔𝐺(𝑔)+ℎ𝐻(𝑔),𝐾𝛩 = 𝑝𝛩 𝑝𝛩 ,其中𝑝𝛩 =100𝑘𝑃𝑎,𝑝 、𝑝 、𝑝 、𝑝 为各组分的平衡分压)。
𝑑 𝑑 𝐶 𝐻 𝐷 𝐸
(
𝑝𝐷)
⋅(
𝑝𝐸)
𝑝𝛩 𝑝𝛩
(4)利用电解原理在酸性条件下也可以将CO 、H S分别通入不同电极,电极间用阳离子交换膜隔开,最
2 2
终得到S单质和乙酸,阴极电极反应式为: ,当消耗34 g H S时,阳离子交换膜通过的离子数量
2
为 。
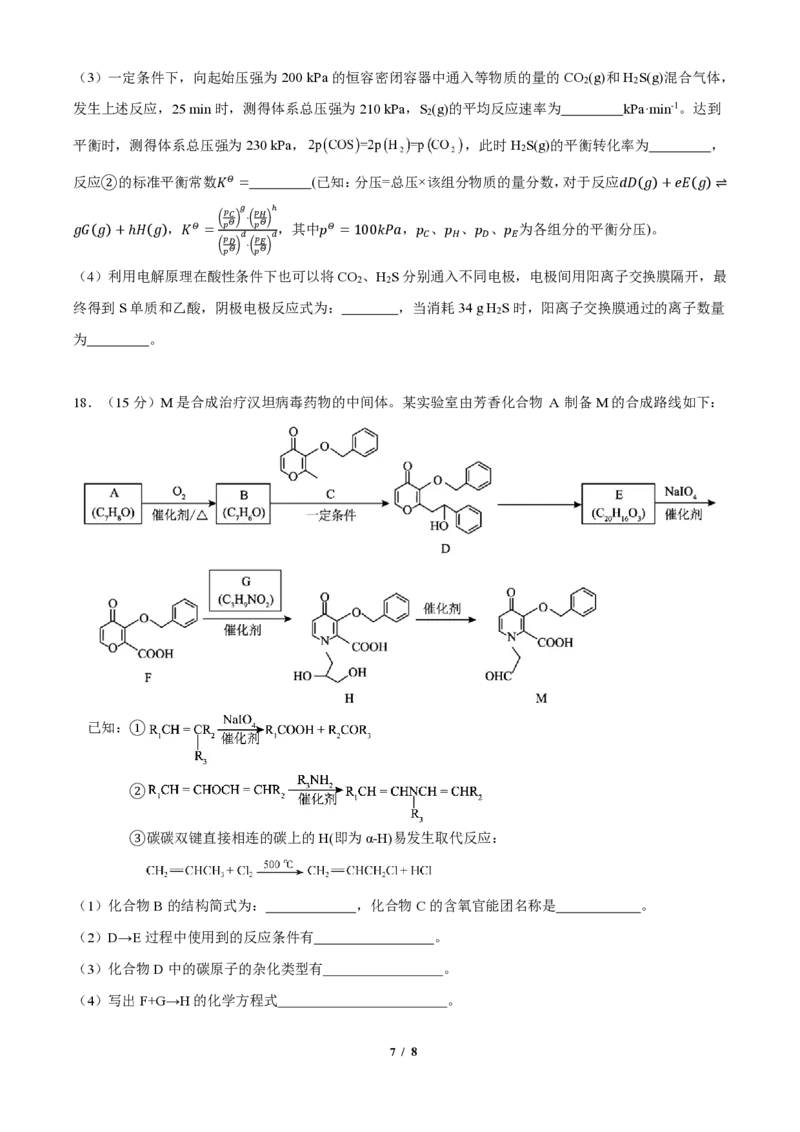
18.(15分)M是合成治疗汉坦病毒药物的中间体。某实验室由芳香化合物 A 制备M的合成路线如下:
已知:①
②
③碳碳双键直接相连的碳上的H(即为α-H)易发生取代反应:
(1)化合物B的结构简式为: ,化合物C的含氧官能团名称是 。
(2)D→E过程中使用到的反应条件有 。
(3)化合物D中的碳原子的杂化类型有 。
(4)写出F+G→H的化学方程式 。
7 / 8(5)写出3种同时符合下列条件的化合物F的同分异构体的结构简式 。
①含有 结构;②1 mol Q最多消耗4 mol NaOH;③核磁共振氢谱中有6组吸收峰。
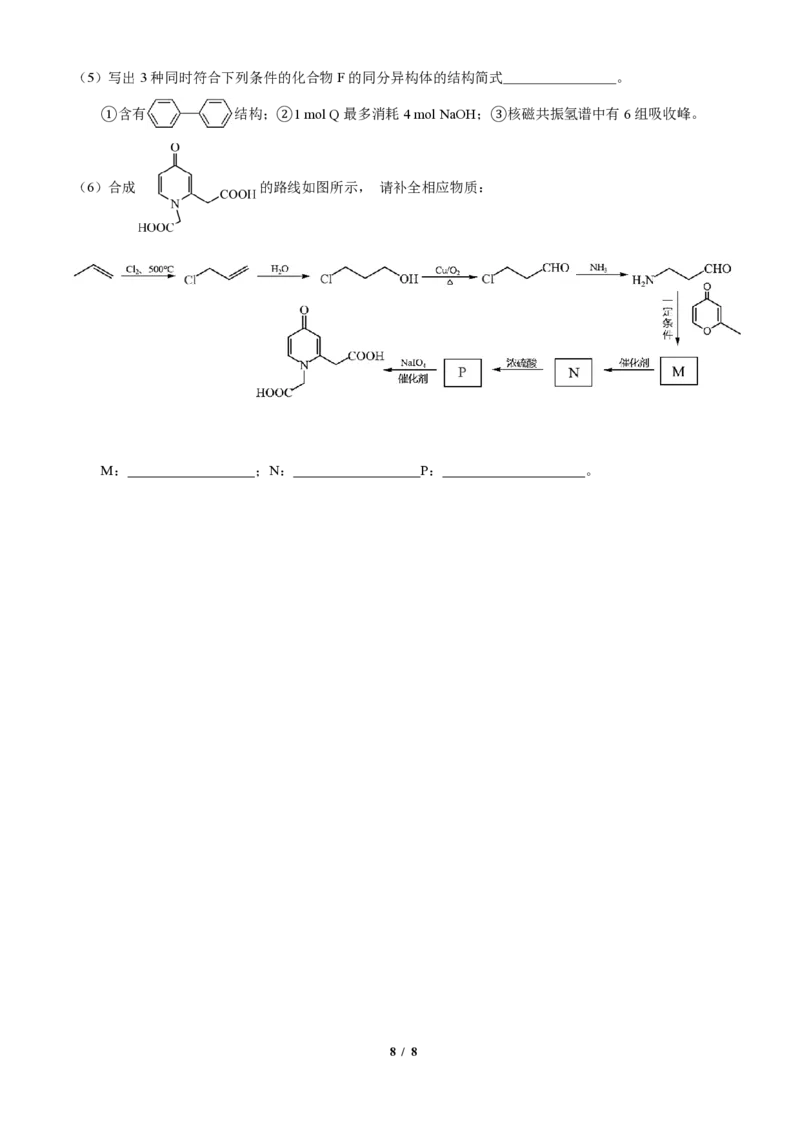
(6)合成 的路线如图所示, 请补全相应物质:
M: ;N: P: 。
8 / 8